藏药仁青常觉及其组方药材抗肿瘤作用及机制研究进展
2024-10-31徐姣姣陈茂升吴思琪吕雅心赵勤*




【摘要】藏医药作为中华传统文化的瑰宝,具有两千年左右的历史,它对癌症的基本认识建立在“三因学说”的基础上,认为癌症是由“隆、赤巴、培根”三因紊乱,生活不当、黄水凝结、邪魔做祟所产生。在疗法上,藏医药有着独特的总体法与具体法,而其抗肿瘤作用与纯天然藏药药材密不可分。藏药仁青常觉是由多种纯天然藏药材组成的复方,具有多种抗肿瘤活性,但由于其含有多种药材、成分非常复杂,其抗癌机制尚不清楚。现阶段关于抗肿瘤药物作用机制主要涉及抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡和自噬,影响细胞周期,抑制肿瘤血管生成、侵袭和转移,调节肿瘤免疫微环境,逆转肿瘤耐药等多个方面。藏药文化博大精深、历史悠久,具有多层次、多靶点作用,基于上述抗肿瘤作用机制,文章对仁青常觉及其组方药材抗肿瘤作用及机制进行归纳总结,以期为筛选具有抗肿瘤活性的新藏药及临床抗肿瘤新方法提供参考。
【关键词】藏药;仁青常觉;组方药材;抗肿瘤作用;作用机制
【中图分类号】R285.6
【文献标志码】A【文章编号】1007-8517(2024)18-0054-10
DOI:10.3969/j.issn.1007-8517.2024.18.zgmzmjyyzz202418012
Abstract:
AsatreasureoftraditionalChineseculture,Zangmedicinehasahistoryofabouttwothousandyears.Itsbasicunderstandingofcancerisbasedonthetheoryof“threecauses”,whichbelievesthatcanceriscausedby“long,redbarkandbacon”threecausesofdisorder,improperlife,yellowwatercondensation,andevilspirits.Inthetreatment,Zangmedicinehasauniqueoverallmethodandspecificmethod,andtheanti-tumoreffectisinseparablefrompurenaturalmedicinalmaterials.RenqingisoftenthoughttobecomposedofavarietyofnaturalZangmedicinalmaterials,withavarietyofanti-tumoractivities,butbecauseitcontainsavarietyofmedicinalmaterials,thecompositionisverycomplex,itsanti-cancermechanismisstillunclear.Atpresent,themechanismofactionofanti-tumordrugsmainlyinvolvesinhibitionoftumorcellproliferation,inductionoftumorcellapoptosisandautophagy,influenceoncellcycle,inhibitionoftumorangiogenesis,invasionandmetastasN992b9N9ENkM4k/0IuRfVtWtrxCy+81dLxOscdWZSg4=is,regulationoftumorimmunemicroenvironment,reversaloftumordrugresistanceandotheraspects.Zangmedicinehasabroadandprofoundculture,alonghistory,andhasmulti-levelandmulti-targeteffects.Basedontheaboveanti-tumormechanisms,thispapersummarizedtheanti-tumoreffectsandmechanismsofRenqingChangjuanditsprescriptionherbs,inordertoprovidereferencesforscreeningnewZangmedicineswithanti-tumoractivitiesandnewclinicalanti-tumormethods.
Keywords:ZangMedicine;RenqingChangjue;PrescriptionMedicinalMaterials;Anti-tumorEffect;MechanismofAction
世界卫生组织国际癌症研究机构发布的2000年全球最新癌症数据显示,中国已经成为了“癌症大国”,新发病例数和死亡例数全球第一。随着现代生物医药技术的发展,肿瘤治疗方式也在不断演变,从传统的手术、放化疗到现代的靶向药物、免疫治疗使肿瘤治疗更加精准、规范,但在治疗的同时也还是会对机体产生一定损伤。随着传统中药、民族药物温和而独特的药效,逐渐受到人们的重视。因此,寻求良好疗效的传统药物,对提升肿瘤的防治效果具有重要的意义。
藏药已有上千年的历史,是我国较为完整、有影响力的民族药之一,通过广泛吸收、融合中医药、印度医药和大食医药并结合藏族先民长期实践所形成的医药体系[1]。早在公元8世纪,仁青常觉记载于著名藏医药学家宇妥·云丹贡布编著的《四部医典》中,详细记录在《利乐之源》,该书记载了本处方的配方和功能主治,至今仍在使用,被称为百病一药、千年古方,又称“药王”。该药组方庞大,由沉香、降香、黄连、诃子、檀香、麝香等160多味生长在青藏高原,天然纯净、稀有珍贵的药材组成,气微香,味甘、微苦、涩,主要功能为清热解毒、调和滋补[2-3],临床主要用于治疗肿瘤、陈旧性胃肠炎、溃疡,“木布”病、萎缩性胃炎、各种中毒症以及梅毒、麻风、炭疽、疖痛等[4-5](如图1所示)。近年来,仁青常觉的抗肿瘤作用日益突显,众多学者对其抗肿瘤作用进行研究,然而仁青常觉组方药材多,抗肿瘤活性成分复杂,多靶点、多通路的抗肿瘤机制尚未得到科学解释。通过文献检索发现其组方中多种药材对多种肿瘤均具有抑制作用,针对此发现,本文通过检索中国知网、万方、PubMed等数据库,创新性的对仁青常觉和它组方中的天然药材及活性成分进行总结归纳,分析其抗肿瘤作用及可能机制(表1),以期为筛选具有抗肿瘤活性的新藏药及临床抗肿瘤新方法提供参考,为未来的抗肿瘤治疗提供思路,并期望提高对民族药物的关注度,发掘更多的民族药物。
1仁青常觉抗肿瘤作用
仁青常觉主要药理作用包括:抗炎、抗溃疡[6-8]、镇痛、抗疲劳、免疫调节[9]、抗肿瘤[10]等。其中在抗白血病方面表现出了显著的作用,张义智等[11]在L615白血病小鼠实验中发现其不仅可以调节T细胞亚群比例,还能促进IL-2,IL-6,IFN-γ等细胞因子分泌,从而起到了较好的免疫调节作用,对白血病的治疗和免疫系统的恢复有显著作用。有研究[12-14]报道,仁青常觉及其石油醚部位、乙酸乙酯部位在体内外实验中对卵巢癌skov3细胞、前列腺癌pc3细胞均有显著的抑制作用,其效果与顺铂相当或略优。临床试验[10]也表明,仁青常觉丸可以有效降低藏族宫颈癌患者血清中的CYFRA1-1和SCC-Ag水平,从而显著改善宫颈癌的症状。
综上,仁青常觉具有显著的抗肿瘤作用,但其作用机制尚不清楚。通过查阅文献资料及书籍发现仁青常觉中部分纯天然药材如沉香、降香、西红花、马钱子、诃子、余甘子、麻花秦艽、小檗皮、黄连、蛇床子、商陆、秦皮、三七、沙棘、肉豆蔻、大高良姜等均具有抗肿瘤成分[15]。故作者总结归纳这些单味药材中活性成分的抗肿瘤作用及作用机制,希望为仁青常觉抗肿瘤作用、作用机制及物质基础提供线索,筛选抗肿瘤特色藏药材,为临床抗肿瘤治疗提供新方法。
2仁青常觉组方药材抗肿瘤作用及机制
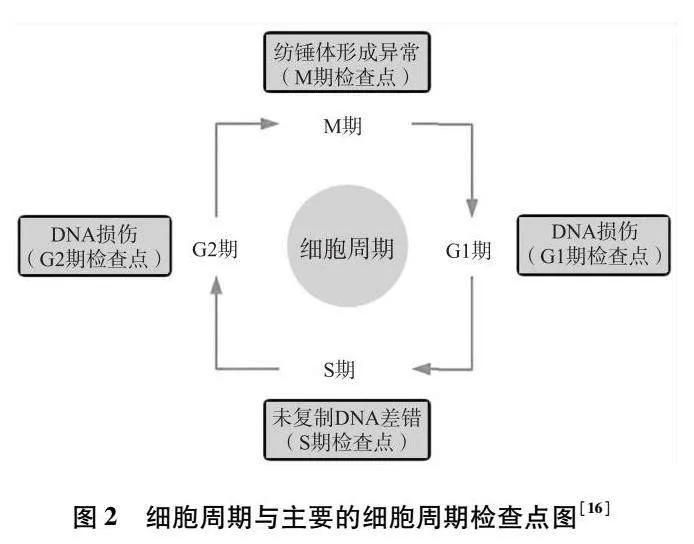
2.1影响细胞周期、抑制肿瘤细胞增殖细胞周期是指细胞从前一次分裂结束起到下一次分裂结束为止的活动过程,肿瘤细胞的增殖周期分为G1、S、G2、M4个时期(如图2所示)。整个周期是一个动态过程,互相关联,不可分割。如果某个阶段的细胞周期受到干扰,细胞增殖则发生障碍。其中G1/S,G2/M和有丝分裂中期/后期的交界处3个调控点最为重要,这些调控点失控就很容易导致肿瘤的发生,所以细胞周期的调控是抑制肿瘤增殖的关键。因此,人们试图在肿瘤细胞增殖周期的不同阶段,采取不同药物干预,影响肿瘤的生长。
降香(Dalbergiaeodoriferaelignum)为仁青常觉中一味重要药材,其叶子、枝条、果实以及种子都具有抗肿瘤作用,主要活性成分为紫铆花素(Butein),紫铆花素对A549和H1650肺癌细胞、MGC803胃癌细胞均有抑制,联合顺铂还可作用于宫颈癌HeLa细胞。不同浓度的紫铆花素抑制EGFR的胞膜表达,降低受体酪氨酸激酶的活性[17],抑制肿瘤细胞增殖,且具有时间和剂量依赖性,其可通过抑制ERK/P38MAPK和XFiGdDsKazxt2A2IpvQgqfsLEZqQ0Ge6vbjdAjTBgMg=PI3K/AKT通路,调节FOXO3a,CyclinB1和CDK1的表达,阻滞G2/M期、G1期肿瘤细胞[18-19]。
G2期合成大量的蛋白质,但此期合成的蛋白与前两期的不同,主要合成着丝粒蛋白质、细胞周期蛋白B和微管蛋白等。其中微管蛋白及微管辅助蛋白可以组成微管,是中空管状结构,在细胞增殖和分化中具有十分重要的作用,微管相关蛋白的异常表达引起微管动态系统的失衡,对肿瘤异常增殖有重要作用。西红花(Crocistigma)又名藏红花,是鸢尾科植株番红花的干燥花蕾,能够起到促进气血流通、消除积滞的作用。研究[20]发现其主要成分藏红花醛(safranal)可干扰宫颈癌HeLa细胞的微管蛋白的二级结构,并抑制其在冷诱导解体后的恢复,阻碍HeLa细胞的再生,从而有效地阻止宫颈癌的生长。
细胞周期蛋白依赖性激酶(cyclin-dependentkinases,CDKs)在调节肿瘤细胞周期方面发挥着极其重要的作用,它是一种蛋白依赖性激酶,可有效地影响和改变细胞周期的运行。小檗皮(Berberiskansuensisschneid)和黄连(Coptidisrhizoma)中都有小檗碱(berberine),通常也被称为黄连素(berberine),能显著抑制乳腺癌MCF7、前列腺癌细胞株PC-3、结直肠癌等多种肿瘤细胞增殖。黄连素(小檗碱)通过促进乳腺癌MCF7细胞p53蛋白的表达,降低CDK抑制蛋白(CDKI)p21的活力,使肿瘤细胞停止于G0/G1期[21]。此外,陆巍等[22]研究表明,黄连素还可以阻滞前列腺癌细胞株PC-3的G/M期,提高FAS蛋白活力,促进癌细胞凋亡。另研究[23]发现黄连素AMPK依赖性途径抑制还能通过mTOR活性和AMPK非依赖性途径抑制核转录因子(NF-κB)信号通路,进而抑制结直肠癌细胞的增殖。
秦皮(Fraxinicortex)也是仁青常觉中的一种重要药材,其主要成分秦皮乙素能够调节P53和P1的表达,有效抑制CDK1和cyclinB1的活性,阻止乳腺癌ZR-75-1细胞进入G2/M期发挥抗肿瘤作用[24]。
沙棘(Hippophaefructus)为胡颓子科植物沙棘的干燥成熟果实,可以起到止咳、祛痰、活血散瘀的作用,而主要成分槲皮素(quercetin)则被证明可以抑制肿瘤细胞的生长[25],研究[26-28]表明,槲皮素对鼻咽癌CNE2细胞、乳腺癌MDA-MB-435s细胞和人膀胱癌BIU-87细胞有抑制作用,可能是通过将肿瘤细胞阻滞在G1、S、G2/M期从而抑制增殖,且呈一定的剂量和时间依赖性。
2.2促进肿瘤细胞凋亡细胞凋亡是多种基因激活和表达调控下发生的自主有序的死亡过程[29],主要有三大途径,包含线粒体介导、死亡受体介导和内质网应激介导。
在线粒体介导凋亡通路中,细胞凋亡是由B淋巴细胞瘤-2(B-celllymphoma-2,Bcl-2)蛋白质家族所引起的,这些蛋白质能够控制凋亡。该家族的蛋白不仅包括抑凋亡蛋白Bcl-2、Bcl-xl、Bcl-w等,还包括Bcl-2相关X蛋白(bcl-2AssociatedXProtein,Bax)、Bak(bcl-2homologousantagonist/killer),Bad(bcl-2antagonistofcelldeath)等促细胞凋亡的蛋白。而其中Bcl-2、Bcl-xl、Bax、Bak是该家族的主要成员。通过分子靶向治疗,可以有效地调节细胞内凋亡信号通路,从而有效地抑制、减缓或阻止肿瘤的进展[30]。
蛇床子(Cnidiifructus)是一种伞形科植物,它的成熟果实的提取物被证实有抗癌作用。蛇床子素(Osthole)作为其重要化学成分,对多种癌细胞有促凋亡作用,在肾癌ACHN和786-O细胞、人慢性髓系白血病K562细胞、宫颈癌Hela细胞及人骨肉瘤细胞株SAOS-2中[31-34],它可以提高细胞中Bax蛋白的表达,降低Bcl-2蛋白的表达,通过线粒体通路诱导肿瘤细胞凋亡。
西红花(Crocistigma)中的西红花苷(crocin)被证实有促进肿瘤细胞凋亡的作用。它通过下调癌细胞中Bcl-2和microRNA-365的表达,上调Bax和p53的表达促进胃癌细胞BGC-823凋亡[35]。此外,西红花苷也能够影响p-Akt、p-mTOR和p-p70核糖体蛋白S6激酶的表达,抑制PI3K/AKT/mTOR信号通路,从而促进肝癌HCC细胞的自噬凋亡[36]。
STAT3是信号传导和转录激活因子(STAT)家族的主要成员,是许多细胞因子(IL-6、IL-10和IL-11等)、生长因子(FGF、VEGF等)以及一些原癌基因(K-Ras、Src和cAbl等)激活的信号通路的汇合点。在致癌信号的刺激下,STAT3会被持续的激活,以活化的状态恒定存在于细胞核中,持续激活靶基因,促进肿瘤细胞增长,抑制细胞凋亡。其中最经典的肿瘤相关通路为白介素-6(IL-6)/转录激活因子3(STAT3)通路,而马钱子(Strychnisemen)中的马钱子碱能够有效地激活IL-6/STAT3通路的活性,进而阻断人体细胞内STAT3的磷酸化,进而诱发人结肠癌细胞HT-9的凋亡[37]。另马钱子碱也能通过减少CyclinD1、CyclinEmRNA以及它们与之相互作用的基因表达阻止人肺癌PC-9细胞的增殖,进而促使它们的凋亡[38]。
Caspase是一类存在于胞质中的半胱氨酸天冬氨酸特异性蛋白酶,在功能上分为诱导Caspase(caspase8、9和10)和效应Caspase(caspase3、6和7)。caspase的执行分子产生凋亡的细胞形态,包括膜泡、细胞收缩、‘凋亡小体’的形成和染色体DNA片段的形成。“解吉嘎保”-麻花秦艽(GentianastramineaMaxim)别名大叶秦艽、麻花艽,它的根部及花朵可供药物使用,能够起到清热利胆、舒筋止痛的疗效,而且它的主要成分獐牙菜苷(Swertiaglycosides)还能够显著地抑制胶质母细胞瘤U251细胞的生长[39]。它可显著提高Caspase-3、DNA修复酶PARP的含量,同时有效阻断Bcl-2的抗凋亡活性,激活Bax,从而引起肿瘤细胞凋亡,达到治疗急性髓系白血病(AML)的目的[40]。
诃子(Chebulaefructus)和余苷子(Phyllanthifructus)中均有没食子酸(gallicacid,GA)这一重要的抗癌成分,在K562、HL-60白血病细胞中,通过增加癌细胞中Caspase-3、Caspase-8和Caspase-9的表达,改变Bcl-2/Bax的比例,下调COX-2水平,促进肿瘤细胞凋亡[41-42]。在对肺癌95-D细胞、A549细胞和NCI-H460细胞抑制作用的实验中,既能刺激ROS大量生成,导致Fas及FasL蛋白的表达上调,Caspase-8活性增高,也通过抑制转化生长因子-β1蛋白的活性,解除转化生长因子-β1蛋白对Fas及FasL蛋白表达的抑制作用[43]。Cheng-zhenLiang在GA体外对卵巢癌U-20S和MNNG/HOS细胞进行了深入的研究[44]发现,没食子酸可以有效地阻断细胞外信号调节激酶1(ERK1)和c-Jun氨基末端激酶(JNK)的信号传导,同时也可以促进p38的信号传导,从而促进卵巢癌的凋亡。Topo-2(拓扑异构酶II)是肿瘤重要调节功能的位点,参与染色体凝聚、染色单体分离以及减轻DNA转录和复制过程中产生的扭应力等过程,从而抑制细胞凋亡,没食子酸能够有效地阻止Topo-2的产生,从而有助于提高人肝癌HepG2细胞肿瘤的凋亡率[45]。
丝裂原活性蛋白质激酶(mitogenactivatedproteinkinase,MAPK)的活性可能会影响凋亡的过程,而这种活性的变化可能会对肿瘤的形成和进程产生重要影响。肉豆蔻(Myristicaesemen)中的13-甲基肉豆蔻酸(13-methyltetradecanoicacid13-MTD),又称13-甲基十四烷酸,对乳腺癌、膀胱癌、宫颈癌以及多种恶性癌症均有作用[46],能通过激活JNK和p38激酶,进而激活MAPK的途径来诱导乳腺癌MFC-7细胞和膀胱癌细胞株T24细胞凋亡[47-48]。另翁绳美等[49]发现13-MTD通过抑制肿瘤线粒体CPT-1酶的活性,对宫颈癌U14肿瘤也有显著的抗癌活性。
沉香(Aquilariaelignumresinatum)可以起到调节身体内部的作用,如行气止痛、温中止呕、纳气平喘等。β-石竹烯(β-caryophyllene)作为其有效成分,是一种多功效的物质,它可以抵御癌细胞的生长,并且还可以抵御自由基的侵袭。研究[50]表明,在人结肠癌HCT116、HT29细胞、人胰腺癌PANC-1细胞中,它均可以通过核浓缩、片段化以及调节线粒体膜电位的途径诱导细胞凋亡。
2.3抑制肿瘤细胞侵袭、转移侵袭与转移是肿瘤扩散的过程,抑制肿瘤的扩散可以通过多种途径,包括:①调节肿瘤细胞的上皮间质转化(epithelial-mesenchymaltransition,EMT);②抑制肿瘤细胞与基质成分的黏附;③抑制基质金属蛋白酶(MMPs)对基底膜和细胞外基质(ECM)的水解;④调控与肿瘤转移相关基因的表达;⑤抑制肿瘤细胞迁移能力[30]。
在癌症的发展过程中,表面受体会通过分析层连蛋白(LN)和纤维粘连蛋白(FN)发挥识别和粘连作用,然后结合到IV型胶原上,从而使得粘在细胞表面的恶性肿瘤得以存活、不被清除,从而获得了侵袭性,通过血液和淋巴循环蔓延到远处。肿瘤完成转移,必须穿过正常细胞或细胞外基质,特别是穿过血管内壁的基底膜。
Arzi等[51]研究发现,西红花(Crocistigma)中的西红花苷(crocin)能显著抑制三阴性转移性乳腺癌细胞4T1的转移扩散,是通过抑制细胞外基质的黏附和细胞外因子(Wnt)/β-连环蛋白途径信号通路实现的。
MMPs是肿瘤浸润和转移的主要水解酶,具有极强的降解功效,可以有效地清除ECM中的多种蛋白,破坏癌细胞侵袭的屏障,加速肿瘤细胞的侵袭和转移。三七(Notoginsengradixetrhizoma)是一种多功效的药材,它的多功效包括抗癌、抗炎、止血、抗衰老,而它的最重要的功效就是三七总皂苷(panaxnotoginsengsaponins,PNS),龚春香等[52]学者发现它可以明显降低人肺腺癌A549细胞MMP-2和MMP-9的mRNA和蛋白的表达,阻止肺腺癌细胞的扩散和复发。
EMT指上皮到间质细胞的转化,它赋予细胞转移和入侵的能力,在EMT过程中,肿瘤细胞的细胞黏附分子的表达逐渐减少,并获得间充质表型以及迁移和侵袭能力,能使癌细胞脱离原发肿瘤并在其他地方形成转移瘤。贾雪峰等[53]研究发现仁青常觉组方药材沙棘(Hippophaefructus)中的槲皮素(quercetin)通过调控PI3K/AKT信号传导通路抑制TGFβ-1诱导的人胃癌BGC-803细胞上皮间质转化(EMT),降低人胃癌细胞的增值能力、迁移能力,抑制肿瘤细胞转移。
2.4调节肿瘤免疫微环境肿瘤微环境(tumormicroenvironment,TME)是指由肿瘤细胞及其周围的免疫、炎症细胞,肿瘤相关的成纤维细胞(CAFs)和附近的间质组织(ECM)、微血管以及各种细胞因子和趋化因子构成的一个复杂综合系统,包括以免疫细胞为主的免疫微环境和成纤维细胞为主的非免疫微环境[54]。TME不仅仅指肿瘤细胞本身,而且还包括肿瘤周围的环境,肿瘤生长所需的营养,免疫、炎症等细胞间质和微小的血管等为肿瘤的生长、发展提供了必要的条件。肿瘤细胞能够通过释放特定的细胞因子来调节原有的生存环境,提高自身的存活能力,还能够激发机体的免疫逃逸,帮助癌症细胞持续繁衍[55]。(如图3所示iPFPjoTj0KnlIrjQI8jLzyPKUPAo0DObhF+Ltin2mM0=)
肿瘤相关免疫细胞:包括巨噬细胞、T细胞、B细胞、自然杀伤细胞(NKCells)和肿瘤相关中性粒细胞(TANCells)等,参与肿瘤免疫反应,影响肿瘤微环境,调控肿瘤生长、转移。近年来,随着肿瘤在免疫学领域的研究不断深入,已经涉及到脾脏、胸腺、淋巴细胞(T,B,Mφ,NK,CD4,CD8)、巨噬细胞、白细胞介素-2(IL-2)、IL-6、IL-10、IL-12、肿瘤坏死因子-α(TNF-α)等。商陆(Phytolaccaeradix)被称为夜呼和当陆,它具有多种功效,包括改善水肿、消化障碍、臃肿和消除疮疡。研究[57]表明,商陆多糖(PAP-I)可以激发小鼠的脾淋巴细胞产生IL-2和集落刺激因子(CSF),活化T淋巴细胞分泌IL-2、IL-3,提高机体的免疫活性发挥抗肿瘤作用。秦皮(Fraxinicortex)中的秦皮乙素(aesculetin,ESC)可以通过免疫调节作用发挥抗肿瘤作用[58],降低骨肉瘤LM8细胞M2巨噬细胞分化中IL-10、MCP-1和TGF-β1的表达而发挥抗肿瘤作用[59]。大高良姜(Alpiniagalanga)作为仁青常觉中的药材之一,花朵可制成香料,从它的种子红豆蔻中提取的精油中含有化合物乙酰氧基胡椒酚乙酸酯(ACA),ACA具有很高的抗癌活性[60],可以有效地阻断小鼠腹膜巨噬细胞释放一氧化碳,从而抵御小鼠腹膜巨噬细胞[61],进而阻断肿瘤相关巨噬细胞助长癌变。
2.5抗肿瘤血管生成研究[30]表明,抑制肿瘤新生血管生成是阻止肿瘤扩散的重要手段。新生血管的生成与血管内皮生长因子(VEGFs)、碱性成纤维细胞生长因子(bFGF)和Ephrin(eph)等有关。
秦皮(Fraxinicortex)中的秦皮乙素(aesculetinESC)对多种肿瘤均有治疗作用。研究[62]结果显示,秦皮乙素能抑制TGF-1及VEGF的作用,有效地阻止骨肉瘤LM8细胞的转移与侵袭。
2.6逆转化疗药物耐药性肿瘤细胞耐药常常是导致肿瘤复发和化疗失败的主要原因[63]。肿瘤耐药可能和肿瘤细胞内药物浓度下降、耐药基因和蛋白质表达发生变化、代谢过程增强以及DNA损伤修复功能失常等有关。现代研究[30]表明中药可以通过以下途径逆转耐药:①调节DNA损伤修复相关蛋白、基因表达;②下调多药耐药基因及其编码的糖蛋白表达;③调节抗凋亡通路的激活或抗凋亡基因表达等。
P-糖蛋白(P-gp)是一类重要的多药耐药转运蛋白,它们能够促进细胞内药物的有效转运,将药物转运到细胞外,从而减少药物的胞内积累,降低治疗效果,并引起药物耐药。延胡索(Corydalisrhizoma)中的延胡索乙素(etrahydropalmatine)可降低人乳腺癌细胞阿霉素耐药株MCF-7/ADM的P-gp蛋白表达,逆转乳腺癌细胞对阿霉素的耐药性[64]。
丝裂原活化蛋白激酶(mitogenactivatedproteinkinase,MAPK)信号传导通路在肿瘤的发生与发展中起着重要作用。它可以激活和抑制细胞内信息转录途径,从而影响细胞内信息转录的过程。MAPK包括细菌外信息调控激酶(extracellularregulatedkiNase,ERK)、应激活化蛋白激酶(c-Junn-terminalkinase,JNK)与p38丝裂原活化蛋白激酶(p38MAPK)这3个主要家族成员。活化的JNK通过对转录因子氨基末端激酶(c-Jun)、活化转录因子(ATF)、重组蛋白(Elk)等的磷酸化来促进或引起细胞凋亡[65]。陈思翰等[66]研究发现,沙棘(Hippophaefructus)中的木犀草素(luteolin)可以促进顺铂诱导HepG2细胞内p-JNK蛋白的活化,从而降低耐药性提高对肝癌杀伤作用。还可以显著降低CCNE的活跃度,从而提高药物他莫昔芬的抗乳腺癌能力[67],为逆转化疗药物耐药性,促进化疗药抗癌活性提供了一种新的思路。
3结语与展望
藏药通过扶正补益、清热解毒、活血化瘀等多种途径抑制肿瘤增殖,促进肿瘤细胞凋亡,增强身体免疫力,在扶正益气的同时可以减轻毒性,无明显不良反应,潜力巨大,是值得深入研究的抗肿瘤药物。近年来,全球各肿瘤学家纷纷聚焦藏药,探索藏药治疗肿瘤作用及机制,并从中筛选更多的抗肿瘤活性药物。
被称为藏药中的“百病克星,藏药之王”的仁青常觉是国家中药专利保护品种,该药主要由天然牛黄、麝香、红花、熊胆等160多种天然名贵药材精制而成。一千多年的临床实践证明,不但能有效解决胃肠疑难杂症,而且对各种肿瘤具有独特疗效。仁青常觉临床疗效可观,副作用少,然而由于其中的有效成分作用靶点十分复杂,因此,目前还无法完全定义其独特的功能,其机制可能是多通路、多靶点的(如图4所示)。在仁青常觉所含单味药材中,含有槲皮素的单味药材包括:沙棘、麻花秦艽、三七、镰形棘豆、大高良姜、肉豆蔻、黄连、沉香;含有没食子酸的单味药材包括:诃子、毛诃子、余苷子、黄连、沙棘、肉豆蔻、含有木犀草素的单味药材包括:麻花秦艽、镰形棘豆、沉香、黄连、沙棘;可以看出较多药材中均含有槲皮素、没食子酸、木犀草素这3种活性单体,它们可能是比较重要的有效成分,对仁青常觉抗肿瘤作用及机制的研究具有一定的提示意义。
目前,关于仁青常觉的抗肿瘤研究仍然相当有限,因此,未来应当加大力度,充分利用现代技术,精准分离出仁青常觉的有效成分,并且深入探索其中的有效部位及其对抗肿瘤的有效化合物,以期望能够更好地揭示其抗肿瘤的机理,从而为抗击dzlbtj/3Lc9B62MTSkVaT5GUGlPQyj23jqmwYsruug8=肿瘤带来更有效的治疗方案和途径。
参考文献
[1]颜承云,谷继伟,宗希明,等.我国民族药资源概述[J].黑龙江医药科学,2003(6):46-47.
[2]扎西次仁,贡布,陈燕.藏药仁青常觉丸的定性鉴别[J].中国民族医药杂志,2005(4):31-32.
[3]尼珍,阿萍,格桑索朗.HPLC测定藏药仁青常觉中西红花苷Ⅰ的含量[J].中成药,2010(8):1445-1446.
[4]李国霞.调理脏腑之王,仁青常觉[J].家庭医药,2010(12):37-38.
[5]陈仁寿.新编临床中成药学[M].北京:科学出版社,2012:72.
[6]王杰琼,王美艳,薛玲,等.仁青常觉对慢性萎缩性胃炎模型大鼠胃黏膜病理学的影响[J].山东中医药大学学报,2015,39(4):358-360.
[7]李莉,赵军宁,宋军,等,仁青常觉抗胃溃疡作用研究[J].中药药理与临床,2007(6):5-7.
[8]魏盛,朱德豪,张克升,等.仁青常觉治疗MNNG致大鼠慢性萎缩性胃炎的实验研究[J].中药新药与临床药理,2015,269(1):52-56.
[9]孙鹏,付琼玲,薛玲.仁青常觉镇痛、抗疲劳、免疫作用药理研究[J].山东中医药大学学报,2014,38(4):400-402.
[10]陈华,周措吉.仁青常觉丸治疗藏族宫颈癌患者的临床研究[J].中国临床药理学杂志,2020,36(3):240-242.
[11]张义智,邵成雷,单玉刚,等.一种藏药仁青常觉及其制剂在制备治疗白血病药物中的应用[P].山东:CN103623143A,2014-03-12.
[12]吴洪革,马宏伟,付素心.仁青常觉治疗卵巢癌的作用研究[J].中国医学创新,2014,11(27):22-24.
[13]张义智,单玉刚,付素心,等.仁青常觉在制备治疗卵巢癌药物中的应用[P].山东省:CN103623144B,2016-03-30.
[14]王海苹,邵成雷,姬涛,等.仁青常觉在制备治疗前列腺癌药物中的应用[P].山东:CN103610849A,2014-03-05.
[15]国家药典委员会.中国药典(一部)[S].北京:中国医药科技出版社,2010:573-574.
[16]朱虹,缪泽鸿,丁健.ATM、ATR和DNA损伤介导的细胞周期阻滞[J].生命科学,2007(2):139-148.
[17]李伟,刘文斌,刘海丹.紫铆因靶向EGFR和AuroraA/B信号通路抑制非小细胞肺癌的研究[J].生命科学研究,2016,20(5):418-423.
[18]代祥军,徐晓刚,张军,等.紫铆因调控PI3K/AKT通路抑制人胃癌细胞增殖[J].基因组学与应用生物学,2019,38(10):4715-4719.
[19]ZHANGL,YANGX,LIX,etal.ButeinsensitizesHeLacellstocisplatinthroughtheAKTandERK/p38MAPKpathwaysbytargetingFoxO3a[J].IntJMolMed,2015,36(4):957-966.
[20]陈莹,张怡婷,开国银,等.西红花等级标准与抗肿瘤药效的研究进展[J].植物生理学报,2021,57(7):1385-1392.
[21]SAKAGUCHIM,KITAGUCHID,MORINAMIS,etal.Berberine-inducednucleolarstressresponseinahumanbreastcancercellline[J].BiochemBiophysResCommun,2020,528(1):227-233.
[22]陆巍,廉吉虎,王潇然,等.黄连素通过诱导G0/G1或G2/M期阻滞抑制前列腺癌细胞株PC-3的增殖作用分析[J].中国现代药物应用,2022,16(5):250-252.
[23]HUANGC,WANGXL,QIFF,etal.Berberineinhibitsepithelialmesenchymaltransitionandpromotesapoptosisoftumourassociatedfibroblast-inducedcolonicepithelialcellsthroughregulationofTGF-βsignaling[J].JCellCommunSignal,2020,14:53-66.
[24]CHANGHT,CHOUCT,LINYS,etal.Esculetin,anaturalcoumarincompound,evokesCa2+movementandactivationofCa2+-associatedmitochondrialapoptoticpathwaysthatinvolvedcellcyclearrestinZR-75-1humanbreastcancercells[J].TumorBiol,2016,37(4):4665-4678.
[25]孙阳,车艳新,吴勃岩.槲皮素抗肿瘤药理作用及剂型研究进展[J].现代医药卫生,2016,32(20):3142-3144.
[26]顾生玖,建楠,姚丽新,等.金槐米槲皮素对人鼻咽癌细胞的干预作用研究[J].安徽农业科学,2012(18):9639-9640,9668.
[27]李世正,李昆,张俊华,等.槲皮素在人乳腺癌细胞中抑制增殖和诱导凋亡的作用[J].中国普外基础与临床杂志,2009,16(2):124-128.
[28]柯尊金,丁心喜,董文奎,等.槲皮素对人膀胱癌BIU-87细胞增殖和凋亡的影响[J].实用癌症杂志,2008(2):116-118.
[29]YAOC,CAOX,FUZ,etal.BoschniakiarossicapolysaccharidetriggerslaryngealcarcinomacellapoptosisbyregulatingexpressionofBcl-2,Caspase-3,andP53[J].MedSciMonit,2017(23):2059-2064.
[30]李小江,邬明歆,孔凡铭,等.中药有效成分抗肿瘤活性及作用机制研究进展[J].中草药,2020,51(9):2587-2592.
[31]潘莉萍,郭静明,袁伟.蛇床子素通过抑制PI3K/AKT信号通路诱导K562细胞凋亡和增殖抑制[J].临床血液学杂志,2016,29(3):232-234.
[32]王大维,梅丽君,温成平.蛇床子素诱导Hela细胞凋亡及其机制研究[J].江西中医药大学学报,2014,26(3):82-84.
[33]LIUL,MAOJ,WANGQ,etal.Invitroanticanceractivitiesofostholeagainstrenalcellcarcinomacells[J].BiomedPharmacother,2017(94):1020-1027.
[34]吕怡凝,刘天华,彭燕丽,等.蛇床子素促进人骨肉瘤细胞株SAOS-2凋亡[J].现代生物医学进展,2017,17(11):2012-2015.
[35]陈莹,张怡婷,开国银,等.西红花等级标准与抗肿瘤药效的研究进展[J].植物生理学报,2021,57(7):1385-1392.
[36]YAOC,LIUBB,QIANXD,etal.CrocininducesautophagicapoptosisinhepatocellularcarcinomabyinhibitingAkt/mTORactivity[J].OncoTargetsTher,2018(11):2017-2028.
[37]王雪,金朗,王炳强.马钱子碱对人结肠癌细胞HT-29增殖与凋亡的影响及相关机制[J].中国老年学杂志,2017,37(17):4194-4196.
[38]李苗,李平,张梅,等.马钱子碱通过阻滞细胞周期抑制人肺癌细胞株PC-9增殖[J].中国肺癌杂志,2014,17(6):444-450.
[39]OUYANGZ,XUG.AntitumoreffectsofSwerosideinhumanglioblastoma:itseffectsonmitochondrialmediatedapoptosis,activationofdifferentcaspases,G0/G1cellcyclearrestandtargetingJNK/p38MAPKsignalpathways[J].BUON,2019,24(5):2141-2146.
[40]HANXL,LIJD,WANGWL,etal.Swerosideeradicatedleukemiacellsandattenuatedpathogenicprocessesinmicebyinducingapoptosis[J].Biomedicine&ampPharmacotherapy,2017(95):477-486.
[41]CHANDRAMOHANREDDYT,BHARATREDDYD,APARNAA,etal.Anti-leukemiceffectsofgallicacidonhumanleukemiaK562cells:downregulationofCOX-2,inhibitionofBCR/ABLkinaseandNF-κBinactivation[J].ToxicolInVitro,2012,26(3):396-405.
[42]YEHRD,CHENJC,LAITY,etal.GallicacidinducesG0/G1phasearrestandapoptosisinhumanleukemiaHL-60cellsthroughinhibitingcyclinDandE,andactivatingmitochondriadependentpathway[J].AnticancerRes,2011,31(9):2821-2832.
[43]郗艳丽.没食子酸诱导肺癌细胞凋亡机制及其应用的研究[D].长春:吉林大学,2012.
[44]LIANGCZ,ZHANGX,LIH,etal.GallicAcidInducestheApoptosisofHumanOsteosarcomaCellsInVitroandInVivoviatheRegulationofMitogen-ActivatedProteinKinasePathways[J].CancerBiotherRadiopharm,2012,10(27):701-710.
[45]Ramirez-MaresMV,ChandraS,dcMejiaEG.InvitrochemopreventiveactivityofCamelliasinensis,IlexparaguariensisandArdisiacompressateaextractsandselectedpoly-phenols[J].MutationResearch2004(554):53-65.
[46]YANGZH,LIUSP,CHENXD,etal.Inductionofapoptoticcelldeathandinvivogrowthinhibitionofhumancancercellsbyasaturatedbranched-chainfattyacid,13-methyltetrade-canoicacid[J].CancerRes,2000,60(3):505-509.
[47]蔡清清,林天歆,范新兰,等.13-MTD通过激活MAPK途径和抑制Akt存活途径诱导乳腺癌MFC-7细胞凋亡[J].中国病理生理杂志,2009,25(5):873-876.
[48]尹心宝,林天歆,许可慰.13-甲基十四烷酸诱导膀胱癌细胞株T24凋亡的机制研究[J].中国病理生理杂志,2009,25(7):1266-1270.
[49]翁绳美,孙建成,黄自强.13-甲基肉豆蔻酸抗小鼠宫颈癌U14[J].福建医科大学学报,2006,40(1):33-36.
[50]DAHHAMSS,TABANAYM,IQBALMA,etal.Theanticancer,antioxidantandantimicrobialpropertiesofthesesquiterpeneβ-caryophyllenefromtheessentialoilofAquilariacrassna[J].Molecules,2015,20(7):11808-11829.
[51]ARZIL,RIAZIG,SADEGHIZADEHM,etal(2018).Acomparativestudyonanti-invasion,antimigration,andantiadhesioneffectsofthebioactivecarotenoidsofsaffronon4T1breastcancercellsthroughtheireffectsonWnt/β-cateninpathwaygenes[J].DNACellBiol,37(8):697-707.
[52]龚春香,徐微微,邵馨.三七总皂苷对A549细胞侵袭转移的影响及机制研究[J].中国医药导报,2018,15(28):17-20.
[53]贾雪峰,陈文明,孙道萍,等.槲皮素抑制胃癌上皮-间质转化的研究[J].海南医学院学报,2015,21(8):1030-1032.
[54]ALBINIA,MAGNANIE,NOONANDM.Thetumormicroenvironment:biologyofacomplexcellularandtissuesociety[J].QJNuclMedMolImaging,2010,54(3):244-248.
[55]李晓玲,吴玉泓,郝民琦,等.中医药调控肿瘤微环境延缓结肠炎-癌转化的研究概况[J].中医药学报,2022,50(3):97-102.
[56]郭光然,张兰军.非小细胞肺癌的免疫微环境与免疫治疗[J].中国临床新医学,2022,15(3):193-197.
[57]王洪斌,郑钦岳,鞠佃文,等.商陆多糖I对小鼠脾淋巴细胞增殖及脾淋巴细胞,巨噬细胞分泌细胞因子的影响[J].药学学报,1993(10):732-737.
[58]BHATTACHARYYASS,PAULS,DEA,etal.Poly(lactide-co-glycolide)acidnanoencapsulationofasyntheticcoumarin:cytotoxicityandbio-distributioninmice,incancercelllineandinteractionwithcalfthymusDNAastarget[J].ToxicolApplPharmacol,2011,253(3):270-281.
[59]KIMURAY,SUMIYOSHIM.Antitumorandantimetastaticactionsofdihydroxycoumarins(esculetinorfraxetin)throughtheinhibitionofM2macrophagedifferentiationintumor-associatedmacrophagesand/orG1arrestintumorcells[J].EuropeanJournalofPharmacology,2015,746(3):115-125.
[60]林新花,蔡明招.大高良姜营养成分的分析研究[J].食品科技,2003(5):102.
[61]SHINA.HISASHIM,1′S-1′-Acetoxychavicolacetateasanewtypeinhibitorofinterferon-bproductioninlipopolysaccharide-activatedmouseeritonealmacrophages[J].Bioorganic&MedicinalChemistry,2005(13):289-294.
[62]KIMURAY.SUMIYOSHIM.Antitumorandantimetastaticactionsofdihydroxycoumarins(esculetinorfraxetin)throughtheinhibitionofM2macrophagedifferentiationintumor-associatedmacrophagesand/orG1arrestintumorcells[J].EuropeanJournalofPharmacology,2015,746(3):115-125.
[63]WANGJ,WUL,KOUL,etal.Novelnanostructuredenoxaparinsodium-PLGAhybridcarriersovercometumormultidrugresistanceofdoxorubicinhydrochloride[J].IntJPharm,2016,513(1-2):218-226.
[64]张晓丽,曹国宪,俞惠新,等.延胡索乙素对人乳腺癌细胞MCF-7摄取99Tcm-MIBI的影响[J].中华核医学杂志,2006,26(5):313.
[65]HONGJY,LEBOFSKYM,FARHOEDA,etal.Oxidantstress-inducedliverinjuryinvivo:roleofapoptosis,oncoticnecrosis.andc-JunNH2-termlnalkineseactivation[J].AmJPhysiolGaatrointestLiverPhysiol,2009.296(3):572-581.
[66]陈思翰,朱德东,付丽云.木犀草素对顺铂诱导肝癌HepG2细胞凋亡的增敏作用及机制[J].中国临床药理学杂志,2018,34(14):1637-1640.
[67]TUSH,HOCT,LIUMF,etal.LuteolinsensitisesdrugresistanthumanbreastcancercellstotamoxifenviatheinhibitionofcyclinE2expression[J].FoodChemistry,2013,141(2):1553-1561.
(收稿日期:2023-12-05编辑:陶希睿)
基金项目:西藏自治区藏医药方向科技重大专项(XZ202101ZD0016G);西藏自治区自然科学基金重点项目(XZ202101ZR0076G)。
作者简介:徐姣姣(1991—),女,汉族,硕士,研究方向为藏药药效学与机制研究。E-mail:2385178180@qq.com
通信作者:赵勤(1970—),女,汉族,药理学教授,硕士研究生导师,研究方向为藏药开发与高原病的药物干预研究。E-mail:xyzhaoqin@126.com
