低温弱光对西瓜光合生理特性的影响
2024-10-25倪栋杨洁朱素英刘琛李静张曼
摘 要:为探讨低温弱光对西瓜光合生理特性的影响,以西瓜品种早佳(8424)为材料,研究不同温度(10、15、25 ℃)和不同光照强度(100、200 µmol·m-2·s-1)对西瓜幼苗的形态、光合指标以及抗氧化酶活性的影响。结果表明,不同低温、弱光或低温弱光复合胁迫均显著抑制西瓜幼苗生长。与对照相比,低温弱光复合胁迫(10 ℃,100 µmol·m-2·s-1)处理7 d,幼苗株高、茎粗、叶面积、地上鲜质量、株干质量、根鲜质量、根干质量分别降低28.7%、29.7%、39.1%、43.6%、60.0%、68.8%和47.7%。与对照相比,PSII最大光化学效率(Fv/Fm)和光化学猝灭系数(qP)在低温弱光处理下均呈现下降趋势。叶绿素a和总叶绿素(Chl a+b)含量降低,叶绿素a/b升高,叶绿素b含量在所有处理下变化幅度不明显。净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)在低温弱光处理下总体上显著降低,气孔导度(Gs)和蒸腾速率(Tr)在弱光胁迫下略有升高,但仍显著低于对照。与对照相比,胞间CO2浓度(Ci)和丙二醛(MDA)含量在弱光胁迫下均显著升高。综合分析,低温弱光影响西瓜生长,在低温条件下,弱光胁迫对西瓜幼苗根系生长影响最大;而在弱光条件下,温度越低对西瓜幼苗地上部生长和光合速率影响最大。
关键词:西瓜;低温;弱光;生长指标;光合特性;生理特性
中图分类号:S651 文献标志码:A 文章编号:1673-2871(2024)10-063-07
收稿日期:2024-01-08;修回日期:2024-05-17
基金项目:江苏现代农业西甜瓜产业技术体系沛县推广示范基地(JATS﹝2022﹞078)
作者简介:倪 栋,男,推广研究员,主要研究方向为西瓜甜瓜栽培技术。E-mail:pxnwyyc@163.com
通信作者:张 曼,女,副研究员,主要研究方向为西瓜抗病分子育种。E-mail:fldzm04@126.com
Effects of low temperature and weak light combined stresses on photosynthetic physiological characteristics of watermelon
NI Dong1, YANG Jie1, ZHU Suying1, LIU Chen1, LI Jing1, ZHANG Man2
(1. Peixian Bureau of Agriculture and Rural Affairs, Peixian 221600, Jiangsu, China; 2. Jiangsu Key Laboratory for Horticultural Crop Genetic Improvement/Institute of Vegetable Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, Jiangsu, China)
Abstract: In order to study the effects of low temperature and weak light on the photosynthetic physiological characteristics of watermelon, the watermelon variety Zaojia(8424)was used as the material, and three different temperature(10, 15, 25 ℃) and two different weak light stresses(100, 200 µmol·m-2·s-1) were used to investigate their effects on the morphology, photosynthetic indicators, and antioxidant enzyme activity of watermelon seedlings. The results showed that different low temperatures, weak light, or low temperature and weak light combined stresses significantly inhibited the growth of watermelon seedlings. Compared with the control, the plant height, stem diameter, leaf area, fresh mass, dry mass, root fresh mass, and dry mass of seedlings after 7 days of low temperature and weak light combined treatment(10 ℃, 100 µmol·m-2·s-1) decreased by 28.7%, 29.7%, 39.1%, 43.6%, 60.0%, 68.8%, and 47.7%, respectively. The maximum photochemical efficiency(Fv/Fm)and photochemical quenching coefficient(qP)of PSII both showed a decreasing trend under low temperature and weak light combined treatment. The content of chlorophyll a and total chlorophyll(Chl a+b) decreased, while chlorophyll a/b increased. There was no significant difference in the changes of chlorophyll b content under all treatments. The net photosynthetic rate(Pn), stomatal conductance(Gs), and transpiration rate(Tr)significantly decreased overall under low temperature and weak light treatment, while slightly increased under weak light stress, but still significantly lower than the control. The intercellular CO2 concentration(Ci)and malondialdehyde(MDA) content both significantly increased. In total, low temperature and weak light affect the growth of watermelon. Under low temperature conditions, weak light stress has the greatest impact on the root growth of watermelon seedlings; while under weak light conditions, the lower the temperature, the greater the impact on the aboveground growth and photosynthetic rate of watermelon seedlings.
Key words: Watermelon; Low temperature; Weak light; Growth index; Photosynthetic characteristics; Physiological characteristics
西瓜是全球重要的园艺作物,在我国的种植面积和产量均居全球首位,在促进农民增产增收和农业产业结构调整升级中发挥重要作用[1-2]。随着设施农业的发展,西瓜栽培面积呈现逐年增加的趋势[3]。西瓜不耐低温[1],在冬春季育苗和栽培生产中,低温和弱光胁迫频繁发生,影响西瓜根系活力,使地上部生长受阻,造成西瓜幼苗长势弱甚至死苗,对西瓜育苗及生产造成严重危害,已成为西瓜冬春季育苗及栽培生产的主要环境限制因素[4]。因此,开展低温弱光胁迫对西瓜幼苗生长和生理特性影响的研究显得十分必要。
温度和光照是影响植物生长的重要环境因素[5]。低温严重影响植物的生长过程,造成植物生长发育受阻,产量和品质下降[6]。研究表明,低温对植物的生物膜系统、细胞渗透调节物质、抗氧化系统造成一定影响[7-9]。同时,低温还会影响光能吸收、气体交换和碳同化等光合作用的多个环节[10]。王薇薇等[11]、贾蓝溪等[12]研究表明,低温影响西瓜幼苗生长,造成叶片卷曲、萎蔫、叶柄弯曲,幼苗的生长量降低,光合速率下降。李爱民等[13]研究表明,低温弱光胁迫严重损害西瓜叶片的主脉结构。刘叶琼等[14]研究表明,低温胁迫加剧了叶绿素的降解,叶片数和叶面积随着温度的降低而减少。因此,低温胁迫对西瓜的影响体现在多个方面,目前的研究多围绕低温等单因素开展,而对于低温弱光的复合胁迫研究相对较少。为全面了解西瓜幼苗在不同低温弱光胁迫下的适应能力,笔者从西瓜幼苗的形态特征、抗氧化酶活性、渗透调节物质积累和低温弱光对光合系统的影响等方面进行评估,探索西瓜对低温弱光胁迫的生理适应机制,为西瓜冬春季育苗及高产栽培提供理论依据。
1 材料与方法
1.1 材料与试验设计
试验材料为西瓜品种早佳(8424),购于章丘市兄弟种子有限公司,该品种为杂交种。试验于2023年10—11月在徐州豪杰苗业农业科技有限公司育苗场进行。选籽粒饱满的种子在28 ℃恒温箱中催芽24~48 h,种子露白后播于50孔穴盘(540 mm×280 mm×45 mm/长×宽×高)中,常规管理,待幼苗长至3叶1心时,选取长势一致的幼苗移入人工气候室进行低温弱光处理。试验共设置1个CK(CK)和4个低温弱光(T)梯度,CK:25 ℃,200 µmol·m-2·s-1光照度,12 h/12 h光周期;T1:15 ℃,200 µmol·m-2·s-1,12 h/12 h;T2:15 ℃,100 µmol·m-2·s-1,12 h/12 h;T3:10 ℃,200 µmol·m-2·s-1,12 h/12 h:T4:10 ℃,100 µmol·m-2·s-1,12 h/12 h。处理7 d时进行光合参数和生理指标的测定。每个处理30株幼苗,设3次重复,每次重复30株。
1.2 指标测定方法
1.2.1 生长指标的测定 用卷尺测量株高(茎基部到生长点)。用游标卡尺测量茎粗(下胚轴上、中、下部位各测量一次,取平均值)。叶面积测量时利用数码相机成像,再用Auto CAD软件计算叶面积。植株干质量测定时先用105 ℃烘箱杀青10 min,然后65 ℃烘干至恒质量。各处理随机选取5株,取平均值。
1.2.2 光合参数测定 参考王薇薇等[11]的方法,将幼苗置于正常温光条件下恢复20 min后,取从上向下数第2片功能叶用LI-6400XT便携式光合作用测定仪(LI-COR,美国)测定植株的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。设定测定环境温度为25 ℃,光量子通量密度为600 µmol·m-2·s-1。每个处理测定5株,每株所有参数均测定10次重复。
1.2.3 叶绿素荧光参数测定 将幼苗暗适应30 min后,取从上向下数第2片功能叶用47213baa7929839d82ff03716917bd44Mini-PAM调制叶绿素荧光仪(WALZ,德国)测定PSⅡ的最大光化学效率(Fv/Fm)和光化学淬灭系数(qP)。所有参数测定10次重复。
1.2.4 生理指标的测定 参考李合生[15]的方法,采用硫代巴比妥酸法测定丙二醛(MDA)含量;采用氮蓝四唑法测定超氧化物歧化酶(SOD)活性;采用愈创木酚法测定过氧化物酶(POD)活性;采用分光光度法测定叶绿素含量。参考Cakmak等[16]的方法测定抗坏血酸过氧化物酶(APX)活性。每个处理测定5株,3次重复。
1.3 数据分析
采用Excel 2016 软件进行数据处理分析及作图,用SAS 9.0软件进行方差分析,利用Duncan法进行差异显著性分析。
2 结果与分析
2.1 低温弱光对西瓜幼苗形态指标的影响
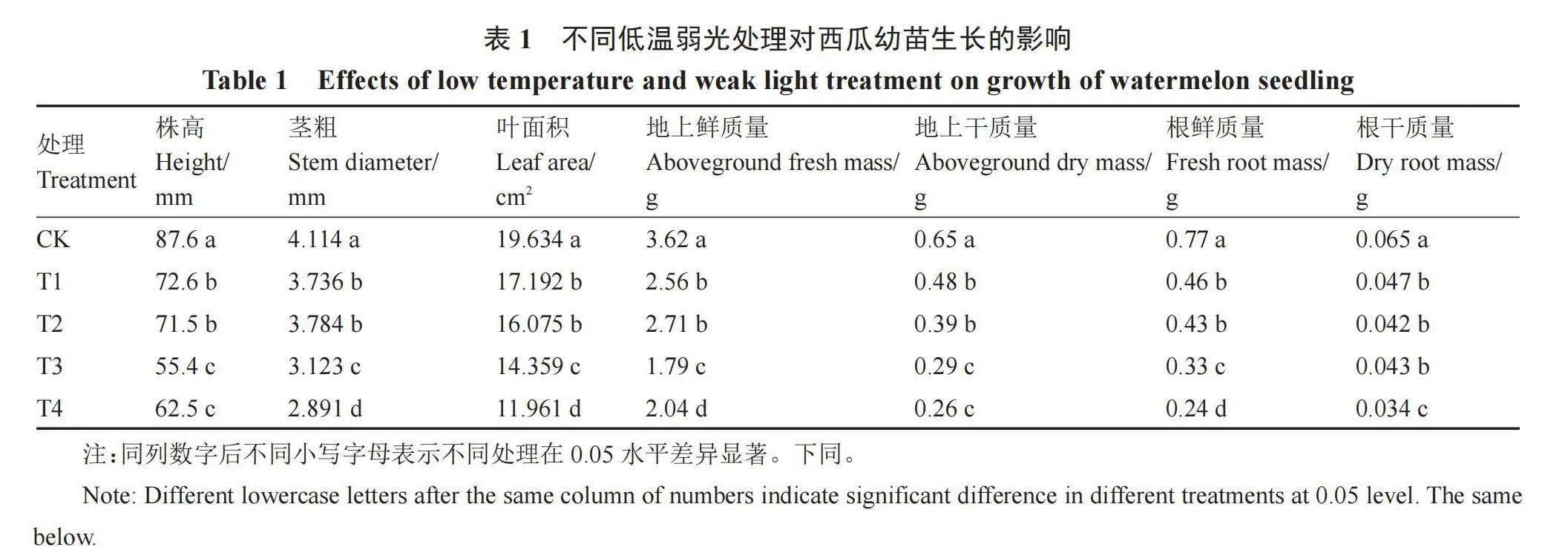
由表1所示,低温弱光处理7 d后,与CK相比,不同低温弱光处理下西瓜幼苗株高、茎粗、叶面积、幼苗干鲜质量等指标均受到影响,表明低温弱光对西瓜幼苗的生长具有显著抑制作用。在正常光照条件下,随着温度降低,西瓜株高显著降低,15 ℃(T1处理)和10 ℃(T3处理)低温胁迫分别较CK降低了17.1%和36.8%。在弱光条件下,随着温度降低,15 ℃(T2处理)和10 ℃(T4处理)低温胁迫下株高分别较CK降低了18.4%和28.7%。但同一温度不同光照度(T1和T2处理、T3和T4处理)对株高无显著影响。与CK相比,低温弱光显著抑制了西瓜幼苗的茎粗和叶面积,在弱光条件下,10 ℃低温胁迫的抑制作用更强。
与CK相比,低温弱光胁迫显著降低了西瓜幼苗的鲜质量。与CK相比,在正常光照条件下,随着温度降低,地上鲜质量显著下降,15 ℃(T1处理)和10 ℃(T3处理)分别较CK降低了29.3%和50.6%;在弱光条件下,随着温度降低,15 ℃(T2处理)和10 ℃(T4处理)低温胁迫地上鲜质量分别较CK降低了25.1%和43.6%。在地上干质量方面,与CK相比,低温弱光处理显著降低了地上干质量,15 ℃(T2处理)和10 ℃(T4处理)低温胁迫分别较CK降低了40.0%和60.0%。低温弱光处理对地下部根鲜质量和根干质量的影响与地上部一致,与CK相比,低温弱光显著降低了根鲜质量和根干质量,在弱光条件下,10 ℃低温胁迫对西瓜幼苗根系生长的影响最大。
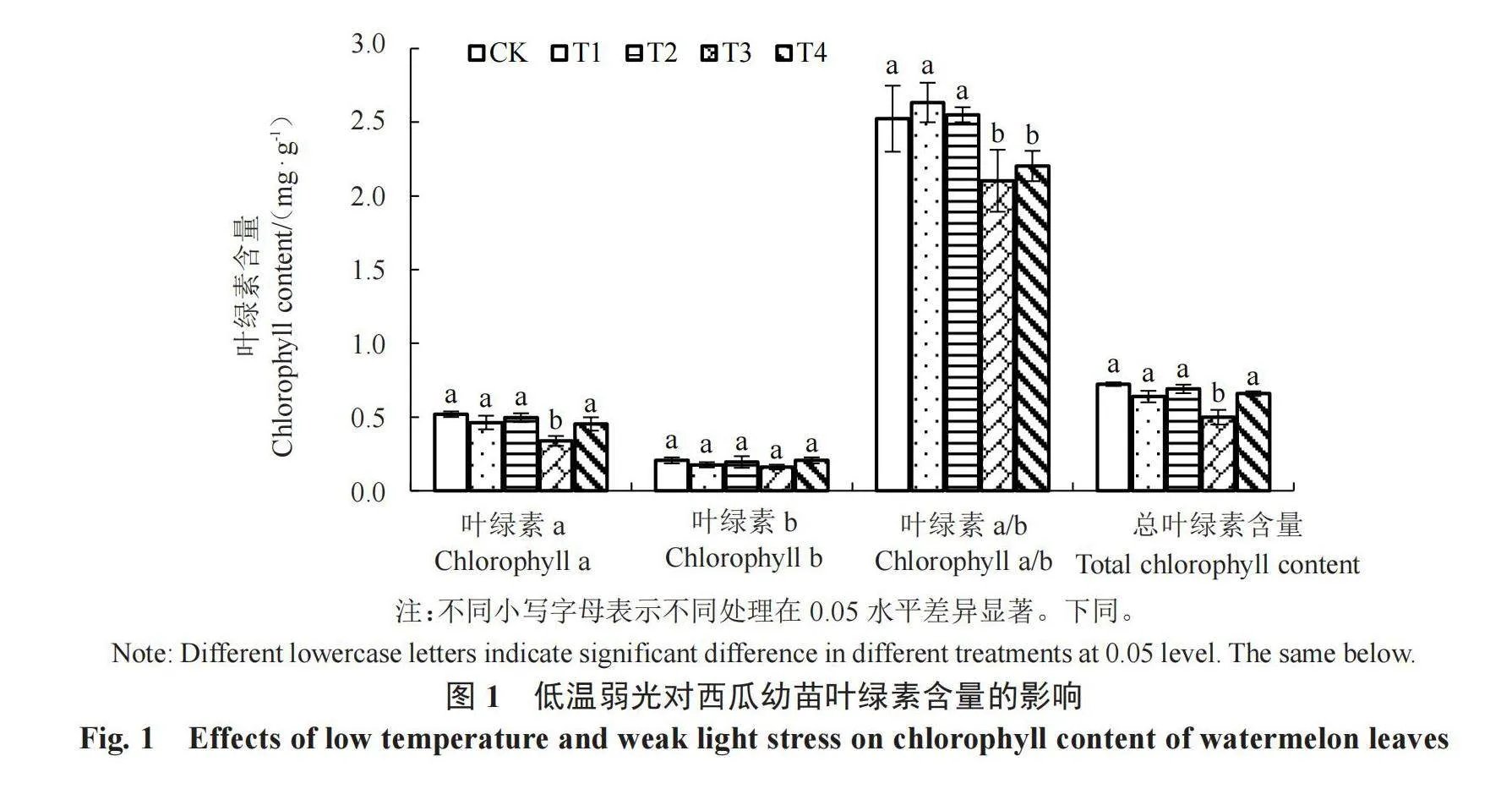
2.2 低温弱光对叶绿素含量的影响
由图1可知,在低温弱光处理下,叶绿素a和总叶绿素含量呈现相同的变化趋势。与CK相比,在正常光照条件下,温度越低,叶绿素a和总叶绿素含量越低,且T3显著低于T1和CK;在弱光条件下(T2和T4处理),温度降低对叶绿素a和总叶绿素含量有轻微的抑制,但达不到显著水平。而在相同温度条件下,弱光处理(T1和T2处理相比、T3和T4处理相比)提高了叶绿素a和总叶绿素含量,但仍低于CK。在不同低温弱光组合处理下,叶绿素b含量总体趋于平稳。在正常光照下,随着温度降低(T1和T3处理),叶绿素a/b值表现为先升高后降低的趋势;在弱光条件下,叶绿素a/b值随温度降低(T2和T4处理)而先升高后降低;在相同温度下,T1和T2处理叶绿素a/b值随光照度的减弱而降低,T3和T4处理叶绿素a/b值随光照度的减弱而略升高。
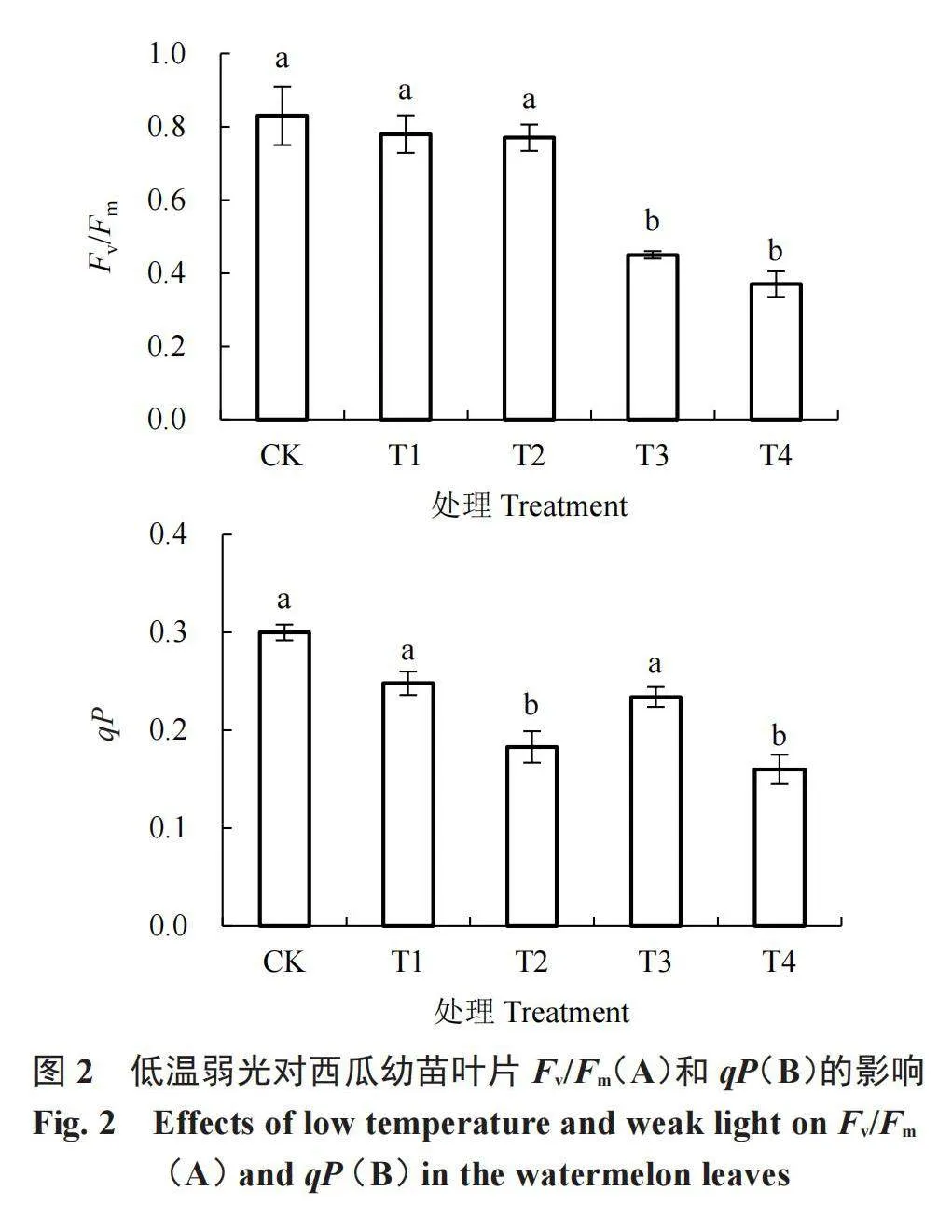
2.3 低温弱光对荧光参数的影响
由图2可知,不同低温光照胁迫下,西瓜幼苗叶片的PSII最大光化学效率Fv/Fm和光化学猝灭系数(qP)均低于CK。在正常光照条件下,随着温度降低,Fv/Fm逐渐降低,与CK和T2处理相比,T3处理显著下降,15 ℃(T1处理)和10 ℃(T3处理)低温胁迫分别较CK下降6.0%和45.8%;在弱光条件下,随温度降低,15 ℃(T2处理)和10 ℃(T4处理)低温胁迫下Fv/Fm分别较CK下降7.2%和55.4%;在相同温度下,光照度降低对叶片Fv/Fm影响不显著。
与CK相比,在正常光照条件下(T1、T3),随着温度降低,叶片qP逐渐降低,但差异不显著;与CK相比,在弱光条件下(T2、T4),叶片qP被显著抑制,10 ℃(T4)时抑制作用略有加强;在相同温度下(T1和T2、T3和T4),弱光对叶片qP影响显著,T2和T4处理qP分别较T1和T3处理下降26.2%和31.6%。
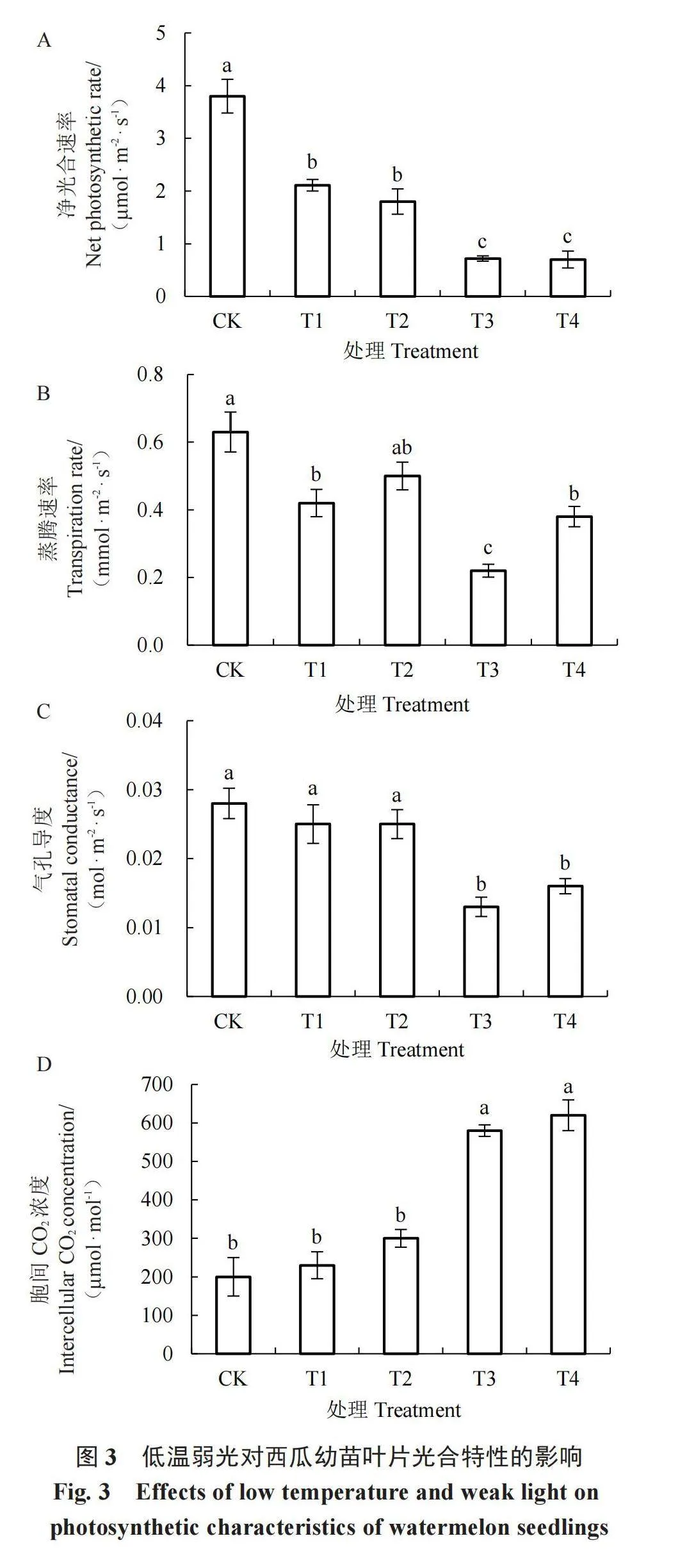
2.4 低温弱光对光合参数的影响
由图3可知,不同低温弱光处理对西瓜幼苗叶片光合参数的影响不同。在正常光照条件下,随着温度降低,T1和T3处理下西瓜叶片净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)均呈现下降趋势,胞间CO2浓度(Ci)呈上升趋势。在弱光条件下,随着温度降低,T2和T4处理下各光合参数表现出相同的变化趋势,与T2处理相比,T4处理的Pn、Gs均显著降低,Tr降低,但差异不显著,Ci则显著升高。在相同温度条件下,随着光照度降低,T2处理Pn较T1处理略有下降,T3处理Pn与T4无显著差异;Tr在弱光条件下升高;胞间CO2浓度在弱光条件下有所升高,但差异不显著;Gs在T1和T2处理中无显著差异,而在T3和T4处理中受到弱光条件诱导,Gs略有回升,但差异仍不显著。
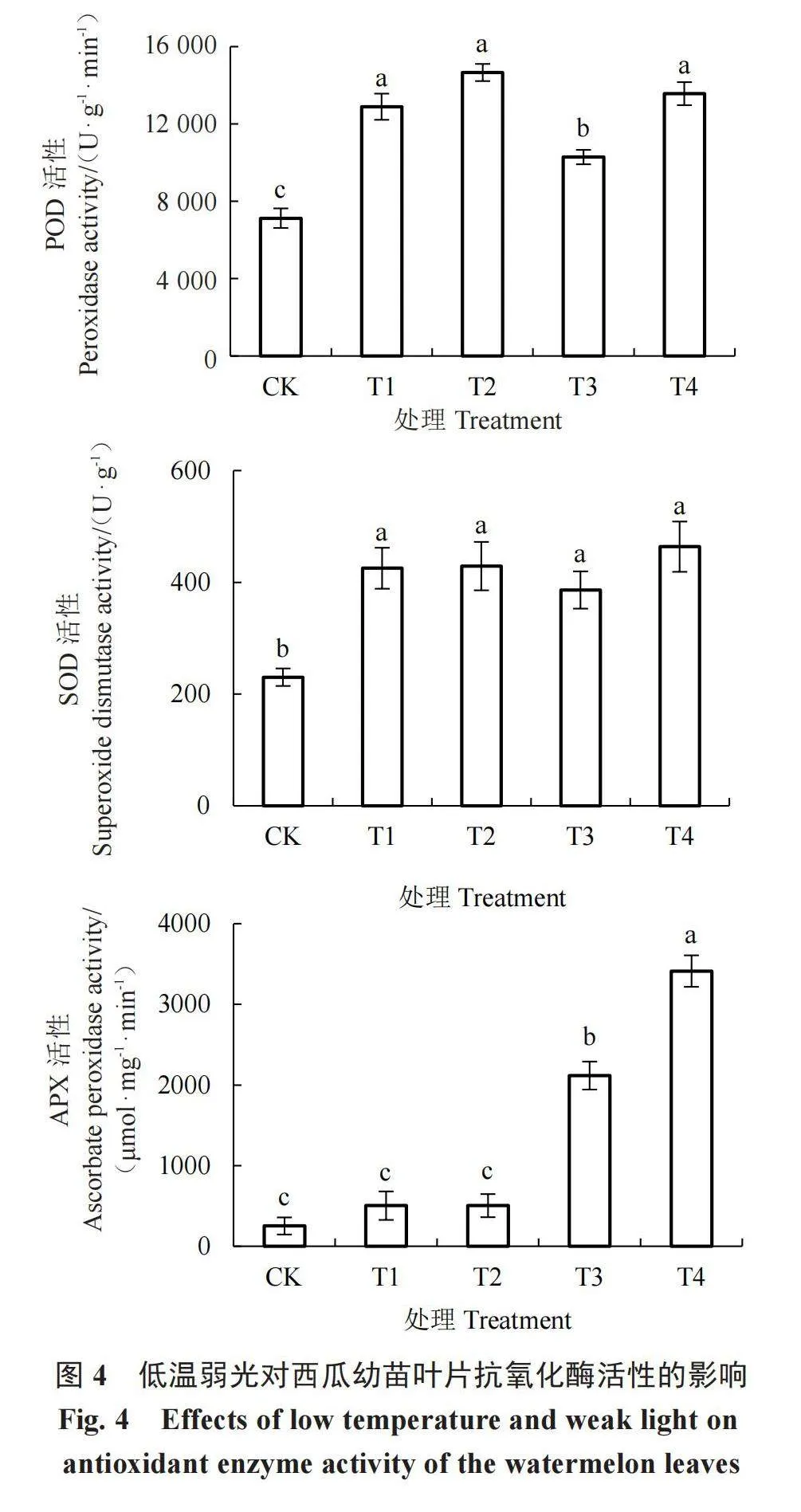
2.5 低温弱光对西瓜幼苗保护酶活性的影响
由图4可知,不同低温弱光处理下POD活性均显著高于CK。与CK相比,T1和T2处理下,POD活性逐渐升高,说明低温促进了POD的合成,而在15或10 ℃低温环境下,光照度越低,POD活性越高。同样的,T3和T4处理下POD活性表现出相同的变化趋势。在正常光照度下,与15 ℃(T1)处理相比,10 ℃(T3)低温处理下POD活性显著下降,但仍高于CK。说明在正常光照度下,达到一定的温度,POD活性随着温度降低而下降。而在弱光条件下,随着温度降低,POD活性略有下降,T4处理比T2处理下降7.5%,但差异不显著。
与CK相比,不同低温弱光处理下西瓜幼苗叶片SOD活性显著升高。10 ℃正常光照(T3)处理下,SOD活性略有下降,但与其他处理无显著差异。总体来看,低温弱光显著提高了叶片SOD活性,而温度降低或弱光条件对SOD活性影响不大。与CK相比,不同低温弱光处理提高了APX活性。与CK相比,15 ℃正常光照(T1)和弱光(T2)处理下APX活性有所升高,但差异不显著。10 ℃正常光照(T3)和弱光(T4)处理下APX活性显著升高,T4处理下APX活性达到最高。在相同光照条件下,温度越低(T3较T1、T4较T2)的处理,APX的活性越显著升高。
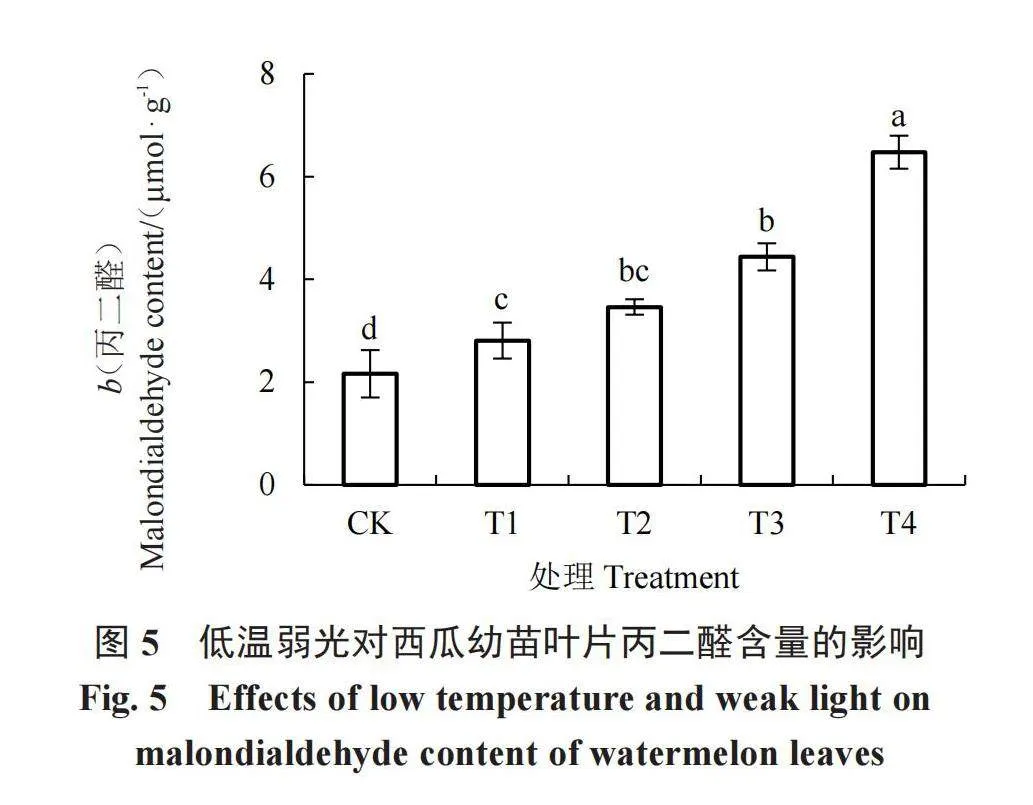
2.6 低温弱光对MDA含量的影响
由图5可知,与CK相比,低温弱光胁迫下西瓜幼苗叶片MDA含量显著上升。在正常光照条件下,与CK相比,15 ℃(T1)和10 ℃(T3)低温处理下MDA含量显著升高,说明在正常光照条件下,随着温度降低,MDA含量逐渐升高。同样的,15 ℃(T2)和10 ℃(T4)低温处理下MDA含量增幅更为显著,说明在弱光条件下,温度越低,MDA含量越高。在相同温度下,随着光照度降低,MDA含量升高,T2处理和T4处理下MDA含量分别较T1和T3处理升高23.27%和45.91%。
3 讨论与结论
低温弱光是影响植物生长、发育和作物产量及品质的重要因素之一[17]。大量研究表明,低温对植物生长发育和形态特征等造成影响,致使叶片萎蔫黄化、植株徒长、坐果率降低,严重影响果实品质[10,12,18-19]。笔者比较了两种低温条件下不同弱光组合对西瓜幼苗的影响,发现低温、弱光或低温弱光组合处理都显著抑制了西瓜幼苗的地上部和地下部组织的生长发育,株高、茎粗、叶面积、地上鲜质量和干质量、根鲜质量和干质量均比CK显著下降,低温弱光组合的抑制效果强于单一胁迫处理。这与许勇等[20]、刘叶琼等[14]、王薇薇等[11]的研究结果一致。低温弱光可能影响了植物呼吸作用中一些关键酶的合成,使植物光合系统受到抑制,最终导致植物根系生长受损,生长发育缓慢[5,21]。
作为光合作用的重要参数,净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci)也是衡量植物光合能力的重要指标。笔者在本研究中发现,在低温或弱光的单一因素处理或是在低温弱光复合胁迫下,西瓜幼苗Pn显著降低;Tr和Gs均降低,但差异不显著;而Ci则升高或显著升高,表明低温弱光使得西瓜幼苗的光合作用受到抑制,光合速率下降,光合产物积累减少,植株生长缓慢。西瓜幼苗Pn、Gs随温度和光照度的减弱而降低的同时伴随着Ci的升高,表明西瓜叶片光合作用效率的降低一方面是由于Gs下降导致CO2的供应减少,另一方面是由于非气孔限制因素阻碍了CO2的利用,导致胞间CO2的积累。同时,低温弱光降低了叶片PSII的原初光化学效率,减弱了叶片吸收光能的光化学反应,使得光能过剩,植物体内活性氧含量增加,膜系统受到损害。
低温胁迫使植物细胞膜受损,细胞内产生大量的活性氧(reactive oxygen species,ROS)导致膜脂过氧化。随着细胞膜和脂质的变化,植物的生理生化功能也随之发生变化[18-19]。MDA是植物在低温胁迫时膜脂过氧化的产物,其含量可以反映细胞膜系统受损伤的程度[21]。本研究结果表明,无论是在低温或弱光的单一因素胁迫下,或是低温弱光复合胁迫下,西瓜叶片MDA含量均显著升高,且温度越低光照度越弱,MDA含量越高。该结果与李爱民等[13]的研究结果一致,说明低温弱光复合胁迫促使西瓜体内ROS过量积累,进而增加了细胞膜质的过氧化程度,导致叶片坏死。研究发现,低温会降低抗氧化酶的活性,因此抗氧化酶活性常表现为先升后降的趋势[9]。笔者发现,在不同低温弱光组合的胁迫下,SOD和POD活性均显著升高,在10 ℃临界温度时SOD和POD活性略有下降,但仍然保持较高的活性水平。表明西瓜可以通过增强抗氧化酶活性来提高其耐低温弱光的能力。
综上所述,低温、弱光或低温弱光复合胁迫均显著抑制西瓜幼苗生长。与CK相比,在低温条件下,100 µmol·m-2·s-1弱光胁迫显著抑制西瓜幼苗根鲜质量和净光合速率,而显著诱导MDA含量升高。在弱光条件下,温度越低对西瓜幼苗的影响越大,当温度低至10 ℃时,西瓜幼苗茎粗、叶面积、根系、净光合速率、气孔导度和蒸腾速率等均受到显著抑制,而APX活性显著升高。建议设施育苗温光控制不低于10 ℃和100 µmol·m-2·s-1,本研究结果为早春西瓜育苗及高产栽培提供了理论基础。
参考文献
[1] 孙立新,王晓君,吴敬学,等.中国西瓜甜瓜生产区域布局变迁及驱动因素研究[J].中国农业资源与区划,2023,44(8):42-51.
[2] 王晓君,杨玉莹,孙立新,等.新冠肺炎疫情对我国西瓜甜瓜产业的影响及后疫情时期发展建议[J].中国瓜菜,2021,34(5):125-131.
[3] 王娟娟,李莉,尚怀国.我国西瓜甜瓜产业现状与对策建议[J].中国瓜菜,2020,33(5):69-73.
[4] XU J H,ZHANG M,LIU G,et al.Comparative transcriptome profiling of chilling stress responsiveness in grafted watermelon seedlings[J].Plant Physiology and Biochemistry,2016,109:561-570.
[5] SOUALIOU S,DUAN F Y,LI X,et al.Crop production under cold stress:An understanding of plant responses,acclimation processes,and management strategies[J].Plant Physiology and Biochemistry,2022,190:47-61.
[6] 吴宇欣,蔡昌杨,唐诗蓓,等.植物响应低温的生长发育及分子机制研究进展[J].江苏农业科学,2023,51(19):1-9.
[7] MA Y,DAI X Y,XU Y Y,et al.COLD1 confers chilling tolerance in rice[J].Cell,2015,160(6):1209-1221.
[8] LI Z,YUAN L,WANG Q,et al.Combined action of antioxidant defense system and osmolytes in chilling shock-induced chilling tolerance in Jatropha curcas seedlings[J].Acta Physiologiae Plantarum,2013,35(7):2127-2136.
[9] FOYER C H,NOCTOR G.Redox homeostasis and antioxidant signaling:A metabolic interface between stress perception and physiological responses[J].Plant Cell,2005,17(7):1866-1875.
[10] 权威,薛文通,赵天瑶,等.植物对低温胁迫的响应机制研究进展[J].中国农业大学学报,2023,28(2):14-22.
[11] 王薇薇,羊杏平,范淑英,等.西瓜耐冷性鉴定指标的筛选[J].华北农学报,2014,29(6):163-171.
[12] 贾蓝溪,郭延亮,宋希梅,等.不同浓度海藻糖处理对西瓜幼苗低温抗性的影响[J].中国瓜菜,2023,36(8):27-32.
[13] 李爱民,张永泰,熊飞,等.低温弱光对西瓜幼苗生理特性的影响[J].扬州大学学报(农业与生命科学版),2012,33(2):78-82.
[14] 刘叶琼,汤伟华,冯英娜,等.不同温度处理对嫁接西瓜幼苗生长和生理特性的影响[J].安徽农业科学,2023,51(21):53-56.
[15] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[16] CAKMAK I,STRBAC D,MARSCHNER H.Activities of hydrogen peroxide-scavenging enzymes in germinating wheat seeds[J].Journal of Experimental Botany,1993,44(258):127-132.
[17] 李薇,史菲,刘敏,等.植物响应低温的生理和分子机制研究进展[J].北方园艺,2023(8):121-126.
[18] 丁红映,王明,谢洁,等.植物低温胁迫响应及研究方法进展[J].江苏农业科学,2019,47(14):31-36.
[19] RITONGA F N,CHEN S.Physiological and molecular mechanism involved in cold stress tolerance in plants[J].Plants-Basel,2020,9(5):560.
[20] 许勇,王永健,张峰,等.西瓜幼苗耐低温研究初报[J].华北农学报,1997,12(2):93-96.
[21] 高博文,孙德玺,刘君璞,等.盐胁迫对西瓜幼苗生理生化特性的影响[J].中国瓜菜,2022,35(8):35-41.
