黄瓜枯萎病抗性的遗传分析
2024-10-25杨侃侃刘晓虹陈惠明周赓陈宸


摘 要:为研究黄瓜枯萎病抗性的遗传规律,选择华南生态型黄瓜枯萎病高感材料Han203为母本与华南生态型黄瓜枯萎病高抗材料BLF-2-1A为父本,华南生态型黄瓜枯萎病高感材料NS为母本与其近等基因系黄瓜枯萎病高抗材料NR为父本,分别杂交获得2个四世代杂交组合,采用主基因与多基因混合模型分析了黄瓜枯萎病的遗传规律。结果显示,Han203× BLF-2-1A在2018年秋季符合E-1(MX2-ADI-AD)模型,在2019年春季符合E-0(MX2-ADI-ADI)模型;NS × NR在2023年春季符合E-1(MX2-ADI-AD)模型,在2023年秋季符合E-0(MX2-ADI-ADI)模型。在这4个模型中,主基因遗传效率分别为87.98%、77.30%、73.96%和72.33%,多基因遗传效率分别为0、2.7%、0和0,环境方差占表型方差百分比分别为12.22%、22.70%、26.40%和27.67%。研究结果为黄瓜枯萎病抗性材料的选育及挖掘黄瓜枯萎病抗性相关基因提供了参考依据。
关键词:黄瓜;枯萎病;主基因+多基因;遗传分析
中图分类号:S642.2 文献标志码:A 文章编号:1673-2871(2024)10-047-09
收稿日期:2024-06-25;修回日期:2024-08-08
基金项目:国家自然科学基金联合基金项目(U22A20498);湖南省自然科学基金青年基金项目(2023JJ40389);湖南省农业科技创新资金项目(2023CX03)
作者简介:杨侃侃,女,在读博士研究生,研究方向为植物基因工程与新品种选育。E-mail:kankankkyang@163.com
通信作者:陈 宸,女,助理研究员,研究方向为黄瓜育种。E-mail:ccad111188@163.com
周 赓,男,助理研究员,研究方向为黄瓜育种。E-mail:zhougeng@hnu.edu.cn
Genetic analysis of resistance of cucumber to Fusarium wilt
YANG Kankan1, 2, LIU Xiaohong2, CHEN Huiming1, 2, ZHOU Geng2, CHEN Chen2
(1. Long Ping Branch, Graduate School of Hunan University, Changsha 410125, Hunan, China; 2. Hunan Vegetable Research Institute/Hunan Academy of Agricultural Sciences, Changsha 410125, Hunan, China)
Abstract: In order to study the genetic law of cucumber resistance to Fusarium wilt, in this study, two four-generation hybrid combinations were obtained by Han203 cross with BLF-2-1A, NS cross with NR, respectively. The inheritance law of cucumber wilt was analyzed by using a mixture of principal genes and multi-gene model. The results showed that Han203×BLF-2-1A conformed to the E-1 (MX2-ADI-AD) model in autumn 2018 and the E-0 (MX2-ADI-ADI) model in spring 2019; NS×NR conformed to the E-1 (MX2-ADI-AD) model in spring 2023 and the E-0 (MX2- ADI-ADI) model in 2023 autumn. In these four models, the main gene genetic efficiency was 87.98%, 77.30%, 73.96% and 72.33%, the polygenic genetic efficiency was 0, 2.7%, 0 and 0, and the environmental variance as a percentage of phenotypic variance was 12.22%, 22.70%, 26.40% and 27.67%, respectively. This study provides a reference basis for the selection and breeding of cucumber wilt resistance materials and the mining of cucumber wilt resistance related genes.
Key words: Cucumber; Fusarium wilt; Major gene + polygene; Genetic analysis
黄瓜为葫芦科黄瓜属作物,是世界上主要的蔬菜作物之一,同时也是中国的重要蔬菜之一[1]。黄瓜在栽培过程中的各种病害会严重影响黄瓜当年的产量,其中黄瓜枯萎病对黄瓜最终产量的影响尤为严重[2]。黄瓜枯萎病主要是由尖孢镰刀菌黄瓜专化型Fusarium oxysporum(Schl.) f. sp. cucumerinum Owen (Foc)所引起的黄瓜病害[3],它是一种世界性的可以通过土壤直接传播的黄瓜病害,给黄瓜生产带来了极为巨大乃至破坏性的社会经济损失。该病发生的初期症状主要表现为幼苗发黄、发育迟缓或死亡;成株叶片容易枯萎、变黄变干,木质部组织变褐色,甚至植株死亡,它可以在黄瓜生长发育的各个阶段都有出现,在成熟期会表现更为严重[4]。枯萎病菌能够在土壤中长时间地持续存活,目前对黄瓜枯萎病的防治方法主要是化学防治、生物防治、嫁接、熏蒸等手段,不能从根本上防治枯萎病带来的危害与损失[5]。目前,选育具有黄瓜枯萎病抗性的黄瓜品种是最经济、环保且有效的方法[6]。具有抗病性的黄瓜品种对腌渍和鲜食黄瓜的生产都十分重要,国内外都将抗病害黄瓜品种的选育放在了最重要的位置。在黄瓜枯萎病的研究过程中,遗传抗性表现出不同的结果。Netzer等[7]用WIS-248(抗病)和Shimshon(感病)进行杂交,Vakalounakis等[8]将SMR-18(抗病)和Straight8(感病)进行杂交,发现黄瓜枯萎病抗性由单显性基因控制。侯安福等[9]则认为是由主效显性基因控制且为数量性状遗传。王亚娟等[10]采用抗病品种Q9和感病品种Q10杂交认为是由单隐形基因控制。周红梅等[11]研究发现,黄瓜亲本WIS2757的枯萎病抗性为单基因显性遗传,但是Cu13为多基因调控。Dong等[12]以黄瓜自交系Superina和Rijiecheng为材料应用数量性状遗传分析发现,黄瓜枯萎病抗性遗传的最佳模型为两对加性-显性-上位性主基因和加性-显性多基因。Bartholomew等[13]认为CsChi23足以增强黄瓜对镰刀菌枯萎病的抗性。笔者利用华南生态型黄瓜枯萎病高感材料Han203与华南型黄瓜枯萎病高抗材料BLF-2-1A,华南生态型黄瓜枯萎病高感材料NS与其近等基因系黄瓜枯萎病高抗材料NR杂交后分别获得对应的P1、P2、F1和F2的四世代遗传组合,应用数量性状主基因+多基因混合遗传模型对黄瓜枯萎病抗性遗传模式和遗传效应进行分析,揭示黄瓜枯萎病抗性的遗传规律,为黄瓜枯萎病抗病基因的精细定位提供参考依据,有助于黄瓜枯萎病抗性遗传机制的建立并为将来开发分子标记并选育抗黄瓜枯萎病新品种提供支撑。
1 材料与方法
1.1 材料
两组试验材料分别为:A组(Han203×BLF-2-1A),母本P1为华南型高感黄瓜枯萎病黄瓜Han203,父本P2为华南型高抗黄瓜枯萎病黄瓜BLF-2-1A,2017年秋季以这两个材料为亲本杂交获得F1,2018年春季用F1自交获得F2; B组(NS×NR),母本P1为华南型高感黄瓜枯萎病黄瓜NS,父本P2为华南型高抗黄瓜枯萎病黄瓜NR,该组材料为系统选育过程中突变出现的感病材料,并对高感材料进行高代自交培育出纯合材料,父母本为近等基因系材料。2022年两个亲本杂交获得F1,2022年秋季由F1自交获得F2。枯萎病菌为尖孢镰刀菌黄瓜专化型,菌种及黄瓜材料全部来自湖南省蔬菜研究所黄瓜课题组,试验分别在湖南省蔬菜研究所气候培养室和湖南省植物保护研究所植物培养室进行。A组在2018年秋季样本容量分别为P1(Han203)20株、P2(BLF-2-1A)20株、F1代20株、F2代200株;2019年春季样本容量分别为P1 (Han203)20株、P2(BLF-2-1A)20株、F1代20株、F2代234株。B组在2023年春季样本容量分别为P1(NS)20株、P2(NR)20株、F1代20株、F2代635株;2023年秋季样本容量分别为P1(NS)20株、P2(NR)20株、F1代20株、F2代525株。所有世代的试验材料均从种子库随机取用。
1.2 方法
1.2.1 黄瓜幼苗的人工接菌试验 第一组试验材料Han203×BLF-2-1A于2018年秋季和2019年春季在湖南省蔬菜研究所气候培养室进行,第二组试验材料NS×NR于2023年春季和秋季在湖南省植物保护研究所植物培养室进行。将试验所需要用到的种子首先用5%次氯酸钠浸泡1 min,并用流水冲洗干净,放入垫有滤纸的培养皿中28 ℃恒温箱中催芽。出芽至0.5 cm时,将种子播种在经高温灭菌的基质中(V草炭∶V蛭石∶V菜田土 = 2∶1∶1,134 ℃,30 min灭菌),在20~28 ℃的温室中育苗。2片子叶展平期,将幼苗根部用水冲洗后用浓度为4×106孢子·mL-1的孢子悬浮液没过根部浸1 min,然后重新定植于装有播种基质的育苗钵中,每天光照16 h,保持正常生长的土壤湿度,温度控制在白天25 ℃,晚上20 ℃,光照50 W·m-2。
1.2.2 黄瓜枯萎病的表型鉴定 于人工接种10~15 d后开始统计发病情况。调查接种后每1株材料的发病情况,记录好对应的病情级别,并按照对应的公式准确病情指数(DI)。病情等级划分和病情指数均按照NY/T 1857.3-2010 黄瓜枯萎病鉴定技术规程计算。正态分布图使用Excel 2019绘制,病情分级标准和病情指数抗性划分级别见表1,病情指数(DI)计算公式为: DI=Σ(发病级别×发病株数)/(最高病级×总株数)×100。
1.2.3 黄瓜枯萎病的遗传模型建立 运用章元明教授团队研发并提供的SEgregation Analysis using F2 and its parental population(SEA-G4F2)植物数量性状分离分析Windows数据软件包对黄瓜枯萎病抗性统计结果进行遗传模型的构建,再根据盖钧镒[16]提出的P1、P2、F1和F2四世代植物数量性状遗传分析方法构建遗传模型。对这2组的4个遗传世代P1、P2、F1和F2的枯萎病抗性进行极大对数似然函数值分析,以AIC值最小及与AIC最小值附近的数值为原则筛选出备选模型,并将备选模型适合性测验的各世代5种均匀性检验(U12, U22, U32, nW 2和Dn)中具有显著性差异特征的指标个数进行统计,按照显著差异个数最少对应的模型才是适合的遗传模型的标准,选择最适的备选模型。最后利用最小二乘法估计筛选出来的最佳遗传模型中的各类遗传参数。
2 结果与分析
2.1 黄瓜枯萎病抗性表型鉴定
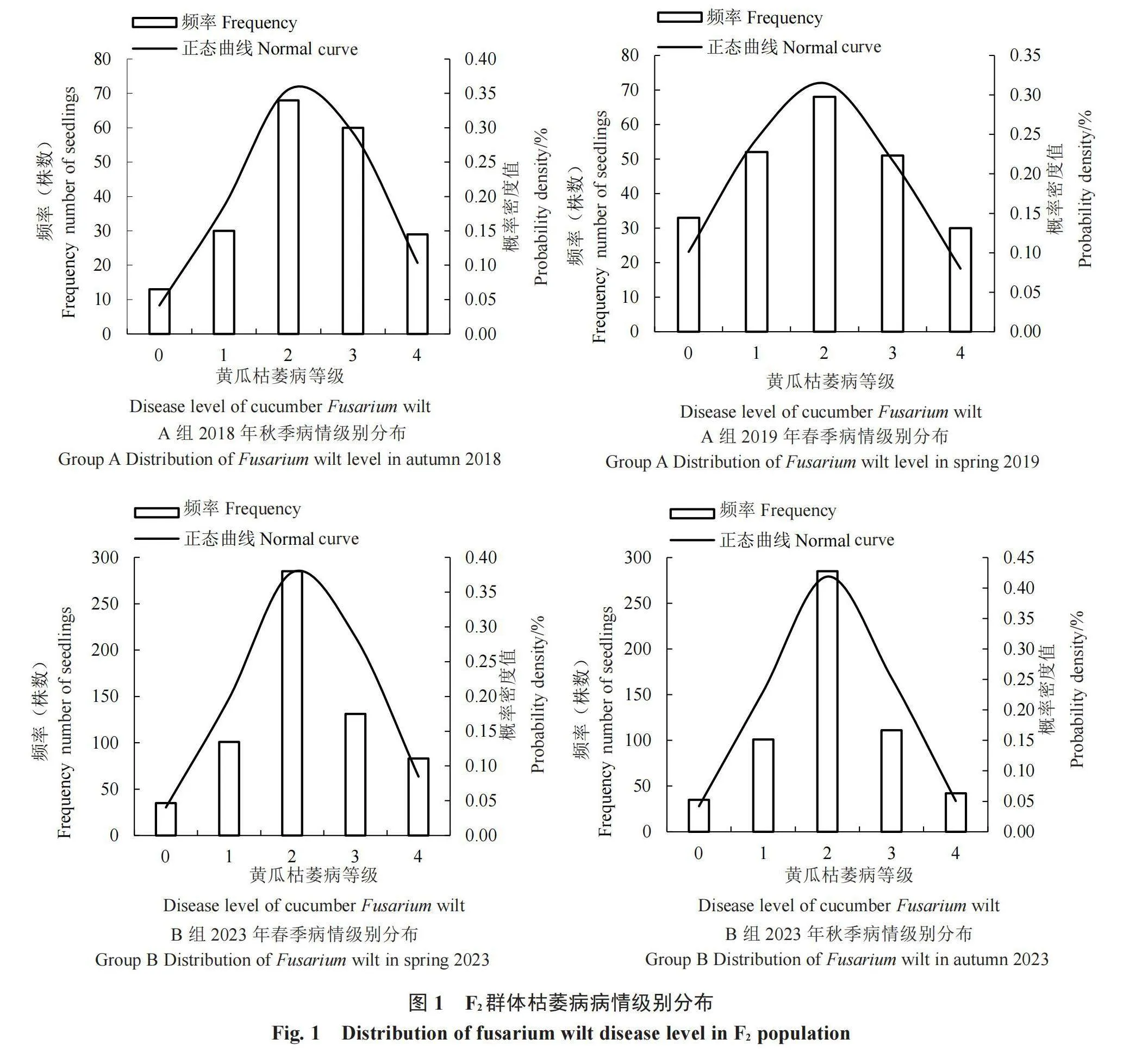
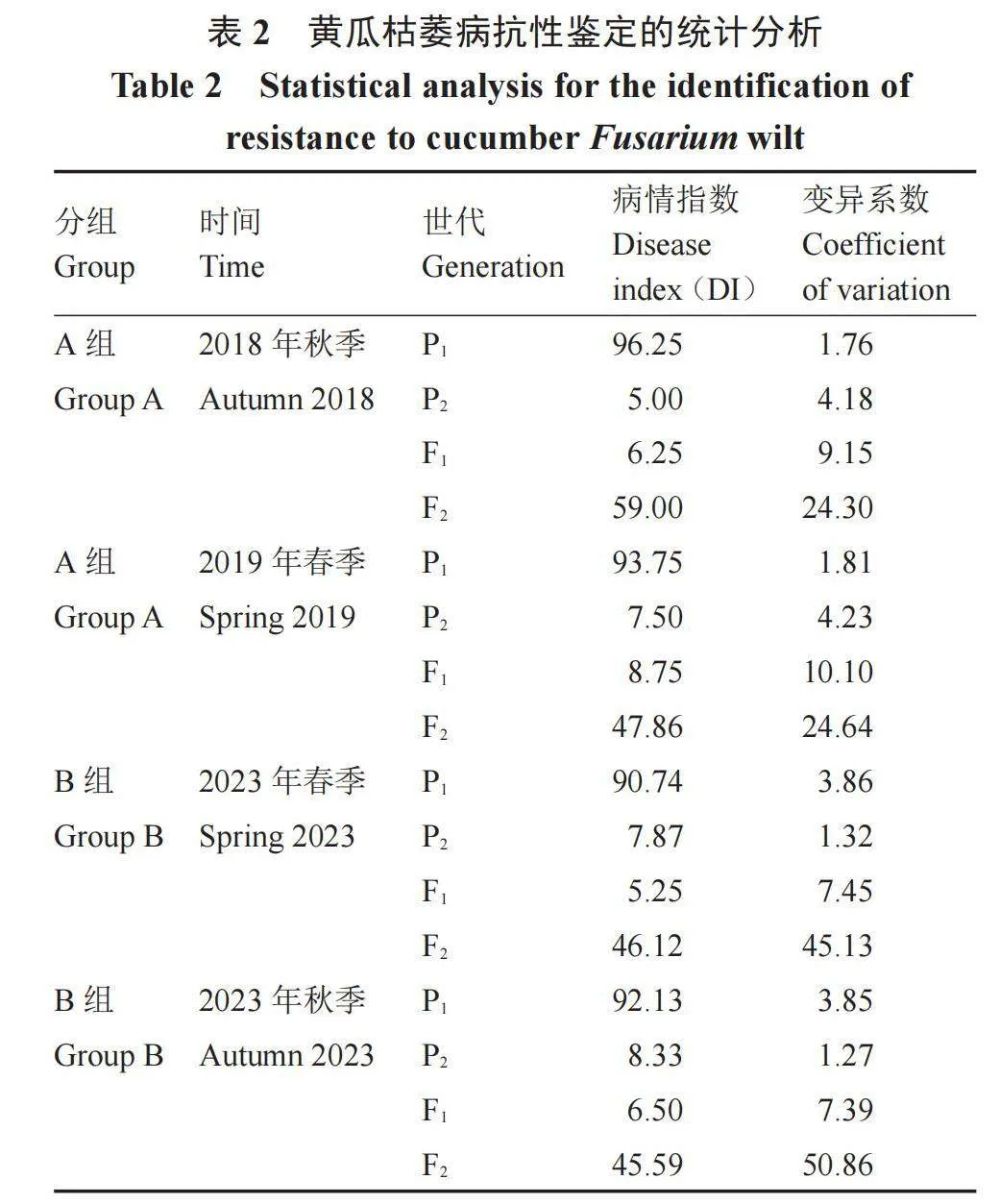
对Han203与BLF-2-1A(A组)、NR与NS(B组)杂交组合的四世代遗传群体进行苗期的黄瓜枯萎病抗性鉴定,并对其表型进行统计分析(表1),发现在A组中,母本Han203(P1)的病情指数在2018年秋季和2019年春季分别为96.25和93.75,黄瓜枯萎病高度感染,父本BLF-2-1A(P2)的病情指数在2018年秋季和2019年春季分别为5.00和7.50,高度抗黄瓜枯萎病,说明两个亲本对黄瓜枯萎病的抗病能力差异显著,且抗性表现稳定,F1在2018年秋季和2019年春季的病情指数分别为6.25和8.75,F1的表型更趋近于P2。在B组中,母本NS(P1)的病情指数在2023春季和秋季分别为90.74和92.13,黄瓜枯萎病高度感染,父本NR(P2)的病情指数在2023春季和秋季分别为7.87和8.33,高度抗黄瓜枯萎病,说明两个亲本对黄瓜枯萎病的抗病能力差异显著,且抗性表现稳定。F1在2023春季和秋季的病情指数分别为5.25和6.50,同样F1的表型更趋近于P2。两个组合F2群体的枯萎病抗性鉴定的变异系数分别为24.30、24.64和45.13、50.86,均大于P1、P2、F1的变异系数,说明F2分离群体具有鲜明的遗传变异特点。根据两个组合的苗期抗性鉴定统计结果分析和F2群体的在不同时间的抗性分布频率,两个组合的抗性分布都呈正态分布的趋势,可以推断华南生态型黄瓜的抗枯萎病性状表现为数量性状(表2 ,图1)。
2.2 黄瓜枯萎病抗性遗传模型建立
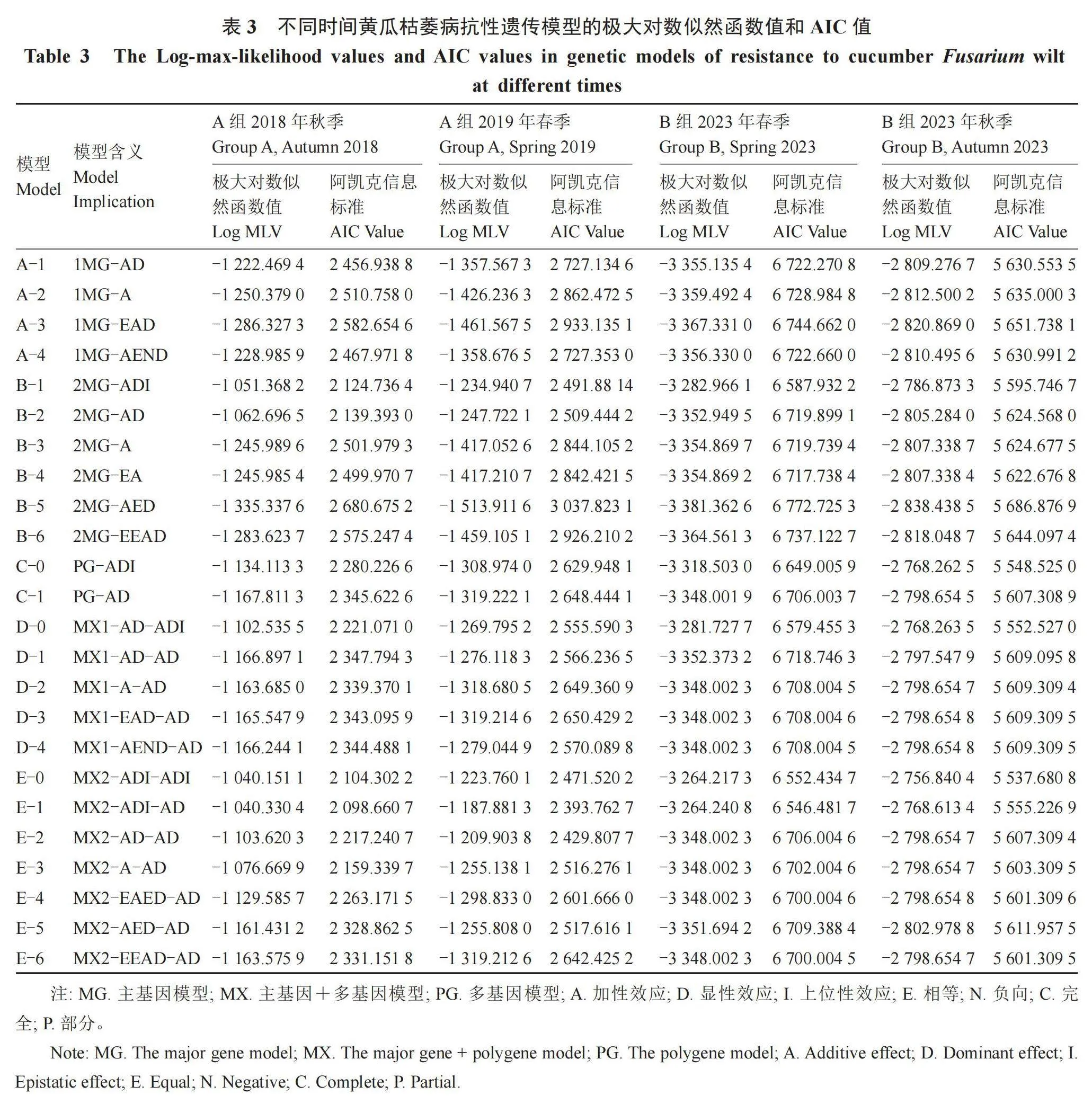
对A组和B组两组杂交群体的P1,P2,F1和F2四世代进行主基因加多基因遗传模型联合分析,通过联合分析得到了5种共24个模型的极大对数似然函数值和AIC(Akaike′s Information Criterion)值(表3)。A组中,2018年秋季和2019年春季的黄瓜枯萎病抗性遗传模型,遵循AIC值最小为相对最适模型的基本原则,得到2018年秋季是AIC值最小的为2 098.660 7的E-1(MX2-ADI-AD)模型,其次是AIC值为2 104.302 2的E-0(MX2-ADI-ADI)模型和AIC值为2 124.736 4的B-1(2MG-ADI)模型,因此选择这3个模型作为2018年秋季黄瓜枯萎病抗性的最终备选模型;2019年春季AIC值最小的遗传模型是AIC值为2 393.762 7的E-1(MX2-ADI-AD)模型,其次是AIC值为2 429.807 7的E-2(MX2-AD-AD)模型和AIC值为2 471.520 2的E-0(MX2-ADI-ADI)模型,因此选择这3个模型作为2019年春季黄瓜枯萎病抗性备选模型。B组中,对2023年春季和2023年秋季的黄瓜枯萎病抗性遗传模型进行分析,得到2023年春季 AIC值最小的为6 546.481 7的E-1(MX2-ADI-AD)模型,其次是AIC值为6 552.434 7的E-0(MX2-ADI-ADI)模型和AIC值为6 579.455 3的D-0(MX1-AD-ADI)模型,因此选择这3个模型作为2023年春季黄瓜枯萎病抗性的最终备选模型。2023年秋季AIC值最小的遗传模型是AIC值为5 537.680 8的E-0(MX2-ADI-ADI)模型,其次是AIC值为5 548.525 0的C-0(PG-ADI)模型和AIC值为5 552.527 0的D-0(MX1-AD-ADI)模型,因此选择这3个模型作为2023年秋季黄瓜枯萎病抗性备选模型。
对上述A组和B组黄瓜枯萎病抗性备选模型进一步统计具有显著性差异特点的适应性检测数据,选择差异最不显著的作为最合适的模型(表4)。在A组中,结果显示2018年秋季备选模型E-1、E-0和B-1中适合性检验中分别有6、6和9个数值有显著差异性,结合AIC值的选择条件,确定2018年秋季黄瓜枯萎病抗性的遗传模型为E-1(MX2-ADI-AD);2019年春季备选模型E-1、E-2、E-0中适合性检验中分别有7、9和5个数值有显著差异,结合AIC值的选择条件,确定2019年春季选择的最佳遗传模型为E-0(MX2-ADI-ADI)。在B组 中,结果显示2023年春季备选模型E-1、E-0和D-0中适合性检验中均有11个数值有显著差异,结合AIC值的选择条件,确定2023年春季黄瓜枯萎病抗性的遗传模型为E-1(MX2-ADI-AD);2023年秋季备选模型E-0、C-0、D-0中适合性检验中均有10个数值有显著差异,结合AIC值的选择条件,确定2023年秋季选择的最佳遗传模型为E-0(MX2-ADI-ADI)。
2.3 黄瓜枯萎病抗性遗传模型参数分析
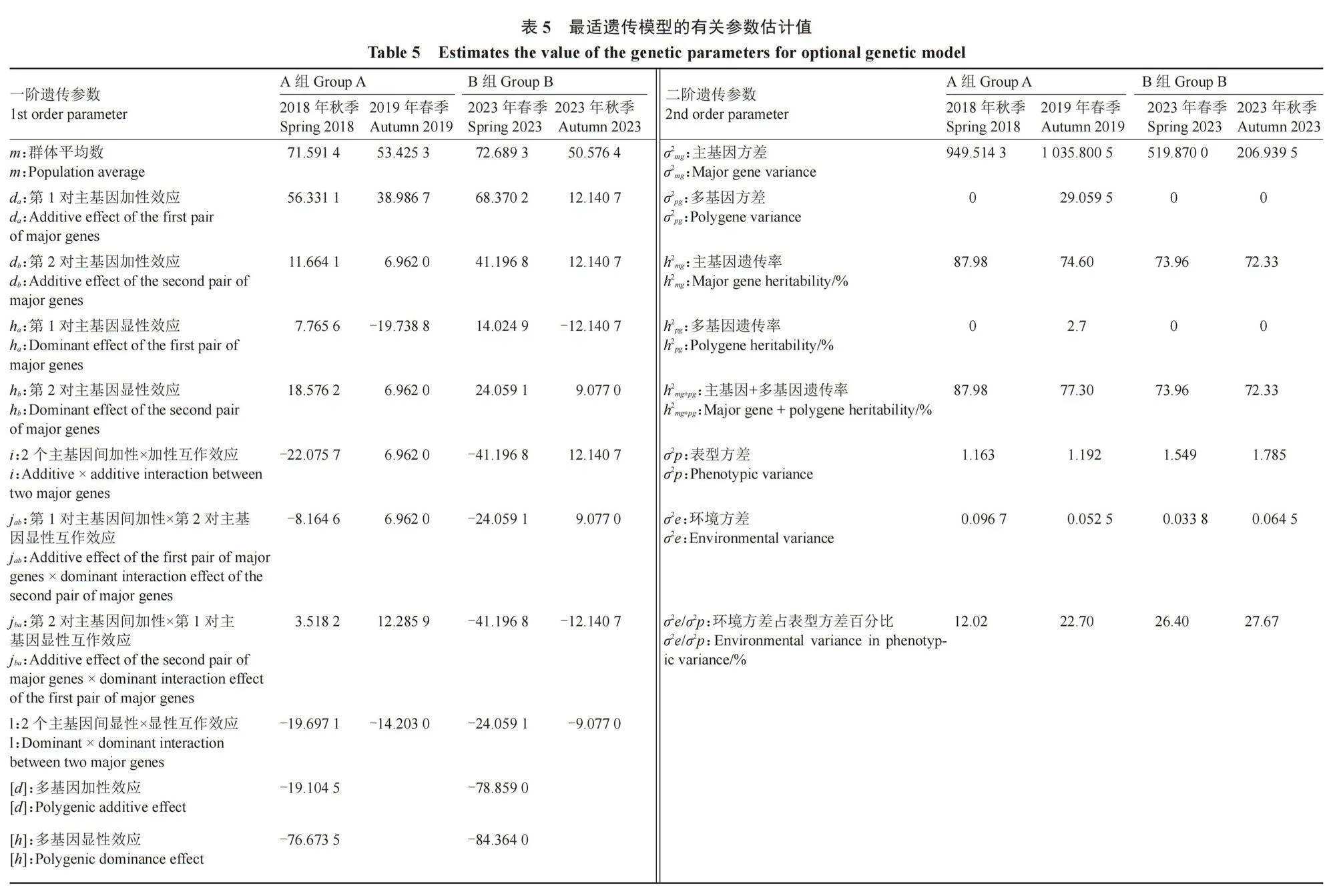
利用最小二乘法对四世代遗传群体A组和B组分别在2018年秋季和2019年春季、2023年春季和秋季的抗性结果进行遗传参数计算,分别获得了2018年秋季遗传模型E-1(MX2-ADI-AD)和2019年春季遗传模型E-0(MX2-ADI-ADI)、2023年春季遗传模型E-1 (MX2-ADI-AD)和2023年秋季遗传模型E-0 (MX2-ADI-ADI)所对应的一阶参数和二阶参数(表5)。
A组和B组的4组遗传模型中(2018年秋季E-1,2019年秋季E-0,2023年春季E-1,2023年秋季E-0)一阶参数数据显示,第1对主基因加性效应值da分别为56.331 1、38.986 7、68.370 2、12.140 7,第2对主基因加性效应值db分别为11.664 1、6.962 0、41.196 8、12.140 7;第1对主基因显性效应值ha分别为7.765 6、-19.738 8、14.024 9、-12.140 7,第2对主基因显性效应值hb分别为18.576 2、6.962 0、24.059 1、9.077 0,2对主基因的加性效应绝对值大于显性效应值绝对值即|da|+|db|>|ha|+|hb|。2个主基因的加性互作值i分别为-22.075 7、6.962 0、-41.196 8、12.140 7,2对主基因的显性互作值分别为-19.697 1、-14.203 0、-24.059 1、-9.077 0,2个主基因的加显互作值jab分别为-8.164 6、6.962 0、-24.059 1、9.077 0,2对主基因的显加互作值jba分别为3.518 2、12.285 9、-41.196 8、-12.140 7。二阶参数数据显示,四组模型的主基因遗传率分别为87.98%、74.60%、73.96%、72.33%,多基因遗传率分别为0、2.7%、0、0,环境方差占表型方差百分比分别为12.02%、22.70%、26.40%、27.67%,说明环境对黄瓜枯萎病抗性有一定的影响。
3 讨论与结论
黄瓜枯萎病是一种可以在土壤中传染,也可以通过种子携带传播,在黄瓜种植过程中随时有可能发生的存活在维管束内的具有极大感染性的系统性病害,特别容易发生在连作地区,是世界性的影响黄瓜产量的毁灭性土传病害[14]。园艺作物的抗病性多为数量性状,开展数量性状的遗传分析对园艺作物育种非常重要[15]。盖钧镒[16]提出的植物数量性状遗传体系,即植物数量性状主基因+多基因控制,效应大的为主基因控制,效应较小而又无法个别测定的则为多基因控制,从数量性状有较大环境变异出发,发展多世代进行联合分析方法。该方法在黄瓜遗传模式的研究中广泛应用,如黄瓜强雌性状[17]、黄瓜雄花性状[18]、黄瓜心腔颜色[19]、黄瓜霜霉病[20]、黄瓜单性结实[21]、黄瓜果实空心性状[22]。
笔者通过对A 组和B组的四世代群体进行黄瓜枯萎病抗性鉴定后,运用多世代联合分离分析的方法,对该群体进行黄瓜枯萎病遗传规律分析,在表型分析中发现F1都趋于抗性性状,表明抗病性为显性性状。两个组合中2018年秋季和2023年春季均为E-1(MX2-ADI-AD)模型,2019年春季和2023年秋季均为E-0(MX2-ADI-ADI)模型。2018年秋季和2023年春季 E-1(MX2-ADI-AD)模型与Dong等[12]用Superina×Rijiecheng六世代构建的黄瓜枯萎病遗传模型相符合,说明了黄瓜枯萎病抗性由两对主基因控制,且主基因存在加性显性效应。同时也与刘子记等[23]用Thai4-6×CN19-1六世代构建的苦瓜枯萎病遗传模型和琚茜茜等[24]用5-278×MC10-1六世代构建的苦瓜枯萎病遗传模型、赵荣茺等[25]用H11Ta×H04六世代构建的瓠瓜枯萎病遗传模型等瓜类抗枯萎病遗传模型相一致。由此可见,黄瓜枯萎病抗性遗传模型可能主要为E-1(MX2-ADI-AD)模型,由主基因控制+多基因控制。在瓜类的枯萎病抗性遗传中,也存在很多其他的遗传模型,邹小花等[26]用97103×PI296341重组自交系材料西瓜枯萎病抗性的遗传规律符合B-3(2MG-A)模型,六世代联合分析模型为D-2(MX1-A-AD),得出西瓜枯萎病抗性由主基因和多基因共同控制。廖建杰等[27]的研究表明,瓠瓜世代群体对枯萎病的抗性由多基因控制,抗性遗传符合“加性-显性”模型。
综上所述,应用主基因-多基因联合遗传分析方法分别获得了E-1(MX2-ADI-AD)模型和E-0(MX2-ADI-ADI)模型,两个模型均由2对主基因+多基因控制。本研究结果初步揭示了黄瓜枯萎病抗性遗传主要由主基因控制,为后续黄瓜枯萎病QTL定位、抗性材料的选育和挖掘抗性基因提供了参考依据。
参考文献
[1] CHEN C,ZHOU G,CHEN J,et al.Integrated metabolome and transcriptome analysis unveils novel pathway involved in the formation of yellow peel in cucumber[J].International Journal of Molecular Sciences,2021,22(3):1494.
[2] XU J,ZHANG N Y,WANG K,et al.Chitinase Chi 2 positively regulates cucumber resistance against Fusarium oxysporum f. sp. cucumerinum[J].Genes,2022,13(1):62.
[3] XU J,XIAN Q Q,ZHANG N Y,et al.Identification of miRNA-Target gene pairs responsive to Fusarium wilt of cucumber via an integrated analysis of miRNA and transcriptome profiles[J].Biomolecules,2021,11(11):1620.
[4] 杜宾.一株黄瓜枯萎病拮抗菌的鉴定及发酵培养基的优化[J].北方园艺,2017(3):132-137.
[5] 隋继超,李晓丽,宋晓飞,等.黄瓜抗枯萎病研究进展[J]. 中国瓜菜,2023,36(1):1-5.
[6] XU J,WANG K,XIAN Q Q,et al.Identification of susceptibility genes for Fusarium oxysporum in cucumber via comparative proteomic analysis[J].Genes,2021,12(11):1781.
[7] NETZER D,NIEGO S,GALUN E.A dominant gene conferring resistance to Fusarium wilt in cucumber[J].Phytopathology,1977,67(4):525-527.
[8] VAKALOUNAKIS D J.Inheritance and linkage of resistance in cucumber line SMR-18 to races 1 and 2 of Fusarium oxysporu f. sp. cucumerinum[J].Plant Pathology,1995,44(1):169-172.
[9] 侯安福,尹彦.黄瓜枯萎病抗性遗传规律的研究[M]. 北京:科学出版社,1995:439-444.
[10] 王亚娟,张显,杜胜利.黄瓜枯萎病与抗性遗传育种进展[J].西北农业学报,2005,14(5):168-172.
[11] 周红梅,毛爱军,张丽蓉,等.黄瓜枯萎病接种方法及抗性遗传的研究[J].华北农学报,2010,25(4):186-190.
[12] DONG J P,XU J,XU X W,et al.Inheritance and quantitative trait locus mapping of Fusarium wilt resistance in cucumber[J].Frontiers in Plant Science,2019,10:1425.
[13] BARTHOLOMEW E S,XU S,ZHANG Y Q,et al.A chitinase CsChi23 promoter polymorphism underlies cucumber resistance against Fusarium oxysporum f. sp. cucumerinum[J].New Phytologist,2022,236(4):1471-1486.
[14] 琚茜茜,黄如葵,黄熊娟,等.瓜类枯萎病抗性遗传育种研究进展[J].热带农业科学,2022,42(4):33-38.
[15] 邹文莉,牛文利,杨华应,等.烟草青枯病抗性突变体486-K和117-K的遗传分析[J].中国烟草科学,2020,41(2):1-7.
[16] 盖钧镒.植物数量性状遗传体系的分离分析方法研究[J].遗传,2005,27(1):130-136.
[17] 陈宸,崔清志,陈惠明,等.黄瓜强雌性状的主基因+多基因混合遗传模型分析[J].热带作物学报,2015,36(10):1769-1773.
[18] 苗永美,隋益虎,简兴.黄瓜雄花性状的遗传分析[J].广西植物,2015,35(5):704-708.
[19] 赵宇,沈佳,李季,等.黄瓜心腔颜色的遗传[J].分子植物育种,2017,15(4):1478-1484.
[20] 丁欢欢,李晓辉,户克云,等.黄瓜霜霉病抗性遗传分析[J].中国瓜菜,2017,30(5):7-10.
[21] 黄亚莉,杨侃侃,周赓,等.华南型雌雄同株黄瓜单性结实遗传分析[J].分子植物育种,2020,18(24):8163-8170.
[22] 周赓,陈宸,刘晓虹,等.黄瓜果实空心性状的数量遗传分析[J/OL].分子植物学报,2021,[2021-11-05].https://kns.cnki.net/kcms/detail/46.1068.S.20211104.1456.004.html.
[23] 刘子记,朱婕,牛玉,等.苦瓜枯萎病抗性材料Thai4-6的遗传模型分析[J].热带作物学报,2018,39(8):1501-1506.
[24] 琚茜茜,黄如葵,黄熊娟,等.苦瓜种质枯萎病抗性鉴定与抗性遗传特征分析[J].分子植物育种,2022,22(15):5014-5023.
[25] 赵荣茺,沈慕洁,张归,等.瓠瓜枯萎病抗性的遗传规律分析[J/OL].分子植物育种,2023,[2023-03-10].https://kns.cnki.net/kcms/detail/46.1068.S.20230310.1349.004.html.
[26] 邹小花,张海英,李胜,等.野生西瓜种质PI296341-FR抗枯萎病菌生理小种2的遗传规律[J].园艺学报,2011,38(9):1699-1706.
[27] 廖建杰,张映卿,徐博娅,等.砧用瓠瓜抗枯萎病相关性及杂种优势分析[J].广西植物,2020,40(20):184-191.
