环尾狐猴弓形虫感染诊治
2024-10-22邓家波岳婵娟高艳凤刘颂蕊杨琬婧陈维刚王利勤李玉飞曹玉琴

摘要:四川某饲养单位于2022年7月起陆续发现环尾狐猴开始出现精神萎靡、不好动、食欲废绝等症状,且病程短、死亡率较高。通过实验室检测诊断为弓形虫感染,选择林可霉素、螺旋霉素、磺胺类等药物进行防治,取得了一定的治疗效果。
关键词:环尾狐猴;弓形虫;检测;诊断;治疗
环尾狐猴(Lemur catta)属于原始灵长类,分布于非洲马达加斯加岛南部和西部的干燥森林中,生活在疏林裸岩地带。环尾狐猴被列入《濒危野生动植物种国际贸易公约》CITES附录Ⅰ中。其性情温和,身体背部的毛呈浅灰褐色,腹部为灰白色,额部、耳背和颊部为白色,与黑色的吻部和眼圈构成了鲜明的对比色彩,十分有趣。很多动物园和萌宠乐园都饲养有环尾狐猴。四川某饲养单位于2022年7月陆续发现环尾狐猴开始发病,多数出现精神萎靡、不好动、食欲废绝、体温升高或体温变化不明显,有些病程很短就死亡,取死亡动物组织实验室检测诊断为弓形虫感染,经治疗和预防投药,取得一定效果。
1 发病情况
2022年7月5,饲养人员发现一亚成体环尾狐猴出现精神萎靡、不好动、食欲废绝、体温升高,血液常规和生化无明显异常,经治疗无效死亡,取该动物血液及死亡后心、肝、脾、肺、肾做弓形体抗原核酸检测弓形虫阳性。7月21日、7月27日相继又有环尾狐猴发病,根据实验室检测结果,结合临床特征,按照弓形虫感染进行治疗,7月21日发病的环尾狐猴,经过长达20 d的治疗,动物逐渐康复,7月27日发病个体治疗无效死亡。
2 材料与方法
2.1 样品采集及处理
血液样本采集自发病环尾狐猴个体。在麻醉的情况下,使用含有EDTA的采血管从待测动物后肢静脉中采集全血样本,分装后至4 ℃保存至血浆分离及DNA提取。收集死亡动物剖检后心、肝、脾、肺、肾等组织样本进行组织病理切片及DNA提取。血液样本DNA提取试剂盒采用QIAGEN的QIAamp DNA Blood Mini Kit;组织样本DNA提取试剂盒采用QIAGEN的Blood & Tissue Kit;PCR预混液(包括DNA聚合酶,10×Buffer,dNTP等)购自赛默飞世尔科技公司,DL2000 DNA Marker购自Biosharp公司。
2.2 血清抗体检测
使用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)和改良凝集试验(modified agglutination test,MAT)对血浆样本中弓形虫抗体IgG进行检测。ELISA试剂盒购自北京天之泰生物科技有限公司,MAT试剂盒购自美国田纳西大学研究基金会,实验使用96孔U型板进行,血浆样本按1∶25~1∶200连续稀释。具体实验步骤及结果判定参照商用试剂盒说明书进行。当MAT和ELISA结果均为阳性时,判断检测结果为阳性,反之则为阴性;当MAT与ELISA结果不同时,重复实验,若结果仍不相同,则判断结果为疑似阳性。
2.3 抗原核酸检测
参照Homan等[1]报道的弓形虫529 bp重复序列(AF146527.1),对提取的环尾狐猴组织及血液DNA进行弓形虫PCR检测,使用引物对:上游引物529ToxoF(5'-CTGCAGGGAGGAAGACGAAAGTTG-3')和下游引物529ToxoR(5'-CTGCAGACACAGTGCATCTGGATT-3'),引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为25 ?滋L,其中包括12.5 ?滋L的PCR预混液(Dream Taq Green MM),8.5 ?滋L的双蒸水,50 ?滋mol/L上下游引物各1 ?滋L,DNA模板2 ?滋L。PCR反应程序为:预变性94 ℃ 5 min,变性94 ℃ 1 min,退火65 ℃ 1 min,延伸72 ℃ 1 min,循环30次,最后72 ℃ 10 min。PCR产物用1.5%琼脂糖凝胶电泳分析(120 V,35 min)。
3 结果与诊断
3.1 剖检与病理组织切片分析
死亡动物剖检主要病变是肺充血、出血,胸腔积液增多,多数发病急的动物组织器官剖检无明显肉眼所见病变。死亡动物组织切片主要表现为肺组织出血、淤血、充血,肝细胞水肿、变性、多灶性坏死、肝细胞胆汁淤积,心脏灶区心肌纤维波浪样变,肠系膜淋巴结凝固性坏死,其他组织病理变化不明显。不同死亡个体组织病变也不完全相同,多数死亡动物均有肺组织病变。
3.2 血清学检查结果
对采集到的环尾狐猴血液样本使用MAT和ELISA进行弓形虫IgG抗体检测。结果显示,采集环尾狐猴血液样本为弓形虫IgG抗体阳性,其中MAT结果效价为1∶50。
3.3 PCR检测及阳性结果测序
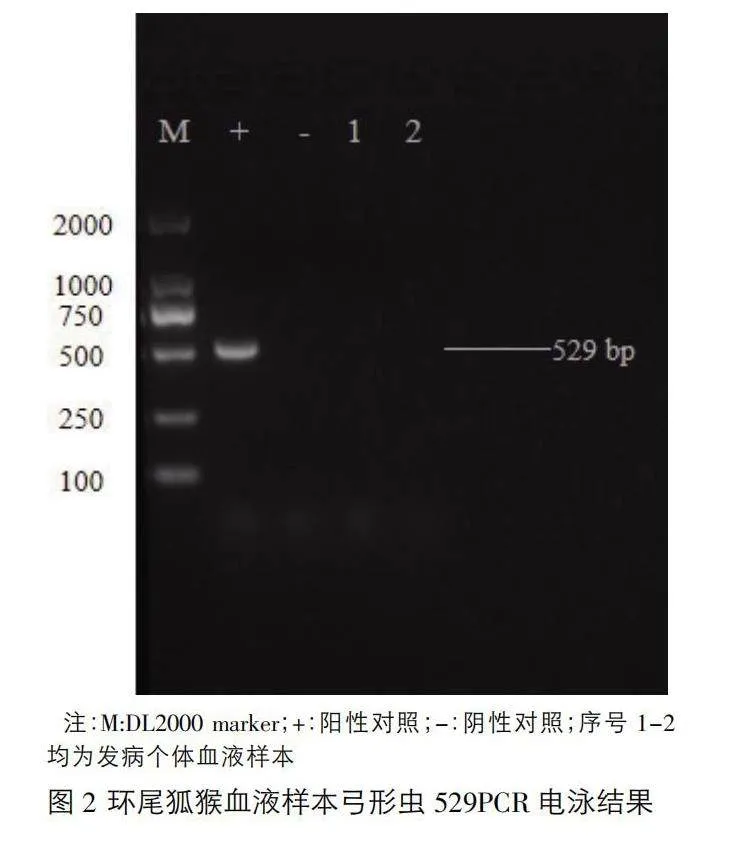
对提取的组织样本DNA及血液样本DNA进行弓形虫529序列进行PCR检测。检测结果显示,环尾狐猴内脏组织样本均为弓形虫PCR阳性(图1),血液样本弓形虫PCR检测结果为阴性(图2)。将阳性样本送至生工生物工程(上海)股份有限公司测序,并将获得的序列进行Blast分析,结果显示扩增片段为弓形虫的529 bp重复序列。
3.4 诊断结果
根据病史、临床症状、剖检、病理组织切片和实验室检查结果,确诊环尾狐猴死亡个体患有弓形虫病。
4 治疗和预防
动物发病后,通过静脉及时补充电解质和能量,早期选用磺胺类和林可霉素联合进行治疗,病情缓解后,再用磺胺类药物进行巩固治疗。其中,7月21日发病的环尾狐猴完全康复,但也有动物发病急,治疗效果不明显。发病高峰期,对其他猴群交替投喂磺胺类和螺旋霉素,加强环境卫生消毒,加强灭鼠,制止流浪猫进入动物兽舍,整体情况得到控制,但动物体内弓形虫包囊杀灭和清除,存在反复感染的情况。
5 转归与预后
目前治疗弓形虫的药物有限,大多药物具有毒副作用强的特点,用药时间过长,动物机体会受到的影响比较大,需要很长时间才能消除药物副作用带来的影响。发病急或发现比较晚的病例治疗效果很不理想。
6 讨论
该养殖单位环尾狐猴感染弓形虫的情况与国内外资料报道的情况相似或相同,无论是临床症状还是病理变化都基本吻合,且发病率和死亡率均很高[2-4]。充分说明,环尾狐猴对弓形虫高度易感,该病对环尾狐猴种群影响非常大,提醒各动物园、萌宠乐园或其他环尾狐猴饲养单位,做好弓形虫的防控任务十分紧迫。
按照当前动物疾病治疗水平,可选择的药物大多为磺胺类、乙胺嘧啶、螺旋霉素、林可霉素、阿奇霉素等,药物的副作用都比较大,再加上动物体内的弓形虫包囊难以杀灭及清除和/或疾病分期的问题,其治疗效果受限[5-6] 。今后在弓形虫敏感低毒药物的筛选、弓形虫在环尾狐猴致病机理、治疗方式方法、早期诊断和预防等方面加大研究力度,方可进行有效防控。
弓形虫病(toxoplasmosis)是刚地弓形虫寄生于多种动物和人的有核细胞内引起的一种重要的人与动物共患病。弓形虫宿主种类广泛,几乎所有的温血动物都可能成为感染弓形虫的来源[7]。弓形虫可寄生在除红细胞外的几乎所有有核细胞内,虫体整个生活史分为五个阶段,分别是滋养期、包囊期、裂殖期、配子体和卵囊期。由于弓形虫病的临床症状无明显特异性,且多呈现隐性感染,故依据临床症状和流行病学难以作出诊断。目前弓形虫病主要依据实验室诊断,主要方法有病原学检查、免疫学检测和分子生物学技术[8]。
病原学检查以从病料中直接查到速殖子或卵囊为确诊标准。采用直接涂片或者组织切片、动物接种和卵囊等检查法,该检查结果准确,但由于检出率低、耗时长,不适用于大熊猫弓形虫病的快速检测和流行情况调查;免疫学检测是从血清或脑脊液内检测到特异性抗体是诊断弓形虫病应用广泛的重要辅助手段。主要方法包括染色试验(sabin-Feldman dye test,DT)、间接血凝试验(indirect hemagglutination test,IHA)、乳胶凝集试验(latrx agglutination test,LAT)、间接免疫荧光试验(indirect immunofluorescent assay,IFA)、酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)等[9]。其中IHA特异性高、假阳性率低、诊断价值高和操作简便;ELISA具有敏感性高、特异性强、检测速度快、受检样本多等特点,有很好的推广应用价值。分子生物学技术已应用于弓形虫病的检测,国内外已经建立了多种弓形虫病基因诊断方法,主要有LAMP、DNA探针和PCR技术等。目前用于弓形虫检测的探针多为特异性DNA克隆片段或人工合成的寡核苷酸探针,但其制备需要一定条件,且费用较高,不易推广。PCR技术自建立以来,以其灵敏、特异、高效而成为一项目前广为应用的诊断技术。为提高试验的敏感性和特异性,在PCR基础上,又发展了巢式PCR(nested PCR)、PCR-ELISA和RT-PCR技术,并在弓形虫病诊断中得以应用[10]。
目前关于圈养非人灵长类动物感染弓形虫的研究仍然知之甚少,已证实首要风险因素是携带弓形虫卵囊的猫科动物,而动物种属、馆舍开放程度和饲养管理等因素在不同地区的非人灵长类感染中的权重也有所差异[11]。现有研究表明新世界灵长类对弓形虫具有较高的易感性,且急性弓形虫病易导致其死亡[12]。获得性弓形虫的常见传播方式是经口感染其组织包囊或卵囊,导致动物发病和传播,因此,加大灭鼠工作力度,加强流浪猫的管控,是控制或防止弓形虫病发生的重要手段。■
参考文献:
[1] Homan W L,Vercammen M , Braekeleer J D,et al.Identification of a 200- to 300-fold repetitive 529 bp DNA fragment in Toxoplasma gondii, and its use for diagnostic and quantitative PCR.[J].International Journal for Parasitology, 2000, 30(1):69-75.
[2] SUREAU P, RAYNAUD JP, LAPEIRE C, et al. Preimer isolement de Toxoplasma gondii a Madagascar toxoplasmose spontanée et expérimentale du Lemur catta[J]. Bull Soc Pathol Exot,1962, 55:357-362.
[3] SPENCER J A, JOINER K S, HILTON C D, et al. Disseminated toxoplasmosis in a captive ring-tailed lemur (Lemur catta) [J]. Journal of Parasitology, 2004, 90(4): 904-906.
[4] 单芬,李康信,徐春忠,等.环尾狐猴源弓形虫的检测与鉴定[J].野生动物学报, 2016, 37(2):118-125.
[5] 孙晓敬,张磊,田甜,等.弓形虫病治疗:从传统药物到纳米药物[J].畜牧兽医学报, 2023, 54(5):1834-1844.
[6] ZHANG Y, ZHANG Q, LI H, et al. In vitro and in vivo anti-Toxoplasma activities of HDAC inhibitor Panobinostat on experimental acute ocular toxoplasmosis[J].Frontiers in Cellular and Infection Microbiology,2022,12:1002817.
[7] MONTOYA J G, LIESENFELD O. Toxoplasmosis. [J]. Lancet, 2004, 363:1965-1976.
[8] 高正琴.弓形虫快速鉴定及国内实验动物感染调查[J].实验动物科学,2018,35(05):40-45.
[9] 沈继龙,余莉.我国弓形虫病我国弓形虫病流行概况及防治基础研究进展[J].中国血吸虫病防治杂志,2019,31(1):71-76.
[10] 王萌,王艳华,蔡志杰,张德林.弓形虫病的分子诊断技术研究进展[J].中国人兽共患病学报,2010,26(12):1160-1162.
[11] 张述义.非人灵长类动物弓形虫病的研究概况[J].中国动物传染病学报, 1998(1):57-59.
[12] EPIPHANIO S, SINHORINI I L, CAT?魨O-DIAS J L. Pathology of toxoplasmosis in captive new world primates [J]. Journal of Comparative Pathology, 2003, 129(2-3): 238-246.
