反复种植失败与复发性流产的病因比较
2024-10-19胡奕芳杨宇欣王灿钟雪梁玉莲龙姝辰陈雪儿叶玉津王琼


【摘要】 目的 了解反复种植失败(RIF)和复发性流产(RPL)患者的病因差异。方法 选择2018年6月至2021年6月在中山大学附属第一医院生殖中心就诊的315例RIF患者和376例RPL患者为研究对象,进行一般资料及病因资料收集,比较其一般资料及病因构成差异。并采用多因素回归分析这两种疾病病因的相对风险度。结果 RIF患者慢性子宫内膜炎、子宫内膜息肉、子宫内膜异位症、子宫内膜异位症合并子宫内膜息肉、卵巢储备功能减退病因比例均高于RPL患者,RIF患者不明原因病因比例低于RPL患者(P均< 0.05)。多因素Logistic回归分析显示,RIF患者中病因为慢性子宫内膜炎(OR=3.044,95% CI 1.849~5.011,P < 0.001)、子宫内膜息肉(OR=3.769,95%CI 1.670~8.510,P < 0.001)、子宫内膜异位症(OR=3.812,95%CI 2.131~6.819,P < 0.001)、卵巢储备功能减退(OR=2.175,95% CI 1.285~3.683,P = 0.004)比RPL患者更为多见,RIF患者中抗米勒管激素水平低(OR=0.917,95%CI 0.864~0.973,P = 0.004)的情况也较RPL患者多见。结论 慢性子宫内膜炎、子宫内膜息肉、子宫内膜异位症、抗米勒管激素水平下降及卵巢储备功能减退等现象,在RIF患者中更为普遍,后续人工辅助生殖的工作实践中临床医师应强化对上述病变的筛查和监测。
【关键词】 反复种植失败;复发性流产;病因;慢性子宫内膜炎;子宫内膜息肉;子宫内膜异位症;抗米勒管激素
Comparison of the etiological composition between recurrent implantation failure and
recurrent pregnancy loss
HU Yifang1,2, YANG Yuxin1,3, WANG Can1,3, ZHONG Xue1,3, LIANG Yulian1,3, LONG Shuchen1,3, CHEN Xueer1,3, YE Yujin1,3, WANG Qiong1,3
(1.The First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510080, China; 2.Fuzhou Maternal and Child Health Care Hospital of Jiangxi Province (the Second People’ s Hospital of Fuzhou City of Jiangxi Province), Fuzhou 344000, China;
3.Guangdong Reproductive Medicine Laboratory and Guangdong Obstetrics and Gynecology Clinical Research Center,
Guangzhou 510080, China)
Corresponding author: WANG Qiong, E-mail: wqiong@mail.sysu.edu.cn
【Abstract】 Objective To explore the differences of etiology of recurrent implantation failure (RIF) and recurrent pregnancy loss (RPL). Methods Patients with RIF (n = 315) and patients with RPL (n = 376) admitted to the Reproductive Center of the First Affiliated Hospital of Sun Yat-sen University from June 2018 to June 2021 were included. General and etiological data were collected to compare the differences in baseline data and etiological composition. Relative risk factors of the etiology of these two conditions were identified by multivariate regression analysis. Results Univariate analysis showed a significantly higher proportion of chronic endometritis, endometrial polyps, endometriosis, endometriosis complicated with polyps, diminished ovarian reserve and a significantly lower proportion of unexplained cause in the RIF group than in the RPL group (all P <0.05). Multivariate logistic regression analysis showed that the incidence of chronic endometritis (OR=3.044, 95%CI 1.849-5.011, P < 0.001), endometrial polyps (OR=3.769, 95%CI 1.670-8.510, P < 0.001), endometriosis (OR=3.812, 95%CI 2.131-6.819, P < 0.001) and diminished ovarian reserve (OR=2.175, 95%CI 1.285-3.683, P = 0.004) in the RIF group was significantly higher than that in the RPL group. The proportion of patients with lower anti-Mullerian hormone levels (OR=0.917, 95%CI 0.864-0.973, P = 0.004) in the RIF group was higher compared with that in the RPL group. Conclusion Chronic endometritis, endometrial polyps, endometriosis, decreased anti-Mullerian hormone level and diminished ovarian reserve are more common in RIF patients, and the screening and monitoring of the above lesions should be strengthened in the subsequent practice of assisted reproduction.
【Key words】 Recurrent implantation failure; Recurrent pregnancy loss; Etiology; Chronic endometritis; Endometrial polyps; Endometriosis; Anti-Müllerian hormone
妊娠是一个复杂而协调的生理过程。当中胚胎着床经历定位、黏附和侵入三个步骤,其中一个步骤出现问题均可能导致着床失败;若着床成功,胚胎将继续发育,依次出现妊娠囊、卵黄囊和胚芽,任何干扰该过程的因素均可能导致流产。目前进行辅助生殖技术(assisted reproductive technology,ART)治疗的患者数量逐渐增加,部分患者在进行了多次优质胚胎移植后仍无法获得临床妊娠,称为反复种植失败(recurrent implantation failure,RIF),在行体外受精/卵胞质内单精子注射治疗的患者中,RIF的发生率可达5%~10%[1]。2018年发表的《胚胎植入前遗传学诊断/筛查技术专家共识》将RIF定义为经历3次及以上胚胎移植,或移植不少于4~6枚优质卵裂期胚胎或3枚优质囊胚而未获得临床妊娠[2]。2023年欧洲人类生殖与胚胎学会推荐如采用以下治疗仍未能实现临床妊娠即可诊断RIF:经历2次及以上取卵周期,35岁以下3次移植,35~39岁4次移植,40岁及以上患者6次移植;40岁以下移植整倍体胚胎1个,40岁及以上移植2个以上的整倍体胚胎[3]。另外,2023年欧洲人类生殖与胚胎学会指南将复发性流产(recurrent pregnancy loss, RPL)定义为连续发生2次及以上妊娠24周前的胎儿丢失[4]。《自然流产中国专家共识(2020年版)》将RPL定义为在连续发生2次及以上,在妊娠28周前的胎儿丢失,其中包括生化妊娠[5]。由于临床上观察到RIF的病因与RPL的病因具有高度一致性,如单角子宫畸形患者的种植率下降并且流产率增加,故目前不少临床医师对RIF患者选择与RPL患者相同的病因筛查项目。但是,种植失败和流产是胚胎在不同发育阶段发生的发育停滞,因此导致RIF与RPL的病因很可能是存在差异的。目前国内对RIF与RPL的病因差异研究甚少,本研究将了解RIF与RPL的病因及相关因素是否存在差异,并且探索2种疾病的高危因素,以期了解两种疾病在临床诊治中的侧重点。
1 对象与方法
1.1 研究对象
收集2018年6月至2021年6月在中山大学附属第一医院生殖中心确诊为RIF或RPL的患者为研究对象。RIF的诊断和纳入标准:①符合2023年欧洲人类生殖与胚胎学会推荐标准[3];②有详细的病史记录,包括一般情况、婚育史、流产情况、手术史等;③有RIF的病因检查结果。RPL的诊断和纳入标准:①自然受孕或采用ART后发生连续2次及以上的生化妊娠或24周及以内的自然流产(由经阴道盆腔超声检查或病理活组织检查确诊)[4-5];②有详细的病史记录,包括一般情况、婚育史、流产情况、手术史等;③有RPL的病因检查结果。排除标准:①RPL患者合并RIF患者;②病因检查结果不全的患者,如无宫腔镜或三维超声检查报告者;③RIF病因为无优质胚胎的患者。本研究已经获得患者的知情同意,并经中山大学附属第一医院医学伦理委员会批准(批件号:伦审临〔2023〕309号)。
1.2 研究方法
1.2.1 一般资料收集
记录患者一般资料:年龄、身高、体质量、月经周期,婚育史、妊娠丢失史(包括既往自然流产情况及胚胎染色体检查结果、既往体外受精与胚胎移植情况)、自身免疫性疾病、内分泌疾病等既往史、手术史、家族遗传病史等。
1.2.2 患者病因检查结果资料收集
1)夫妻双方染色体核型分析。夫妻任意一方存在染色体异常即归为亲代染色体异常病因。
2)超声(三维)检查结果、宫腔镜手术记录以及术后病理报告。了解患者是否存在黏膜下子宫肌瘤、先天性子宫畸形(包括单角子宫、弓形子宫、子宫纵隔等)、慢性子宫内膜炎、子宫内膜息肉及宫腔粘连等疾病。其中黏膜下子宫肌瘤定义为肌瘤向宫腔方向生长,突出于子宫腔,表面仅由子宫内膜覆盖;先天性子宫畸形定义为胚胎发育过程中双侧副中肾管在各种因素作用下发生单侧或双侧发育异常、融合异常、发育不全或发育停滞而导致的各种子宫畸形;慢性子宫内膜炎定义为子宫内膜免疫组织化学染色CD138阳性细胞数≥5个/高倍视野(本研究同时记录CD138阳性细胞数);子宫内膜息肉定义为局部子宫内膜腺体和间质过度生长,被覆上皮并突出于周围子宫内膜;宫腔粘连定义为由多种原因引起子宫内膜基底层损伤,导致子宫腔、子宫峡部、宫颈管的相互粘连甚至闭塞;子宫内膜异位症定义为子宫内膜腺体和间质生长在子宫腔以外的不同部位。
3)内分泌和代谢系统检查结果。相关指标包括雌二醇(estradiol,E2)、卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、睾酮(testosterone,T)、催乳素(prolactin,PRL)、抗米勒管激素(anti-Müllerian hormone,AMH)、促甲状腺激素(thyearoid stimulating hormone,TSH)、游离甲状腺素(free thyearoxine,FT4)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、空腹胰岛素(fasting insulin,FINS)、空腹血糖(fasting plasma glucose,FPG)水平。同时筛查患者有无内分泌和代谢异常疾病,其中甲状腺功能异常包括甲状腺功能亢进(TSH水平降低,FT4水平升高)、甲状腺功能减退(TSH水平升高,FT4水平减低)、亚临床甲状腺功能亢进(TSH水平<
0.34 mU/L)及亚临床甲状腺功能减退(TSH水平>
5 mU/L);多囊卵巢综合征采用鹿特丹会议标准;糖耐量异常指FPG浓度<7.0 mmol/L、口服葡萄糖耐量试验2 h后血糖浓度7.8~11.0 mmol/L;高PRL血症指外周血PRL水平持续高于30 U/L;卵巢储备功能减退指AMH质量浓度<1.1 μg/L,两侧卵巢窦卵泡数(antral follicle counting,AFC)<5~7枚。
4)自身免疫性抗体检查结果。相关指标包括抗核抗体、抗双链DNA抗体、抗组蛋白抗体、抗核小体抗体、抗甲状腺过氧化物酶抗体、抗甲状腺球蛋白抗体、抗心磷脂抗体、抗β2-糖蛋白1抗体及狼疮抗凝物。抗体阳性患者均转诊至中山大学附属第一医院风湿免疫科,由风湿免疫科按相应自身免疫疾病的名称诊断后计入自身免疫疾病的病因。
1.3 统计学方法
采用SPSS 26.0和SAS 9.2分析数据。计数资料以n(%)表示,组间比较采用χ 2检验,当期望频数小于5的格子较多时,组间比较采用Fisher确切概率法。计量资料使用Shapiro-Wilk方法验证是否呈正态分布,若为正态分布,用表示,组间比较采用独立样本t检验;若为非正态分布,则以M(P25, P75)表示,组间比较采用Mann-Whitney U检验。为探究RIF与RPL病因的差异,纳入有临床意义的因素,包括年龄、体质量指数、AMH、月经周期以及在单因素分析中有统计学意义的病因,将病因及相关因素赋值为1(有)与0(无),采用逐步回归法,建立多因素二元Logistic回归方程,计算比值比(odds ratio,OR)及95%可信区间(confidence interval,CI)。双侧P < 0.05为差异有统计学意义。
2 结 果
2.1 RIF组患者与RPL组患者的一般资料
本研究共纳入315例RIF患者和376例RPL患者。其中RIF组患者年龄为(35.30±4.60)岁,RPL组患者年龄为(35.00±4.48)岁;RIF组患者年龄分布较RPL患者更集中于35岁及以上年龄段(P < 0.05)。与RPL组患者比较,RIF组患者的AMH水平较低、E2水平较高、月经周期较短(P均< 0.05),2组体质量指数、其他基础内分泌水平及有腹腔镜手术史者比例比较差异均无统计学意义(P均> 0.05)。见表1。
2.2 RIF组患者与RPL组患者病因构成分布
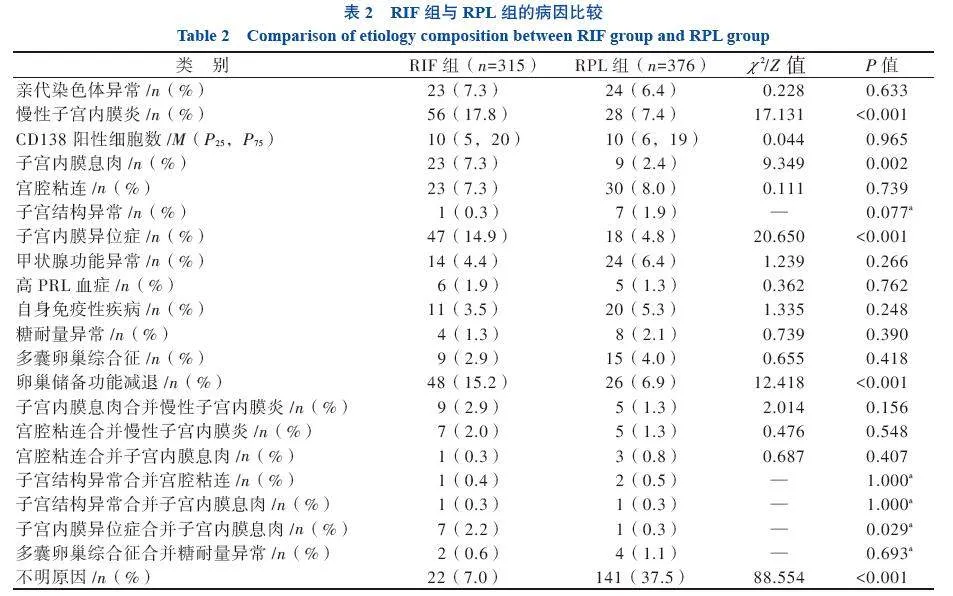
RIF组中23例存在亲代染色体异常,其中女性染色体异常11例、男性染色体异常12例,无夫妻双方染色体均异常者;RPL组中24例存在亲代染色体异常,其中女性染色体异常18例,男性染色体异常6例,无夫妻双方染色体均异常者。2组亲代染色体异常病因比例比较差异无统计学意义(P > 0.05)。RIF组中176例(55.9%)存在解剖结构异常或妇科疾病,RPL组中109例(28.9%)存在解剖异常或妇科疾病,组间慢性子宫内膜炎、子宫内膜息肉、子宫内膜异位症病因比例比较差异均有统计学意义(P均< 0.05)。RIF组中35例(11.1%) 存在内分泌异常,RPL组中56例(14.9%)存在内分泌异常,组间各内分泌病因比较差异均无统计学意义(P均> 0.05)。RIF组中11例存在自身免疫性疾病,均为未分化结缔组织病,RPL组中20例存在自身免疫性疾病,其中未分化结缔组织病12例,抗磷脂抗体综合征5例,类风湿关节炎2例,舍格伦综合征1例。2组自身免疫性疾病病因比例比较差异无统计学意义(P > 0.05)。与RPL组相比,RIF组卵巢储备功能减退、子宫内膜异位症合并子宫内膜息肉病因比例较高、不明原因病因比例均较低(P均< 0.05)。见表2。
2.3 RIF组患者与RPL组患者病因的多因素分析
以RIF和RPL作为因变量(RIF =1,RPL=0),将年龄、体质量指数、AMH、E2、月经周期以及病因分布比例中组间比较差异有统计学意义的病因作为自变量,其中年龄、AMH、E2、体质量指数以及月经周期为连续变量,病因均为二分类变量,有赋值为1,无赋值为0,采用逐步回归法,建立多因素二元Logistic回归方程。结果显示,与RPL患者相比,慢性子宫内膜炎、子宫内膜息肉、子宫内膜异位症、卵巢储备功能减退和AMH水平降低在RIF患者中较多见(P均< 0.05)。见表3。
3 讨 论
RIF与RPL病因高度重叠交叉,主要包括亲代染色体异常、先天性子宫结构异常、获得性解剖异常、免疫因素及内分泌因素等,所以病因差异往往被混淆。这2种疾病均病因复杂而且治疗棘手,在近年受到较多关注。目前笔者尚未查及RIF与RPL病因差异的文献报道,而病因构成是疾病治疗的关键所在。因此,本研究采用最新欧洲人类生殖与胚胎学会的RIF诊断共识,分析RIF及RPL的相关病因差异。研究结果显示,与RPL患者相比,慢性子宫内膜炎、子宫内膜息肉、子宫内膜异位症、卵巢储备功能减退和AMH水平降低在RIF患者中更为多见。
慢性子宫内膜炎是指局限于子宫内膜的慢性炎症,目前临床上常将免疫组织化学染色阳性细胞数≥5个/高倍视野作为慢性子宫内膜炎的诊断标准[6]。文献报道慢性子宫内膜炎在一般人群中的发生率为2.8%~44.0%,在RPL患者中的发生率为8.9%~56.0%,在RIF患者中的发生率为14.0%~57.6%[6-7]。本研究显示,RIF患者的慢性子宫内膜炎病因比例高于RPL患者(17.8% vs. 7.4%),RIF患者以慢性子宫内膜炎为病因的概率为RPL患者的3.044(95%CI 1.849~5.011)倍。胚胎植入过程包括胚胎定位、黏附和侵入等阶段。胚胎植入成功与否取决于三大条件:胚胎的质量、子宫的完整性和子宫内膜的容受性[8]。胚胎植入成功后,胚层分化,胚体形成,胚胎进一步发育。研究者发现,相比于未患慢性子宫内膜炎的不孕患者,患有慢性子宫内膜炎的不孕患者分泌晚期子宫内膜中CD56+CD16-子宫自然杀伤细胞的比例降低而CD3+T细胞比例升高[9]。RIF或RPL合并子宫内膜炎患者的分泌中期子宫内膜CD68+巨噬细胞、CD83+成熟树突细胞、CD8+T细胞数量均多于非子宫内膜炎患者[10]。Kitaya等[11]发现,RIF合并慢性子宫内膜炎患者子宫内膜IgM、IgA和IgG的表达水平升高,IgG2的表达水平高于其他亚类。以上研究结果说明,慢性子宫内膜炎可能导致子宫内膜免疫状态改变。有学者比较了非慢性子宫内膜炎人群与慢性子宫内膜炎患者的子宫内膜基质细胞培养后蜕膜标志物表达差异,发现慢性子宫内膜炎患者的PRL、促肾上腺皮质激素释放因子及胰岛素样生长因子结合蛋白 1的表达减少,提示慢性子宫内膜炎患者子宫内膜蜕膜化受损[9, 12]。此外,慢性子宫内膜炎可影响子宫内膜收缩模式,慢性子宫内膜炎患者相比于正常妇女在黄体中期出现了不必要的收缩,影响胚胎植入[13]。因此,慢性子宫内膜炎可能通过改变子宫内膜免疫状态、改变子宫内膜容受性及影响子宫内膜收缩,进而影响胚胎植入或早期胚胎发育过程。
本研究中,RIF组与RPL组的CD138阳性细胞数比较差异无统计学意义,即两者的子宫内膜炎严重程度相近。目前尚无有关RIF与RPL患者患慢性子宫内膜炎严重程度的研究报道。Rimmer等[14]对CD138阳性细胞数分级,发现相比于非慢性子宫内膜炎患者,CD138阳性细胞数≥16个/高倍视野的RIF或RPL的慢性子宫内膜炎患者妊娠后再次发生流产的风险更高(RR=10.0,95% CI 2.78~36.02)。因此,根据本研究结果推测,RIF患者因慢性子宫内膜炎发生流产的概率可能高于RPL患者,但是炎症程度差异不大。
子宫内膜息肉在不孕症女性中的发生率为6%~32%,在RIF患者中的发生率为16.7%[15],在RPL患者中的发生率为1%~6%[16]。研究显示,子宫内膜息肉患者体内雌激素、孕激素受体表达异常导致局部内膜过度增生[17]、子宫内膜息肉组织中内膜容受性关键基因HOXA10和HOXA11的mRNA相对表达量下降[18]、内膜中代谢物肌酸表达下降、乳酸表达升高[19]等是导致胚胎种植受阻的机制。本研究显示,相比于RPL患者,子宫内膜息肉病因在RIF患者中更为常见(7.3% vs. 2.4%),RIF患者中以子宫内膜息肉为病因的概率为RPL患者的3.769(95%CI 1.670~8.510)倍,提示子宫内膜息肉可能对着床过程影响更大。有研究者报道,在不孕患者中子宫内膜异位症合并子宫内膜息肉的检出率可达46.7%[20]。本研究也显示,在RIF患者中子宫内膜异位症病因较在RPL患者中多见(14.9% vs. 4.8%),RIF中以子宫内膜异位症为病因的概率为RPL患者的3.812(95%CI 2.131~6.819)倍,而子宫内膜异位症合并子宫内膜息肉病因在RIF患者中比例也较在RPL患者中高(2.2% vs. 0.3%)。子宫内膜异位症被认为是RIF潜在未被诊断的病因[3],而子宫内膜异位症与RPL的关系尚不明确[21]。有学者报道,在ART中,子宫内膜异位症患者每个周期和每次移植的妊娠率和着床率有统计学意义上的降低(与接受体外受精的输卵管性不孕妇女对照组相比)[22]。Borges等[23]观察到子宫内膜异位症患者的卵母细胞及胚胎质量下降,氧化应激及免疫调节紊乱可能是导致其卵母细胞及胚胎质量下降的原因[24]。
卵巢储备功能减退指由于卵母细胞的质量下降或数量减少导致生育能力下降,临床上常用AMH<1.1 ng/mL或两侧卵巢AFC<5~7枚诊断[25]。卵巢储备功能减退在人群中发生率约为10%~35%,其发生可能与年龄、遗传因素、生殖道手术史、免疫因素、环境因素及社会心理因素等有关[26-28]。笔者团队及其他学者研究均发现,RPL患者卵巢储备功能减退现象增加[28-29]。Bunnewell等[30]通过荟萃分析发现,相比于非RPL患者,RPL患者卵巢储备功能减退发生率更高;不明原因RPL患者卵巢储备功能减退检出率高于明确病因RPL患者,以上均提示卵巢储备功能减退与RPL有密切关系。本研究首次发现,RIF患者卵巢储备功能减退病因比例高于RPL患者(15.2% vs. 6.9%),RIF患者出现卵巢储备功能减退的概率为RPL患者的2.175(95%CI 1.285~3.683)倍,同时RIF患者出现AMH水平降低的情况更普遍。卵巢储备功能减退与RIF的关系应该引起关注,并应行进一步研究明确。
本次研究的不足之处在于,研究对象均来自就诊于中山大学第一附属医院生殖中心的患者,纳入样本量仍然有限,对于合并多种疾病患者的情况仍需扩大样本量进行深入研究。其次,胚胎染色体异常是RPL患者发生流产的常见原因,而RPL患者反复胚胎染色体异常的发生率尚未有研究报道,同时因RIF疾病本身特性及排除RIF病因为无优质胚胎的患者,未纳入胚胎染色体异常作为病因进行分析,未来的研究将重点关注RIF和RPL患者子宫内膜炎症、子宫内膜息肉、子宫内膜异位症和卵巢储备功能减退致病机制的异同。
综上所述,慢性子宫内膜炎、子宫内膜息肉、子宫内膜异位症、卵巢储备功能减退、AMH水平降低等现象,在RIF患者中更为普遍。因此,对RIF患者建议常规行子宫内膜炎症、子宫内膜息肉、子宫内膜异位症及卵巢储备功能筛查,主诊医师在诊治过程中可根据患者年龄、卵巢功能、子宫相关疾病等情况综合判断且有相应侧重地进行个性化诊疗。
参 考 文 献
[1] MAK J S M, CHUNG C H S, CHUNG J P W, et al. The effect of endometrial scratch on natural-cycle cryopreserved embryo transfer outcomes: a randomized controlled study[J]. Reprod Biomed Online, 2017, 35(1): 28-36. DOI: 10.1016/j.rbmo.2017.04.004.
[2] 徐晨明. 胚胎植入前遗传学诊断/筛查技术专家共识[J/OL]. 中国产前诊断杂志(电子版), 2018, 10(2): 57. DOI: 10.13470/j.cnki.cjpd.2018.02.017.
XU C M. Expert consensus on preimplantation genetic diagnosis/screening technology[J/OL]. Chin J Prenat Diagn(Electron Ed), 2018, 10(2): 57. DOI: 10.13470/j.cnki.cjpd.2018.02.017.
[3] ESHRE Working Group on Recurrent Implantation Failure, CIMADOMO D, DE LOS SANTOS M J, et al. ESHRE good practice recommendations on recurrent implantation failure[J]. Hum Reprod Open, 2023, 2023(3): hoad023. DOI: 10.1093/hropen/hoad023.
[4] ESHRE Guideline Group on RPL, BENDER ATIK R, CHRISTIANSEN O B, et al. ESHRE guideline: recurrent pregnancy loss: an update in 2022[J]. Hum Reprod Open, 2023, 2023(1): hoad002. DOI: 10.1093/hropen/hoad002.
[5] 自然流产诊治中国专家共识编写组, 赵爱民. 自然流产诊治中国专家共识(2020年版)[J]. 中国实用妇科与产科杂志, 2020, 6(11):1082-1090.DOI: 10.19538/j.fk2020110113.
Writing Group of Chinese Expert Consensus on Diagnosis, ZHAO A M. Chinese expert consensus on diagnosis and treatment of spontaneous abortion(2020 edition)[J]. Chin J Pract Gynecol Obstet, 2020, 6(11): 1082-1090.DOI: 10.19538/j.fk2020110113.
[6] BOUET P E, HACHEM H E, MONCEAU E, et al. Chronic endometritis in women with recurrent pregnancy loss and recurrent implantation failure: prevalence and role of office hysteroscopy and immunohistochemistry in diagnosis[J]. Fertil Steril, 2016, 105(1): 106-110. DOI: 10.1016/j.fertnstert.
2015.09.025.
[7] SONG D, FENG X, ZHANG Q, et al. Prevalence and confounders of chronic endometritis in premenopausal women with abnormal bleeding or reproductive failure[J]. Reprod Biomed Online, 2018, 36(1): 78-83. DOI: 10.1016/j.rbmo.
2017.09.008.
[8] JOHNSTON-MACANANNY E B, HARTNETT J, ENGMANN L L, et al. Chronic endometritis is a frequent finding in women with recurrent implantation failure after in vitro fertilization[J]. Fertil Steril, 2010, 93(2): 437-441. DOI: 10.1016/j.fertnstert.
2008.12.131.
[9] MATTEO M, CICINELLI E, GRECO P, et al. Abnormal pattern of lymphocyte subpopulations in the endometrium of infertile women with chronic endometritis[J]. Am J Reprod Immunol, 2009, 61(5): 322-329. DOI: 10.1111/j.1600-0897.
2009.00698.x.
[10] LI Y, YU S, HUANG C, et al. Evaluation of peripheral and uterine immune status of chronic endometritis in patients with recurrent reproductive failure[J]. Fertil Steril, 2020, 113(1): 187-196.e1. DOI: 10.1016/j.fertnstert.2019.09.001.
[11] KITAYA K, TADA Y, HAYASHI T, et al. Comprehensive endometrial immunoglobulin subclass analysis in infertile women suffering from repeated implantation failure with or without chronic endometritis[J]. Am J Reprod Immunol, 2014, 72(4): 386-391. DOI: 10.1111/aji.12277.
[12] WU D, KIMURA F, ZHENG L, et al. Chronic endometritis modifies decidualization in human endometrial stromal cells[J]. Reprod Biol Endocrinol, 2017, 15(1): 16. DOI: 10.1186/s12958-017-0233-x.
[13] PINTO V, MATTEO M, TINELLI R, et al. Altered uterine contractility in women with chronic endometritis[J]. Fertil Steril, 2015, 103(4): 1049-1052. DOI: 10.1016/j.fertnstert.
2015.01.007.
[14] RIMMER M P, FISHWICK K, HENDERSON I, et al. Quantifying CD138+ cells in the endometrium to assess chronic endometritis in women at risk of recurrent pregnancy loss: a prospective cohort study and rapid review[J]. J Obstet Gynaecol Res, 2021, 47(2): 689-697. DOI: 10.1111/jog.14585.
[15] FATEMI H M, KASIUS J C, TIMMERMANS A, et al. Prevalence of unsuspected uterine cavity abnormalities diagnosed by office hysteroscopy prior to in vitro fertilization[J]. Hum Reprod, 2010, 25(8): 1959-1965. DOI: 10.1093/humrep/deq150.
[16] GALAMB Á, PETHŐ B, FEKETE D, et al. Uterine anomalies in women with recurrent pregnancy loss[J]. Orv Hetil, 2015, 156(27): 1081-1084. DOI: 10.1556/650.2015.30136.
[17] PENG X, LI T, XIA E, et al. A comparison of oestrogen receptor and progesterone receptor expression in endometrial polyps and endometrium of premenopausal women[J]. J Obstet Gynaecol, 2009, 29(4): 340-346. DOI: 10.1080/01443610902878775.
[18] KIM M R, KIM Y A, JO M Y, et al. High frequency of endometrial polyps in endometriosis[J]. J Am Assoc Gynecol Laparosc,
2003, 10(1): 46-48. DOI: 10.1016/s1074-3804(05)60233-2.
[19] OZYURT R, TURKTEKIN N. Endometrial polyps prevent embryo implantation via creatine and lactate pathways[J]. Eur Rev Med Pharmacol Sci, 2022, 26(9): 3278-3281. DOI: 10.26355/eurrev_202205_28746.
[20] JIAO Z, BUKULMEZ O. Potential roles of experimental reproductive technologies in infertile women with diminished ovarian reserve[J]. J Assist Reprod Genet, 2021, 38(10): 2507-2517. DOI: 10.1007/s10815-021-02246-6.
[21] 徐红, 赵爱民. 子宫内膜异位症和子宫腺肌病与复发性流
产[J]. 中国实用妇科与产科杂志, 2020, 36(11): 1077-1081. DOI: 10.19538/j.fk2020110112.
XU H, ZHAO A M. Endometriosis, adenomyosis and recurrent spontaneous abortion[J]. Chin J Pract Gynecol Obstet, 2020, 36(11): 1077-1081. DOI: 10.19538/j.fk2020110112.
[22] SIMÓN C, GUTIÉRREZ A, VIDAL A, et al. Outcome of patients with endometriosis in assisted reproduction: results from in-vitro fertilization and oocyte donation[J]. Hum Reprod, 1994, 9(4): 725-729. DOI: 10.1093/oxfordjournals.humrep.a138578.
[23] BORGES E Jr, BRAGA D P, SETTI A S, et al. Endometriosis affects oocyte morphology in intracytoplasmic sperm injection cycles[J]. JBRA Assist Reprod, 2015, 19(4): 235-240. DOI: 10.5935/1518-0557.20150046.
[24] SIMOPOULOU M, RAPANI A, GRIGORIADIS S, et al. Getting to know endometriosis-related infertility better: a review on how endometriosis affects oocyte quality and embryo development[J].
Biomedicines, 2021, 9(3): 273. DOI: 10.3390/biomedicines
9030273.
[25] 程萌, 孔令伶俐, 许良智, 等. 卵巢储备功能减退临床诊治专家共识解读[J]. 实用妇产科杂志, 2022, 38(10): 743-745.
CHENG M, KONG L L L, XU L Z, et al. Interpretation of expert consensus on clinical diagnosis and treatment of ovarian reserve hypofunction[J]. J Pract Obstet Gynecol, 2022, 38(10): 743-745.
[26] YUAN X, LIN H Y, WANG Q, et al. Is premature ovarian ageing a cause of unexplained recurrent miscarriage[J]. J Obstet Gynaecol, 2012, 32(5): 464-466. DOI: 10.3109/
01443615.2012.668578.
[27] 时荣, 郑贤芳, 陶群, 等. 腹腔镜输卵管切除术对异位妊娠患者卵巢储备功能及血清神经肽Y、皮质醇的影响[J]. 实用医学杂志, 2024, 40(6): 801-806. DOI: 10.3969/j.issn.
1006-5725.2024.06.012.
SHI R, ZHENG X F, TAO Q, et al. Effect of laparoscopic salpingectomy on ovarian reserve function and serum neuropeptide Y and cortisol in patients with ectopic pregnancy[J].
J Pract Med, 2024, 40(6): 801-806. DOI:10.3969/j.issn.1006-
5725.2024.06.012.
[28] 李再仪, 游泽山, 罗宋, 等. 抗苗勒管激素在腹膜型子宫内膜异位症患者卵巢储备功能评估中的价值研究[J]. 新医学, 2018, 49(2): 129-132. DOI: 10.3969/j.issn.0253-9802.
2018.02.012.
LI Z Y, YOU Z S, LUO S, et al. Study of anti-Müllerian hormone in the assessment of ovarian reserve in patients with peritoneal endometriosis[J]. J New Med, 2018, 49(2): 129-132. DOI: 10.3969/j.issn.0253-9802.2018.02.012.
[29] 王琼, 林海燕, 李洁明, 等. 原因不明性复发性流产患者的基础性激素水平[J]. 中山大学学报(医学科学版), 2010, 31(3): 409-412. DOI: 10.13471/j.cnki.j.sun.yat-sen.univ(med.sci). 2010.0076.
WANG Q, LIN H Y, LI J M, et al. Basal hormone level in unexplained recurrent spontaneous abortion[J]. J Sun Yat-sen Univ (Med Sci), 2010, 31(3): 409-412. DOI: 10.13471/j.cnki.
j.sun.yat-sen.univ(med.sci).2010.0076.
[30] BUNNEWELL S J, HONESS E R, KARIA A M, et al. Diminished ovarian reserve in recurrent pregnancy loss: a systematic review and meta-analysis[J]. Fertil Steril, 2020, 113(4): 818-827.e3. DOI: 10.1016/j.fertnstert.2019.11.014.
(责任编辑:林燕薇)
