分析泛素特异性蛋白酶5在不同肿瘤中的致癌作用
2024-10-15张骋刘同刚



【摘要】目的 分析泛素特异性蛋白酶5(USP5)在不同肿瘤中的致癌作用,为临床治疗提供参考。方法 利用癌症基因组图谱(TCGA)、基因型组织表达(GTEx)、基因表达谱交互式分析2(GEPIA2)分析USP5 mRNA在不同肿瘤中的表达情况,USP5与不同癌症患者病理分期的相关性。利用GEPIA2数据库分析USP5表达与不同癌症患者预后的相关性。利用cBioPortal数据库分析USP5基因变异情况。利用UCLCAN数据库分析USP5磷酸化水平。利用TIMER2数据库分析USP5表达与肿瘤相关成纤维细胞(CAFs)免疫浸润的相关性。利用STRING、GEPIA2、注释、可视化及综合发现(DAVID)数据库构建USP5相关基因的富集图。结果 USP5在多种肿瘤中的表达显著增高,而在急性髓性白血病(LAML)中表达显著降低;USP5蛋白在乳腺癌(BRCA)、结肠腺癌(COAD)、胶质母细胞瘤(GBM)、肺腺癌(LUAD)及胰腺癌(PAAD)中表达明显偏低;USP5蛋白在肾透明细胞癌(KIRC)、肺鳞癌(LUSC)及卵巢癌(OV)中表达明显偏高;USP5表达与BRCA、KIRC、肝细胞癌(LIHC)、LUAD、OV及PAAD的病理分期之间存在显著关系(均P<0.05)。USP5的高表达与LAML、LUAD、皮肤黑色素瘤(SKCM)及葡萄膜黑色素瘤(UVM)的总体生存率(OS)呈正相关(均P<0.05)。子宫内膜癌(UCEC)中USP5的改变频率最高,主要改变类型为突变;子宫癌肉瘤(UCS)中USP5改变频率次高,主要类型为“扩增”。进一步分析USP5的额外突变和位置,未获得主导性的遗传改变,遗传改变的位置较少。USP5在COAD、GBM等肿瘤中显著的去磷酸化。宫颈鳞状细胞癌(CESC)、头颈部鳞状细胞癌(HNSC)、HPV阴性HNSC的CAFs与USP5水平呈正相关(均P<0.05)。“核部分”“核腔”“剪接体”“泛素介导的蛋白水解”可能参与USP5在肿瘤发生中的作用。结论 USP5表达水平与生存预后、基因突变、免疫浸润及与USP5相关基因富集之间有相关性,有助于从多个方面了解USP5在肿瘤发生和发展中的作用,为今后肿瘤免疫治疗方面的研究提供理论依据。
【关键词】泛素特异性蛋白酶5;肿瘤;基因突变;免疫浸润
【中图分类号】R730.2 【文献标识码】A 【文章编号】2096-2665.2024.18.0030.07
DOI:10.3969/j.issn.2096-2665.2024.18.010
恶性肿瘤的发生机制十分复杂,筛选疾病进展中的关键基因并对其进行综合泛癌分析、探究其临床意义对深入理解肿瘤发生发展机制、提高早期诊断率、改善预后评估、指导临床治疗具有重要意义。去泛素化是一种常见的蛋白质翻译后修饰过程,参与调节多种生理功能和病理过程,包括细胞周期进程、信号转导等[1]。去泛素化酶(DUB)能够识别并切割泛素与靶蛋白之间的连接,从而介导泛素链的可逆去除、维持细胞稳态[2]。泛素特异性蛋白酶5(USP5)是一种半胱氨酸去泛素化酶[3]。多项研究显示, USP5在多种癌症中异常表达,如胆管癌(cholangiocarcinoma, CHOL)[4]、膀胱癌[5]、乳腺癌(breast invasive carcinoma, BRCA)[6]、肝细胞癌(liver hepatocellular carcinoma, LIHC)[7]等。 USP5与癌症发展中的关键分子和通路密切相关,但目前尚不清楚USP5在不同癌症中的具体作用机制。基于此,本研究探究USP5在不同肿瘤中的致癌作用,现报道如下。
1 材料与方法 ⑴USP5在不同肿瘤中的表达情况及相关性分析。利用癌症基因组图谱(TCGA)和基因型组织表达(GTEx)数据库筛选出33种癌症类型、癌旁细胞、正常样本的USP5 mRNA数据。利用CPTAC 数据库分析不同肿瘤中的USP5蛋白表达水平。利用基因表达谱交互式分析2(GEPIA2)数据库分析USP5表达与不同癌症病理分期的相关性。利用R包进行统计学分析,利用ggplot2包进行可视化分析。组间差异比较采用 Wilcoxon 秩和检验,以P<0.05为差异有统计学意义。⑵USP5表达与不同癌症患者预后的相关性分析。利用GEPIA2数据库分析不同肿瘤中USP5基因的总体生存率(OS)的显著性地图数据(设置组分割点=中位数)。采用Log-Rank方法进行统计学假设检验。⑶USP5基因变异情况分析。利用cBioPortal数据库获取USP5的遗传改变特征。遗传改变特征包括改变频率、突变类型、突变位点信息、拷贝数改变及蛋白质的三维结构。⑷USP5磷酸化水平分析。利用UCLCAN数据库获取不同肿瘤中USP5的磷酸化水平。⑸USP5表达与肿瘤相关成纤维细胞(CAFs)免疫浸润的相关性分析。利用TIMER2数据库获取USP5表达与CAFs免疫浸润间的关联数据,将USP5输入“基因名称”字段进行分析。采用热图和散点图呈现结果。使用TIMER算法, EPIC、 XCELL、 MCPCOUNTER、 CIBERSORT-ABS、 QUANTISEQ及CIBERSORT评估免疫浸润的程度。⑹构建USP5相关基因的富集图。利用STRING数据库筛选与USP5结合的蛋白质。设置参数:最低交互所需的分数[低置信度(0.150)],显示的互作蛋白质的最大数量(≤50个),网络边缘的示例(证据)和活跃的相互作用(实验);检测可以与USP5结合的蛋白质。利用GEPIA2数据库筛选与USP5相关的前100个靶向基因,并与USP5进行基因Pearson相关性成对分析。使用log2 TPM的均值计算点图。使用TIMER2的Gene_Corr模块呈现热图数据。使用校正纯度测试计算Spearman等级相关性。利用注释、可视化和综合发现(DAVID)数据库和ggplot2包分析代谢通路公共(KEGG)通路,结果以气泡图形式呈现。利用cluster Profiler包和R语言软件分析基因本体(GO)富集,根据结果生成条形图。
2 结果
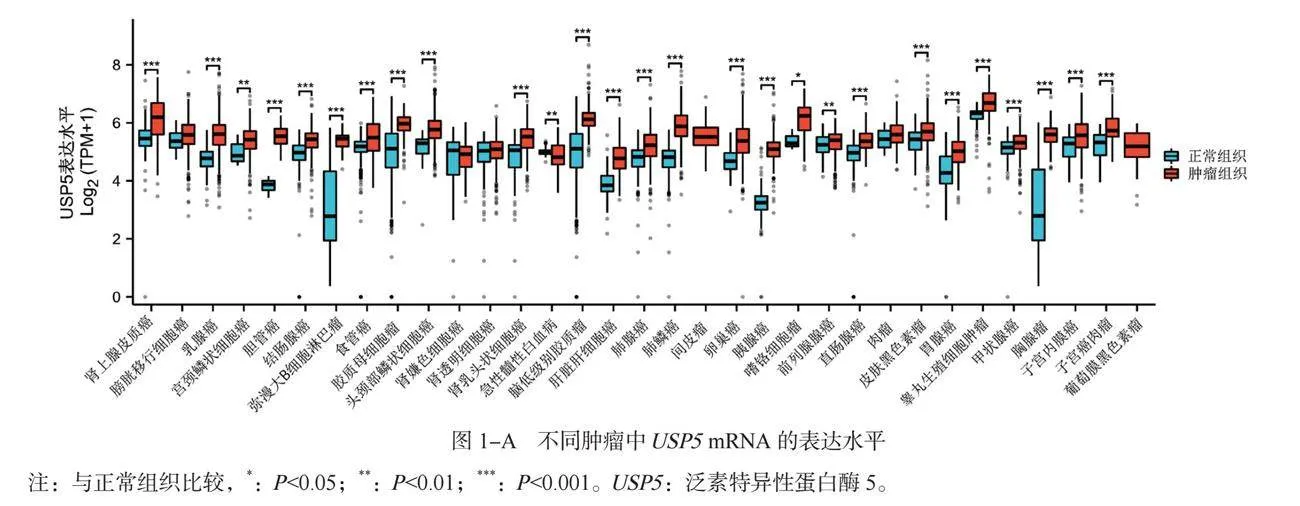
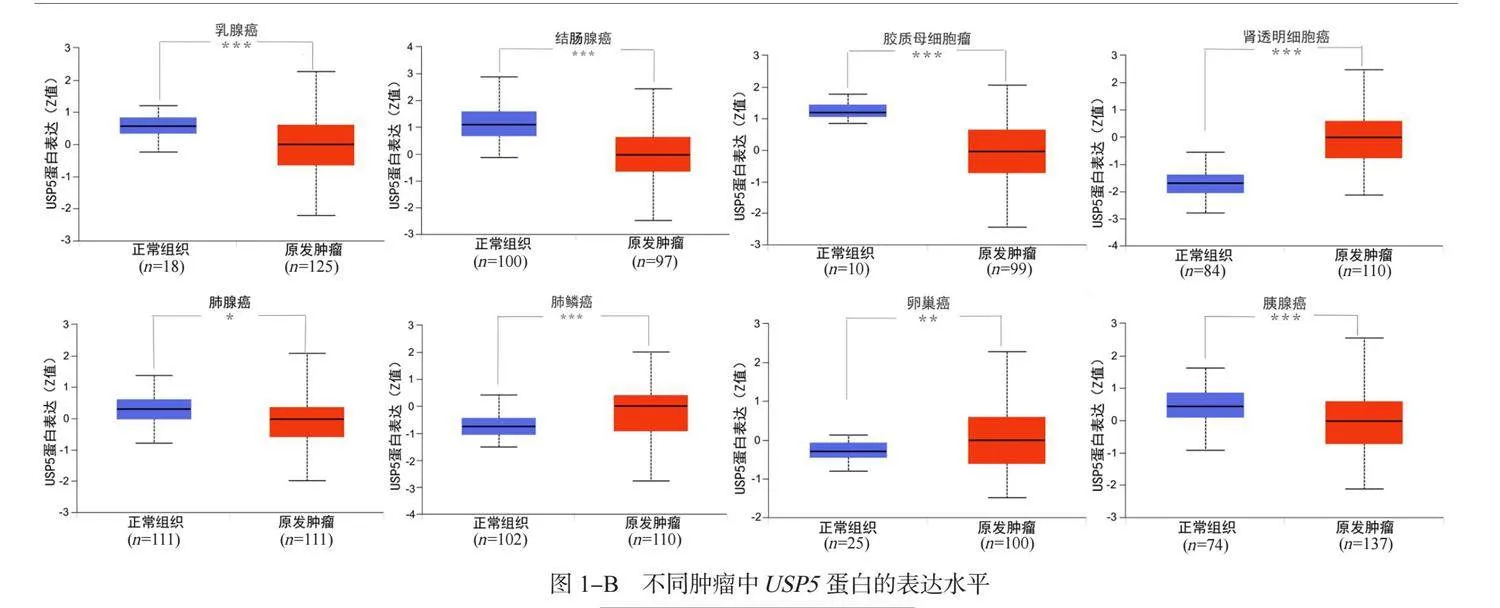
2.1 USP5mRNA在不同肿瘤中的表达情况及相关性分析结果 USP5在肾上腺皮质癌(adrenocortical carcinoma, ACC)、 BRCA、宫颈鳞状细胞癌(cervical squamous cell carcinoma and endocervical adenocarcinoma, CESC)、 CHOL、结肠腺癌(colon adenocarcinoma, COAD)、弥漫性大B细胞淋巴瘤(lymphoid neoplasm diffuse large B-cell lymphoma, DLBC)、食管癌(esophageal carcinoma, ESCA)、胶质母细胞瘤(glioblastoma multiforme, GBM)、 头颈部鳞状细胞癌(head and neck squamous cell carcinoma, HNSC)、肾乳头状细胞癌(kidney renal papillary cell carcinoma, KIRP)、脑低级别胶质瘤(brain lower grade glioma, LGG)、 LIHC、肺腺癌(lung adenocarcinoma, LUAD)、肺鳞癌(lung squamous cell carcinoma, LUSC)、卵巢癌(ovarian serous cystadenocarcinoma, OV)、胰腺癌(pancreatic adenocarcinoma, PAAD)、前列腺癌(prostate adenocarcinoma, PRAD)、直肠腺癌(rectum adenocarcinoma, READ)、皮肤黑色素瘤(skin cutaneous melanoma, SKCM)、胃腺癌(stomach adenocarcinoma, STAD)、睾丸生殖细胞肿瘤(testicular germ cell tumors, TGCT)、甲状腺癌(thyroid carcinoma, THCA)、胸腺癌(thymoma, THYM)、子宫内膜癌(uterine corpus endometrial carcinoma, UCEC)、子宫癌肉瘤(uterine carcinosarcoma, UCS)、嗜铬细胞瘤和副神经节瘤(pheochromocytoma and paraganglioma , PCPG)中表达显著升高; USP5在急性髓性白血病(acute myeloid leukemia, LAML)中表达显著降低(均P<0.05),见图1-A。 USP5蛋白在BRCA、 COAD、 GBM、 LUAD、 PAAD中表达明显偏低; USP5蛋白在肾透明细胞癌(kidney renal clear cell carcinoma, KIRC)、 LUSC、 OV中表达明显偏高(均P<0.05),见图1-B。 USP5表达水平与BRCA、 KIRC、 LIHC、 LUAD、 OV、 PAAD的病理分期之间存在显著关系(均P<0.05),见图1-C。
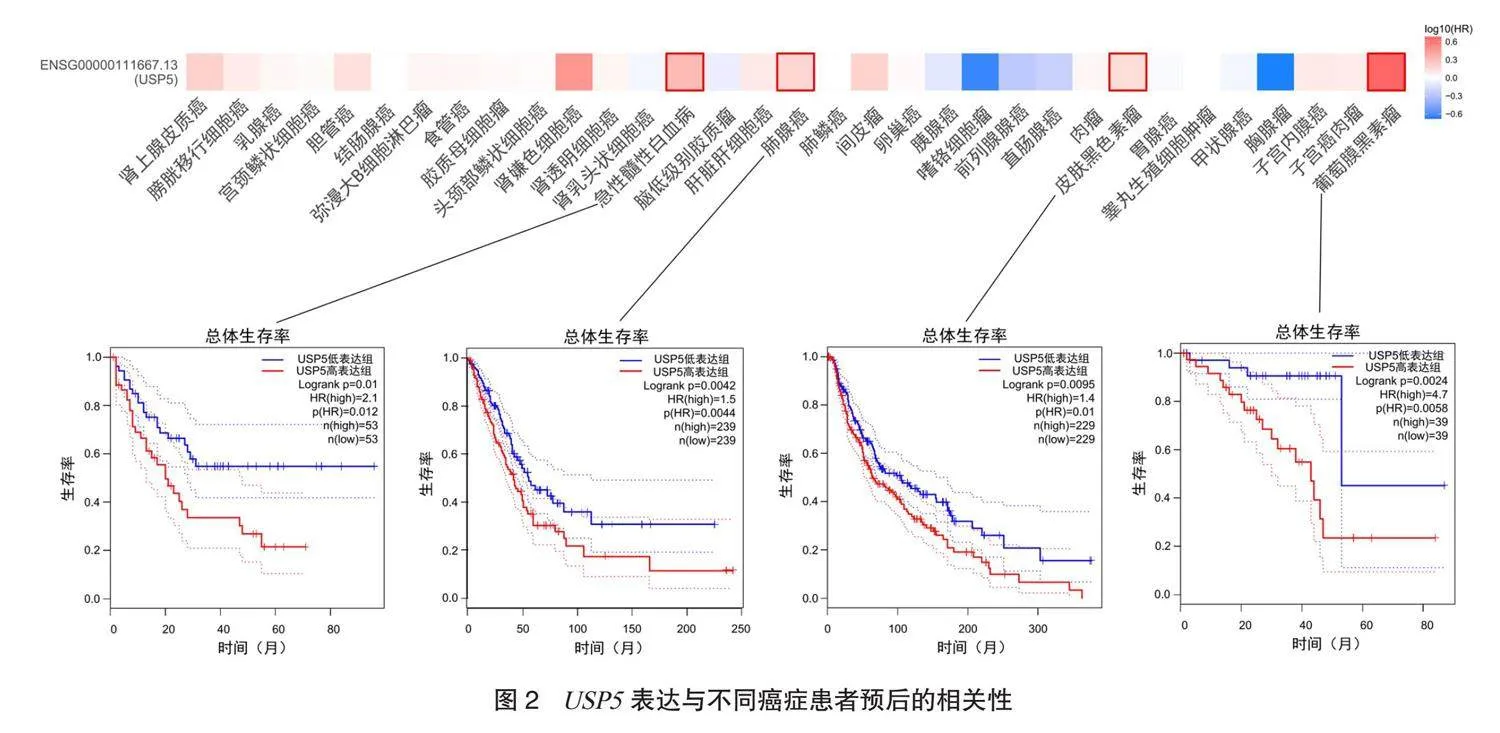
2.2 USP5表达与不同癌症患者预后的相关性分析结果 USP5的高表达与LAML、 LUAD、 SKCM、葡萄膜黑色素瘤(uveal melanoma, UVM)的OS呈正相关(均P<0.05),见图2。
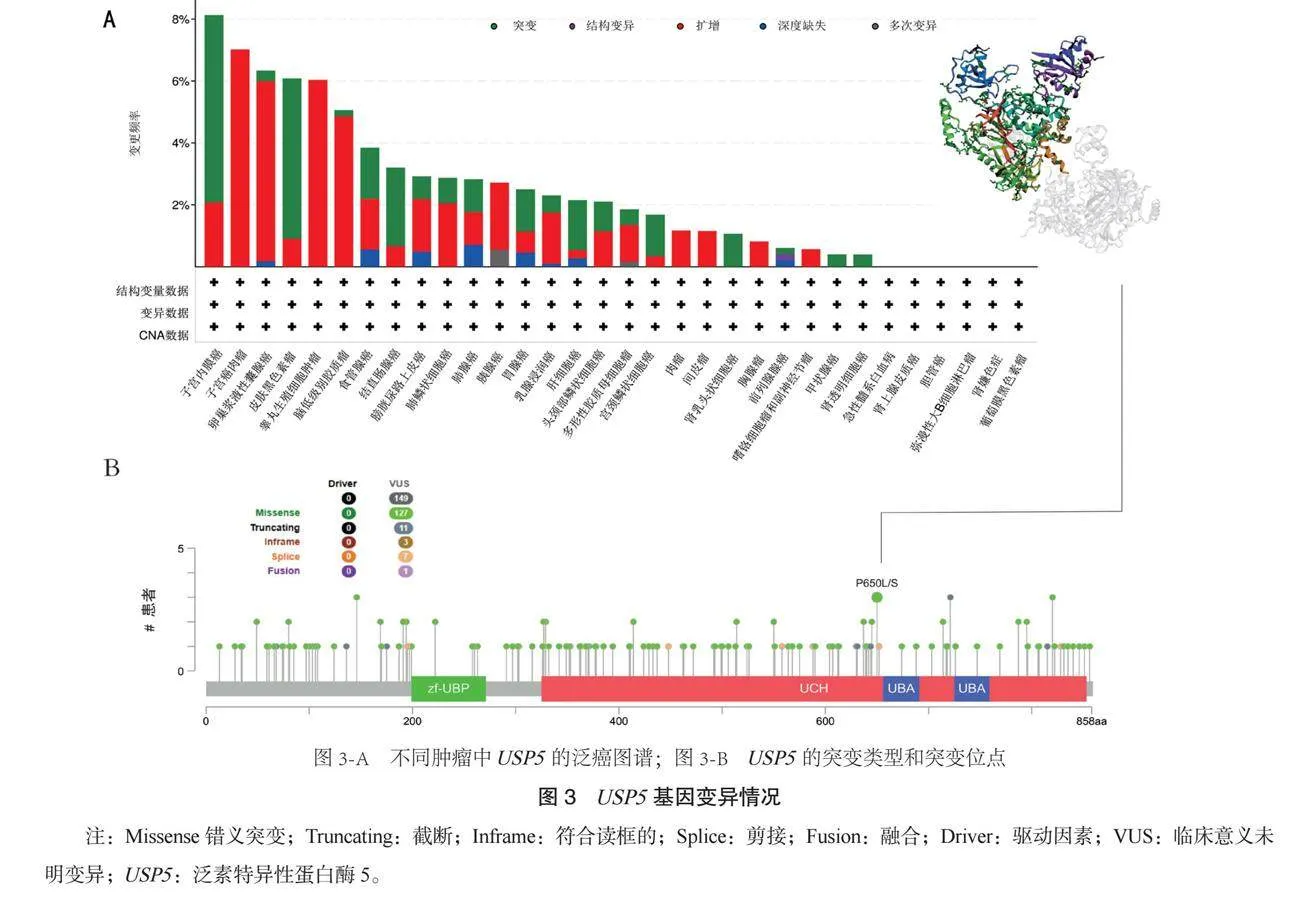
2.3 USP5基因变异情况分析结果 UCEC中USP5的改变频率最高,主要改变类型为突变; UCS中USP5改变频率次高,主要类型为扩增,见图3-B。进一步分析USP5的额外突变和位置,未获得主导性的遗传改变,遗传改变的位置较少,见图3-B。
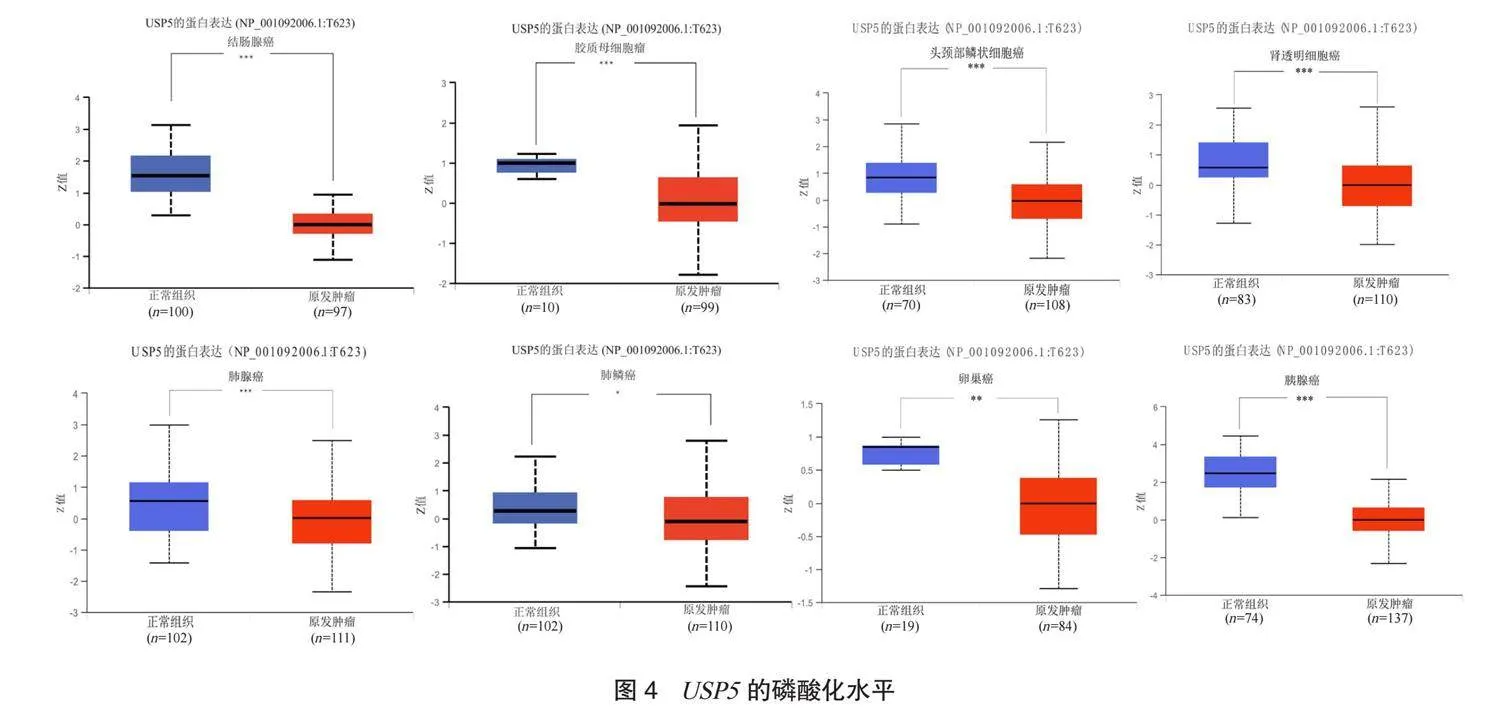
2.4 USP5的磷酸化水平分析结果 USP5在COAD、GBM、 HNSC、 KIRC、 LUAD、 LUSC、 OV、PAAD的肿瘤中显著的去磷酸化,见图4。
2.5 USP5表达与CAFs免疫浸润相关性的分析结果 CESC、 HNSC、 HPV阴性HNSC的CAFs与USP5水平呈正相关(均P<0.05),见图5。
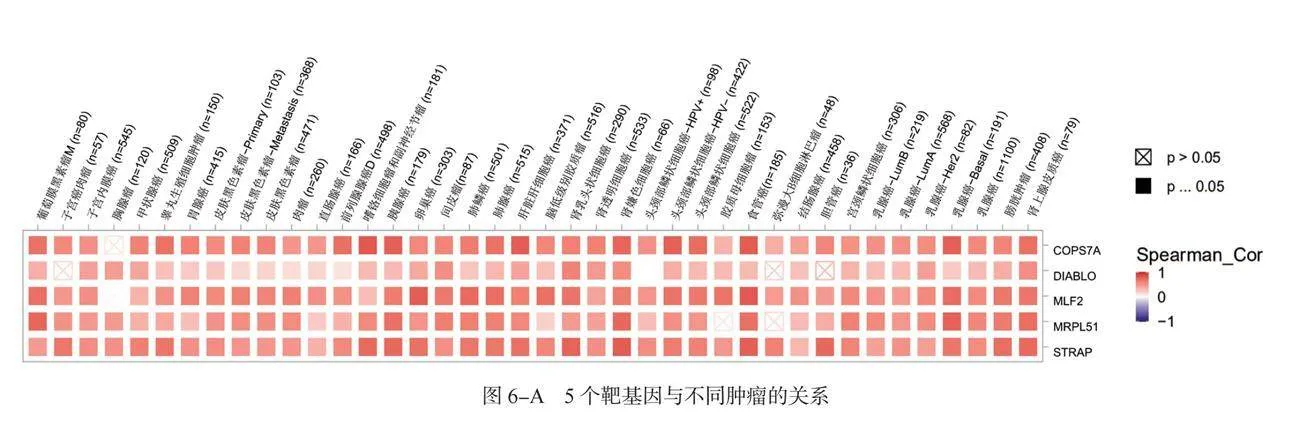
2.6 USP5相关基因的富集分析结果 热图数据显示, USP5在多数肿瘤中均与图述5个基因呈显著正相关,见图6-A。利用STRING数据库获得50个与USP5结合的蛋白质,见图6-B;利用GEPIA2数据库获得排名前100位与USP5表达相关的基因,交集显示共同成员为交叉盆蛋白质(FOX)M1,见图6-C。 USP5的表达与信号转导蛋白亚基(COPS)7A(R=0.73)、凋亡抑制蛋白IAP结合线粒体蛋白(DIABLO)(R=0.52)、 MLF2(R=0.77)、线粒体核糖体蛋白(MRP)L51(R=0.57)和STRAP(R=0.58)基因呈正相关(均P<0.001),见图6-D。 “核部分”“核腔”“剪接体”“泛素介导的蛋白水解”可能参与USP5在肿瘤发生机制中的作用,见图6-E、图6-F。
3 讨论
近年来,研究证实USP5与癌症密切相关,但USP5在不同癌症中是否依靠特定机制发挥重要作用仍需探索[8-9]。
本研究发现USP5在多数肿瘤中表达显著升高,在LAML中表达显著降低。 有研究表明,USP5能够通过稳定YBX1促进CHOL进展[6],稳定c-Jun蛋白促进膀胱癌进展[7]等。本研究结果显示,USP5的高表达与LAML、 LUAD、SKCM及UVM的总生存预后不良呈正相关,故不同肿瘤受基因表达影响的程度不同。
本研究结果显示,USP5主要的变异类型是错义突变。UCEC最常发生基因错义突变,而UCS最常发生基因扩增。USP5在COAD、GBM、HNSC、KIRC、LUAD、LUSC、OV及PAAD的肿瘤组织显著去磷酸化。但USP5的磷酸化修饰尚无与肿瘤发生发展之间有相关报道,需进一步探索。
肿瘤免疫浸润细胞是肿瘤微环境中关键的组成之一,与免疫检查点及肿瘤的预后密切相关[10]。本研究发现,CESC、HNSC及HPV阴性HNSC的CAFs与USP5水平呈正相关。本研究结果显示,“核部分”“核腔”“剪接体”“泛素介导的蛋白水解”可能参与USP5在肿瘤发生机制中的作用,这可为后续的分子生物学研究提供依据。
综上所述,USP5表达水平与生存预后、基因突变、免疫浸润及USP5相关基因富集相关,有助于了解USP5在肿瘤发生中的作用,为肿瘤免疫治疗的研究提供理论依据。
参考文献
LIN J W, BAO X C, LI X. A tri-functional amino acid enables mapping of binding sites for posttranslational-modification-mediated protein-protein interactions[J]. Mol Cell, 2021, 81(12): 2669-2681.
QIN W H, STEINEK C, KOLOBYNAINA K, et al. Probing protein ubiquitination in live cells [J]. Nucleic Acids Res, 2022, 50(21): e125.
NING F L, HONG X, LIU J Q, et al. Structure and function of USP5: Insight into physiological and pathophysiological roles[J]. Pharmacol Res, 2020, 157: 104557.
NING F L, DU L, LI J Y, et al. The deubiquitinase USP5 promotes cholangiocarcinoma progression by stabilizing YBX1 [J].Life Sciences, 2024, 348: 122674.
CAI H, KE Z B, CHEN Y J, et al. Ubiquitin-specific protease 5 promotes bladder cancer progression through stabilizing Twist1[J].Oncogene, 2024, 43(10): 703-713.
PENG Z M, HAN X J, WANG T, et al. PFKP deubiquitination and stabilization by USP5 activate aerobic glycolysis to promote triple-negative breast cancer progression[J].Breast Cancer Research, 2024, 26(1): 10.
YAN B K, GUO J X, WANG Z L, et al.The ubiquitin-specific protease 5 mediated deubiquitination of LSH links metabolic regulation of ferroptosis to hepatocellular carcinoma progression[J].MedComm, 2023, 4(4): e337.
PAN J H, QIAO Y T, CHEN C C, et al. USP5 facilitates non-small cell lung cancer progression through stabilization of PD-L1[J]. Cell Death Dis, 2021, 12(11): 1051.
GUO H, LIU R, LV H, et al. USP5 facilitates diabetic retinopathy development by stabilizing ROBO4 via deubiquitination[J]. Cellular signalling, 2024, 120: 111225.
HINSHAW D C, SHEVDE L A.The tumor microenvironment innately modulates cancer progression[J]. Cancer Res, 2019, 79(18): 4557-4566.
