红仁核桃内种皮多酚提取工艺研究
2024-10-14许飞利任嘉瑜王丹凤方青王蕾贾国伦常亮郭耀东


摘 要:红仁核桃是我国重要的经济树种,有丰厚的营养价值和广阔的市场前景,其内种皮富含酚类物质,为获得较高的多酚提取率而开展研究,旨在得到一组最佳多酚提取工艺组合方案。
以红仁核桃内种皮为研究对象,先采用单因素试验后,再采用正交试验进行提取工艺条件优化,同时采用Folin-Ciocaileu法对核桃内种皮中总酚进行检测,以多酚得率为评价指标,通过正交分析从而得出在本试验中四个考察因素下最优的一组工艺组合。通过试验建立的没食子酸标准曲线回归方程为A=1.039 3C+0.019 8,R+2=0.991 4,其在试验范围内质量浓度与吸光度值表现出良好的线性关系。通过单因素试验,选取70℃为红仁核桃内种皮多酚提取最适温度水平选取60∶[KG-*2]1作为红仁核桃内种皮多酚提取最适液固比条件选取2 h作为红仁核桃内种皮多酚提取最适时间采用45%的乙醇浓度做为最佳提取条件。在单因素试验基础上,筛选出四个考察因素,即乙醇体积分数、液固比、提取温度及提取时间设计三水平正交试验。得出四因素的影响大小顺序为:提取温度gt;液固比gt;乙醇体积分数gt;提取时间。当提取条件为乙醇体积分数45%、
液固比为60 mL∶[KG-*2]1 g、提取温度为70℃、时间为2 h时,红仁核桃内种皮多酚提取率最高。进行重复验证试验三次,最后取平均值得到此条件下红仁核桃内种皮多酚提取率为27.93%,此条件为红仁核桃内种皮多酚提取最佳工艺条件。本试验获得的红仁核桃内种皮多酚提取工艺方法提取率高,提取效果理想,可作为红仁核桃内种皮多酚提取方法的参考。
关键词:红仁核桃内种皮多酚提取单因素试验正交试验
中图分类号:Q819" 文献标识码:A" 文章编号:0488-5368(2024)08-0030-07
Technology for Extraction of Polyphenols from Inner Seed Coat of Red Kernel Walnut
XU Feili+1, REN Jiayu+1, WANG Danfeng+2, FANG Qing+1, WANG Lei+1, JIA Guolun+1, CHANG Liang+1, GUO Yaodong+1
(1. College of Health Management, Shangluo University, Shangluo, Shaanxi 726000, China
2. College of Biopharmaceutical and Food Engineering, Shangluo University, Shangluo, Shaanxi 726000, China)
Abstract: Red kernel walnuts are an important economic crop in China, known for their rich nutritional value and market potential. The inner seed coat of the red kernel walnut contains a high amount of phenolic substances. This study aims to optimize the extraction process to achieve a higher yield of polyphenols. Initially, single-factor experiments were conducted, followed by an orthogonal experiment to refine the extraction process. The Folin-Ciocalteu method was used to measure the total phenol content, with the polyphenol yield as the evaluation index. Through orthogonal analysis of four factors, the optimal extraction conditions were determined. The results showed that the regression equation for the standard curve of gallic acid, established through experiments, was A=1.039 3C+0.019 8, R+2=0.991 4, indicating a good linear relationship between mass concentration and absorbance value within the experimental range. The optimal conditions identified through single-factor experiments were 70°C as the extraction temperature, a liquid-solid ratio of 60∶[KG-*2]1, an extraction time of 2 hours, and a 45% ethanol concentration. Based on these single-factor experiments, four factors were selected for further examination: ethanol volume fraction, liquid-solid ratio, extraction temperature, and extraction time. A three-level orthogonal experiment was designed. The order of influence of the four factors was found to be: extraction temperature gt; liquid-solid ratio gt; ethanol volume fraction gt; extraction time. The optimal extraction conditions were identified as 45% ethanol volume fraction, 60∶[KG-*2]1 (mL) liquid-solid ratio,70℃" extraction temperature, and 2 hours extraction time. Under these conditions, the extraction rate of polyphenols from the inner seed coat of the walnut was 27.93%. In conclusion, the extraction method optimized in this study yields a high extraction rate and ideal extraction effect, providing a valuable reference for extracting polyphenols from the inner seed coat of red kernel walnuts.
Key words: Red kernel walnut Endotesta Polyphenol extraction Single-factor experiment Orthogonal experiment
核桃是我国重要的经济树种[1],早在2 000多年前我国就已开始种植,其栽培种植技术已十分成熟。我国已成为世界上最大的核桃种植国,其生产地以云南、陕西、新疆为主,具有很高的经济效益和社会效
益[2,3]。核桃营养价值丰厚[4],还具有降血脂等多种保健功能,对人体起积极的抗氧化作用。与普通核桃相比,红仁核桃更是重要的经济树种,因其内种皮富含花色苷而具有独特的营养价值,因而具有很好的发展前景,如加以充分开发利用,将可以有效带动当地乡村经济发展。关于红仁核桃的研究尚处在初级阶段,研究空间广阔。目前,红仁核桃主要以小规模种植为主,随着对红仁核桃研究的深入,未来也会逐步实现大规模种植,红仁核桃浑身是宝,关于其内种皮多酚提取利用等更多红仁核桃的研究也会更具现实意义。本研究通过筛选出红仁核桃内种皮多酚的最佳提取工艺,为当地红仁核桃的进一步深加工利用、减少核桃多酚资源的浪费提供参考资源。
核桃内种皮即核桃仁表面附着的外表皮。研究表明,核桃内种皮集中了核桃内部大多数多酚类物质[5,6]。核桃内种皮多酚具有显著的营养保健功能,如抗氧化作用[7]、抗心脑血管疾病[8,9]、抗肿瘤[10,11]、缓解肝脏损害[12,13]、调节血脂和血管功能[14,15]、清除体内自由基、抗衰老[16]、阻止微生物致病因子的产生[17]、改善脾淋巴细胞活性、T细胞亚群数等[18],还可以有效运用到阿尔茨海默病的治疗中[19]。核桃内种皮不仅可以用来泡水喝,在一定程度上缓解身体疲劳,还具有保护血管健康,增强肠胃蠕动力,治疗便秘等多种功效。同时,由于核桃内种皮中的某些物质会相互作用导致蛋白质产生沉淀,同时伴随一定的苦涩味,从而对食品的味道和颜色造成一定的损害,因此,在食品工业生产中常将核桃内种皮作为废料处理[20],从而导致大量核桃资源的流失。未来如何将核桃内种皮变废为宝是一项重要又值得研究的课题。
红仁核桃是美国加利福尼亚大学于1978年杂交育成的一种独特的核桃,其内种皮为红色,且营养价值高于普通品种核桃[21],因此引起国内外学者的广泛重视。红仁核桃内种皮中富含大量的酚类及黄酮类化合物,具有重要的营养和开发应用价值。
核桃多酚的提取和纯化一直是国际研究的热点之一。传统溶剂提取法主要以一定浓度的乙醇为提取剂,采用水浴或索氏抽提对多酚进行提取超声辅助溶剂提取法,是在有机溶剂提取的基础上增加了超声波处理微波辅助溶剂提取法,是在有机溶剂提取的基础上增加了微波处理酶法复合超声辅助法,仍处在实验室研究阶段亚临界提取法,以亚临界水为提取剂,此法更适合于核桃壳中有效成分的提取闪式提取法,是一种新型提取技术,主要通过高速搅拌和高压作用,在短时间内将核桃中的多酚物质提取出来。在核桃多酚的提取过程中,可以结合实际情况,采用多种方法相结合的方式进行优化,以实现高效、节能且环保的多酚提取。目前,核桃多酚的提取和纯化技术已经取得了显著的进展[22,23]。然而,由于核桃多酚的组成复杂,其完全分离和纯化仍然具有挑战性,因此这一领域仍有许多研究需要进行。
目前,我国对核桃内种皮多酚的提取工艺还处在研究阶段,研究人员一般采用甲醇、乙醇为提取液,同时加入少量酶类、螯合剂等用以提高多酚提取率。本文从红仁核桃内种皮中多酚的提取工艺入手,对提取时间、提取温度、乙醇体积分数、液固比4个因素进行优化,探究最优的一组提取工艺组合,从而获得最佳提取率。通过试验研究,最终确定一种理想的红仁核桃内种皮多酚提取率的方法。
1 材料与方法
1.1 试验材料
红仁核桃(滇彩甄选农产品店提供),破壳取仁,剥取内种皮后室温条件下自然干燥,粉碎过0.85 mm孔径的筛网,放置备用。
紫外-可见分光光度计(UV759S,上海习仁科学仪器有限公司)。摇摆式高速粉碎机(DFY-500C,温岭市林大机械有限公司)、四孔恒温水浴锅(HH-S4,巩义市予华仪器有限责任公司)、电冰箱(BCD-328WDGF,青岛海尔股份有限公司)、万分之一电子天平(CP114,奥豪斯仪器有限公司)。没食子酸(北京索莱宝科技有限公司),福林酚试剂(北京索莱宝科技有限公司),无水乙醇、碳酸钠等试剂均为分析纯。
1.2 试验方法
1.2.1 标准曲线的建立 用电子天平称取0.005 g没食子酸标准品,置于50 mL容量瓶中溶解定容,即可得到100 mg/L没食子酸标准溶液,即配即用。用移液管分别准确吸取标准溶液0.1~0.8 mL共8份于10 mL具塞试管内,再分别加水补足至1 mL,轻轻摇动,使溶液混合均匀后加入10%福林酚试剂5.0 mL,5 min后再加入7.5% Na-2CO-3溶液4.0 mL,摇匀后室温避光反应1 h,在波长765 nm处测定吸光度值,绘制没食子酸标准曲线[24]。
1.2.2 多酚类含量的测定 多酚类化合物的测定采用Folin-Ciocaileu(福林酚试剂)比色法[25]。
样品溶液:取干燥的核桃内种皮粉末0.20 g,置于150 mL平底烧瓶中,加入一定体积的60%乙醇,恒温水浴两次,每次30 min,抽滤,合并滤液并用蒸馏水定容至50 mL,用移液管精确量取上述样品溶液1.0 mL,用蒸馏水定容至100 mL,摇匀,得样品溶液。
采用1.2.1方法测定红仁核桃内种皮中多酚提取液吸光度值,通过1.2.1绘制出的标准曲线计算各样品溶液多酚得率,计算公式如下:
多酚得率(%)=m-1/m-2×100
式中,m-1为样品溶液中多酚的含量(g)m-2为红仁核桃内种皮样品质量(g)。
1.3 试验步骤
1.3.1 单因素试验 温度:用电子天平称取0.2 g干燥的核桃内种皮5份分别置于150 mL平底烧瓶中,保持乙醇体积分数(60%)、液固比(60 mL∶[KG-*2]1 g)、提取时间(60 min)等因素一致,同时设置50 ℃、60 ℃、70 ℃、80 ℃、90 ℃ 5个温度梯度,各样品均提取2次后抽滤,合并浸提液,按标准曲线建立方法,测定吸光度值,用福林酚比色法测定样品溶液中多酚含量,在试验范围内探究提取温度对红仁核桃内种皮多酚得率的影响[26,27]。
液固比:按上述试验步骤,将液固比设置为40∶[KG-*2]1、60∶[KG-*2]1、80∶[KG-*2]1、100∶[KG-*2]1四个梯度,温度为上述确认最佳温度水平,各样品均浸提2次后抽滤,合并浸提液,按标准曲线建立方法,测定吸光度值,用福林酚比色法测定样品溶液中多酚含量,在试验范围内探究液固比对红仁核桃内种皮多酚得率的影响。
提取时间:按上述试验步骤,保持其余变量不变,温度及液固比为上述步骤已经确认的最佳水平,将提取时间设置为0.5 h、1 h、1.5 h、2 h、2.5 h五个梯度,各样品均浸提2次后抽滤,合并浸提液,按标准曲线建立方法,测定吸光度值,用福林酚比色法测定样品溶液中多酚含量,在试验范围内探究提取时间对红仁核桃内种皮多酚得率的影响。
乙醇体积分数:按上述试验步骤,其余变量均按照上述步骤已经确认的最佳水平,将乙醇体积分数设置为40%、45%、60%、75%、90%五个梯度,各样品均浸提2次后抽滤,合并浸提液,按标准曲线建立方法,测定吸光度值,用福林酚比色法测定样品溶液中多酚含量,在试验范围内探究乙醇体积分数对红仁核桃内种皮多酚得率的影响。
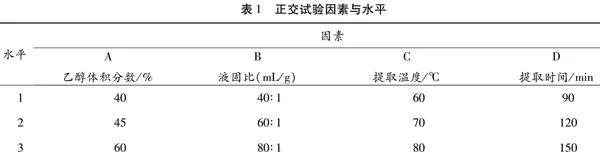
1.3.2 正交试验 准确称取干燥的核桃内种皮0.2 g于150 mL平底烧瓶中,以单因素试验结果为依据,以4个因素设计L9(34)正交试验,以多酚得率为评价指标,每个组合设3个重复,取平均值作为多酚得率。优化红仁核桃内种皮多酚提取工艺。正交试验因素及水平如表1所示。通过SPSS26.0分别对提取温度等4个因素与多酚提取率之间的关系进行分析。
1.3.3 正交试验验证 重复验证正交试验得到的最优组合,考察最优提取条件下结果的稳定性,最后取平均值,得到最优提取条件下的多酚得率。
2 结果与分析
2.1 标准曲线
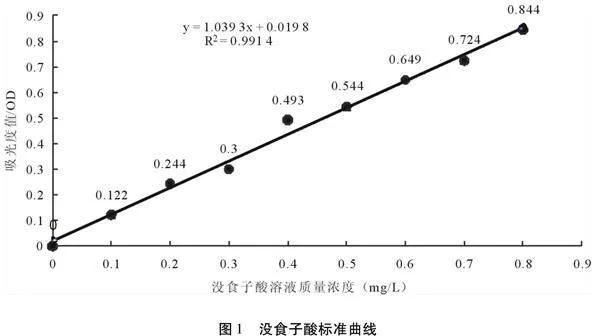
设置吸光度值A为纵坐标,没食子酸质量浓度C为横坐标,绘制没食子酸的标准曲线,进行回归分析。结果如图1所示:
没食子酸标准曲线回归方程为A=1.039 3C+0.019 8,R+2=0.991 4,其在试验范围内,质量浓度与吸光度值表现出良好的线性关系。
2.2 单因素试验结果
2.2.1 提取温度对多酚得率的影响 按1.3.1试验方法,控制其余变量一致,提取温度对红仁核桃内种皮多酚得率的影响见图2。
由图2可知,其余条件不变,温度为50~90℃的范围内,多酚得率逐渐上升,原因可能是在较高温度下,溶质中多酚物质扩散速度增加,分子运动剧烈,导致氢键更易破裂,从而加快多酚的溶出和扩散速率,因而酚类化合物浸出率逐渐升高[28]。70℃时多酚提取率达到最高,为27.52%,温度达到80℃时,多酚得率随着温度的升高开始呈下降趋势,这可能是因为在过高温度下,多酚的氧化程度增加使得活性多酚含量减少的缘故[29],因此,选取70℃作为红仁核桃内种皮多酚提取的最适温度。
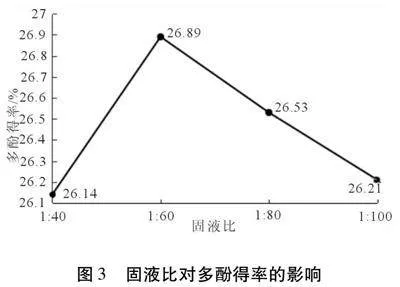
2.2.2 液固比对多酚得率的影响 按1.3.1试验方法,控制其它变量一致,液固比对红仁核桃内种皮多酚得率的影响见图3。
由图3可知,随着液固比增大,红仁核桃内种皮得率呈现先增后降的趋势,液固比为60∶1时,多酚得率达到峰值,为26.89%。原因可能是随着提取液体积的增多,酚类物质扩散的压力差变大,使其在提取液中的溶解度变大,多酚得率也随之增大但如果继续增大溶剂比例,后续压力差变化小,导致酚类化合物扩散速率降低,同时,随着溶液总体积增大,使得浓度变小不利于酚类物质提取[30],因此选取60∶1作为红仁核桃内种皮多酚提取的最适液固比。
2.2.3 提取时间对多酚得率的影响 按1.3.1试验方法,控制其他变量一致,提取时间内对红仁核桃内种皮多酚得率的影响见图4。
由图4可知,随着提取时间的延长,多酚提取率呈先上升后下降的趋势,120 min时达到峰值,此时提取率为27.21%。原因可能是起初随着时间的延长,有利于酚类物质的溶出,因此,多酚得率呈上升趋势,并在2 h时达到峰值。随后,提取率呈下降趋势,这可能是由于随着时间的延长,多酚类物质发生了缩合反应,或被氧气氧化所致[31],因此,选取2 h作为红仁核桃内种皮多酚提取的最适时间。
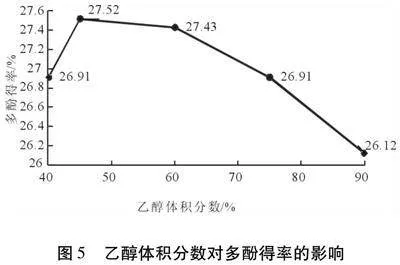
2.2.4 乙醇体积分数对多酚得率的影响 按1.3.1试验方法,控制其他变量一致,乙醇浓度对红仁核桃内种皮多酚得率的影响见图5。
由图5可知,当乙醇体积分数在40%~45%区间时,随着体积分数的增加,多酚得率提高。乙醇体积分数为45%时,多酚得率达到峰值,此时提取率为27.52%,乙醇体积分数在45%~60%区间时,核桃内种皮多酚得率开始呈下降趋势。原因可能是乙醇体积分数的增加使红仁核桃内种皮多酚溶解度增加,从而利于提取,表现为提取率升高。此后,随着乙醇体积分数的升高,导致有机溶剂与多酚极性差异增大[32],因此,多酚提取率降低。故选取45%作为红仁核桃内种皮多酚提取的最佳乙醇体积分数。
2.3 正交试验结果
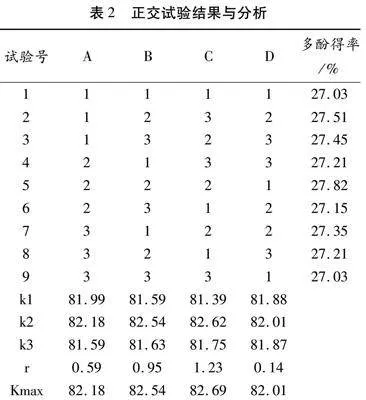
在以上单因素试验基础上,筛选出四个考察因素,即乙醇体积分数(A)、液固比(B)、提取温度(C)及提取时间(D)设计三水平正交试验。K为每个因素各个水平下的指标总和,r为极差,Kmax为每个因素各个水平下指标总和的最大值,运用SPSS26.0进行数据分析,结果见表2。
根据表2中极差数值,上述四因素的影响大小为:提取温度gt;液固比gt;乙醇体积分数gt;提取时间,即提取温度对多酚得率的影响最大,其次为液固比和乙醇体积分数,而提取时间对多酚得率的影响最小。其中条件A-2B-2C-2D-2为核桃内种皮多酚提取中的最优提取工艺参数,即乙醇体积分数为45%,提取时间为120 min,液固比为60 mL∶[KG-*2]1 g,温度为70℃。
按正交分析所得最优工艺条件组合,进行验证试验,三次验证试验多酚平均得率为27.93%。
3 讨论
张春梅[33]等对云南漾濞地区的新鲜核桃进行多酚提取研究,结果表明温度70℃、时间60 min、液固比60 mL∶[KG-*2]1 g)、乙醇体积分数45%时,该品种核桃内种皮多酚的得率最大为25.05%,本研究多酚得率为27.93%,比其高出2.88%。同时,张春梅等通过正交分析试验得出,提取温度对多酚得率的影响最大,本研究结论与此一致。周晔等[34]通过对“娘青”品种核桃进行超声波提取研究发现,核桃内种皮粉在100 W超声波下,53℃,55 min,液固比58 mL∶[KG-*2]1 g 时,为其最佳提取条件,此条件下多酚得率为30.7%,比本研究所用方法多酚得率高出2.77%。试验结果存在差别的原因,除了可能与试验提取方法、核桃品种、产地有关外,还可能与研究条件、环境不一致等误差因素也有关系。
张天财等[35]通过对云南地区核桃各部分多酚化合物含量进行测定,表明核桃内种皮(21.73%)中含量最高,其次为核桃青果皮(6.37%)和核桃壳(2.92%),而核桃仁(0.77%)中含量最低,可以看出核桃内种皮多酚含量明显高于其他部分。本研究核桃内种皮多酚得率27.93%,也是对此结论的一方面证实,说明核桃内种皮多酚确实具有重要的研究价值。研究人员可以充分发挥核桃内种皮这一资源优势,进一步开发出更多商品,提高产品附加值。
贾淑平等[36]采用复合酶-超声波技术,用纤维素酶和果胶酶提取核桃青皮多酚,效果较好。郑晓宁等[37]采用乙醇作为提取剂,利用微波萃取技术从胡桃青皮中萃取酚类物质,同时加入适量六偏磷酸钠,发现多酚产出量比常规对照溶剂提取法有所提高。李笑笑[38]利用酸化乙醇超声提取法发现,当盐酸浓度为0.05 mol/L,提取温度为65℃,提取时间为10 min时,核桃仁多酚提取率最大,达96%, 提取效果理想。这些多酚类物质的提取方法,尤其是提取率很高的方法,未来也可以尝试应用在核桃内种皮或其他部位的提取上。
4 结论
本研究以红仁核桃内种皮为试验原料,采用单因素法和正交法,研究了提取剂乙醇浓度、液固比例、提取时间、提取温度对内种皮粉中多酚提取率的影响。通过正交分析确认了各因素的最佳水平,得到了红仁核桃内种皮多酚最佳提取工艺参数(提取温度70℃、时间2 h、液固比60 mL∶1 g、乙醇体积分数45%)。通过比较极差,确定了四种因素对多酚提取率的影响顺序为:提取温度>液固比(mL∶g)>乙醇体积分数>提取时间,且通过正交试验验证了在此最佳提取工艺条件下,红仁核桃内种皮多酚提取率为27.93%。总的来说,本研究得到的红仁核桃内种皮多酚提取方法切实可行,较为理想,有一定的参考性。
参考文献:
[1] 王云生. 我国野生果树资源及其开发利用概况[J]. 广东农业科学, 2015, 42(22): 39-44.
[2] 霍灿灿, 招礼军, 朱栗琼, 等. 桂西北喀斯特区山核桃叶片及土壤养分的季节动态[J]. 广东农业科学, 2022, 49(5): 44-52.
[3] 胡青, 肖良俊, 杨嫱, 等. 我国漾濞泡核桃研究进展[J]. 西部林业科学, 2019, 48(3): 141-147.
[4] HAYES D, ANGOVE M J, TUCCI J, %et al.% Walnuts(Juglans regia) chemical composition and research in human health[J]. Critical Reviews in Food Science and Nutrition, 2016, 56(8): 1 231-1 241.
[5] LI A, MEI Y, ZHAO M, %et al. %Do urinary metals associate with the homeostasis of inflammatory mediators" Results from the perspective of inflammatory signaling in middle-aged and older adults[J]. Environment International. 2022, 163(2):2 637-2 648.
[6] 谢素雅, 曹尚桥, 李红波, 等. 核桃内种皮脂质和氨基酸组成分析[J]. 农产品加工, 2022, 565(23): 5-10.
[7] 张泽生, 王霄然, 王田心, 等. 核桃内种皮提取物的体内抗氧化活性研究[J]. 中国食品添加剂, 2017(1):110-114.
[8] 王根宪, 董兆斌, 王英宏. 红仁核桃坚果经济性状与果实营养成分分析[J]. 西北园艺(果树), 2021(5):33-35.
[9] NAGHSIHI S, SADEGHIAN M, NASIRI M, %et al.% Association of total nut, tree nut, peanut, and peanut butter consumption with cancer incidence and mortality: a comprehensive systematic review and dose-response meta-analysis of observational studies[J]. Advances in Nutrition(Behesda, MD.), 2021, 12(3): 793-808.
[10] 彭凯, 罗春彦, 黄文, 等. 植物多酚的解毒作用及其在动物生产中的应用[J]. 饲料研究, 2022, 45(2):127-130.
[11] Carvalho M, Ferreira P J, Mendes V S, %et al.% Human cancer cell antiproliferative and antioxidant activities of Juglans regia L. [J]. Food amp; Chemical Toxicology, 2010, 48(1): 441-447.
[12] Yada K, Roberts L A, Oginome N, %et al.% Effect of acacia polyphenol supplementation on exercise-induced oxidative stress in mice liver and skeletal muscle[J]. Antioxidants (Basel). 2019, 9(1): 29-35.
[13] Bati B, Celik I, Dogan A. Determination of hepatoprotective and antioxidant role of walnuts against ethanol-induced oxidative stress in rats[J]. Cell Biochemistry And Biophysics, 2015, 71(2): 1 191-1 198.
[14] Alruwad M I, Sabry M M, Gendy A M, %et al.% In vitro cytotoxic potential of selected jordanian flora and their associated phytochemical analysis[J]. Plants (Basel), 2023, 12(8):1 626-1 647.
[15] Novaj A, Engel M G, Wang R, %et al.% Dietary walnuts preserve aspects of health span and alter the hippocampal lipidome in aged high-fat diet-fed mice[J]. International Journal of Molecular Sciences, 2023, 4(3): 2 314-2 335.
[16] 沈雨潇, 白雅如, 石亚菲, 等. 膳食营养对阿尔兹海默症机制的调控作用[J]. 公共卫生与预防医学, 2022, 33(6): 1-5.
[17] 邹燕, 罗圣群, 曾婕, 等. 茶多酚在医学研究中的进展[J]. 福建茶叶, 2023, 45(6): 146-148.
[18] 杨璐冰. 核桃多酚提取物对4-戊基苯酚和3-甲基-4-硝 基苯酚诱导的小鼠脾淋巴细胞免疫毒性的缓解作用[D]. 北京: 北京林业大学,2016.
[19] Chauhan A, Chauhan V. Beneficial effects of walnuts on cognition and brain health[J]. Nutrients. 2020, 12(2):550-568.
[20] Jahanban E A, Ostadrahimi A, Tabibiazar M, %et al.% A Comparative review on the extraction, antioxidant content and antioxidant" potential of different parts" of" walnut (Juglans" regia L.) [J]. Fruit and Tree. Molecules. 2019, 24(11): 21 33-2 149.
[21] Feduraev P, Skrypnik L, Nebreeva S, %et al.% Variability of phenolic compound accumulation and antioxidant activity in wild plants of some rumex species (polygonaceae)[J]. Antioxidants (Basel), 2022, 11(2): 311-332.
[22] 魏欢, 杨建文, 颜小捷, 等.核桃青皮的化学成分研究——酚类化合物[J].广西植物, 2018, 38(4): 463-468.
[23] 黄小龙, 孙雨辰, 张维, 等.核桃多酚化学及生物活性研究进展[J].食品工业科技, 2018, 39(21): 348-352.
[24] 张锦东, 王小玉, 游淑珠, 等. 菠萝蜜种子中总黄酮的提取工艺及其抗氧化性研究[J]. 广东农业科学, 2017, 44(12): 136-143.
[25] 汪丹丹, 杨瑞楠, 张良晓, 等. Folin-Ciocaileu比色法测定油菜籽中总酚含量[J]. 食品安全质量检测学报, 2018, 9(5): 979-984.
[26] 卢俊. 响应面优化核桃青皮总黄酮提取工艺及其抗氧化活性研究[J].饲料研究, 2023, 46(9): 97-102.
[27] 肖淋, 肖钦, 程心玲, 等. 正交试验优选紫白栓剂中紫草的提取工艺[J]. 海峡药学, 2022, 34(8): 6-8.
[28] 缪福俊, 宁德鲁. 核桃多酚类物质生物活性研究进展[J]. 中国油脂, 2021, 46(1): 48-51.
[29] 高杨, 李铉军.不同等级茶叶中茶多酚含量的比较[J].吉林农业, 2019(1): 52-53.
[30] 安淦鼎, 曾志康, 魏泽民, 等. 核桃青皮多酚的提取及其对油脂抗酸败作用的影响[J]. 食品安全导刊, 2021, 321(28): 63-65.
[31] 王纪辉, 耿阳阳, 刘亚娜, 等. 泡核桃果实副产物多酚物质响应及组成探究[J]. 西南林业大学学报(自然科学), 2023, 43(2): 172-180.
[32] 王新然, 刘瑶, 张晓瑞, 等. 核桃瓣膜提取物组成、体外抗氧化性及其对羊肉保鲜作用分析[J]. 食品与发酵工业, 2019, 45(10): 78-85.
[33] 张春梅, 陈朝银, 赵声兰, 等. 核桃内种皮多酚提取工艺及其体外抗氧化活性的初步研究[J]. 中国酿造, 2014, 33(7): 130-134.
[34] 周晔, 王伟, 陶冉, 等. 超声波提取核桃内种皮多酚的响应面优化及其抗氧化研究[J]. 林产化学与工业, 2013, 33(4): 73-78.
[35] 张天财, 陈朝银, 赵声兰, 等. 核桃种皮中多酚的测定及种皮对核桃贮藏品质的影响[J]. 食品工业科技, 2013, 34(20): 65-69+74.
[36] 贾淑平, 燕子红, 买买提吐尔逊. 响应面法优化核桃青皮多酚复合酶-超声波提取工艺[J]. 河南工业大学学报, 2016(6): 75-80.
[37] 郑晓宁, 李俊, 牟建楼, 等. 核桃果实多酚活性及其分离纯化研究进展[J]. 食品工业科技, 2020, 41(21): 351-358.
[38] 李笑笑. 核桃内种皮多酚的提取及核桃油与核桃蛋白粉的稳定性研究[D].无锡: 江南大学, 2017.
基金项目:商洛学院保健食品开发研究项目(18SCX005)商洛学院博士科研启动基金项目(20SKY030)。
第一作者简介:许飞利(1979-),女,讲师,博士,研究方向:食品营养与安全。
