金钗石斛种子直播幼苗不同月龄共生真菌群落多样性变化
2024-10-09高世南张文杰王梦雪梁玉琼邵士成



关键词:金钗石斛;幼苗;ITS 扩增子测序;菌根真菌;种群重建
中图分类号:S567.239 文献标志码:A
兰科(Orchidaceae)是被子植物中物种数量较为丰富的类群之一,全世界约有870 属29 524种[1],我国约有181 属1708 种[2]。兰科植物的生存和繁衍依赖于专性的共生真菌和传粉昆虫[3-4],因此更容易受到气候变化和人为采集的影响[5-6]。目前所有野生兰科植物均列入《濒危野生动植物种国际贸易公约》(CITES),并严禁在国际上交易流通[7]。兰花中不乏有一些具有重要观赏价值和药用价值的种类,如石斛属(Dendrobium)、开唇兰属(Anoectochilus)、独蒜兰属(Pleione)等。兰科植物不仅是植物多样性保护的旗舰类群,也是科学研究的热点类群。
兰科植物的种子大多细若粉尘,缺乏胚乳储存营养,需要共生真菌为其提供碳源、氮源、水和无机盐等才能成功萌发[8-9]。共生真菌的菌丝在种子萌发形成的原球茎基部细胞中或成年植株的根皮层细胞内部会缠绕形成菌丝团结构(peloton),这是兰科菌根的典型特征[10]。兰科植物在生命伊始就与共生真菌建立了特殊的营养作用关系,二者无论是在生理上还是生态上均存在密切的联系。与兰科植物共生的典型真菌类群俗称“ 兰科丝核菌” 包括: 蜡壳耳科( Sebacinaceae)、无孢蜡壳科(Serendipitaceae)、胶膜菌科(Tulasnellaceae)和角担菌科(Ceratobasidiaceae)等[10]。此外,一些外生菌根真菌和腐生真菌也可以作为兰科植物的共生真菌而存在[11]。兰科植物在整个生活史中总是部分或完全依赖共生真菌获取必要的营养,因此探究兰科植物与共生真菌关系的稳定性及其变化规律,对兰花的人工栽培和野外回归具有重要意义。
多数兰科植物从种子至成年植株的发育过程中,需要先经历依赖真菌获取营养的异养阶段,然后才逐步开始光合自养。由于营养需求的转变,共生真菌类群可能会发生变化。VENTRE 等[12]综合分析了兰科菌根真菌种类随宿主发育的转变模式包括:不转变、嵌套性增加或减少、部分替换以及完全替换4 种类型。某些兰科植物终生偏好于某一特定真菌类群,如杏黄兜兰(Paphiopedilumarmeniacum)从幼苗到开花的发育过程中,仅有胶膜菌科真菌是优势类群[13];欧洲对叶兰(Neottia ovata)从原球茎到成年植株阶段的主要真菌类群均为无孢蜡壳科[14]。共生真菌在兰花生命历程中发生转变也是常见的模式,药用植物天麻(Gastrodia elata)种子的萌发依赖紫萁小菇(Mycena osmundicola),而原球茎后续发育需要与蜜环菌(Armillaria mellea)共生[15]。同样在地生兰和附生兰中发现了真菌类群转变,杜鹃兰(Cremastra appendiculata)在原球茎阶段的优势真菌属于鬼伞科(Psathyrellaceae),在成年后增加了角担菌科和蜡壳耳目(Sebacinales)[16];而风兰(Vanda falcata)的种子萌发由角担菌科真菌诱导,成年植株还与胶膜菌科真菌共生[17]。由此可见,兰科植物在生长发育过程中的共生真菌转变模式不尽相同,对于特定的兰花物种往往需要野外验证,才能深入了解其自然状态下对共生真菌的真实需求。
依赖有效的促萌发真菌对兰科植物进行野外种苗扩繁是濒危物种恢复的有效手段。目前基于种子和共生真菌的人工扩繁主要集中在地生兰,JIANG 等[18] 针对药用植物手参( Gymnadeniaconopsea)的野外原地共生萌发试验证实了角担菌属(Ceratobasidium)GS2 菌株能够在自然条件下促使手参种子成功萌发并形成幼苗;对于具有观赏价值的纹蝶兰(Anacamptis papilionacea),胶膜菌科AP1 菌株能够有效促进其种子在原地条件发育为幼苗[19]。本实验室前期也利用一株蜡壳耳科JC-01 菌株对濒危附生兰金钗石斛(Dendrobiumnobile)开展了适宜自然生境下的原地共生萌发,成功建立了人工种群[20]。然而,这些在自然条件下形成的人工幼苗,其根系真菌的变化模式有待进一步探究,这将有助于理解个体在发育过程中对共生真菌的动态需求以及共生真菌对人工种群维持和变化的影响。
石斛(D. nobile Lindl.),又称金钗石斛,是石斛属多年生附生草本植物,因干燥后形态酷似我国古代妇女的发钗而得名[21]。作为我国传统中药材,金钗石斛被《中华人民共和国药典》(2020年版)所收录。金钗石斛茎中富含石斛碱、多糖和酚类等有机化合物等,经药理研究证明有降血糖血脂、抗氧化衰老以及抗肿瘤等功能[22]。然而,对金钗石斛的过度利用以及自身繁殖率低等原因导致野生资源濒危[23],我国2021 年颁布的《国家重点保护野生植物名录》将其列为国家二级保护植物。本研究所用的金钗石斛幼苗基于“种子-真菌混合播种技术”在茶树上获得种苗,并在采集根系的基础上对比人工扩繁的幼苗与自然形成的幼苗在共生真菌群落组成和多样性方面的差异,同时也对人工幼苗种群的共生真菌的菌群转变模式进行探究,以期为金钗石斛的种苗繁育和人工种群生态恢复提供理论依据。
1 材料与方法
1.1 材料
利用种子原地共生萌发技术,于2023年4月在云南省勐腊县象明乡茶园(22°13′N,101°20′E,海拔约为1500 m)播种获得金钗石斛人工幼苗,播种方法参照本实验室已有的成熟技术[24]进行,利用2 株胶膜菌科真菌(编号为FDL-01、JC-03)、2 株蜡壳耳科真菌(编号为JC-01、YB-01)和4株无孢蜡壳科真菌(编号为LP-01、RJC-131、YB-03 和YDLXB)作为真菌处理组,不添加真菌的作为空白对照组(CK)。于当年8 月、9 月和10 月分别采集真菌处理组120d(4 月龄)、150d(5 月龄)、180d(6 月龄)及CK 的幼苗根样,每个处理采集3个重复样本。将收集的根系样本分装至无菌采样袋中并做好标记,置于生物样品采样箱中低温运回实验室。
直播茶园所在的象明乡是典型热带季风气候区, 年平均温度21.9 ℃ , 年降雨量为1500~1900 mm,森林覆盖率达到64.96%,主要植被类型为热带雨林、亚热带常绿阔叶林、落叶阔叶林等[25]。茶园中的主要树种是普洱茶(Camelliasinensis var. assamica),周围伴有一定的遮荫乔木。茶园温暖、湿润以及一定遮荫的生态条件适于金钗石斛种子的野外共生萌发。
1.2 方法
1.2.1 根样处理参考 PANDEY 等[26]的方法对金钗石斛幼苗根样进行处理,先用流水清洗干净根上附着的苔藓等杂质,然后用无菌滤纸吸干水分。随后用75%乙醇消毒1 min,再用质量体积分数为3%的次氯酸钠溶液消毒30 s,重复75%乙醇消毒1 min,最后用无菌纯水清洗5 次。消毒的根样用无菌滤纸吸干水分后,刮去根被。将处理的根样放入无菌离心管并编号,置于液氮中速冻,于–80 ℃冰箱低温保存。
1.2.2 真菌总 DNA的提取和rDNA-ITS 扩增子测序 金钗石斛幼苗根样品经冷链运输至上海派森诺生物科技股份有限公司进行真菌总DNA 的提取和rDNA-ITS 扩增子测序。以真菌核糖体DNA的内部转录间隔区ITS2 序列为目标,用兰科菌根真菌特异性引物ITS3(5ʹ–GCATCGATGAAGAACGCAGC–3ʹ)和ITS4OF(5ʹ–GTTACTAGGGGAATCCTTGTT–3ʹ),并添加特异性标签序列(AAGCACTG)对ITS2 区域进行PCR 扩增[27]。回收后的PCR 产物进行定量与测序文库的构建,对质量合格的文库,在NovaSeq-PE250(Illumina,USA)平台上进行2×250 bp 的双端测序。
1.3 数据处理
对得到的下机原始序列文件,首先利用QIIME2 软件( Quantitative Insights Into MicrobialEcology, v2023-7, http://qiime.org/)的cutadapt 插件去除序列的引物片段,然后在R 软件中用DADA 2 方法对序列进行后续的质量过滤、去噪、拼接和去嵌合体等质控步骤,将序列以100%相似度聚类,得到ASVs(amplicon sequence variants)特征序列,去除序列总数仅为1 的ASVs 后得到ASVs 特征表。使用QIIME 2 软件以最低样本量的95%对各样本进行抽平,预测同一测序深度下观测到的ASVs 数量及其相对丰度,计算α 多样性指数并绘制稀疏曲线;使用R 软件中的Venndiagram 包绘制不同样本间的Venn 图,分析不同分组间独有和共有的ASVs 数量; 基于真菌UNITE 数据库,利用QIIME 2 软件的classifysklearn插件对每个ASVs 特征序列进行物种注释,绘制物种堆积柱状图;使用R 软件中的vegan包和ggplot2 包分别计算Bray-Curtis 距离和绘制主坐标分析图,结合ANOSIM 相似性分析,分析样本间群落结构的差异。
不同播种方式比较采用独立样本t 检验,不同龄期比较采用非参数Kruskal-Wallis 检验。
2 结果与分析
2.1 金钗石斛幼苗根样测序结果
基于Illumina NovaSeq-PE250高通量测序结果,不同金钗石斛幼苗根样品中的序列长度主要分布在350~400 bp 之间,共获得1029977条高质量的ITS2序列,金钗石斛4 月龄、5 月龄、6月龄和CK 根中分别获得287969、232556、274084、235368条有效序列(图1)。各样品的ASVs 曲线随着测序深度的增加而趋于平缓,覆盖度接近100%,表明本次测序量达到饱和状态,能够全面覆盖幼苗根系的真菌类群。
通过剔除非真菌序列、嵌合体和singleton 序列等质控步骤并结合聚类分析,共得到876 个真菌ASVs。真菌处理组的金钗石斛幼苗根系的真菌ASVs 为686 个,多于CK(264个),二者共有80 个真菌ASVs(图2A)。金钗石斛4月龄、5月龄和6 月龄幼苗根系的真菌ASVs 总量和独特的真菌ASVs 数量随龄期的增长而增加,不同月龄幼苗根系的真菌ASVs 总数分别为134、262和399个,三者共有29个真菌ASVs。金钗石斛6月龄幼苗根系独特的真菌数量最多,达335 个ASVs(图2B)。
2.2金钗石斛幼苗根系真菌多样性
对于不同处理的金钗石斛幼苗根样,真菌处理组的菌群丰度指数Chao1 指数(109.69±45.23)高于CK(102.98±42.27),即真菌处理组幼苗根系的物种数目多于CK;而真菌处理组的菌群多样性指数Shannon 指数和Simpson 指数均低于CK,真菌处理组与CK 间3 个多样性指数均无显著差异。在不同龄期的金钗石斛幼苗根系中,6月龄幼苗的Chao1 指数(156.45±22.35)显著高于4月龄幼苗(66.17±3.49)和5 月龄幼苗(106.45±2.23),6 月龄幼苗的Shannon 指数和Simpson 指数同样也高于其他龄期,但无显著性差异(表1)。
基于Bray-Curtis 距离的主坐标分析对不同处理的金钗石斛幼苗根系真菌群落组成信息进行降维和排序后投射于二维平面上,结果显示真菌处理组和CK 各聚为一类(图3A)。根据样本点的分布情况,真菌处理组各样本点比CK 更加聚集,结合ANOSIM 非参数检验结果,虽然两组间菌落组成差异较大(R2=0.778),但并无显著差异。而在不同龄期的幼苗样品中,4 月龄、5 月龄和6 月龄也各聚为一类,其中6月龄样本点的分布比其他月龄更加分散(图3B)。对不同龄期幼苗根系真菌群落结构进行ANOSIM 检验表明,金钗石斛幼苗不同龄期之间的根系真菌群落组成具有一定差异(R2=0.424),且差异显著(P=0.005)。
2.3 金钗石斛幼苗根系真菌物种组成
2.3.1 不同直播方式 从真菌处理组和CK 的幼苗根样品中获得870 个真菌ASVs,隶属于2 门11 纲28 目46 科56 属,两组之间根系真菌群落的种类组成和相对丰度有一定差异。在门水平,真菌处理组和CK 的根系真菌均由担子菌门(Basidiomycota)和子囊菌门(Ascomycota)组成,两类真菌的相对丰度类似,担子菌门分别为83.29%和83.93%,子囊菌门分别为16.71%和16.07%(图4A)。
在纲水平,真菌的主要纲(相对丰度大于1%)包括: 伞菌纲( Agaricomycetes ) 、粪壳菌纲(Sordariomycetes)、座囊菌纲(Dothideomycetes)、散囊菌纲(Eurotiomycetes)、银耳纲(Tremellomycetes)和锤舌菌纲(Leotiomycetes)。伞菌纲是真菌处理组和CK 的优势纲,相对丰度分别达80.04%和83.75%。其余各纲的相对丰度均低于10%,其中粪壳菌纲在真菌处理组的相对丰度较高,达9.15%,而座囊菌纲在CK 的丰度达7.80%(图4B)。
在目水平,主要类群(相对丰度大于2%)有:蜡壳耳目、鸡油菌目(Cantharellales)、格孢腔菌目(Pleosporales)、Conioscyphales、刺盾炱目(Chaetothyriales)、曲霉目(Eurotiales)和银耳目(Tremellales)。蜡壳耳目是真菌处理组和CK的优势目,相对丰度分别为79.71%和67.52%。对于真菌处理组而言,其余各目的相对丰度均低于5%,而在CK 中,鸡油菌目和格孢腔菌目的相对丰度分别为16.22%和6.74%(图4C)。
在科水平,主要类群(相对丰度大于2%)包括: 无孢蜡壳科、蜡壳耳科、胶膜菌科、Conioscyphaceae、Herpotrichiellaceae 和大疱担子科(Bulleribasidiaceae)。无孢蜡壳科是真菌处理组和CK 的优势科,相对丰度分别达57.52%和55.55%。蜡壳耳科在两组中的相对丰度占比均较高,分别为22.19%和11.98%。胶膜菌科仅出现在CK 中,相对丰度达16.22%。其余各科的相对丰度在两组中均低于5%(图4D)。
在属水平,真菌的主要属(相对丰度大于2%)有: 无孢蜡壳属( Serendipita ) 、蜡壳耳属(Sebacina)、胶膜菌属(Tulasnella)、Conioscypha、Pyrenochaetopsis、Hannaella 和Medicopsis。无孢蜡壳属和蜡壳耳属是真菌处理组的优势属,相对丰度分别达57.52%和22.19%,而CK 的优势属不仅包括无孢蜡壳属和蜡壳耳属,还包括胶膜菌属,相对丰度分别为55.55%、11.98%和16.22%。其余各属的相对丰度均低于5%(图4E)。此外,针对相对丰度大于5%的不同真菌属进行组间差异分析,结果显示无孢蜡壳属在两组间的差异不大,而真菌处理组的蜡壳耳属相对丰度比CK 高10.21%。胶膜菌属仅出现在CK,相对丰度比蜡壳耳属高4.24%,是CK 幼苗根系的优势属之一(图4F)。
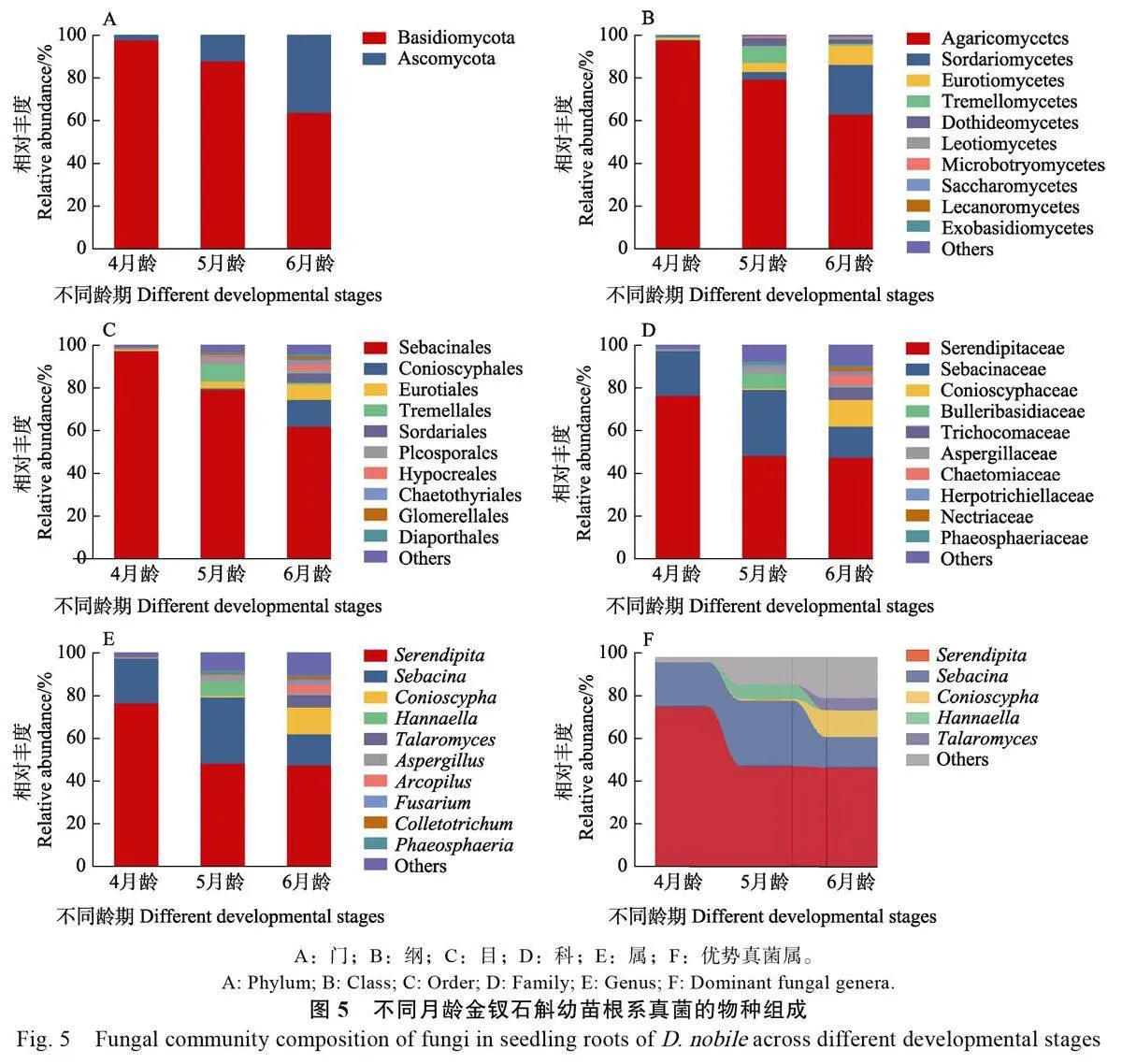
2.3.2 不同龄期 从真菌处理组不同龄期幼苗根样品中获得686 个真菌ASVs,隶属于2 门11 纲28 目46 科56 属,不同龄期幼苗根系真菌群落的种类组成和相对丰度有一定差异。在门水平,各龄期幼苗根系真菌均由担子菌科和子囊菌科组成,随着培养龄期的增加,担子菌门的相对丰度逐渐下降,而子囊菌门则逐渐增加(图5A)。
在纲水平,伞菌纲(97.62%)是4 月龄幼苗的主要真菌类群,其相对丰度随幼苗龄期的增长而减少,其余纲的相对丰度均小于1%;5月龄幼苗根中的粪壳菌纲、散囊菌纲和银耳纲的相对丰度比4 月龄分别增加至3.56%、4.35%和7.93%;6月龄幼苗根中的粪壳菌纲和散囊菌纲的相对丰度则分别增至23.38%和9.09%,而银耳纲的相对丰度降至0.72%(图5B)。
在目水平,4月龄幼苗根系的主要目是蜡壳耳目(相对丰度为97.61%),其余目的相对丰度均小于1%。除蜡壳耳目外,5月龄幼苗根中相对丰度较高的真菌类群为银耳目(7.94%),但6月龄幼苗根中的银耳目相对丰度却降为0.72%,而Conioscyphales 和曲霉目的相对丰度则分别增至12.65%和7.12%(图5C)。
在科水平,无孢蜡壳科和蜡壳耳科是4 月龄幼苗根系的主要真菌类群, 相对丰度分别为76.55%和21.06%,其余真菌科的相对丰度低于1%。5 月龄幼苗的主要真菌科为无孢蜡壳科、蜡壳耳科和大疱担子科,而6 月龄幼苗的主要真菌科基于上一阶段还增加了发菌科(Trichocomaceae,5.70%)和毛壳科(Chaetomiaceae, 4.49%)(图5D)。
在属水平,无孢蜡壳属和蜡壳耳属占据4 月龄幼苗根系主要地位,总体相对丰度高达97.61%。5 月龄幼苗根系的主要真菌类群在4 月龄幼苗的基础上增加了Hannaella ( 6.75% ) 和曲霉属(Aspergillus, 3.11%),而6 月龄幼苗根中优势真菌转变为Conioscypha ( 12.65%) 、篮状菌属(Talaromyces, 5.71%)和Arcopilus(4.15%)(图5E)。此外,针对相对丰度大于5%的真菌属进行组间差异分析,结果显示无孢蜡壳属从4 龄期幼苗转变成5 龄期幼苗过程中相对丰度减少了28.11%,而在后续发育中趋于稳定;蜡壳耳属从4 月龄到6 月龄的相对丰度呈先增后降的趋势;Hannaella 是5 月龄幼苗的独特优势真菌,相对丰度达6.75%,该真菌类群在其他龄期幼苗根中的相对丰度小于1%;Conioscypha 和篮状菌属的相对丰度随幼苗的生长而增加,在6 月龄幼苗中的相对丰度分别达到12.65%和5.71%(图5F)。
3讨论
本研究表明金钗石斛种子原地共生萌发不同处理方式形成的幼苗根系在真菌群落组成和相对丰度方面具有一定差异,真菌处理组和CK 的优势真菌类群有重叠,但CK 能够招募到环境中的胶膜菌科真菌并作为优势类群而存在。不同龄期幼苗根系的菌群结构差异显著,真菌的丰富度和多样性随幼苗生长而增加,典型兰科共生真菌的相对丰度随着月龄的增加而下降,同时非共生真菌的占比增加,且种类和丰度具有龄期特异性。
金钗石斛原地共生萌发形成的幼苗和自然条件(CK)形成的幼苗中,二者的真菌ASVs 数量虽然差别较大,但真菌群落的丰富度和多样性无显著差异,表明在同质的环境下,金钗石斛幼苗偏好性地选择相似的共生真菌作为主要类群,如蜡壳耳目。某些兰科植物也表现出在相似的生境下选择相同的真菌类群的现象。在大陆尺度上,分布于亚洲的不同手参种群偏好的共生真菌均属于角担菌科[28];而生长在同一个岛屿上的琉球石斛(D. okinawense)均倾向于选择同一株胶膜菌科真菌TU11 作为主要共生菌[29];分布于相似沼泽生境的5 个幽灵兰(D. lindenii)种群,其根系的优势共生真菌均为角担菌科真菌[30]。虽然兰科共生真菌是广泛分布的,但某些真菌在局部特殊生境中相对较高的丰度可能使同一环境内的兰花个体对共生真菌的选择更加局限和集中。
在本研究中,金钗石斛幼苗根系真菌的多样性和丰度随着龄期的增长而逐渐增加,同时独特的ASVs 数量也随之增加,从4 月龄幼苗的79 个ASVs 增加到6 月龄幼苗的355 个ASVs。当幼苗逐渐适应环境而存活下来,环境中的机会性真菌(opportunistic fungi)势必会占据根中的一席之地。这一现象也常见于其他兰花类群,如黄花白及(Bletilla ochracea)从生长期到花期的发育过程中,真菌OTUs 从119 个增加到270 个[31];在哥斯达黎加热带雨林共存的4 种附生兰,从幼年阶段到成年阶段的发育过程中其根系的核心真菌类群会保留,同时增加了新的真菌类群[32]。但这种规律不能一概而论,对杏黄兜兰生长过程中的真菌组成研究表明,杏黄兜兰从幼苗的营养生长转变到成年植株的生殖生长期间,根系的真菌OTUs 数量从幼苗时期的126 个降至开花时期的67 个[13];针对风兰的菌群变化的研究则显示,幼苗和成年植株的真菌群落组成保持相对稳定,子囊菌门占比超过一半,其次为担子菌门,其中典型的兰科共生菌仅占少部分[33]。不同生活型的兰花在生长期间复杂的营养需求可能会导致真菌类群组成的变化,从而影响特定时期的真菌丰度差异。
在本研究的金钗石斛幼苗根系的真菌组成中,典型的兰科植物共生真菌占据大部分,在真菌处理组种子原地共生萌发形成的幼苗中主要由无孢蜡壳属和蜡壳耳属组成,而在CK 组形成的幼苗中,胶膜菌属同样成为了优势真菌。金钗石斛的共生真菌种类丰富,早期从金钗石斛根中分离到角担菌属和兰小菇(Mycena orchidicola),被认为是潜在的共生真菌[34],这已在铁皮石斛(D.officinale)的种子共生萌发试验中得到证实[35]。本研究中,CK 的幼苗能够招募到胶膜菌属真菌,暗示周围环境中有该真菌类群的存在和分布,但真菌处理组幼苗根系中该类群的相对丰度仅为0.02%,低于CK(16.22%),这可能是因为人工添加的真菌在野外播种点建立了局部优势并与环境中的真菌彼此具有拮抗作用,导致真菌处理组根系中胶膜菌科真菌的相对丰度极低。然而兰科共生真菌之间的拮抗关系验证试验主要集中在实验室条件下,与单独菌株的种子共生萌发相比,不同共生真菌的叠加培养会导致金钗石斛和纹蝶兰的种子萌发率下降[36-37],本研究结果也初步表明共生真菌的拮抗作用可能在金钗石斛种子原地共生萌发中存在。
金钗石斛幼苗根系真菌组成并非一成不变,随着龄期的增长(4 月龄至6 月龄),优势真菌的占比逐渐下降,而机会性真菌的相对丰度逐渐增加。在优势真菌属中,无孢蜡壳属的相对丰度先下降后趋于稳定,而蜡壳耳属的相对丰度则先增后降,这反映出金钗石斛幼苗随着个体发育变化对共生真菌的偏好性发生了改变。这种偏好性变化可能与兰科植物在不同生长时期的营养需求有关,一项针对不同营养型鸟巢兰属(Neottiaspp.)兰花的研究发现,能够进行光合作用的类群通常在发育早期与无孢蜡壳科真菌建立共生关系,而腐生的类群则经常与蜡壳耳科真菌共生[14]。推测其原因可能是无孢蜡壳科真菌仅能够支持兰科植物早期真菌异养萌发时期的营养需求,在幼苗逐渐生根的过程中对营养需求逐渐增大,不足以支持后续的大量营养需求[38]。而蜡壳耳科是腐生兰[如鸟巢兰(Neottia nidus-avis)]的主要共生真菌类群,因其同时具有形成外生菌根的能力,很可能从周围树木中获取碳源,从而支持腐生兰完成其生活史[39],据此推测5 月龄幼苗根系中蜡壳耳属真菌增加的原因是该类群具有更加高效的营养供应能力。此外,5 月龄幼苗根系特有的优势真菌属是Hannaella,据报道是禾本科(Poaceae)植物内生酵母菌能够产生植物激素吲哚乙酸(IAA),促进植物的生长发育,是潜在的金钗石斛内生真菌资源[40]。6 月龄幼苗的优势真菌属为Conioscypha 和篮状菌属,前者主要从沉水腐烂的木屑中分离得到[41],可能是茶园环境中广泛存在的机会性真菌;后者则是青霉菌属(Penicillium)的有性世代,是典型的植物内生真菌,在帮助幼苗抵抗病原微生物方面可能具有重要作用[42]。
本研究明确了金钗石斛人工形成的幼苗和自然形成的幼苗根系在共生真菌和内生真菌的多样性和真菌群落组成上的差异,以及不同龄期人工幼苗根系的共生真菌及内生真菌相对丰度的变化模式。在后期有必要对金钗石斛幼苗根系中潜在的有功能性的共生真菌和内生真菌进行分离和验证,将具有生态功能的菌株应用到金钗石斛的野外回归中,维持人工幼苗群落稳定,实现该濒危物种的生态恢复。
致谢 感谢云南省林业和草原科学院研究员蒋宏和深圳市兰科植物保护和研究中心资源管理部副部长孔德敏惠赠金钗石斛种子。感谢曲靖师范学院Don NalinNilusha Wijayawardene 教授对英文摘要的修改。感谢普洱学院实习生龙兰和王汶倩以及租车师傅王玉明在野外直播试验中的帮助。
