基因编辑MeERF127提高木薯抗旱和耐盐性
2024-10-09张兴龙张亚文王晓彤唐湘宁郭建春闵义刘姣






关键词:木薯;MeERF127;基因编辑;干旱胁迫;盐胁迫
中图分类号:S533 文献标志码:A
AP2/ERF 转录因子是一类主要存在于植物中的转录因子大家族, 其包括5 个亚族:AP2(APETALA2)、乙烯响应因子(ERF)、脱水响应元件结合蛋白(DREB)、RAV 和Soloist [1]。AP2/ERF 转录因子包含约60 个氨基酸的AP2DNA 结合域,能与目标基因启动子处的脱水响应元件DRE/C-repeat 元件和GCC box 元件结合互作。AP2/ERF 超家族转录因子调控植物的多种发育过程,在激素调控和逆境应答中发挥重要作用[2]。目前,在很多植物中已鉴定出大量的ERF 家族成员,如水稻中存在170 个ERF 基因[3],拟南芥中存在147 个ERF 基因[4],小麦中存在238 个ERF基因[5],木薯中存在155 个ERF 基因[6]。
植物通过激活各种防御机制来抵御不同来源的生物(如昆虫和病原体的攻击)和非生物胁迫(如干旱、高盐和极端温度)。AP2/ERF 家族转录因子主要存在于植物中,在植物逆境响应中发挥着重要作用。大量的研究表明,AP2/ERF 型转录因子是植物生长发育和激素调节的重要调控因子,如控制花的生长、发育和衰老[7],小穗分生组织的命运[8],根的萌生和发育[9],叶的大小[10],籽粒发育[11],果实发育和成熟等[12]。大豆GmERF057在受到激素(SA、JA、ABA)和非生物胁迫(盐、干旱)处理后,其表达会显著增加,并且在烟草中过表达该基因还可以提高植物的耐盐性[13]。在盐胁迫下,过表达PagERF072 的转基因杨树具有较高的耐盐性,转基因杨树的过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性显著高于野生型杨树,而丙二醛(MDA)含量则表现出相反的趋势[14]。在干旱和盐胁迫下,过表达SlERF.B1 番茄明显萎焉,脯氨酸含量显著低于对照,丙二醛含量显著高于对照,而基因沉默株系恰好相反,说明SlERF.B1负调控番茄的抗旱和耐盐性[15]。
木薯(Manihot esculenta Crantz)又名树薯、木番薯,是大戟科木薯属双子叶植物,因其根部富含淀粉而被广泛种植。在南美洲、非洲和亚洲的热带地区,约有10 亿人以木薯为生存的能量来源[16]。已有研究发现逆境胁迫导致木薯的品质和产量受到一定的影响[17]。但是,ERF 基因在木薯逆境胁迫中的研究还很少,主要集中于木薯作为饲料的价值研究[18]、采后生理性变质的研究[19-20]和木薯抵抗病虫害的研究[21]。因此,本研究从华南8 号(SC8)木薯中克隆获得MeERF127 基因,对其进行生物信息学分析、亚细胞定位、转录活性和表达模式分析, 构建基因编辑载体获得MeERF127 基因编辑木薯,并研究MeERF127 基因编辑木薯在干旱、盐和低温胁迫下的形态学和生理学特征,为探究MeERF127 转录因子在木薯抗逆中的功能提供理论依据。
1 材料与方法
1.1 材料
供试木薯(Manihot esculenta Crantz)为华南8 号(SC8)木薯品种,来源于国家木薯种质资源圃。取生长于组培瓶中50 d 的木薯组培苗,一部分用300 mmol/L 甘露醇溶液、400 mmol/L NaCl溶液浸没木薯的根,另外一部分置于4 ℃冰箱,处理0、12、24、48 h 取材,将其中一半样品立即置于液氮速冻后保存于–80 ℃冰箱待用,另外一半取材后直接进行氧化产物检测和染色。每个样品3 个重复。
DH5α 大肠杆菌菌株、AH109 酵母菌株、LBA4404 菌株和GV3101 菌株均购自上海唯地生物技术有限公司;pMD19-T 载体、pCAMBIA1300-GFP 载体、pGBKT7 诱饵载体、基因编辑载体由本实验室保存。
1.2 方法
1.2.1 MeERF127基因克隆和序列结构分析 从木薯基因组数据网站(https://phytozome.jgi.doe.gov)下载MeERF127(Manes. 15G066800)的序列,设计该基因的克隆引物(MeERF127-F: ATGAGGAGAGGAAGGGGAG,MeERF127-R: TTAAAGCCATAGAGCAGTAC)。以SC8 木薯组培苗cDNA 为模板,PCR 扩增MeERF127 编码区片段,反应程序:94 ℃ 5 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,30 个循环;72 ℃ 10 min。将PCR产物切胶回收,得到纯化产物连接pMD19-T 载体并转化DH5α 大肠杆菌感受态,PCR 检测挑选阳性菌落送生工生物工程(上海)股份有限公司测序。使用DNAMAN 软件将测序成功的木薯MeERF127 基因序列所对应的蛋白序列与其他物种中已鉴定的且同源性较高的AP2/ERF 蛋白进行序列比对,分析其保守结构。
1.2.2 MeERF127 亚细胞定位分析 以测序成功的MeERF127-19T 载体为模板,采用同源重组法将MeERF127 基因构建到pCAMBIA1300-GFP 载体,构建pCAMBIA1300-MeERF127-GFP 重组质粒[MeERF127-F (Sal I): tgatacatatgcccgtcgacATGAGGAGAGGAAGGGGAG,MeERF127-R (BamHI): acgtcgtatgggtaggatccTTAAAGCCATAGAGCAGTACAATG],然后转入农杆菌GV3101。成功转化的菌株在YEP(50 mg/L 利福平+50 mg/L 卡那霉素)液体培养基中过夜培养至OD600 为1.0,5000 r/min 离心10 min 去上清,用烟草侵染液重悬菌体至OD600=0.6,室温避光放置2 h 后用注射器缓慢注入烟草叶片背面进行瞬时侵染表达,注射后的烟草于25 ℃培养2~3 d 后取材制片,在激光共聚焦显微镜下进行荧光观察。
1.2.3 MeERF127 转录活性分析 以测序成功的MeERF127-19T 载体为模板,采用同源重组法将MeERF127 基因构建到酵母双杂交载体pGBKT7上, 构建pGBKT7-MeERF127 重组质粒[MeERF127-F (BamH I): ggccgaattcccggggatccATGAGGAGAGGAAGGGGAG,MeERF127-R(Sal I): tgcggccgctgcaggtcgacTTAAAGCCATAGAGCAGTACAATG]。将pGBKT7-MeERF127、pGBKT7-p53+pGADT7-largeT(阳性对照)和pGBKT7(阴性对照)分别转化酵母感受态AH109。涂布于SD/-Trp 固体培养基,待其长出菌斑,随机挑选10 个菌斑进行阳性检测。转化成功的菌液在SD/-Trp 液体培养基中培养至OD600=0.6 时,各取5 μL 菌液点到含10 mg/mL X-α-gal 的SD/-Trp固体培养基上,30 ℃培养2 d 后观察菌落生长情况及菌落颜色,以此判断MeERF127 蛋白的转录活性。
1.2.4 MeERF127 基因在各组织器官和块根不同发育时期的表达分析 根据已获得的SC8 木薯9个组织器官(脆性愈伤、体胚、块根、块根韧皮部、块根木质部、须根、茎、成熟叶和嫩叶)的转录组测序结果,提取MeERF127 的FPKM 值(每千个碱基的转录每百万映射读取的片段),对其进行不同组织的表达分析。根据已获得的SC8 木薯种植后5 个发育时期(S1:块根形成期,80 d;S2:块根膨大前期,130 d;S3:块根膨大后期,180 d;S4:块根成熟前期,230 d;S5:块根成熟后期,80 d)木薯块根的转录组测序结果,提取MeERF127 的FPKM 值,对其进行木薯块根不同发育时期的表达分析。
1.2.5 MeERF127 在干旱、盐、低温胁迫下的表达分析 选取生长状态良好且长势一致的8~10周SC8 木薯组培苗,分别用300 mmol/L 甘露醇(干旱胁迫)、400 mmol/L NaCl 溶液(盐胁迫)和4 ℃(低温胁迫)处理0、12、24、48 h 后取材,每个样品取3 个重复。提取RNA并逆转录成cDNA。设计MeERF127 定量PCR 引物(qPCR-F: CTGTGGAGTCATTCAGCGGT,qPCR-R: CACAAAGACGACGACGATGC),以Tublin 为内参基因(Tublin-F: ATGCGGTTCTTGATGTTGTTC, Tublin-R:TCGGTGAAGGGAATACAGAGA),对MeERF127基因进行荧光定量PCR 检测。反应体系:Mon-AmpTM ChemoHS qPCR Mix 5 μL,DNA 模板1 μL,上/下游引物各0.2 μL,H2O 3.6 μL。反应程序:95 ℃ 10 min;95 ℃ 10 s,58 ℃ 10 s,72 ℃30 s,共40 个循环;95 ℃ 15 s;60 ℃ 15 s,95 ℃15 s 作溶解曲线。使用2–ΔΔCT 法计算相对表达量,每个样品3 次重复,利用SPSS 软件进行数据显著性分析,用Graphpad 软件作图。
1.2.6 MeERF127 基因编辑木薯的转化及鉴定参照耿沙等[22]方法,利用CRISPR-P 2.0 网站设计MeERF127 基因的靶点,送金斯瑞生物科技有限公司合成pCAMBIA1301-Cas9-MeERF127-gRNA基因编辑载体,然后转入LBA4404 农杆菌并转化SC8 木薯脆性愈伤组织。待转基因木薯出芽后,用15 mg/L 潮霉素进行生根筛选,再选取生根苗的叶片进行PCR 分子检测是否转化成功。用叶片裂解液提取叶片DNA 后用2×M5 Hiper 超光速mix 进行PCR,所用引物为Cas 9 通用检测引物(Cas 9-F: GCTGGGCCGTGATCACCGAC, Cas9-R: CACTCTCAGGATGTCGCTCAGC),PCR 反应程序如下:95 ℃ 3 min;94 ℃ 25 s,59 ℃ 25 s,72 ℃ 50 s,32 个循环;72 ℃ 5 min。提取阳性株系的基因组DNA,用MeERF127 基因靶点引物( target-F: GAGGAGAGGAAGGGGAGGAG, target-R: ATCTCAGCGGCGTATCTTCC ) 扩增MeERF127 基因靶点区域上、下游200 bp 的序列,用Hi-TOM 接头引物(F: GGAGTGAGTACGGTGTGC,R: GAGTTGGATGCTGGATGG)进行新一轮PCR后送至广州诺禾生物科技有限公司进行高通量测序,检测靶点是否成功编辑。
1.2.7 MeERF127 基因编辑木薯胁迫后生理特性研究 选取生长状态良好且长势一致的8~10 周的MeERF127 基因编辑木薯组培苗和未转基因的SC8 木薯组培苗(对照,WT),分别用300 mmol/L甘露醇、400 mmol/L NaCl 溶液和4 ℃低温处理48 h。参照苏州科铭生物技术有限公司生理指标测定试剂盒的操作步骤,检测胁迫处理前后各木薯株系叶片的超氧化物歧化酶(SOD)、过氧化物酶(POD)的酶活,丙二醛(MDA)、脯氨酸(Pro)的含量,用酶标仪测定吸光值。每个样品设3 次重复。
1.2.8 超氧阴离子染色 取1.2.7 中干旱、盐和低温胁迫处理前后的MeERF127 基因编辑木薯组培苗和未转基因的SC8 木薯组培苗叶片,洗净后浸没于NBT 染色液(武汉赛维尔生物科技有限公司)中,室温避光染色12 h。取出叶片用纯水洗净后滤纸吸干,置于95%乙醇中40 ℃处理12 h,让叶片中的叶绿素溶于酒精,每隔2~3 h 更换1次95%乙醇。当叶片中的叶绿素被全部去除后取出木薯叶片,用纯水洗净吸干后置于NBT 样本保存液30 min 即可取出拍照。每个样本取6~8 个叶片进行染色。
1.2.9 逆境胁迫相关基因的表达分析 取1.2.7中干旱、盐和低温胁迫处理前后的MeERF127 基因编辑木薯组培苗和未转基因的SC8 木薯组培苗,提取RNA,逆转录成cDNA。以Tublin 为内参基因,对逆境响应基因MeSOD、MeWRKY31进行荧光定量PCR。MeSOD 引物为qMeSOD-F(CGCTATGGAGAAGGGCGATT)和qMeSOD-R(GTCAATAGCCCGAGCGAGAG),MeWRKY31引物为qMeWRKY31-F(TCTCAAGAAACGGTGCCCTC)和qMeWRKY31-R(TTGTGGGCATTAGTGCTGGT)。反应体系:MonAmpTM ChemoHSqPCR Mix 5 μL,DNA 模板1 μL,上/下游引物各0.2 μL,H2O 3.6 μL。反应程序:95 ℃ 10 min;95 ℃ 10 s,58 ℃ 10 s,72 ℃ 30 s,40 个循环;95 ℃ 15 s;60 ℃ 15 s,95 ℃ 15 s 作溶解曲线。使用2–ΔΔCT 法计算相对表达量,每个部位进行3次重复。利用SPSS 软件进行差异显著性分析,并采用Graphpad 软件制图。
2 结果与分析
2.1 MeERF127 基因的克隆和序列结构分析
为克隆木薯MeERF127(Manes.15G066800)基因,本研究提取SC8 木薯总RNA 逆转录得到cDNA 为模板,PCR扩增MeERF127 基因CDS 片段,获得总长为711bp的MeERF127 基因(图1)。
将木薯MeERF127 与其他物种中已鉴定的且同源性较高的AP2/ERF 基因的蛋白序列进行比对,发现其蛋白序列具有高度保守性,均含有1个AP2/ERF 结构域,N 端是YRG 元件,C 端是RAVD 元件,且AP2/ERF 结构域的第14 位和第19 位的氨基酸分别是丙氨酸和天冬氨酸,说明MeERF127 属于ERF 亚家族(图2)。
2.2 MeERF127 的亚细胞定位
将pCAMBIA1300-MeERF127-GFP 重组质粒和pCAMBIA1300-GFP 空载质粒通过农杆菌GV3101转入烟草瞬时表达。激光共聚焦显微镜观察发现pCAMBIA1300-MeERF127-GFP 重组质粒转化的烟草叶片只在细胞核中可见GFP 绿色荧光(图3),说明MeERF127 蛋白定位于细胞核。
2.3转录活性测定
将pGBKT7-MeERF127、pGBKT7(阴性对照)、pGBKT7-p53+pGBKT7-largeT(阳性对照)质粒分别转化酵母AH109,挑选阳性菌斑点板至SD/-Trp 固体培养基上(含10 mg/mL X-α-gal)。结果发现带有目的基因的pGBKT7-MeERF127 和阳性对照pGBKT7-p53+pGBKT7-layqcLzUMUmD9VO8ePaoX4AQ==rgeT 长出蓝色菌斑,而阴性对照pGBKT7 的菌斑未变蓝(图4),说明MeERF127 具有转录活性,是转录因子。
2.4 MeERF127 在不同组织器官的表达模式分析
将植后180d的SC8木薯的脆性愈伤、体胚、块根、块根韧皮部、块根木质部、须根、茎、嫩叶和成熟叶等9 个组织器官进行转录组测序,发现MeERF127 在各组织器官中均有表达,在茎中的表达量最高,其次为嫩叶和块根木质部,在愈伤组织中的表达量最低(图5)。
2.5 MeERF127 在木薯块根发育过程中的表达模式分析
对植后不同发育时期的木薯块根进行表达分析,发现MeERF127 在块根发育前期如形成期(S1)和膨大前期(S2)的表达量较高,在块根发育后期表达水平趋于平缓( 图6 )。推测MeERF127 主要在木薯块根发育的前期发挥作用,促进木薯块根的形成和膨大。
2.6 MeERF127在干旱、盐和低温胁迫下的表达分析
为了研究干旱、盐和低温胁迫是否会影响MeERF127 在木薯中的表达,采用实时荧光定量PCR 分析MeERF127 基因在干旱、盐和低温胁迫下的表达情况。结果如图7 所示,在干旱胁迫48 h后,MeERF127 的表达显著上升;在盐胁迫12 h后,MeERF127 表达量上调至显著水平;在4 ℃低温胁迫后,MeERF127 的表达变化不大,仅在48 h 时稍有下降。
2.7 MeERF127 基因编辑木薯苗的获得与鉴定
根据MeERF127 基因序列信息在CRISPR-P2.0 在线软件上设计MeERF127 的基因编辑靶点构建PCAMBIA1301-Cas9-MeERF127-gRNA 基因编辑载体(图8),转入LBA4404 农杆菌并转化SC8 木薯脆性胚性愈伤组织,诱导出芽成苗后进行潮霉素生根筛选,提取生根阳性苗叶片DNA用Cas9 检测引物进行PCR 分子检测,成功获得带有编辑表达框的阳性株系(图9)。
为检测获得的转基因阳性株系体内发生MeERF127 的成功编辑,分别提取5 个阳性株系基因组DNA 进行Hi-TOM 高通量测序。测序结果如表1 所示,与SC8 对照相比,5 个株系均为缺失22个碱基和3个碱基的杂合突变,且22个碱基缺失的概率远大于3 个碱基缺失,说明成功得到MeERF127基因编辑植株。
2.8 MeERF127 基因编辑木薯在干旱、盐和低温胁迫下的生理特性研究
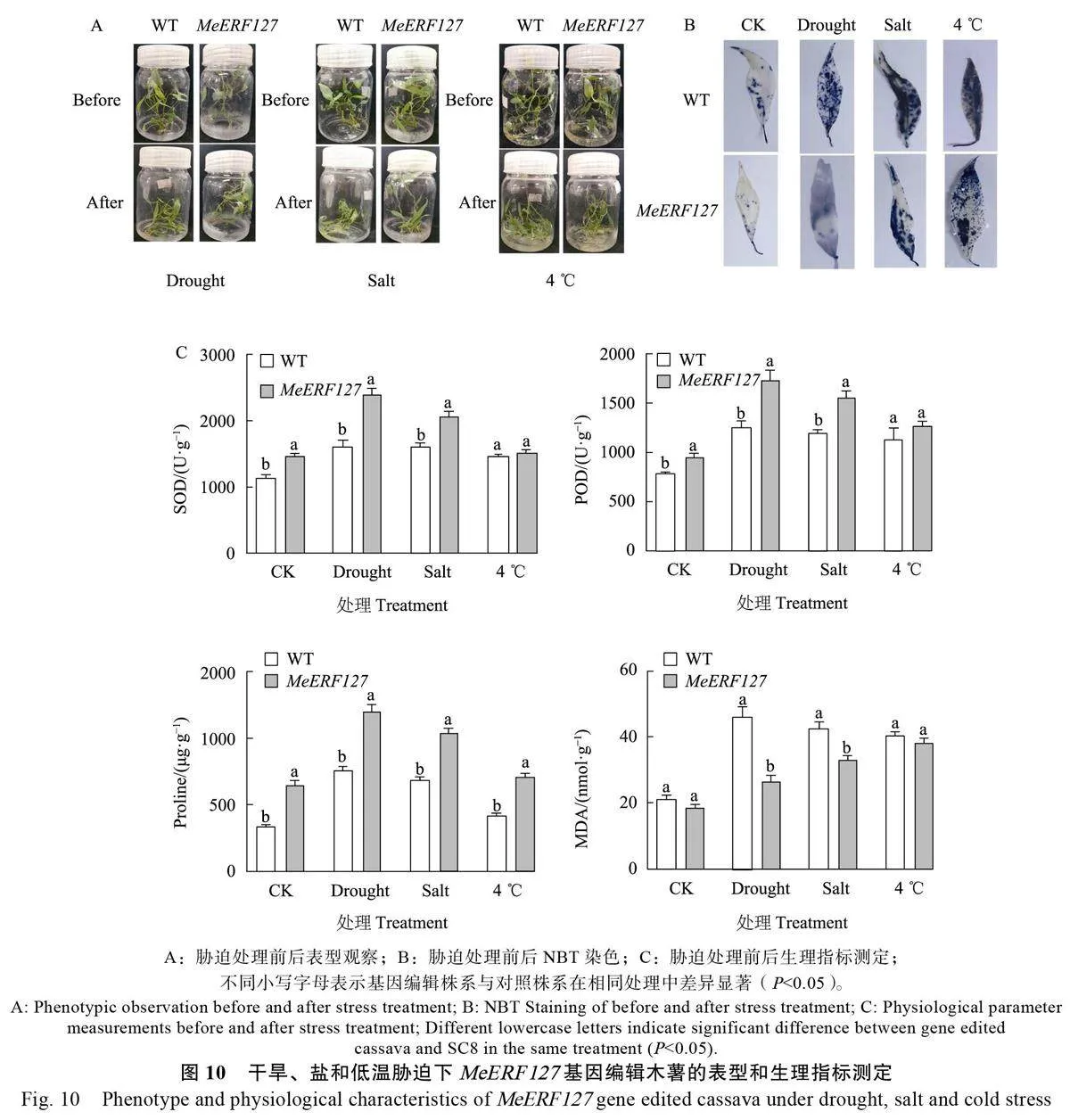
为了研究MeERF127 基因编辑木薯对干旱、盐碱和低温胁迫的耐受性,以SC8 木薯为对照(WT),对MeERF127基因编辑木薯用300 mmol/L 甘露醇、400 mmol/L NaCl 溶液和4 ℃低温处理48 h,观察其表型并测量其生理指标。发现在干旱和盐胁迫后,对照SC8 木薯植株发生明显萎焉,叶片下垂,而MeERF127 基因编辑木薯未出现萎焉;在低温胁迫下,二者均出现萎焉(图10A)。
NBT 染色后植株呈现的蓝色深浅代表植株的超氧阴离子含量,可用来判断植株的受损伤程度,蓝色越深说明超氧阴离子含量越高,植株受损伤度越高。干旱、盐和低温胁迫处理后的木薯叶片的NBT 染色结果显示,干旱和盐处理后,MeERF127基因编辑木薯较对照组叶片颜色更浅,说明MeERF127 基因编辑木薯的超氧阴离子含量更低,受损伤程度更小,可能更抗旱和耐盐。在低温处理后,MeERF127 基因编辑木薯和对照组的颜色深浅差别不大,说明受损伤程度大致相同,MeERF127基因编辑木薯对低温胁迫无响应(图10B)。
进一步测定胁迫前后各株系的生理指标发现(图10C),在正常条件下,MeERF127基因编辑木薯的SOD、POD活性和Pro 含量均显著高于野生型木薯,MDA 含量则差异不显著。在干旱和盐胁迫下,MeERF127 基因编辑木薯的SOD、POD活性和Pro 含量均显著高于野生型木薯,而MDA含量显著低于野生型木薯;在低温胁迫下,基因编辑木薯的SOD、POD酶活和MDA含量与野生型木薯差异不显著。以上结果说明,MeERF127基因编辑木薯对干旱和盐胁迫有一定的耐受性,而对低温胁迫不敏感。
2.9 胁迫响应基因在MeERF127基因编辑木薯中的表达分析
为了进一步阐明MeERF127 基因响应胁迫的具体机制,选取SOD 和WRKY31 这2 个逆境响应基因,分析其在MeERF127 基因编辑木薯受到干旱、盐和低温胁迫后的表达变化情况。结果如图11所示,在干旱和盐胁迫后,胁迫响应基因SOD 和WRKY31在MeERF127 基因编辑木薯中的表达量显著高于野生型;而在低温胁迫时二者差异不显著,表明MeERF127 可能调控这些基因以响应干旱和盐胁迫。综上,基因编辑MeERF127提高了木薯的抗旱性和耐盐性,但对低温胁迫无响应。本研究结果为揭示MeERF127 基因在木薯响应干旱和盐胁迫过程中的调控作用提供理论依据。
3讨论
AP2/ERF 家族是包含AP2/ERF 型DNA 结合域的大型转录因子家族,该结构域首次在拟南芥同源异型基因APETALA2[23]中被发现。木薯ERF家族被鉴定出155 个成员,本研究的MeERF127基因是其中之一。AP2/ERF 家族中的ERF 亚族存在一个AP2/ERF 结构域,其N 端和C 端分别包含YRG 和RAYD 两个保守结构元件,且第14 位和第19 位的氨基酸分别是丙氨酸和天冬氨酸[24],本研究从华南8 号木薯中成功克隆获得的MeERF127 基因的蛋白结构和ERF 亚族一致。ERF 家族作为转录因子,大多定位于细胞核[25],但也有定位于细胞质[26] 和叶绿体[27] 的ERF 基因。本研究发现MeERF127 定位于细胞核,转录活性分析证实其具有转录活性,说明MeERF127 是一个定位于细胞核且具有转录活性的ERF 转录因子。
已有研究表明,AP2/ERF 型转录因子在植物生长发育过程中扮演重要角色。HIROTA 等[28]从拟南芥中鉴定出一个AP2/ERF 家族基因PUCHI,该基因参与侧根的萌生和发育。杨树PtaERF 基因在韧皮部组织中表达,对杨树茎的发育具有潜在作用[29]。本研究中的MeERF127 在茎中的表达最高,在叶片和木质部也有较高的表达。并且在块根形成期高表达,推测MeERF127 可能参与木薯茎、叶和块根的生长发育。
干旱、盐碱和低温等非生物胁迫严重影响作物的生长发育并限制其产量[30]。大量研究表明AP2/ERF 转录因子在植物逆境响应中发挥着重要作用。例如,番茄ERF 蛋白JERF1 通过增加渗透脯氨酸的合成显著提高抗旱性[31]。水稻OsERF922通过破坏Na+/K+稳态和介导ABA 信号通路负调控植物的耐盐性[32]。水稻OsERF101 过表达植株中脯氨酸含量和过氧化物酶活性的增加有助于提高水稻的耐旱性[33]。刚毛柽柳(Tamarix hispida)中ThWRKY2 基因在干旱胁迫下启动乙烯响应因子ThERF1 基因的表达,负向调控包括干旱胁迫在内的非生物胁迫[34]。木薯MeERF5 基因能快速响应干旱、盐和低温胁迫[35]。本研究中MeERF127基因在干旱和盐胁迫处理后表达上调,基因编辑MeERF127 提高了木薯的抗旱性和耐盐性,胁迫响应基因SOD 和WRKY31 在MeERF127 基因编辑木薯中的表达量显著高于野生型,推测MeERF127可能通过调控这些基因来参与调节木薯的抗旱和耐盐能力。本研究为揭示AP2/ERF 基因在木薯响应干旱和盐胁迫过程中的调控作用提供理论依据,具体的调控机制还有待进一步研究。
