牛奶中劳拉西泮的高效液相色谱分析
2024-09-30郑佳妍李昳晴冯瑶韩晓利王庭欣刘峥颢





摘" 要:为了建立检测牛奶中劳拉西泮的高效液相色谱分析方法,用体积分数0.2%甲酸-乙腈溶液离心提取样品中劳拉西泮残留(重复3次),C18固相萃取柱净化,洗脱液经氮气吹干后用体积分数50%甲醇水溶液溶解,0.22 μm滤膜过滤,供高效液相色谱测定.采用安捷伦ZORBAX SB-C18色谱柱(4.6 mm×150 mm,5 μm)为分析柱,V(甲醇)∶V(水)=68∶32为流动相,紫外检测器在230 nm波长处检测.结果表明:劳拉西泮在40~500 μg/mL内线性关系良好,回归方程为y=4.047x-36.11,相关系数为0.999,检出限为0.927 μg/mL,定量限为3.097 μg/mL,牛奶中添加质量浓度分别为70、180、300 μg/mL,添加回收率为81.27%~97.58%,相对标准偏差为1.1%,日内、日间相对标准偏差为1.2%~2.6%.该方法灵敏度高,准确度好,简便,快捷,适用于牛奶中劳拉西泮的检测分析.
关键词:劳拉西泮;牛奶;高效液相色谱法;外标法
中图分类号:O627""" 文献标志码:A""" 文章编号:10001565(2024)05049509
DOI:10.3969/j.issn.10001565.2024.05.006
High performance liquid chromatography analysis of lorazepam in milk
ZHENG Jiayan, LI Yiqing, FENG Yao, HAN Xiaoli, WANG Tingxin, LIU Zhenghao
(College of Quality and Technical Supervision, Hebei University, Baoding 071002, China)
Abstract: In order to establish detection of lorazepam in milk, high performance liquid chromatography (HPLC) method was used, The conditims are: dissolved in 0.2% formic acid, centrifugal extraction of lorazepam residual in acetonitrile solution, repeat 3 times, C18 solid phase extraction column, eluent after nitrogen blow dry with volume fraction of 50% methanol aqueous solution dissolve, 0.22 mu m filter membrane filtration. An Agilent ZORBAX SB-C18 column (4.6 mm×150 mm,5 μm) was used as the analytical column with methanol: water (V/V)=68∶32 as the mobile phase. The detection was carried out at 230 nm with a UV detector.The results showed that: the linear range of lorazepam was 40~500 μg/mL, the regression equation was y=4.047x-36.11, the correlation coefficient was 0.999, the limit of detection was 0.927 μg/mL, the limit of quantification was 3.097 μg/mL, and the additive levels in milk were 70, 180, 300 μg/mL, respectively.The recoveries ranged from 81.27% to 97.58% with relative standard deviations (RSD) of 1.1%, intra-day and inter-day RSD of 1.2% to 2.6%. The method is sensitive, accurate, simple and quick, and suitable for the determination and analysis of lorazepam in milk.
收稿日期:20240605;修回日期:20240625
基金项目:
河北省重点研发计划项目(18275502D)
第一作者:郑佳妍(1997—),女,河北大学在读硕士研究生,主要从事食品安全快速检测技术研究. E-mail:574166857@qq.com
通信作者:王庭欣(1965—),女,河北大学教授,主要从事食品安全快速检测技术研究.E-mail:tingxingwang@126.com
刘峥颢(1973—),女,河北大学副教授,主要从事食品安全及标准化研究.E-mail:sgl1997@126.com
Key words: lorazepam; milk; high performance liquid chromatography; external standard method
劳拉西泮是一种具有抗焦虑、抗癫痫、镇静、催眠作用的苯二氮卓类药物,也被称作软毒品,与其他镇静药物相比,起效迅速、作用时间长,是较为常用的镇静剂类药物,可应用于抑郁症和焦虑症的治疗[1-3].服用小剂量劳拉西泮后可能会出现头晕、嗜睡、乏力等症状,大剂量使用该药品可能会出现呼吸困难、呼吸道堵塞等问题,易成瘾,危害人类健康[4-6].该药物常被饲料商违法添加到奶牛饲料中,使奶牛多睡少动,减少奶牛体内营养物质的消耗,提高奶牛的产奶量,同时劳拉西泮也会残留在牛奶中造成兽药残留问题[7].目前对于劳拉西泮的检测方法有高效液相色谱法[8]、气相色谱法[9]、液相色谱-串联质谱法[10]、气相色谱-串联质谱法[11]等,但无论是哪种方法,检测样品基本是人血浆或尿液[11-14].对于食品类样品中的劳拉西泮的检测方法鲜见报道,因此,建立快捷、简便、高效的检测牛奶中劳拉西泮的方法,具有实际应用价值.
1" 仪器与材料
1.1" 仪器
高效液相色谱仪(1260 Infinity Ⅱ,Agilent Technologies);冷冻离心机(FC5718R,奥豪斯仪器有限公司);超声清洗机(SB25-12DTD,宁波新芝生物科技公司);氮吹仪(TTL-DC型氮吹仪,北京同泰联科技公司);C18固相萃取柱(江苏杰岛高新材料科技公司).
1.2" 材料
甲醇、乙腈(色谱纯,天津科密欧股份有限公司);劳拉西泮(1.0 mg/g,湖南洞庭药业公司);脱脂牛奶(200 mL,广州杰钬公司).
1.3" 溶液配制
1.3.1" 标准溶液的配制
500 μg/mL标准储备液:准确称取0.050 0 g劳拉西泮,甲醇溶液定容至100.0 mL,封口膜塑封置于2~8 ℃中保存.
标准工作液:体积分数50%甲醇水溶液作为稀释溶剂,分别得到质量浓度为40、60、70、80、100、180、200、300、500 μg/mL的标准工作液.
1.3.2" 加标试样溶液的配制
分别配制劳拉西泮质量浓度为70、180、300 μg/mL的牛奶样品.
1.3.3" 其他溶液的配制
体积分数0.2%甲酸-乙腈溶液,体积分数20%、50%甲醇水溶液.
1.4" 数据处理
应用Minitab17分析软件进行数据处理.
2" 方法
2.1" 色谱条件
色谱柱:ZORBAX SB-C18(4.6 mm×150 mm,5 μm);柱温:30 ℃;进样器温度:4 ℃;流动相:V(甲醇)∶V(水)=68∶32;流速:1.0 mL/min;进样量:20.0 μL;检测波长:230 nm.
2.2" 流动相选择
流动相A为V(体积分数0.1%甲酸水溶液)∶V(体积分数0.1%甲酸-乙腈溶液)=1∶1,流动相B为V(甲醇)∶V(水)=68∶32.将标准工作液分别在流动相A、B下进样,对2种流动相下的色谱图、峰面积进行比较,确定最优的流动相.
2.3" 稀释溶剂选择
2种稀释溶剂,分别为体积分数50%甲醇水溶液和纯甲醇.
用稀释溶剂将标准储备液稀释成80、200 μg/mL的标准工作液,每个质量浓度进样2次,观察比较2种稀释溶剂的色谱图及峰面积,确定最优的稀释溶剂.
2.4" 出峰时间、检测时间的确定
将标准工作液(质量浓度为2、40、80 μg/mL)按质量浓度从低到高依次进样,观察出峰时间及峰面积的变化,确定出峰时间及检测时间.
2.5" 样品前处理
2.0 mL脱脂牛奶中加入2.0 mL体积分数0.2%甲酸-乙腈溶液,旋涡震荡1 min,在8 000 r/min下离心5 min,取上清液,重复操作2次,合并上清液.上清液在8 000 r/min下再次离心5 min,取上清液[15].于50 ℃水浴条件下氮气吹干.加入1 mL体积分数20%甲醇水溶液旋涡溶解残留物,备用.
依次用5.0 mL水和5.0 mL甲醇活化C18固相萃取柱,取上述备用液过柱,控制流速(每3~4 s 1滴),用5.0 mL水淋洗,加压挤干,用5.0 mL甲醇洗脱,收集洗脱液.
洗脱液于50 ℃水浴条件下氮气吹干,用1.0 mL体积分数50%甲醇水溶液溶解残余物,0.22 μm滤膜过滤,供高效液相色谱测定.
2.6" 实际样品检测
经过样品前处理的脱脂牛奶在已优化的实验条件下进样,做平行实验.
2.7" 标准曲线
2.7.1" 线性范围的确定
将标准工作液(2、20、40、80、100、200、300、500 μg/mL)按质量浓度从低到高依次进样,观察峰面积变化,确定标准工作液的线性范围.
2.7.2" 标准曲线绘制
将标准工作液(40、60、80、100、200、300、500 μg/mL)在2.1色谱条件下从低到高质量浓度进样检测,记录各质量浓度下劳拉西泮的色谱峰面积.以标准品质量浓度为横坐标(μg/mL),标准品峰面积为纵坐标(mAU·s),利用Minitab17分析软件进行计算拟合,建立标准曲线,得到线性回归方程和相关系数.
2.8" 检出限和定量限
当S/N=3时,目标物质量浓度为劳拉西泮的最低检出限;当S/N=10时,目标物质量浓度为劳拉西泮的最低定量限[16].
2.9" 回收率
70、180、300 μg/mL的3份加标牛奶样品和1份空白牛奶样品在上述色谱条件下从低到高质量浓度上机检测,做平行实验,记录各质量浓度的峰面积,将峰面积代入回归方程计算待测质量浓度、各质量浓度回收率以及同一质量浓度下的平均回收率,考察实验准确度.
劳拉西泮的回收率=(加标样品的测定值-空白样品的测定值)/加标量×100%.
2.10" 精密度
2.10.1" 方法精密度
300 μg/mL的牛奶样品重复进样6次,记录每次的峰面积以及保留时间,计算峰面积的相对标准偏差,考察方法的精密度.
2.10.2" 仪器精密度
1)日内精密度
在上述2.1色谱条件下,100 μg/mL的标准工作液在同一天内的8、10、12、14、16、18 h时分别进样1次,记录峰面积及保留时间,计算实际质量浓度及相对标准偏差RSD,检测仪器日内精密度.
2)日间精密度
在上述2.1色谱条件下,100 μg/mL的标准工作液分别在周一、周三、周五的上午9点进样1次,记录峰面积及保留时间,计算实际质量浓度及相对标准偏差RSD,检测仪器日间精密度.
3" 结果与讨论
3.1" 色谱条件的优化
3.1.1" 流动相的选择
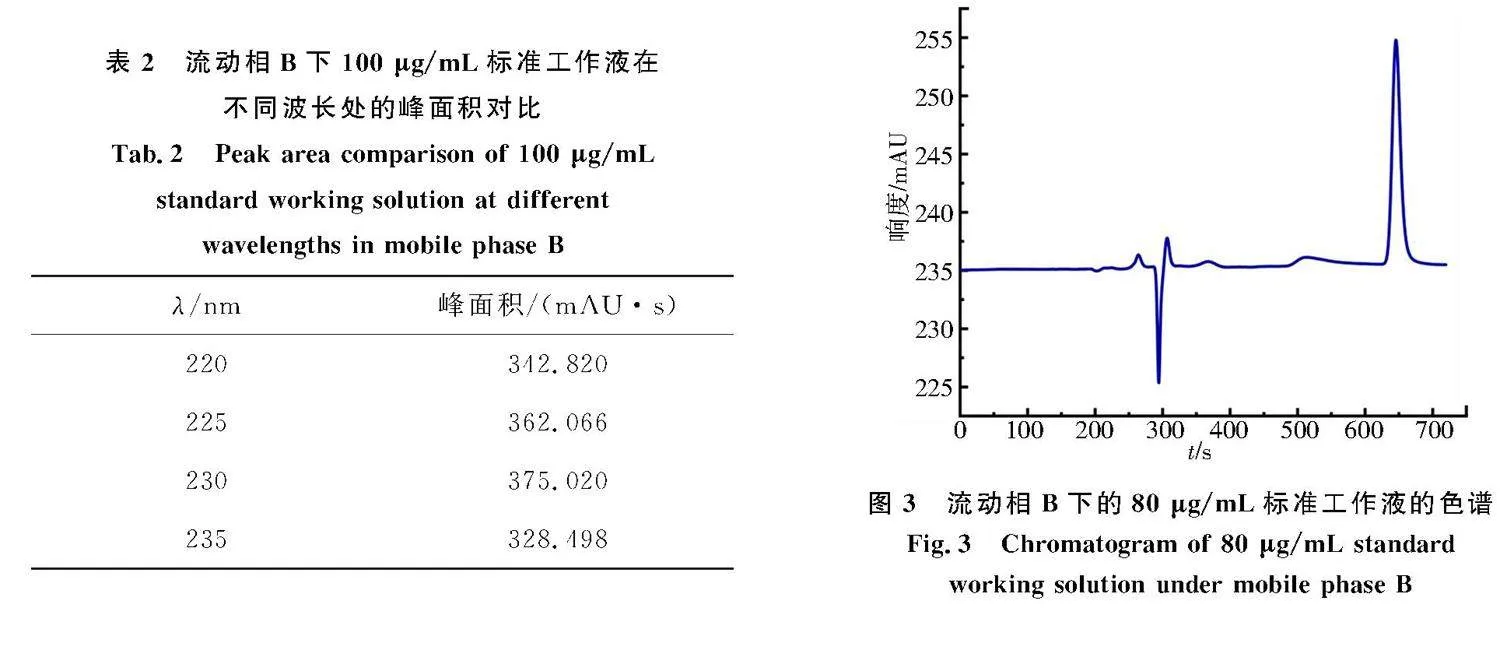
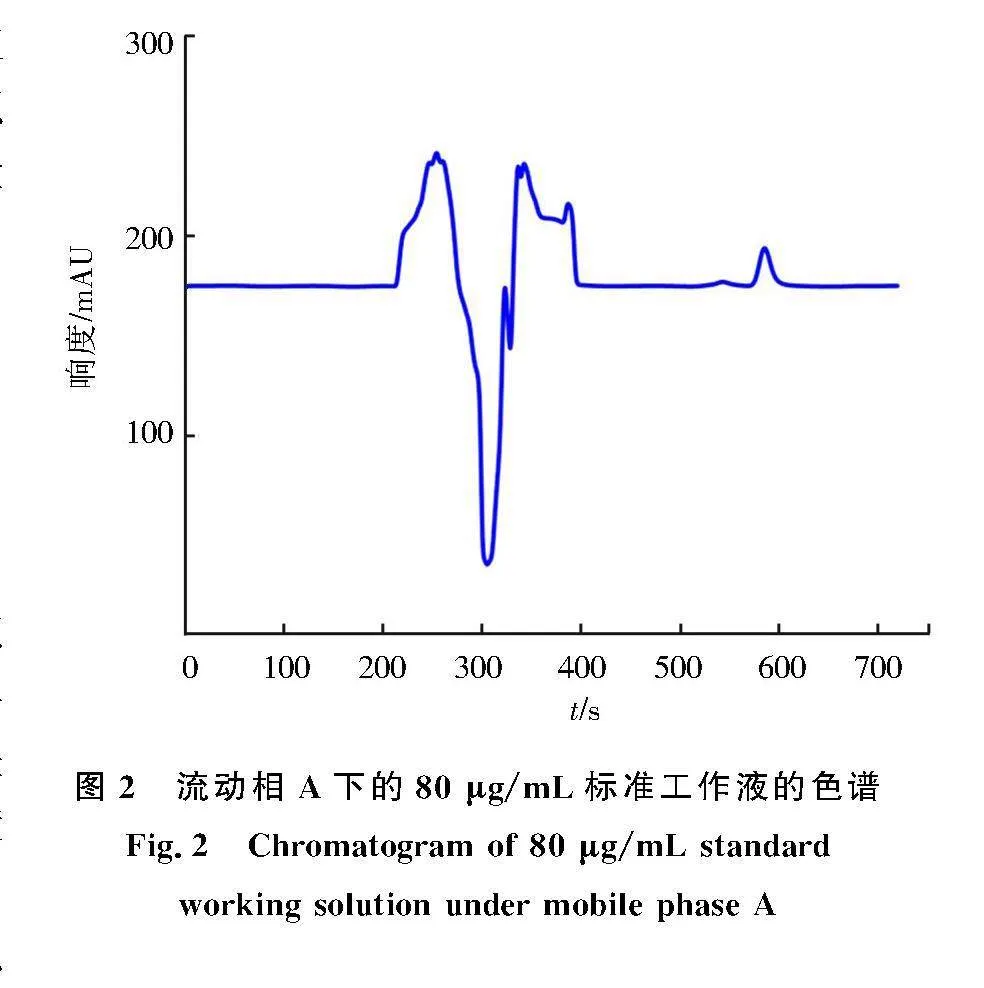
分析结果的准确度与流动相的选择密切相关.在流动相A下,将80 μg/mL标准工作液进样分析.劳拉西泮的出峰时间在9.5~10.5 min,出峰效果良好,回归方程为y=3.883x-41.05,其中x为标准工作液的质量浓度(μg/mL),y为标准工作液所对应的峰面积(mAU·s),相关系数高达0.998,线性关系良好.但是溶剂峰却杂乱无章,有明显倒峰,且峰面积巨大,如图2所示.
表1为流动相A下60 μg/mL标准工作液在不同波长处的峰面积.理论上,由于230 nm是最大检测波长,在波长为220、225 nm时,药品峰的峰面积应小于波长为230 nm时的峰面积,但实验结果与其相悖,考虑到在此流动相下检测波长与峰面积的理论关系变化不明显以及溶剂峰混乱、药品峰不规则等原因,流动相A视为备用选项.
在流动相B下,将100 μg/mL标准工作液进样分析.出峰时间为10.5~11.5 min,由此可以看出改变流动相,出峰时间会略微改变.此时出峰效果良好,基线平稳,能明显观察到在230 nm处,检测到的峰面积最大,而且当波长增大或减小时,劳拉西泮的峰面积都适当增大减小,如表2所示.图3为液动相B下的80 μg/mL标准工作液的色谱.见图3可知,溶剂峰仅有微小倒峰及1个很小的正峰,因此选用V(甲醇)∶V(水)=68∶32为流动相.
3.1.2" 稀释溶剂的选择
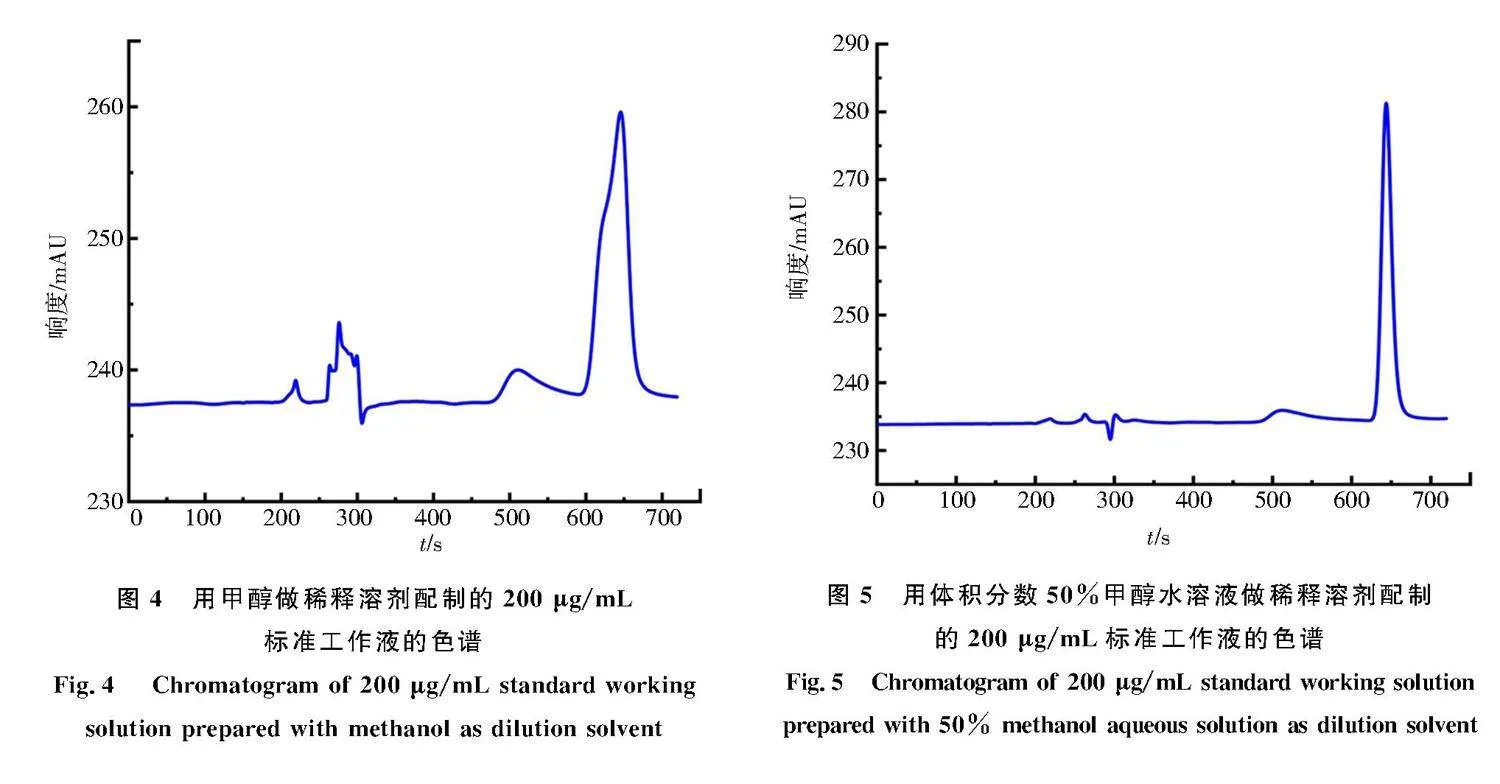
一般会选用流动相做稀释溶剂,这样可以提高分离速度,减少稀释溶剂对待测物的影响,使峰形尖锐、对称,基线更加平稳,减少溶剂峰.
用甲醇作稀释溶剂配制80、200 μg/mL的标准工作液,每个质量浓度进样2次,几次进样检测的结果表明:以甲醇做稀释溶剂时,不仅会出现双肩峰,还有出峰杂乱、基线不稳、溶剂峰以及杂质峰过多等问题(图4),影响实验结果及精密度.当以体积分数50%甲醇水溶液做稀释溶剂时,基线平稳,峰形对称,溶剂峰较少,如图5所示.因此排除以甲醇做稀释溶剂的方法,决定以体积分数50%甲醇水溶液做稀释溶剂,来配制标准工作液.
3.1.3" 出峰时间的确定
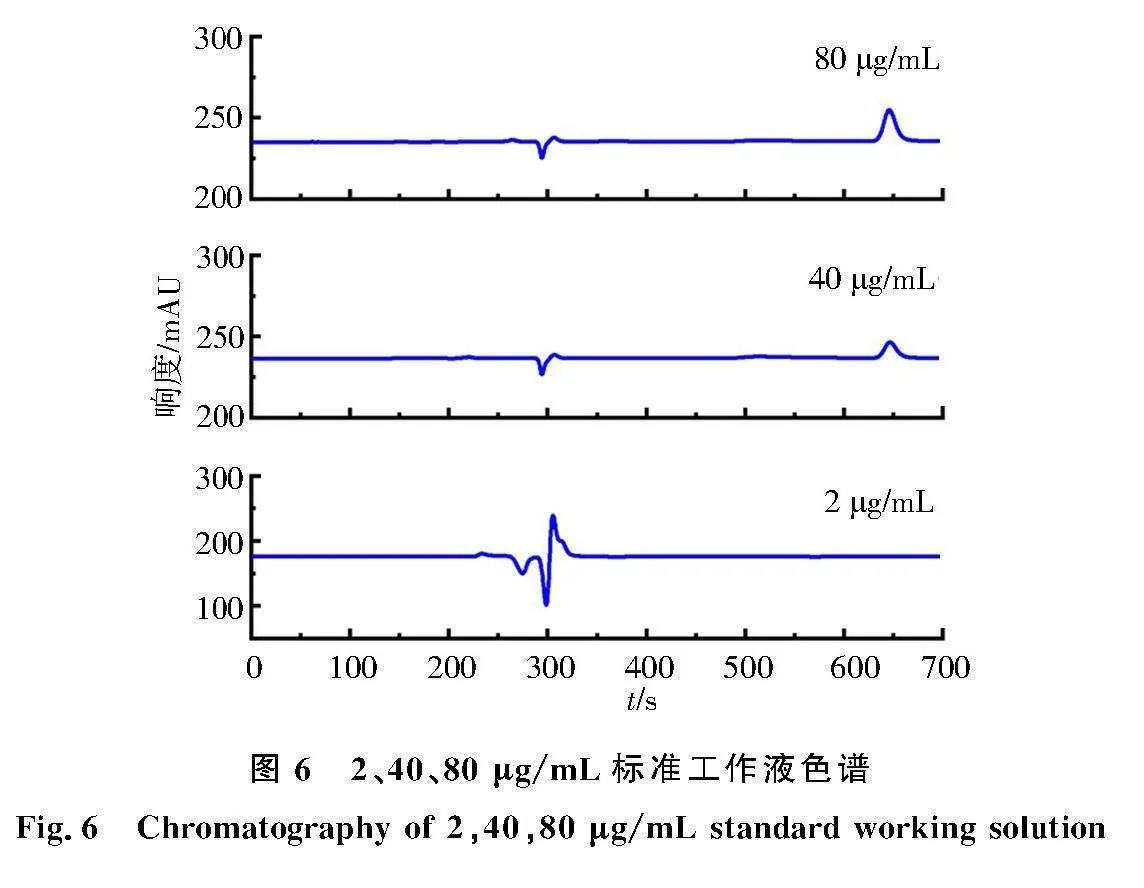
将2 μg/mL的标准工作液进样,检测时间设置为20~30 min,发现除溶剂峰外,几乎没有出峰,如图6所示.随后进样40 μg/mL的标准工作液,观察到1个小峰,出峰时间为10.5~11.5 min;80 μg/mL的标准工作液进样,观察到在10.5~11.5 min内的峰面积增大,其余峰面积几乎不变.因此可以确定最低出峰质量浓度在2~40 μg/mL、出峰时间为10.5~11.5 min、检测时间设定为12 min.
3.2" 样品前处理优化
此方法与GB 29681—2013食品安全国家标准[17]中的样品前处理方法相比,所需设备简单,处理过程简便、快捷,对药品耗费量较少,大大缩短了样品处理时间.牛奶中存在大量蛋白质和脂肪,C18固相萃取柱常用于处理牛奶等类似基质的样品,经处理后,镇静剂的提取率可达80%以上[18].
3.3" 实际样品检测
经检测,脱脂牛奶中无劳拉西泮.
3.4" 标准曲线
3.4.1" 线性范围的确定
对比2、20、40、80、100、200、300、500 μg/mL标准工作液的峰面积,明显观察到2 μg/mL没有出样品峰,如图6所示.20 μg/mL样品峰极小,如图7所示.在40~500 μg/mL内劳拉西泮的出峰效果良好,500 μg/mL标准工作液色谱图见图8.据此配制质量浓度为40、60、80、100、200、300、500 μg/mL的标准工作液.
3.4.2" 标准曲线的绘制
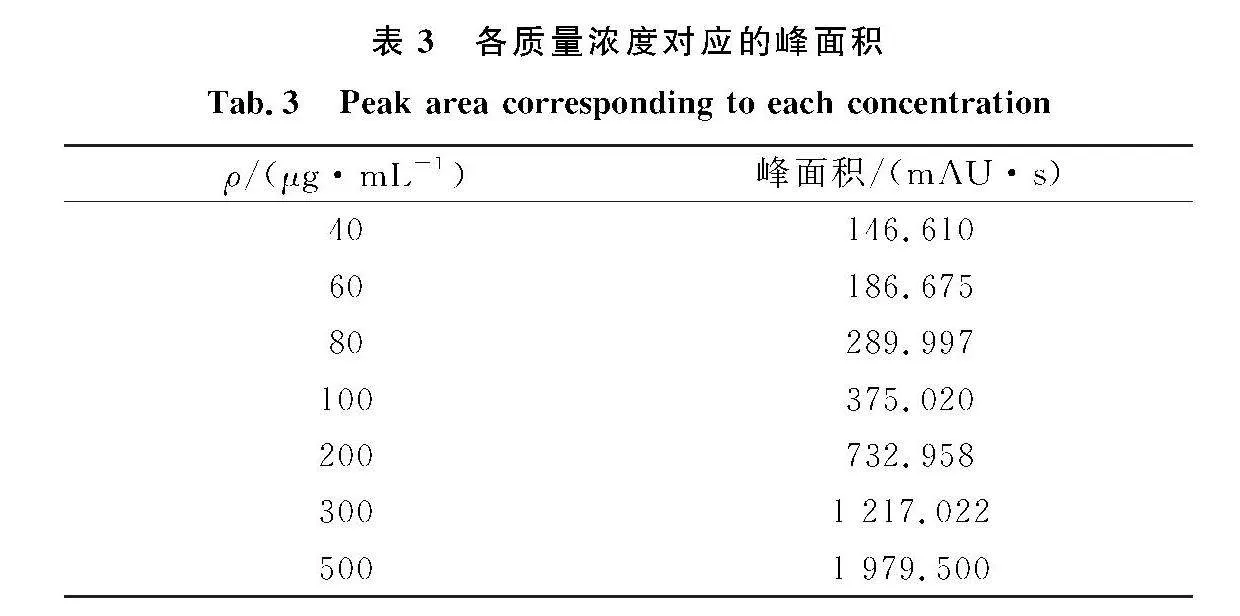
将标准工作液按质量浓度从低到高进样得到的峰面积数据如表3所示.根据质量浓度和各质量浓度所对应的峰面积进行拟合回归,得到线性回归方程为y=4.047x-36.11,相关系数为0.999,线性关系良好.
3.5" 检出限和定量限
用仪器计算S/N=3时,样品中劳拉西泮的质量浓度为0.927 μg/mL,是最低检出限;当S/N=10时,劳拉西泮的质量浓度为3.091 μg/mL,是最低定量限.
3.6" 回收率
实验所得具体数据如表4所示.结果表明回收率为81.27%~97.58%,该方法具有良好的准确度.空白牛奶样品以及质量浓度为300 μg/mL加标牛奶样品的色谱图分别如图9、10所示,在本实验所用的脱脂牛奶中并未检测出劳拉西泮.
3.7" 精密度
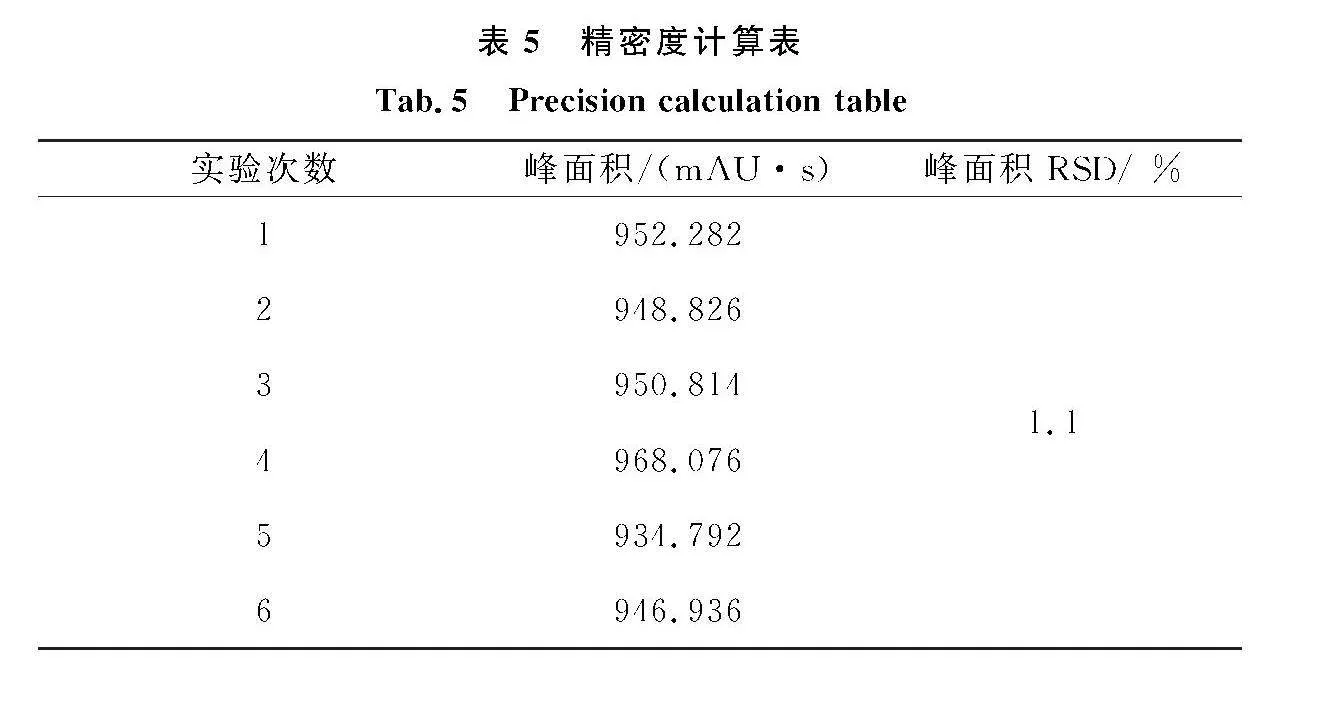
3.7.1" 方法精密度
将300 μg/mL的加标牛奶重复进样得到的峰面积数据如表5所示,峰面积RSD为1.1%.此数据表明该方法的精密度良好.
3.7.2" 仪器精密度
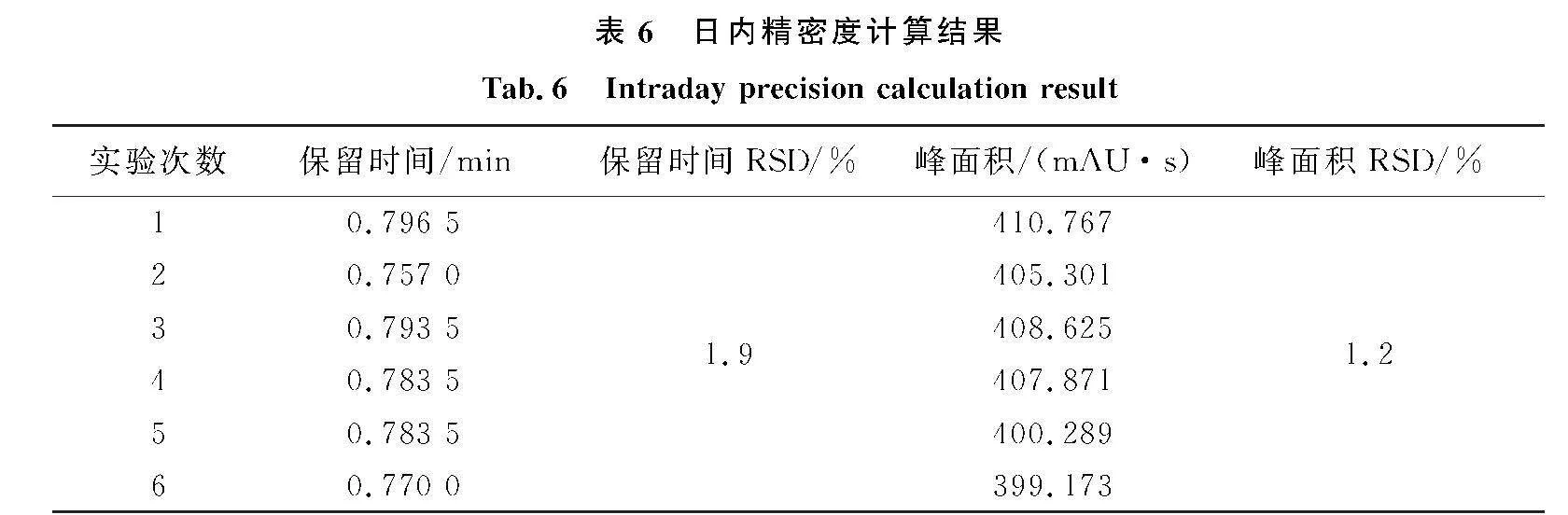
1)日内精密度
按2.10.2中的方法进行实验并计算日内精密度,具体数据如表6所示,结果表明100 μg/mL标准工作液保留时间的RSD为1.9%,峰面积的RSD为1.2%,此数据表明标准工作液日内较稳定,该仪器的精密度较好,实验结果准确可信.
2)日间精密度
按2.10.2中的方法进行实验并计算日间精密度,具体数据如表7所示,保留时间的RSD为1.2%,峰面积的RSD为2.6%,符合要求,这表明该仪器的日间精密度较好.
4" 讨论
本文建立的高效液相色谱法检测牛奶中的劳拉西泮残留与李贤良等[7]建立的液-质联用方法相比,方法相对偏差低、稳定.虽然检出限不及液质联用方法,但液质联用方法较之纯液相方法成本高昂,检测时间长,同时对操作人员有较高的专业知识要求,不适用于基层检测机构使用.
本文通过对高效液相色谱的色谱条件、样品前处理的优化、流动相、固相萃取柱、稀释溶剂的选择等进行探讨,确定了以V(甲醇)∶V(水)=68∶32为流动相,以体积分数50%甲醇水溶液作为稀释溶剂来配制标准工作液,以230 nm作为检测波长,用C18固相萃取柱来净化牛奶样品,以体积分数0.2%甲酸-乙腈溶液萃取药品,建立了牛奶中劳拉西泮的高效液相色谱检测分析方法.结果表明,在40~500 μg/mL内劳拉西泮具有较好的线性和相关系数.在3个质量浓度的加标实验中(70、180、300 μg/mL)劳拉西泮回收率为81.27%~97.58%,峰面积的RSD为1.1%;在日内精密度实验中保留时间的RSD为1.9%,峰面积RSD为1.2%;在日间精密度实验中,保留时间的RSD为1.2%,峰面积的RSD为2.6%,说明本实验的回收率和精密度良好.该方法具有成本较低、操作简便等优点,具有一定的实用性,为牛奶中劳拉西泮残留的检测提供了技术支持.
参" 考" 文" 献:
[1]" 李瑛.劳拉西泮的现状及前景展望[J].中国医药导刊,2000(6):30-31.
[2]" 洪二郎,常凤坤,李德生,等.劳拉西泮对广泛性焦虑症患者的临床效果及QOL评分的影响[J].中国医学创新,2020,17(6):47-51.DOI: 10.3969/j.issn.1974-4985.2020.06.012.
[3]" 尹婕,金方方,南楠,等.劳拉西泮片的关键质量属性研究[J].药物评价研究,2018,41(9):1630-1639.DOI: 10.7501/j.issn.1674-6376.2018.09.012.
[4]" MICHELINI S, CASSANO GB, FRARE F, et al. Long-term use of benzodiazepines: tolerance, dependence and clinical problems in anxiety and mood disorders[J]. Pharmacopsychiatry,1996, 29(4):127-134.DOI: 10.1055/S-2007-979558.
[5]" AMORE M,DANDREA M,FAGIOLINI A, et al. Treatment of agitation with lorazepam in clinical practice: A systematic review[J]. Frontiers in Psychiatry, 2021,12: 628965.DOI: 10.3389/fpsyt.2021.628965.
[6]" 向小军,刘铁榜,王传跃,等.苯二氮卓类药物的不良反应及处理[J].中国药物滥用防治杂志,2017,23(5):256-260.DOI: 10.15900/j.cnki.zylf1995.2017.05.003.
[7]" 李贤良,严爱花,郗存显,等.液相色谱-串联质谱法同时检测牛奶中20种苯二氮卓类药物残留[J].分析试验室,2013,32(4):42-47.
[8]" 孙爱华,胡文辉.HPLC法测定劳拉西泮片有关物质的含量[J].安徽医药,2016,20(5):866-869.DOI: 10.3969/j.issn.1009-6469.2016.05.014.
[9]" LILLSUNDE P, SEPPL T. Simultaneous screening and quantitative analysis of benzodiazepines by dual-channel gas chromatography using electron-capture and nitrogen-phosphorus detection[J]. Journal of chromatography,1990,533:97-110.DOI: 10.1016/S0378-4347100782190-8.
[10]" 何晓明,李丽,余鹏飞,等.磁性石墨烯固相萃取-高效液相色谱-串联质谱法测定家畜尿液中10种苯二氮卓类药物残留量[J].理化检验(化学分册),2019,55(1):4-9.DOI: 10.11973/1hjy-hx201901002.
[11]" LVAREZ-FREIRE I, BRUNETTI P, CABARCOS-FERNNDEZ P, et al. Determination of benzodiazepines in pericardial fluid by gas chromatography–mass spectrometry[J]. J Pharm Biomed Anal,2018,159:45-52.DOI: 10.1016/j.jpba.2018.06.039.
[12]" 于交远,王瑞花,常靖,等.液液萃取法分析血液中劳拉西泮[J].刑事技术,2020,45(4):383-386.DOI: 10.16467/j.1008-3650.2020.04.011.
[13]" 刘金磊,顾捷,陈丽琴,等.超分子溶剂萃取-气相色谱-串联质谱法检测尿液中苯二氮卓草类药物[J].法医学杂志,2021,37(01):26-32.DOI: 10.12116/j.issn.1004-5619.2020.300402.
[14]" 王朝虹,张琳,赵蒙,等.超高效液相色谱-质谱定量测定全血中的13种苯二氮卓类安眠镇静药物[J].刑事技术,2016,41(1):46-49.
[15]" 严丽娟,张洁,潘晨松,等.超高效液相色谱-飞行时间质谱法高通量筛查乳制品中20种镇静剂[J].分析化学,2013,41(1):31-35.DOI: 10.3724/SP.J.1096.2013.20555.
[16]" 李超.毛发中两种合成大麻素及其代谢物的检验方法研究[D].北京:中国人民公安大学,2020.
[17]" 中华人民共和国农业部,中华人民共和国国家卫生和计划生育委员会.食品安全国家标准:GB 29681—2013[S].北京:中国标准出版社,2013-09-16.
[18]" 张群,吴南村,马晨,等.固相萃取-气相色谱质谱测定牛奶中氯氟氰菊酯和氯氰菊酯残留[J].中国兽医杂志,2020,56(3):122-127.
(责任编辑:梁俊红)
