例析元素电负性的考查
2024-09-25沈妍燕

电负性是理解化学键和化合物性质的重要概念,是元素的原子在化合物中吸引电子能力的标度,元素的电负性越大,表示其原子在化合物中吸引电子的能力越强.在化合物中,电子对偏向电负性更大的原子.
1 电负性与元素非金属性的关系
电负性的强弱反映出元素原子的原子核对电子吸引能力的相对大小.同周期元素从左到右,原子半径减小、核电荷数增大,原子核对电子吸引能力增强,因此同周期元素从左到右电负性逐渐增大;同主族元素从上到下电负性逐渐减小.对于不同周期也不同主族的元素,位于左上角与右下角的2种元素比较,右下角原子的电负性较强.此外,电负性不大于1.8的元素都是金属元素,电负性大于1.8的元素绝大多数是非金属元素.
例1 表1是M、N、P、Q、E5种短周期元素的某些性质,下列判断正确的是( ).
A.Q、E的非金属性:Q>E
B.与元素N 同周期且第一电离能最小的元素的单质和E单质均能与H2O 发生置换反应
C.元素N、P之间不可能形成化合物
D.P、Q、E的氢化物的稳定性:E>P>Q
分析 由表1知,M 为C元素,N 为S元素,P为Cl元素,Q 为O 元素,E 为F元素.金属性F>O,选项A 错误.Na能与H2O 发生置换反应生成NaOH 和H2,选项B正确.S的最外层有6个电子,Cl的最外层有7个电子,它们之间可形成S2Cl2、SCl2 等化合物,选项C错误.P、Q、E的氢化物分别为HCl、H2O、HF,稳定性:HF>H2O>HCl,选项D错误.答案为B.
点评 解答本题的关键是先根据最低化合价确定元素在周期表中族的序数(最低化合价=主族序数-8),再根据电负性相对大小判断出具体元素.
2 电负性对化学键类型、物质结构的影响
成键元素电负性的相对大小对化学键类型、化合物结构有直接的影响,具体情况如下.1)当成键两元素电负性差值大于17时,形成的化学键为离子键,相应的化合物为离子化合物;当差值小于17时多为共价键.2)形成共价键的两元素,电负性差值越大,共价键的极性越强.
例2 已知X、Y、Z、W 是同周期的4种主族元素,其电负性:X>Y>18>Z>W,下列说法正确的是( ).
A.元素的第Ⅰ电离能:X一定比Y的大
B.非金属性最强的是W
C.X与W 形成的化合物可能是离子化合物
D.最高价氧化物对应的水化物均是酸
分析 由电负性的关系可知,4种元素在周期表中的顺序(从左到右)为W、Z、Y、X,若X是第ⅥA 族元素而Y是第ⅤA 族元素,则第一电离能的关系是X<Y,选项A 错误.金属性最强的是W,非金属性最强的是X,选项B、D错误,选项C正确.答案为C.
点评 同一周期元素从左到右电负性逐渐增大;电负性越大,元素的非金属性越强.
3 电负性大小对物质性质的影响
1)对物质酸性的影响:元素的电负性越大,原子吸引键合电子能力越强,对于能电离出H+ 的物质来说,凡能导致物质中O—H 键的极性增强的诱因,均会导致物质更容易电离出H+ ,对应的酸性增强.
2)对物质酸性强弱的影响:对于组成为(HO)mROn 的含氧酸来说,当R相同时,n 值越大,R的正电性越高,导致R—O—H 中氧的电子越偏向R,进一步导致O—H 键键合电子更移向O,即导致O—H键极性增强,更易电离出H+ ,即(HO)mROn酸性越强.
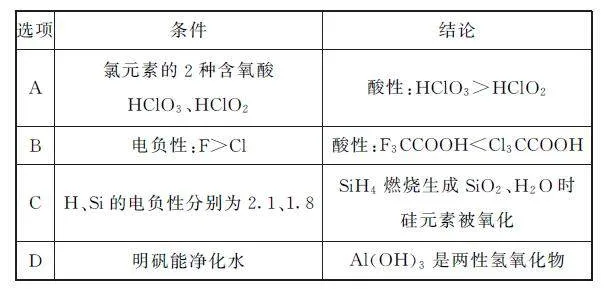
例3 由下列条件得出的结论正确的是( )
分析 HClO3、HClO2 可分别表示为HOClO2、HOClO,故前者中氯元素价态更高,O—H 键极性更强,相应酸的酸性更强,选项A 正确.电负性越大,吸电子能力越强,更容易电离出氢离子,酸性越强,故酸性:F3CCOOH>Cl3CCOOH,选项B错误.成键时,电负性较强的元素显负价,故SiH4 中氢元素显-1价,Si显+4价,因此燃烧过程中被氧化的是H 元素,选项C错误.明矾能净化水是因为铝离子水解生成氢氧化铝胶体,表面积大,能吸附水中悬浮的杂质,与Al(OH)3是两性氢氧化物无关,选项D错误.答案为A.
点评 成键元素电负性差值越大,在溶液中越易发生断裂,从而导致物质相应性质的强弱发生变化.
4 电负性与共价键的键角关系
对于组成为ABn 型的不同物质来说,当不同物质中的A 元素位于同一主族时,A 元素的电负性越大,键角越大;当各物质的A 原子种类相同时,配位原子B的电负性越大,键角越小.
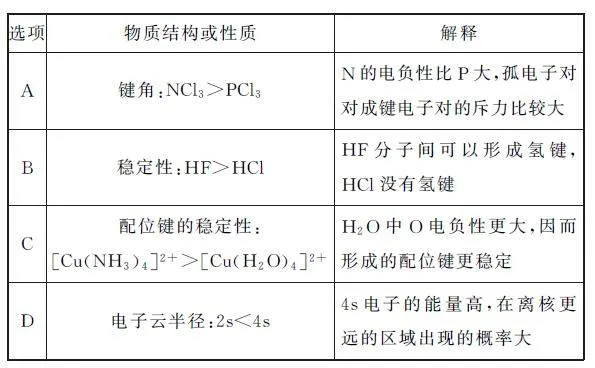
例4 下列关于物质结构或性质及解释有错误的是( ).
分析 由于N 的电负性大于P的,所以NCl3 的价电子对离中心原子更近,键角较大,选项A 不符合题意.F原子半径小于Cl,H—F 键键长小于H—Cl键键长,则H—F键能较大,HF比HCl稳定,与氢键无关,选项B符合题意.H2O 中O 的电负性大于NH3中N 的电负性,则O 提供孤电子对的能力小于NH3中N 提供孤电子对的能力,NH3 形成的配位键更稳定,选项C不符合题意.同种能级,能层越高,对应能级能量越高,能级电子云半径越大,4s电子的能量高,在离核更远的区域出现的概率大,则电子云半径:2s<4s,选项D不符合题意.答案为B.
点评 对于结构相似的分子,键角大小与中心原子的电负性有关,电负性越大,价电子对离中心原子越近,键角较大.
5 电负性与物质的性质
电负性可用于衡量元素非金属性的强弱,因此电负性的相对大小会对组成物质的各元素化合价、物质的化学性质等产生影响.
例5 根据元素的电负性,写出下列反应的化学方程式.
(1)已知电负性:Cl>H>Si,SiHCl3 在浓NaOH溶液中发生反应的化学方程式为____.
(2)硼氢化钠(NaBH4)是研究最广泛的储氢材料之一.B的电负性为20,H 的电负性为21.向NaBH4水溶液中加入催化剂Ru/NGR 后,能够迅速反应.写出该反应的化学方程式: ____.
分析 (1)由电负性:Cl>H>Si可知,SiHCl3 中Cl元素为-1价,H 元素为-1价,Si元素为+4价.SiHCl3 与浓NaOH 溶液反应的化学方程式为SiHCl3+5NaOH=Na2SiO3+3NaCl+H2↑+2H2O.
(2)H 的电负性大于B的电负性,因此NaBH4 中B为+3价,H 为-1价,向NaBH4 水溶液中加入催化剂Ru/NGR后,能够迅速发生H 的归中反应,化学方程式为NaBH4+2H2O Ru/NGR→NaBO2+4H2↑.
点评 化合物中,电负性最大的元素一定显负价;电负性最小的元素一定显正价.
总之,电负性的大小既能体现相应元素金属性、非金属性的相对强弱,同时也会对所形成的化学键类型、化合物结构与性质产生重大影响.在学习过程中,我们要充分认识、理解上述关系并能利用这种关系解决实际问题.
(完)
