术前焦虑对肝癌患者麻醉苏醒与术后恢复的影响
2024-07-13朱文智邱倩谭宏宇
朱文智 邱倩 谭宏宇
作者单位:北京大学肿瘤医院暨北京市肿瘤防治研究所麻醉科,恶性肿瘤发病机制及转化研究教育部重点实验室(邮编100142)
作者简介:朱文智(1979),男,副主任医师,主要从事麻醉与疼痛方面研究。E-mail:sunseter@yeah.net
△通信作者 E-mail:maggitan@yeah.net
摘要:目的 探讨术前焦虑对肝脏肿瘤切除手术患者术后苏醒和短期预后的影响。方法 选择行择期开腹肝癌切除术的患者96例,美国麻醉师协会(ASA)Ⅰ—Ⅱ级,据汉密尔顿焦虑量表(HAMA)将患者分为对照组41例(HAMA<7分)和焦虑组55例(HAMA≥7分)。记录患者入手术室心率(HR)、平均动脉压(MAP)、手术时间、术中出血量、术中补液量、术中瑞芬太尼消耗量;记录苏醒时间,拔管时间,苏醒期躁动(EA)评分,拔出气管导管后5 min(T1),术后6 h(T2)、12 h(T3)、24 h(T4)、48 h(T5)静息及活动疼痛视觉模拟(VAS)评分,以及患者自控静脉镇痛(PCIA)累计有效按压次数、镇痛药物补救情况、术后胃肠道反应情况、术后排气时间、术后5 d血清丙氨酸转氨酶(ALT)与天冬氨酸转氨酶(AST)值和术后住院天数。结果 与对照组相比,焦虑组入手术室HR和MAP增高,苏醒时间、拔管时间延长;术中瑞芬太尼消耗量,EA评分,T1、T2、T3静息及活动VAS评分,T4活动VAS评分,PCIA按压次数,镇痛药物补救次数均增加,术后胃肠道反应的发生率升高,术后下床时间、排气时间、进食时间和术后住院天数延长(P<0.05)。结论 术前焦虑不利于肝脏肿瘤切除术患者麻醉苏醒和短期预后。
关键词:癌,肝细胞;焦虑;麻醉苏醒延迟;手术后并发症
中图分类号:R749.72,R735.7文献标志码:ADOI:10.11958/20231376
The impact of preoperative anxiety on anesthesia and postoperative recovery in
patients with liver cancer
ZHU Wenzhi, QIU Qian, TAN Hongyu△
Department of Anesthesiology, Peking University Cancer Hospital and Institute, Key Laboratory of Carcinogenesis and
Translational Research (Ministry of Education/Beijing), Beijing 100142, China
△Corresponding Author E-mail: maggitan@yeah.net
Abstract: Objective To investigate the effect of preoperative anxiety on postoperative recovery and short-term prognosis in patients with liver cancer resection. Methods A total of 96 patients underwent elective open hepatocellular carcinoma resection, with American Society of Anesthesiologists (ASA) grade Ⅰ-Ⅱ were included in this study. Patients were divided into the control group (41 cases, HAMA < 7 points) and the anxiety group (55 cases, HAMA ≥7 points) according to Hamilton Anxiety Scale (HAMA). Heart rate (HR), mean arterial pressure (MAP) after entering the operating room, operative time, intraoperative bleeding, intraoperative fluid infusion and intraoperative remifentanil consumption were monitored in patients. Recovery time, extubation time, Emergence Agitation (EA) score, the resting and dynamic visual analogue scale ( VAS ) at 5 min after extubation (T1), 6 h (T2), 12 h (T3), 24h (T4) and 48 h (T5) after surgery, the cumulative effective pressing times of patient controlled analgesia (PCA), the remedy times of analgesic drugs, the postoperative gastrointestinal reaction, exhaust time, hospital stay, the serum alanine aminotransferase (ALT) and aspartate aminotransferase (AST) levels at the 5th day after operation were recorded. Results Compared with the control group, the heart rate and MAP in the anxious group were significantly increased after entering operating room, and the recovery time and extubation time were significantly prolonged (P<0.05). The incidence of intraoperative remifentanil consumption, EA score, T1, T2, T3 resting and dynamic VAS score, T4 dynamic VAS score, PCA pressing times, analgesic drug remedy times and postoperative gastrointestinal reactions were significantly higher in the anxious group than those in the control group (P<0.05), and incidence of gastrointestinal reactions, postoperative out of bed time, exhaust time, feeding time and hospital stay were significantly prolonged (P<0.05). Conclusion Preoperative anxiety is not conducive to anesthesia recovery and short-term prognosis in patients with liver tumor resection.
Key words: carcinoma, hepatocellular; anxiety; delayed emergence from anesthesia; postoperative complications
2023年全球癌症调查研究显示,原发性肝癌是全球癌症死亡的第4大原因[1]。尽管近年来我国肝癌发病率呈下降趋势,但其病死率在我国各类型肿瘤中始终高居第2位[2]。术前焦虑常被描述为手术前不安的、紧张的、恐惧的不良情绪,是人对于现实的潜在挑战或威胁的一种情绪反应,也是围手术期患者最常见的、最典型的应激反应之一。研究显示,外科手术本身引起的焦虑发生率为18%~35%,肝肿瘤患者术前焦虑的发生率为20%~80%[3]。当应激反应引起的心理变化无法调整至正常时,可能会导致患者心理障碍,影响手术预后[4]。目前,关于术前焦虑对肝肿瘤患者术后苏醒和短期预后影响的研究较少。本研究拟采用汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)对患者进行评估,筛选出术前焦虑的患者,观察术前焦虑对肝脏肿瘤患者术后苏醒及短期预后的影响,以期为临床提供参考。
1 对象与方法
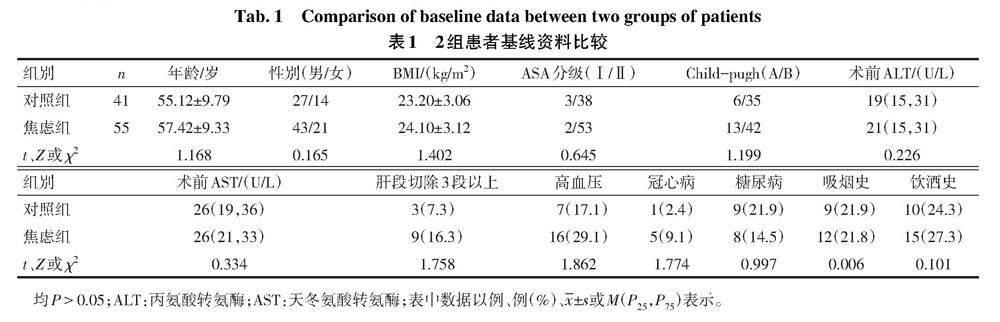
1.1 研究对象 选择2019年8月—2020年2月于北京肿瘤医院肝脏外科择期行开腹肝癌切除术的患者96例,肝癌诊断标准符合《2019版肝癌诊疗指南》。纳入标准:年龄18~75岁;美国麻醉医师协会(ASA)分级Ⅰ—Ⅱ级。排除标准:肝切除手术同时行肠切除或其他器官切除的患者;存在焦虑抑郁病史,长期服用镇痛药、镇静药或抗抑郁药;患有严重心、肺及肝肾功能不全者;认知障碍患者,未能或拒绝完成HAMA评分或疼痛视觉模拟(visual analogue scale,VAS)评分者。据患者术前24 h HAMA评估焦虑程度分为焦虑组(HAMA≥7分)55例和对照组(HAMA<7分)41例。2组年龄、性别、体质量指数(BMI)、ASA分级及Child-pugh分级等差异无统计学意义,具有可比性,见表1。本研究经医院伦理委员会批准(2019YJZ22-GZ02),患者及家属均签署知情同意书。
1.2 研究方法
1.2.1 麻醉方法 麻醉诱导按照丙泊酚(规格:20 mL∶0.2 mg,批号:16ID0894,北京费森尤斯卡比医药有限公司)2 mg/kg、舒芬太尼(规格:1 mL∶50 μg,批号:H20054171,宜昌人福药业有限责任公司)0.02 ?g/kg、顺式阿曲库铵(规格:?10 mg,批号210219BL,江苏恒瑞医药股份有限公司)0.2 mg/?kg静脉注射,气管插管。术中维持给予1.5%七氟醚吸入与瑞芬太尼(规格:1 mg,批号:10A05131,宜昌人福药业有限责任公司)静脉滴注复合麻醉维持,每间隔40 min给予顺式阿曲库铵0.2 mg/kg维持肌松作用。手术结束前30 min停用肌松药和瑞芬太尼。于手术结束时,停止吸入七氟醚,给予阿托品1 mg和新斯的明2 mg静脉注射,拮抗肌松残余效应。术毕入麻醉恢复室(PACU),在PACU拔管后接自控静脉镇痛(PCIA)泵。PCIA泵药液配方:舒芬太尼注射液2.5 ?g/kg、托烷司琼20 mg加入生理盐水至100 mL。参数设定为预充量4 mL,单次按压2 mL,背景输注速率1 mL/h,锁定时间15 min,患者苏醒完全后送回病房。由专人对患者进行术后随访,记录患者具体的术后疼痛、镇痛及康复情况。术后采用VAS评分对患者进行评估。VAS评分≥4分时静脉给予盐酸羟考酮注射液(规格:1 mL∶10 mg,批号:TW210,萌蒂制药有限公司)0.07 mg/kg。
1.2.2 观察指标 (1)采集患者的人口统计学特征:性别、年龄、BMI,ASA分级,肝脏Child-pugh分级,既往病史,吸烟史与饮酒史。(2)术中麻醉管理[入手术室心率(HR)与平均动脉压(MAP)、术中补液情况、瑞芬太尼消耗量],手术相关因素(手术切除范围、手术时间、术中补液情况、术中出血量),苏醒相关情况[苏醒时间、拔管时间、苏醒期躁动(EA)评分]。(3)术后疼痛与镇痛情况[拔出气管导管后5 min(T1),术后6 h(T2)、12 h(T3)、24 h(T4)、48 h(T5)静息及活动VAS评分,PICA按压次数,镇痛药物补救],术后恢复情况(术后下床时间、排气时间、进食时间、术后胃肠道反应情况、术后5 d ALT和AST、术后住院天数)。
1.3 统计学方法 采用SPSS 23.0分析数据。符合正态分布的计量资料以[[x] ±s
]表示,2组间比较用独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较用Mann-Whitney U检验;计数资料以例或例(%)表示,组间比较用χ2检验或Fisher精确检验。P<0.05为差异有统计学意义。
2 结果
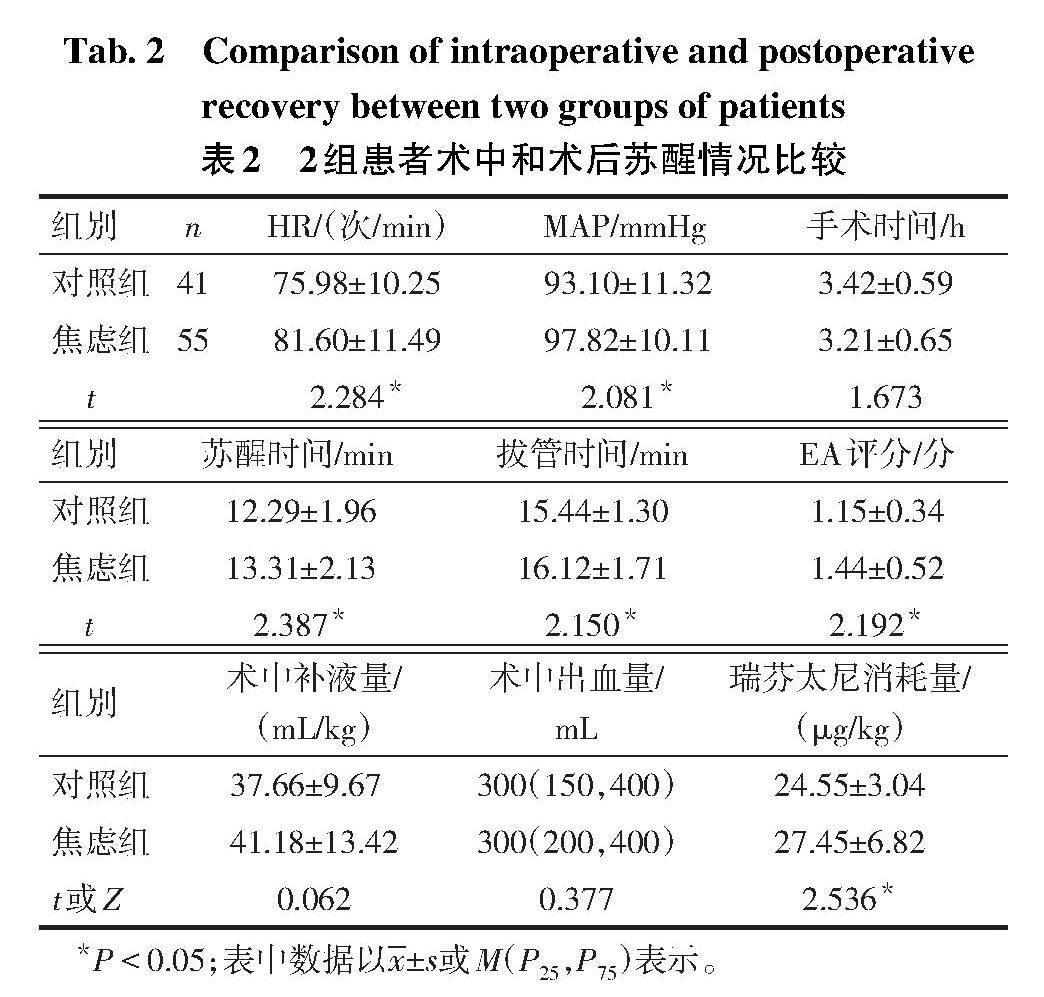
2.1 2组患者术中及苏醒情况比较 2组患者手术时间、术中补液与术中出血比较差异无统计学意义(P>0.05)。与对照组相比,焦虑组HR和MAP增高,苏醒时间、拔管时间延长,术中瑞芬太尼消耗量、EA评分增加(P<0.05),见表2。
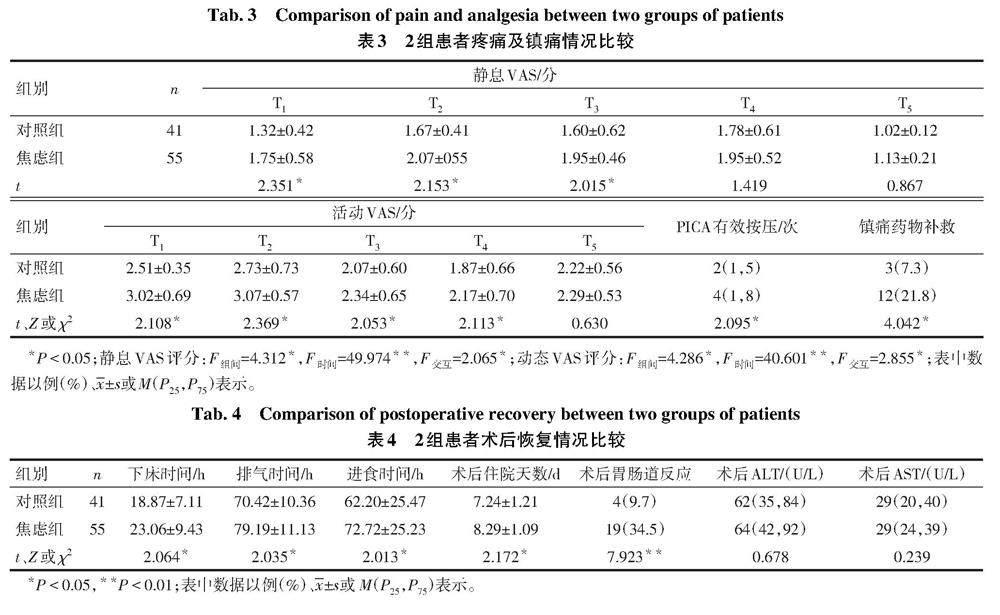
2.2 2组患者疼痛及镇痛情况比较 与对照组相比,焦虑组T1、T2、T3时静息及活动VAS评分、T4活动VAS评分、PICA有效按压次数、镇痛药物补救比例增加(P<0.05);2组T5静态与活动的VAS评分和T4静态VAS评分差异无统计学意义,见表3。
2.3 2组患者术后恢复情况比较 与对照组比较,焦虑组术后下床时间、排气时间、进食时间和术后住院天数延长,术后胃肠道反应的发生率升高(P<0.05)。2组术后血清ALT与AST水平差异无统计学意义,见表4。
3 讨论
既往研究表明,术前焦虑会使患者处于应激状态,刺激下丘脑释放促肾上腺皮质激素释放激素,交感神经兴奋性增加,从而使肾上腺素和去甲肾上腺在血浆中的浓度迅速升高,引起患者心输出量增加,心率加快和血压升高[5]。本研究结果亦显示,焦虑组入手术室HR、MAP高于对照组,考虑原因是:为了减轻术中患者心率、血压升高引起的血流动力学紊乱,临床必然会加大阿片类药物、镇静催眠药物及心血管活性药物的使用量,增加了药物不良反应的发生率,从而增加了患者的围手术期风险[6]。
目前,大多数全身麻醉药物均需经过肝脏代谢;而接受手术的肝脏肿瘤患者均会出现不同程度的肝功能障碍,因此也会影响到麻醉药物的代谢,进而延迟患者的苏醒[7]。患者苏醒的快慢则会直接影响到术后的康复速度。降低肝脏肿瘤切除术患者的苏醒延迟发生率对实现快速康复的理念意义较大。本研究中,焦虑组术中瑞芬太尼总的消耗量大于对照组,考虑与患者焦虑时体内应激状态提升有关;其苏醒时间和拔管时间长于对照组,考虑与焦虑组术中瑞芬太尼的用量增加,也协同加强了术中其他麻醉药物的镇静作用,影响了患者的苏醒[8]。焦虑是恐惧感觉的延伸,这种状态在术后苏醒期的延续可能会导致躁动等异常的精神行为。由于在麻醉恢复期麻醉药还有部分残余作用,麻醉药对中枢的抑制作用尚未完全消失,大脑皮质和上行网状激活系统的功能尚未完全恢复,此时不良的刺激均可能诱发患者的躁动[9]。有研究表明,术前焦虑是发生全麻术后躁动的重要危险因素[10]。本研究结果也显示,焦虑组的EA评分高于对照组。
肝肿瘤手术创伤较大,属于重度疼痛的手术[11]。肝癌术后急性疼痛的发生不仅影响患者术后的早期情绪和康复活动,甚且还延迟了术后肝功能的恢复[12]。在本研究中,焦虑组拔出气管导管后5 min,术后6 h、12 h静息及活动VAS评分,24 h活动VAS评分,PICA按压次数,镇痛药物补救次数显著高于对照组,表明术前焦虑能够增加患者术后疼痛的敏感性,尤其在术后24 h内。有研究显示,焦虑会抑制人体内啡肽物质的分泌,增加了痛觉感受器的敏感性[13]。Cho等[14]研究显示,术前焦虑与术后VAS评分呈正相关,患者术前焦虑状况越严重,术后疼痛越严重,镇痛药物使用量也会高于术前低焦虑者。本研究发现,从VAS评分看,焦虑组患者在24 h内的疼痛程度明显高于对照组,下床活动时间晚于对照组,可见控制好术前焦虑对于术后早期下床活动有益,进而也缩短了排气时间和进食时间,实现早期快速康复,这也与以往的研究一致[15]。
术后胃肠道反应包括恶心与呕吐,术前焦虑被认为与患者术后恶心呕吐发生密切相关[8]。本研究结果也显示,焦虑组胃肠道反应的发生率高于对照组。有研究报道,术前焦虑状态可以导致体内5-羟色胺分泌增加,引起胃排空延迟,导致患者恶心呕吐[16]。此外,血清ALT和AST作为反映肝细胞损伤的指标,ALT存在于肝细胞胞浆中,肝细胞膜受损时,血清中ALT含量增加。AST存在于肝细胞的线粒体中,血清中AST升高往往提示肝细胞损伤已到细胞器水平。相关研究显示,ALT和AST水平对肝癌患者术后肝功能的恢复有一定预测作用[17]。然而,术前焦虑是否会影响术后血清中ALT与AST水平鲜见报道。本研究结果显示,2组术后ALT和AST差异无统计学意义。
综上所述,术前焦虑对肝脏肿瘤患者的术后苏醒和短期预后可能会产生不利影响,但本研究未能检测患者围手术期血液儿茶酚胺的含量,直观地反映患者的应激状态,后续有待增加这一指标的分析。
参考文献
[1] SIEGEL R L,MILLER K D,WAGLE N S,et al. Cancer statistics,2023[J]. CA Cancer J Clin,2023,73(1):17-48. doi:10.3322/caac.21763.
[2] FENG R,SU Q,HUANG X,et al. Cancer situation in China:what does the China cancer map indicate from the first national death survey to the latest cancer registration? [J]. Cancer Commun (Lond),2023,43(1):75-86. doi:10.1002/cac2.12393.
[3] G?TZE H,FRIEDRICH M,TAUBENHEIM S,et al. Depression and anxiety in long-term survivors 5 and 10 years after cancer diagnosis[J]. Support Care Cancer,2020,28(1):211-220. doi:10.1007/s00520-019-04805-1.
[4] WILLIAMS H,JAJJA M R,BAER W,et al. Perioperative anxiety and depression in patients undergoing abdominal surgery for benign or malignant disease[J]. J Surg Oncol,2019,120(3):389-396. doi:10.1002/jso.25584.
[5] BOTZET K,DALYANOGLU H,SCH?FER R,et al. Anxiety and depression in patients undergoing mitral valve surgery: a prospective clinical study[J]. Thorac Cardiovasc Surg,2018,66(7):530-536. doi:10.1055/s-0037-1604461.
[6] AHMETOVIC-DJUG J,HASUKIC S,DJUG H,et al. Impact of preoperative anxiety in patients on hemodynamic changes and a dose of anesthetic during induction of anesthesia[J]. Med Arch,2017,71(5):330-333. doi:10.5455/medarh.2017.71.330-333.
[7] ST?HR T,COLIN P J,OSSIG J,et al. Pharmacokinetic properties of remimazolam in subjects with hepatic or renal impairment[J]. Br J Anaesth,2021,127(3):415-423. doi:10.1016/j.bja.2021.05.027.
[8] STAMENKOVIC D M,RANCIC N K,LATAS M B,et al. Preoperative anxiety and implications on postoperative recovery:what can we do to change our history[J]. Minerva Anestesiol,2018,84(11):1307-1317. doi:10.23736/S0375-9393.18.12520-X.
[9] MENSER C,SMITH H. Emergence agitation and delirium: considerations for epidemiology and routine monitoring in pediatric patients[J]. Local Reg Anesth,2020,13:73-83. doi:10.2147/LRA.S181459.
[10] ZHANG M Q,XU M Z,HE Y,et al. Comparison of S-ketamine and midazolam for intravenous preoperative sedative and anxiolytic effects in preschool children:study protocol for a randomized controlled clinical trial[J]. Trials,2023,24(1):724. doi:10.1186/s13063-023-07767-2.
[11] ZHU H,XIAO H,LU G,et al. Effect of transdermal fentanyl patch combined with enhanced recovery after surgery on the curative effect and analgesic effect of liver cancer[J]. Biomed Res Int,2022,2022:9722458. doi:10.1155/2022/9722458.
[12] LEE J A,YOUNG S,O'CONNOR V,et al. Safety and efficacy of an enhanced recovery protocol after hepatic resection[J]. Am Surg,2020,86(10):1396-1400. doi:10.1177/0003134820964492.
[13] HENRIQUE A J,GABRIELLONI M C,RODNEY P,et al. Non-pharmacological interventions during childbirth for pain relief, anxiety, and neuroendocrine stress parameters: a randomized controlled trial[J]. Int J Nurs Pract,2018,24(3):e12642. doi:10.1111/ijn.12642.
[14] CHO C H,SEO H J,BAE K C,et al. The impact of depression and anxiety on self-assessed pain, disability, and quality of life in patients scheduled for rotator cuff repair[J]. J Shoulder Elbow Surg,2013,22(9):1160-1166. doi:10.1016/j.jse.2013.02.006.
[15] MANCUSO C A,DUCULAN R,CRAIG C M,et al. Psychosocial variables contribute to length of stay and discharge destination after lumbar surgery independent of demographic and clinical variables[J]. Spine (Phila Pa 1976),2018,43(4):281-286.
[16] RODRIGUES H F,FURUYA R K,DANTAS R,et al. Association of preoperative anxiety and depression symptoms with postoperative complications of cardiac surgeries[J]. Rev Lat Am Enfermagem,2018,26:e3107. doi:10.1590/1518-8345.2784.3107.
[17] 刘欣,李丽. 原发性肝癌患者体液变化的研究[J]. 天津医药,2021,49(7):756-759. LIU X,LI L. The study on changes of body fluid in patients with primary liver cancer[J]. Tianjin Med J,2021,49(7):756-759. doi:10.11958/20203264.
(2023-12-19收稿 2024-02-20修回)
(本文编辑 陆荣展)
