基于早期血小板相关参数的支气管肺发育不良风险预测模型的构建与验证
2024-07-13薛玉恒茆宁刘文强杨倩倩徐艳王军
薛玉恒 茆宁 刘文强 杨倩倩 徐艳 王军


基金项目:江苏省妇幼健康科研项目(F201850)
作者单位:徐州医科大学附属医院儿科(邮编221000)
作者简介:薛玉恒(1995),女,硕士在读,主要从事新生儿支气管肺发育不良方面研究。E-mail:719741950@qq.com
△通信作者 E-mail:664586331@qq.com
摘要:目的 构建并验证基于新生儿重症监护病房(NICU)的早产儿早期血小板相关参数对支气管肺发育不良(BPD)风险预测模型,从而早期识别高风险人群并进行干预。方法 收集NICU收治的291例胎龄(GA)≤32周或出生体质量(BW)<1 500 g的早产儿的临床资料。最终纳入214例作为建模组,根据生后28 d是否吸氧分为BPD组(76例)和非BPD组(138例)。比较2组围生期资料、血小板相关参数等指标,采用Logistic回归筛选BPD的影响因素,应用受试者工作特征(ROC)曲线评价模型的预测价值,并构建列线图。收集同一中心收治的GA≤32周或BW<1 500 g的105例早产儿作为验证组,分为BPD组(43例)和非BPD组(62例),利用ROC曲线、校准曲线内部验证预测模型的效能。结果 建模组Logistic回归分析显示,GA、BW、Apgar 5 min≤7分、有创通气、血小板计数(PLT)、平均血小板体积(MPV)在模型中有统计学意义(P<0.05)。根据多因素分析结果以R语言分别绘制预测模型列线图。3个模型的ROC曲线下面积(AUC)分别为0.908、0.931和0.918(P<0.05)。采用Bootstrap法对验证组进行验证,校准曲线显示拟合度良好,3个模型内部验证的AUC分别为0.877、0.890和0.886。结论 GA、BW、有创通气、Apgar 5 min≤7分、MPV、PLT可作为BPD发生的预测因素,有助于临床医生早期发现并干预BPD的发生发展。
关键词:支气管肺发育不良;婴儿,早产;血小板计数;危险因素;预测
中图分类号:R722.6,R446.111文献标志码:ADOI:10.11958/20231602
Construction and validation of a risk prediction model for bronchopulmonary dysplasia
based on early platelet-related parameters
XUE Yuheng, MAO Ning, LIU Wenqiang, YANG Qianqian, XU Yan, WANG Jun△
Department of Neonatology, the Affliated Hospital of Xuzhou Medical University, Xuzhou 221000, China
△Corresponding Author E-mail: 664586331@qq.com
Abstract: Objective To develop and validate a risk prediction model based on early platelet-related parameters for bronchopulmonary dysplasia (BPD) in neonates admitted to the neonatal intensive care unit (NICU), and to facilitate early identification and intervention in high-risk populations. Methods Clinical data of 291 preterm infants with a gestational age (GA) ≤32 weeks or a birth weight (BW) <1 500 g, admitted to the NICU, were retrospectively analyzed. Out of these, 214 cases were selected as the modeling group. This group was further categorized into the BPD group (n=76) and the non-BPD group (n=138), based on whether they required oxygen therapy at 28 days post-birth. Perinatal data, platelet-related parameters and other indicators between the two groups. Univariate and multivariate Logistic regression analyses were conducted to identify BPD risk factors, followed by the construction of a nomogram. An additional cohort of 105 preterm infants with GA≤32 weeks or BW<1 500 g, were used to validate the model. This cohort was divided into the BPD group (n=43) and the non-BPD (n=62) group. Receiver operating characteristic (ROC) curve and calibration curve were used to internally verify the efficiency of the prediction model. Results The Logistic regression analysis identified GA, BW, Apgar score at 5 minutes≤7, invasive ventilation, platelet count (PLT) and mean platelet volume (MPV) as significant factors in the model (P<0.05). The constructed nomogram was formulated using R language, and the areas under the ROC curve (AUC) for the three models were 0.908, 0.931 and 0.918, respectively (P<0.05). The verification group was verified by Bootstrap. The calibration curve showed a good fit. The internal validation AUC values of the three models were 0.877, 0.890 and 0.886, respectively. Conclusion GA, BW, invasive ventilation, Apgar score at 5 minutes≤7, MPV and PLT are key risk factors for BPD onset. The risk prediction model based on these indicators can effectively predict BPD, providing clinicians with a valuable tool for early detection and intervention in the development of BPD.
Key words: bronchopulmonary dysplasia; infant, premature; platelet count; risk factors; forecasting
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿最常见的肺部慢性疾病[1],严重影响患儿预后。随着新生儿救治和管理技术的不断进步,“经典型”BPD已转变为以肺发育阻滞为特征的“新型”BPD,其最重要的病理特征是肺泡数目减少和肺微血管发育异常[2]。血小板是止血、炎症和组织修复的关键效应细胞,参与调节肺血管通透性和肺泡毛细血管的屏障功能,并影响肺血管反应性。有研究表明血小板是多种肺部疾病的标志物[3]。因此,本研究旨在通过使用血小板相关参数构建BPD早期风险预测模型,从而对高风险患儿进行早期干预。
1 对象与方法
1.1 研究对象 回顾性收集2019年9月—2021年8月于徐州医科大学附属医院产科出生,并于生后2 h内转入新生儿重症监护病房(neonatal intensive care unit,NICU)的291例胎龄(gestational age,GA)≤32周或出生体质量(birth weight,BW)<1 500 g的早产儿的临床资料,最终纳入214例作为建模组并建立BPD预测模型。根据生后28 d是否吸氧分为BPD组(76例)和非BPD组(138例)。另收集2021年9月—2022年4月本中心收治的105例同标准早产儿作为验证组进行内部验证,分为BPD组(43例)和非BPD组(62例)。纳入标准:(1)GA≤32周或BW<1 500 g。(2)存活至少28 d。排除标准:(1)严重的先天发育畸形、复杂型先天性心脏病、遗传代谢性疾病、恶性肿瘤疾病。(2)孕母孕期使用抗凝药。(3)孕母合并系统性红斑狼疮、肾病综合征、溶血肝功能异常血小板减少(HELLP)综合征等免疫性疾病。(4)严重感染。(5)围产期窒息并发症。出生后Apgar 1 min或5 min评分<3分、缺氧缺血性脑病、急性肾小管坏死或短暂性心肌缺血等。(6)并发血液系统疾病。(7)患儿家长放弃治疗或死亡。本研究已获得患儿家长知情同意及徐州医科大学附属医院伦理委员会批准(伦理号:XYFY2023-KL035-01)。
1.2 方法
1.2.1 一般资料收集 (1)早产儿一般情况。GA、BW、性别、适于胎龄儿、Apgar 1 min及5 min评分等。(2)孕母情况。分娩方式、是否多胎、产前糖皮质激素和抗生素使用情况、胎膜早破≥18 h、妊娠期高血压、妊娠期糖尿病、妊娠期甲状腺功能减退、妊娠期甲状腺功能亢进、妊娠期贫血等。(3)相关治疗。住院期间氧气支持模式及时间、最大吸入氧浓度(FiO2)、最大吸气末峰压(PIP)、使用咖啡因、静脉营养持续时间、抗生素使用时间等。(4)相关合并症。≥Ⅱ级新生儿呼吸窘迫综合征(RDS)、新生儿败血症、有血流动力学意义的动脉导管未闭(hsPDA)、≥Ⅲ级颅内出血(IVH)、≥Ⅱ期坏死性小肠结肠炎(NEC)、早产儿视网膜病(ROP)、肺动脉高压等。
1.2.2 血小板相关参数收集 收集早产儿生后第1天、第1周、第2周外周血中血小板相关参数,包括血小板计数(PLT)、平均血小板体积(MPV)、血小板压积(PCT)、大型血小板比率(P-LCR)、血小板分布宽度(PDW)、血小板质量指数(PMI=PLT×MPV)、血小板/淋巴细胞(PLR)。其中第1周取生后2~7 d平均值,第2周取生后8~14 d平均值。
1.3 相关诊断标准 BPD诊断标准采用2001年美国儿童健康和人类生长发育研究院(National Institute of Child Health and Human Development,NICHD)定义[2],即持续吸氧≥28 d,吸入氧浓度>21%的新生儿。hsPDA诊断标准为出生后动脉导管持续开放>72 h,动脉导管内径≥1.5 mm;需伴以下一项临床表现:心率持续>160次/min、收缩期杂音、脉压>25 mmHg(1 mmHg=0.133 kPa)、肝大、脾大、皮肤发花、喂养不耐受、胸部影像学检查显示肺血增多;且合并以下任一项超声心动图表现,如大动脉短轴切面左心房收缩期前、后径与主动脉根部内径比值≥1.4,动脉导管左向右分流速率≤2.5 m/s或穿过导管的平均压力梯度≤8 mmHg,降主动脉舒张期血流消失或反转[4]。其他新生儿疾病诊断依据第5版《实用新生儿学》[5]。
1.4 统计学方法 采用SPSS 26.0软件进行数据分析,R3.6.1软件绘制列线图。符合正态分布的计量资料采用[x] ±s表示,组间比较采用独立样本t检验;非正态资料采用M(P25,P75)表示,组间比较采用Mann-Whitney U检验。计数资料采用例(%)表示,组间比较采用χ2检验。采用向前条件法建立Logistic回归模型分析BPD的影响因素。采用受试者工作特征(ROC)曲线分析模型对BPD的预测价值,并绘制列线图。采用Bootstrap法抽样1 000次对模型进行内部验证。通过ROC曲线及校准曲线对模型的预测效能进行评价。P<0.05为差异有统计学意义。
2 结果
2.1 2组一般情况、孕母情况及并发症比较 BPD组有创通气、有创通气≥3 d、有创通气≥14 d、Apgar 5 min≤7分、使用咖啡因、最大FiO2>25%、新生儿败血症、ROP、≥Ⅱ级RDS、hsPDA、肺动脉高压、≥Ⅲ级IVH所占比例,有创通气、无创通气、抗生素使用及静脉营养持续时间均明显高于非BPD组,GA、BW明显低于非BPD组(P<0.05)。2组间性别、Apgar 1 min≤7分、最大PIP≤20 cmH2O(1 cmH2O=0.098 kPa)、适于胎龄儿、妊娠期高血压、妊娠期糖尿病、妊娠期甲状腺功能减退、妊娠期甲状腺功能亢进、妊娠期贫血、剖宫产、多胎、应用产前激素、应用产前抗生素、胎膜早破≥18 h、≥Ⅱ期NEC所占比例差异均无统计学意义,见表1。
2.2 2组血小板参数动态比较 BPD组第1天、第1周、第2周PLT、PCT、PMI明显低于非BPD组,MPV明显高于非BPD组,BPD组第1周、第2周PDW明显高于非BPD组(P<0.05)。2组间第1天、第1周、第2周P-LCR、PLR以及第1天PDW差异无统计学意义(P>0.05),见表2。
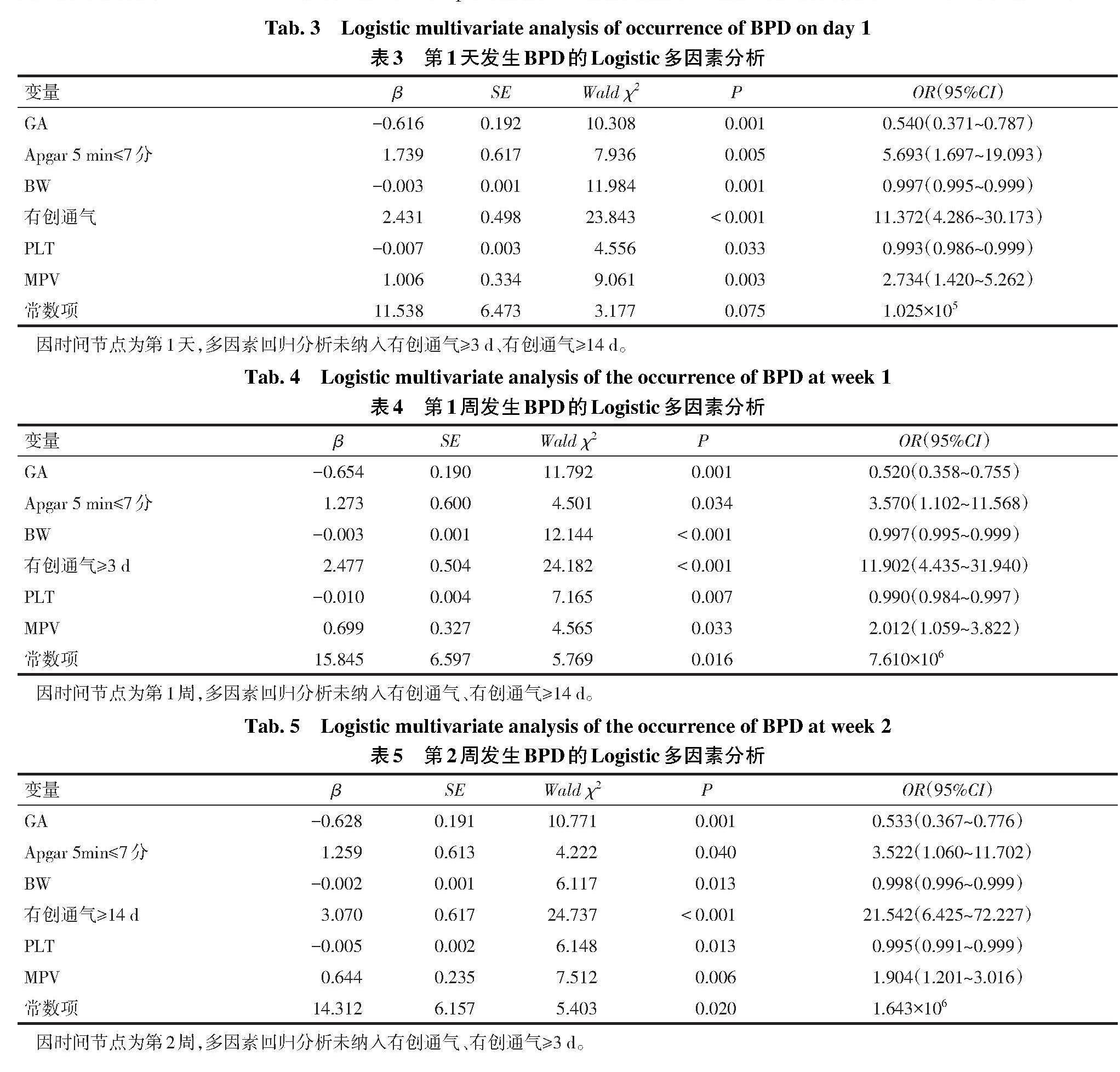
2.3 早产儿生后不同时间血小板参数预测BPD风险模型构建及验证 将是否发生BPD作为因变量(是=1,否=0),取表1及表2中有统计学意义(P<0.05)的变量为自变量,但表1中根据专业判断不适宜纳入的变量,如本研究将2组早产儿住院期间的有创及无创通气时间、抗生素使用及静脉营养总持续时间以及住院期间使用的最大FiO2进行比较,而非比较3个时间节点内的使用天数及最大FiO2,故以上一般情况未纳入多因素回归分析;对比2组早产儿住院期间所发生的并发症,而非3个时间节点内出现的并发症,故新生儿败血症、ROP、≥Ⅱ级RDS、hsPDA、肺动脉高压、≥Ⅲ级IVH未纳入多因素回归分析)。采用向前条件法建立Logistic回归模型,结果显示GA、Apgar 5 min≤7分(是=1,否=0)、BW、有创通气(是=1,否=0)、PLT、MPV在模型中均有统计学意义(P<0.05)。根据纳入不同时间的PLT、MPV结果,分别构建第1天(模型1)、第1周(模型2)、第2周(模型3)的多因素回归预测模型并绘制列线图,见表3—5、图1—3。采用Bootstrap法分别对模型1、模型2、模型3进行内部验证,模型拟合度良好,见表6。建模组及验证组ROC曲线提示模型预测区分度较好,见图4、5。
2.4 不同时间模型的预测效能 ROC曲线结果示,生后第1周风险模型预测BPD发生的AUC为0.931,预测价值最高,敏感度最高,但特异度最低。见表6。
3 讨论
3.1 BPD研究现状 BPD发病机制尚不明确,有研究表明其发生发展的相关因素包括早产、机械通气、氧毒性、血管发育不良、感染等[6-7]。BPD是早产儿常见的肺部疾病,其对患儿的影响甚至可以持续终身。因此,寻找预测BPD的生物标志物一直以来都是研究热点。目前已有研究发现BPD与血小板有关[8]。
3.2 血小板作用机制 Lefran?ais等[9]发现在肺部循环中含有大量巨核细胞动态释放血小板,并在肺血管外发现了巨核细胞及造血祖细胞群,当血小板减少和骨髓干细胞缺乏时,祖细胞从肺部迁移至骨髓,从而恢复血小板的生成。目前“新型”BPD主要病理机制为异常的肺泡化和肺微血管的形成,因此BPD的发生与血小板的关系越来越受到重视。研究表明,血小板参与调节组织修复和再生,当血管内皮受损,暴露出胶原、血管性血友病因子等内皮下基质成分,血小板通过特异性受体结合血管性血友病因子,激活胞内信号通路,引起血小板活化,释放出内部颗粒中的物质,促进血小板聚集,参与受损血管的修复,促进肺部血管的生成[10]。本研究发现,第1周时2组PLT均减少,第2周时PLT较前增多,可能原因为机体感染后释放的炎性因子作用于靶细胞,而血小板的组织修复作用使其减少,随后的骨髓造血功能代偿性增强,促使血小板数量增加;同时,本研究中BPD组血小板减少更为显著,这与Wang等[11]报道的BPD患儿较非BPD患儿生后血小板低结果相符,均提示血小板减少患儿发生BPD风险更高,推测可能与血小板减少导致其分泌生长因子减少,影响肺泡化和肺血管发育有关。
3.3 血小板相关参数与BPD的相关研究 MPV可反映血小板的体积和活性[12],是血小板活化的标志物,MPV升高的血小板活性增强,其中含有丰富的内部颗粒和酶,可以促进炎症反应发生[13]。Dani等[14]研究发现,MPV升高与早产儿严重RDS相关,RDS相关的肺损伤、肺部炎症和氧化损伤是BPD发生的主要危险因素,MPV升高会增加RDS的严重程度和BPD发生风险,因为较大的血小板含有更多的内部颗粒,产生更多的血管活性因子等;该研究结果显示BPD患儿生后24~48 h内MPV高于非BPD患儿,并且已经发现MPV>11 fL是BPD发展的独立危险因素。本研究同样发现,BPD组患儿MPV大于非BPD组,且在第2周时BPD组患儿MPV>11 fL。
PDW反映血小板形态的异质性,当体内血小板活化时,由盘状变为球状,PDW随之升高[15]。因此,PDW也是血小板活化程度的表现。本研究中BPD组与非BPD组间PDW无明显差异,这与江君生等[16]的研究结果一致。PMI是一个新的概念,它是PLT与MPV的乘积,能更好地反映血小板功能。血小板活化和消耗在危重症新生儿中常见,并与较差的预后相关。Okur等[17]研究发现,出生后3~7 d的PMI可以作为BPD、NEC、ROP和IVH发展的预测因子。PLR是一种新型炎症指标,能较好反映机体炎症变化,血小板-中性粒细胞结合可促进血管活性物质的释放,从而放大局部炎症反应[18]。Cakir等[19]利用全身炎症指标预测中重度BPD的研究中发现PLR对于BPD的预测能力有限。本研究也发现,2组患儿PMI、PLR存在差异,但对于BPD发生的预测价值不高,可能原因是检测方法的差异、选择人群不同等。
3.4 BPD其他危险因素 机械通气可引发复杂的肺损伤和修复级联反应,导致慢性肺部疾病。因此国内外学者渴望通过采取保护性通气策略以减少肺损伤,从而降低BPD的发生,如使用压力控制通气、适当的呼气末正压避免肺不张、高频通气降低压力和容积波动等[20]。在本研究中,BPD组患儿机械通气持续时间较非BPD组患儿显著延长,且为BPD发生的独立危险因素。胎龄小和出生体质量低均为BPD发生的危险因素,这一结果与胡海英等[21]研究结果相符。可能原因为肺泡结构简单化和肺微血管发育发生在肺发育的后期阶段,早产中断了关键的晚期肺发育,导致结构和功能不成熟。
3.5 纳入不同时间段血小板参数的BPD风险预测模型的效能评价 本研究中小胎龄、低BW、机械通气、PLT减少与MPV升高是BPD发生的主要危险因素。本研究显示生后第1周预测模型敏感度更高,第2周预测模型特异度更高,说明第1周及第2周2个时间点的预测模型对于预测BPD的发生具有一定的优势,为临床制定诊疗方案提供可靠依据。但本研究为单中心、小样本研究,需进一步行多中心、大样本研究加以验证该模型的效能。
参考文献
[1] 中华医学会儿科学分会新生儿学组,中华儿科杂志编辑委员会. 早产儿支气管肺发育不良临床管理专家共识[J]. 中华儿科杂志,2020,58(5):358-365. The Subspecialty Group of Neonatology,the Society of Pediatrics,Chinese Medical Association,the Editorial Board,Chinese Journal of Pediatrics. Expert consensus on clinical management of premature infants with brochopulmonary dysplasia[J]. Chin J Pediatr,2020,58(5):358-365. doi:10.3760/cma.j.cn112140-20200317-00254.
[2] GILFILLAN M,BHANDARI A,BHANDARI V. Diagnosis and management of bronchopulmonary dysplasia[J]. BMJ,2021,375:n1974. doi:10.1136/bmj.n1974.
[3] HUANG D Y,WANG G M,KE Z R,et al. Megakaryocytes in pulmonary diseases[J]. Life Sciences,2022,301. doi:10.1016/j.lfs.2022.120602.
[4] 钟林平,蒋燕,栗燕,等. 超早产儿/超低出生体重儿呼吸道解脲脲原体定植与支气管肺发育不良的关系[J]. 中华围产医学杂志,2023,26(3):236-342. ZHONG L P,JIANG Y,LI Y,et al. Association between ureaplasma urealyticum colonization in respiratory tract and bronchopulmonary dysplasia in extremely preterm or extremely low birth weight infants[J]. Chin J Perinat Med,2023,26(3):236-342. doi:10.3760/cma.j.cn113903-20221014-00896.
[5] 邵肖梅,叶鸿瑁,丘小汕. 实用新生儿学[M]. 5版. 北京:人民卫生出版社,2019. SHAO X M,YE H M,QIU X S. Practice of neonatology[M]. 5th Ed. Beijing:People's Medical Publishing House,2019.
[6] 李羽白,王军,殷静. Wnt 5a在支气管肺发育不良模型中的作用机制探讨[J]. 天津医药,2022,50(6):566-570. LI Y B,WANG J,YIN J. Mechanism of Wnt 5a in bronchopulmonary dysplasia model[J]. Tianjin Med J,2022,50(6):566-570. doi:10.11958/20212391.
[7] BRIANA D D,MALAMITSI-PUCHNER A. An update on lung function of extremely and very preterm infants in later life:the role of early nutritional interventions[J]. Nutrients,2023,15(15):3353. doi:10.3390/nu15153353.
[8] CHEN X,ZHONG J,HAN D,et al. Close association between platelet biogenesis and alveolarization of the developing lung[J]. Front Pediatr,2021,9:625031. doi:10.3389/fped.2021.625031.
[9] LEFRAN?AIS E,ORTIZ-MUNOZ G,CAUDRILLIER A,et al. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors[J]. Nature,2017,544(7648):105-109. doi:10.1038/nature21706.
[10] VAN DER MEIJDEN P E J,HEEMSKERK J W M. Platelet biology and functions: new concepts and clinical perspectives[J]. Nat Rev Cardiol,2018,16(3):166-179. doi:10.1038/s41569-018-0110-0.
[11] WANG X,MA Y,WANG S,et al. Platelet is the early predictor of bronchopulmonary dysplasia in very premature infants:an observational cohort study[J]. BMC Pulm Med,2022,22(1):109. doi:10.1186/s12890-022-01895-2.
[12] 路洪祥,杨博峰,程颖,等. 平均血小板体积与淋巴细胞比值对静脉溶栓治疗的急性缺血性脑卒中患者预后的预测价值[J]. 天津医药,2021,49(3):291-295. LU H X,YANG B F,CHENG Y,et al. The predictive value of mean platelet volume and lymphocyte ratio in patients with acute ischemic stroke treated with intravenous thrombolysis[J]. Tianjin Med J,2021,49(3):291-295. doi:10.11958/20202510.
[13] 孙芳,朱美君. 平均血小板体积/血小板计数、血清Presepsin水平对重症肺炎患者预后的评估价值[J]. 检验医学与临床,2023,20(12):1721-1725. SUN F,ZHU M J. Evaluation value of mean platelet volume/platelet count and serum Presepsin level in prognosis of patients with severe pneumonia[J]. Lab Med Clin,2023,20(12):1721-1725. doi:10.3969/j.issn.1672-9455.2023.12.012.
[14] DANI C,POGGI C,BARP J,et al. Mean platelet volume and risk of bronchopulmonary dysplasia and intraventricular hemorrhage in extremely preterm infants[J]. Am J Perinatol,2011,28(7):551-556. doi:10.1055/s-0031-1274503.
[15] WANG F,MENG Z,LI S,et al. Platelet distribution width levels can be a predictor in the diagnosis of persistent organ failure in acute pancreatitis[J]. Gastroenterol Res Pract,2017,2017:8374215. doi:10.1155/2017/8374215.
[16] 江君生,卢红艳,朱少轩,等. 血小板参数的动态监测与早产儿支气管肺发育不良相关性研究[J]. 江苏大学学报(医学版),2022,32(2):93-98. JIANG J S,LU H Y,ZHU S X,et al. Clinical significance of platelet parameters in preterm infants with bronchopulmonary dysplasia[J]. Journal of Jiangsu University(Medicine Edition),2022,32(2):93-98. doi:10.13312 /j.issn.1671-7783.y210148.
[17] OKUR N,BUYUKTIRYAKI M,URAS N,et al. Platelet mass index in very preterm infants:can it be used as a parameter for neonatal morbidities?[J]. J Matern Fetal Neonatal Med,2016,29(19):3218-3222. doi:10.3109/14767058.2015.1121475.
[18] ZHOU D,WANG G,FAN Y,et al. Platelet to lymphocyte ratio is associated with the severity of coronary artery disease and clinical outcomes of percutaneous coronary intervention in the Chinese Han population[J]. Exp Ther Med,2017,13(2):731-738. doi:10.3892/etm.2016.3993.
[19] CAKIR U,TAYMAN C,TUGCU A U,et al. Role of systemic inflammatory indices in the prediction of moderate to severe bronchopulmonary dysplasia in preterm infants[J]. Arch Bronconeumol,2023,59(4):216-222. doi:10.1016/j.arbres. 2023.01.003.
[20] SAHNI M,BHANDARI V. Invasive and non-invasive ventilatory strategies for early and evolving bronchopulmonary dysplasia[J]. Semin Perinatol,2023,47(6):151815. doi:10.1016/j.semperi. 2023.151815.
[21] 胡海英,许东宝,陈小慧,等. 胎龄<32周早产儿中重度支气管肺发育不良危险因素的多中心回顾性分析[J]. 中国当代儿科杂志,2022,24(10):1104-1110. HU H Y,XU D B,CHEN X H,et al. Risk factors for moderate/severe bronchopulmonary dysplasia in preterm infants with a gestational age of<32 weeks:a multicenter retrospective analysis[J]. Chin J Contemp Pediatr,2022,24(10):1104-1110. doi:10.7499/j.issn.1008-8830.2204145.
(2023-10-25收稿 2023-12-26修回)
(本文编辑 李鹏)
