双参饮片—标准汤剂—成品量值传递研究
2024-07-12田方耿彦梅李雪利高晗李妍李军山
田方 耿彦梅 李雪利 高晗 李妍 李军山


摘 要:
为将少数民族用药双参开发成配方颗粒,建立双参饮片、标准汤剂与配方颗粒的高效液相色谱马钱苷酸含量测定方法及薄层色谱鉴别方法,并同时考察双参饮片—标准汤剂—配方颗粒的量值传递关系。采用安捷伦1260Ⅱ液相色谱仪与Waters Symmetry C18柱(4.6 mm×250 mm,5 μm),以乙腈-0.1%磷酸溶液为流动相进行梯度洗脱,检测波长为240 nm,流速为1 mL/min,柱温为30 ℃,建立马钱苷酸含量测定方法;以乙酸乙酯-甲醇-水(10∶2∶1)为展开剂,置紫外光灯(254 nm)下检视,建立薄层鉴别方法;以出膏率、马钱苷酸含量、薄层鉴别图谱为主要评价指标,分析量值传递规律。结果表明:马钱苷酸含量测定、鉴别方法具有较高的稳定性、重复性及可信度;3批双参配方颗粒出膏率均值为18.7%,马钱苷酸含量均值为41.1 mg/g,马钱苷酸含量转移率均值为43.1%,均在15批标准汤剂均值±3SD范围内。马钱苷酸含量测定和薄层色谱鉴别方法可用于双参配方颗粒质量评价,为进一步开展双参配方颗粒研究提供数据基础,并促进少数民族用药现代化。
关键词:
中药药剂学;双参;标准汤剂;马钱苷酸;含量测定
中图分类号:
R283
文献标识码:A
DOI: 10.7535/hbgykj.2024yx03001
收稿日期:2023-11-11;修回日期:2024-04-11;责任编辑:王海云
基金项目:云南省重大科技专项计划项目(202102AA310027)
第一作者简介:
田方(1989—),女,河北石家庄人,主要从事中药配方颗粒工艺方面的研究。
通信作者:
李军山正高级工程师。E-mail:swljs@sina.com
田方,耿彦梅,李雪利,等.
双参饮片—标准汤剂—成品量值传递研究
[J].河北工业科技,2024,41(3):161-168.
TIAN Fang,GENG Yanmei,LI Xueli,et al.
Study on quantity and transfer relationship of Triplostegia glandulifera Wall.ex DC. pieces-standard decoction-finished product
[J]. Hebei Journal of Industrial Science and Technology,2024,41(3):161-168.
Study on quantity and transfer relationship of Triplostegia glandulifera Wall.ex DC. pieces-standard decoction-finished product
TIAN Fang1, GENG Yanmei1, LI Xueli1, GAO Han1, LI Yan2, LI Junshan1,3,4
(1.Shineway Pharmaceutical Group Limited, Shijiazhuang, Hebei 051430, China;2.School of Foreign Languages, Tangshan University, Tangshan, Hebei 063000, China;3.Yunnan Shineway Spirin Pharmaceutical Company Limited, Chuxiong, Yunnan 675000, China;4.Yunnan Province Formula Granules Key Laboratory, Chuxiong, Yunnan 675000, China)
Abstract:
In order to develop Triplostegia glandulifera Wall.ex DC. into foromula granules, a high performance liquid chromatography method for determination and TLC identification of loganic acid in decoction pieces, standard decoction and formula granules of Triplostegia glandulifera Wall.ex DC. were established, and the quantity-value transfer relationship between Triplostegia glandulifera Wall. ex DC. pieces, standard decoction and formula granules was investigated. The Agilent 1260Ⅱ high performance liquid chromatograph and Waters Symmetry C18 column (4.6 mm×250 mm,5 μm) were used with acetonitrile-0.1%phosphoric acid solution as the mobile phase, the column temperature of 30 ℃, the flow rate of 1 mL/min, and the detection wavelength of 240 nm to establish a gradient elution method. Using ethyl acetate-methanol-water (10∶2∶1)as developer, and examination under UV lamp(254 nm), a TLC identification method of Triplostegia glandulifera Wall.ex DC. was established. The transfer rule of the quantity value was analyzed by using the extract rate, the content of maggianin and the TLC as the main evaluation indexes. The results show that the method for the determination and identification of maggianin is stable, reproducible and reliable.The average yield of 3 batches is 18.7%, the average loganic acid content is 41.1 mg/g.and the average loganic acid content transfer rate is 43.1%, all within the mean value ±3SD of 15 batches of standard decoction. Those methods for content determination of loganic acid and TLC identification can be used to evaluate the quality of Triplostegia glandulifera Wall. ex DC. formula granules, provide data basis for further research on Triplostegia glandulifera Wall. ex DC. formula granules, and promote the modernization of medicine for ethnic minorities.
Keywords:
pharmaceutics of Chinese medicine; Triplostegia glandulifera Wall.ex DC.; standard decoction; loganic acid; content determination;
双参,又称萝卜参、童子参,羊蹄参、山苦参、子母参、合合参等,始载于《云南中草药选》[1],为川续断科植物双参(Triplostegia glandulifera Wall.ex DC.)的干燥块根,具有调经活血、益肾的功效,主治闭经、月经不调、肾虚腰痛、遗精、阳痿、不孕症。双参一般于秋季采挖,洗净、干燥而得[2]。
双参是云南少数民族的药用植物,对其研究的现代文献较少,已有文献主要集中在化学成分的分离鉴定及药理作用方面[1,3-17]。研究[1,3-11]发现,双参药材中主要含有环烯醚萜类、三萜类、生物碱类等成分;支雅婧等[18]利用UPLC-ESI-Q-TOF-MS/MS技术快速鉴定出双参药材含有绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、马钱苷、马钱苷酸和樟芽菜苷等化学成分;另有研究[12-17]证明,双参具有降血糖、抗肿瘤、抗病毒、抗应激和抗氧化等作用。此外,文献中报道较多的双参颗粒 [19-22],是由几种不同的中药材制成的中成药复方制剂[23-24],并不含双参药材。双参配方颗粒的研究仍处于空白阶段。
本研究收集15批不同产地的双参饮片,制备出双参的标准汤剂和配方颗粒,并建立马钱苷酸含量测定方法及薄层色谱鉴别方法,以标准汤剂为桥接[25-32],研究双参饮片—标准汤剂—成品马钱苷酸含量和薄层鉴别量值的传递规律,为进一步确立双参配方颗粒质量标准以及更好地开发双参配方颗粒提供技术基础。
1 主要仪器与材料
1.1 仪 器
高效液相色谱仪:Waters Alliance e2695,沃特世公司提供;LC-15C,岛津公司提供;1260 InfinityⅡ,安捷伦科技有限公司提供。色谱柱:Waters Symmetry C18(4.6 mm×250 mm,5 μm),沃特世公司提供;Agilent Eclipse Plus C18(4.6 mm×250 mm,5 μm),安捷伦科技有限公司提供;Thermo Scientific AcclaimTM 120 C18(4.6 mm×250 mm,5 μm),赛默飞世尔科技公司提供。
分析天平,赛多利斯科学仪器(北京)有限公司提供;JM-A5002电子天平(d=0.01 g),余姚市纪铭称重校验设备有限公司提供;水循环真空泵,上海申生科技有限公司提供;超声波清洗器(KQ-250型,功率250 W,频率40 kHz),昆山市超声仪器有限公司提供;三用紫外分析仪(ZF-2型),上海市安亭电子仪器厂提供;养生药膳壶,合肥荣事达小家电有限公司提供;旋转蒸发器(RE-3000型),上海亚荣生化仪器厂提供;冷冻干燥机(FD-1C-50型),北京博医康实验仪器有限公司提供;UPR-II-20L超纯水系统,四川优普超纯科技有限公司提供。
1.2 试 剂
马钱苷酸对照品(批号为111865-202005,纯度为97.5%),中国食品药品检定研究院提供;乙腈(色谱纯),美国Fisher公司提供;磷酸(色谱纯),美国ACS公司提供;超纯水,自制。
1.3 饮 片
15批双参药材经河北省药品检验研究院孙宝惠主任鉴定为川续断科植物双参的干燥块根。将双参药材除去杂质[2],得到双参饮片。样品详细信息见表1。
2 实验部分
2.1 标准汤剂的制备
双参可益肾养肝、健脾宁心,属于滋补用药,结合《中药配方颗粒质量控制与标准制定技术要求》[33]中关于标准汤剂制备的指导原则,将双参饮片煎煮2次,煎煮时间分别以60,40 min为宜;同时,加水量以没过双参饮片3 cm为宜。
取15批双参饮片,分别制备标准汤剂。每次称取双参饮片100 g,置养生药膳壶中,第1次加饮片质量9倍的水,浸泡30 min,武火煮沸后文火保持微沸60 min,药液趁热过200目(0.075 mm,下同)滤布倒出,置于容器中备用;第2次加饮片质量7倍的水,武火煮沸后文火保持微沸40 min,药液趁热过200目滤布倒出,合并2次煎液,快速冷却,真空低温浓缩(温度不超过65 ℃),浓缩至饮片质量(g)与药液体积(mL)的比约为1∶3,浓缩液冷冻干燥,即得双参标准汤剂。
2.2 配方颗粒的制备
经过对不同工艺条件的考察,确定了双参提取制剂的中试工艺:取适量双参饮片,加水煎煮2次,第1次加饮片量10倍的水,煎煮90 min;第2次加饮片量8倍的水,煎煮60 min;滤过,浓缩,喷雾干燥;加适量糊精,制粒。
取序号1—3的3批双参饮片,分别制备成双参配方颗粒。
2.3 含量测定方法
2.3.1 色谱条件
色谱柱为Waters Symmetry C18色谱柱(4.6 mm×250 mm,5 μm),以乙腈-0.1%(体积分数,下同)磷酸为流动相,按表2中的规定进行梯度洗脱。流速为1.0 mL/min,检测波长为240 nm,柱温为30 ℃,进样量为10 μL。理论板数按马钱苷酸峰计算,应不低于5 000。
2.3.2 对照品溶液的制备
取马钱苷酸对照品适量,精密称定,加甲醇制成每l mL含0.2 mg的溶液,即得对照品溶液。
2.3.3 供试品溶液的制备
1)标准汤剂供试品溶液的制备 取双参标准汤剂适量,研细,取约0.1 g,精密称定,置具塞锥形瓶中,精密加入75%(体积分数,下同)甲醇溶液25 mL,称定质量,超声处理(功率为250 W,频率为40 kHz)20 min,放冷,再称定质量,用75%甲醇溶液补足减失的质量,摇匀,滤过,取续滤液,即得。
2)配方颗粒供试品溶液的制备 因配方颗粒中糊精含量较少,折算后的配方颗粒取样量与标准汤剂取样量相近,配方颗粒与标准汤剂物质基础一致,故配方颗粒供试品溶液的制备方法同标准汤剂。
2.4 含量测定方法学考察
2.4.1 专属性考察
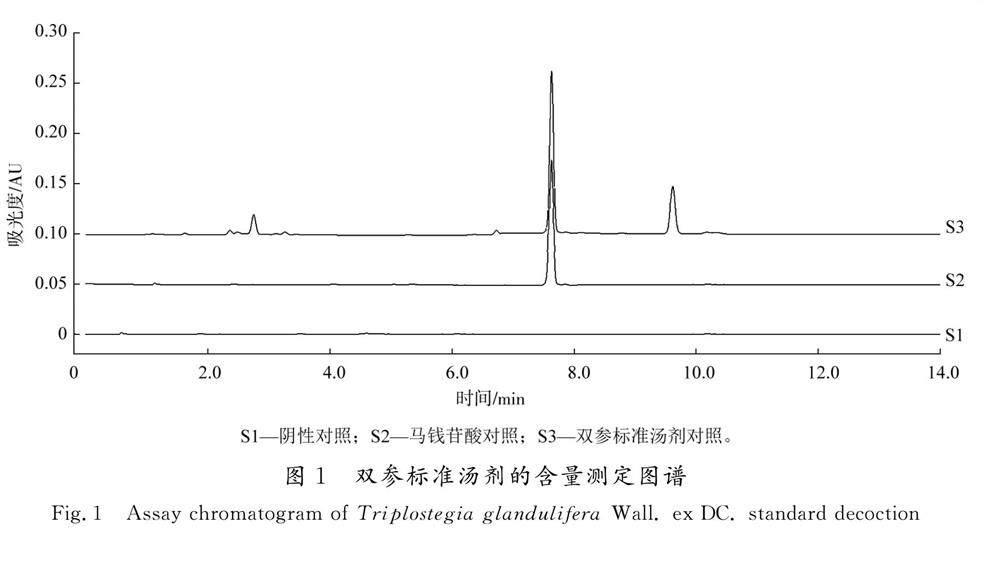
取糊精适量,按2.3.3项供试品溶液制备方法进行制备,得阴性样品溶液。吸取对照品溶液、阴性样品溶液及供试品溶液,按照含量测定条件进行检测,结果见图1。结果表明,辅料糊精对含量测定无干扰,本文所建立的含量测定方法专属性良好,可用于双参标准汤剂和配方颗粒中马钱苷酸含量的测定。
2.4.2 线性考察
精密吸取质量浓度为0.201 3 mg/mL的马钱苷酸对照品溶液,分别取4,6,10,15,20 μL注入液相色谱仪,按2.3.1项下色谱条件进行测定,以马钱苷酸峰面积值为纵坐标Y,马钱苷酸的进样量为横坐标X,绘制标准曲线,回归方程为Y=1.395 9×106X-2.924 9×103,R2=0.999 1,表明马钱苷酸进样质量在0.885 2~4.026 μg线性关系良好。
2.4.3 精密度考察
取批号为2010101双参饮片制备的标准汤剂,按上述2.3.3项供试品溶液制备方法制备供试品溶液,分别精密吸取马钱苷酸的对照品溶液和供试品溶液10 μL,按确定的色谱条件连续进样6次,计算马钱苷酸峰面积的RSD值分别为0.98%,0.64%。结果表明,仪器精密度良好。
2.4.4 重复性考察
取批号为2010101双参饮片制备的标准汤剂,按上述2.3.3项供试品溶液制备方法平行制备6份样品,按确定色谱条件进样,计算马钱苷酸含量的RSD为0.98%,符合《中华人民共和国药典(2020版,四部)》[34](以下简称《中国药典》)规定的≤1.5%。
2.4.5 稳定性考察
取批号为2010101双参饮片制备的标准汤剂,按2.3.3项供试品溶液制备方法制备供试品溶液,分别在溶液放置0,6,12,18,24 h进行测定。马钱苷酸峰面积的RSD为1.13%,表明供试品在24 h内较稳定。
2.4.6 准确度考察
精密称定双参标准汤剂6份,每份约0.05 g,按样品马钱苷酸质量分数的50%,100%,150%分别精密加入马钱苷酸对照品,按供试品制备方法制备供试品溶液。测定后计算加样回收率为98.7%~101.1%,平均回收率为99.50%,RSD为0.98%,符合《中国药典》[34]关于回收率限度为95%~105%的规定。
2.4.7 耐用性考察
1)不同柱温考察
分别在柱温为30,35,40 ℃时,进行马钱苷酸含量的测定,考察不同柱温对含量测定的影响。结果表明,不同柱温条件下进行同一样品的定量检测,马钱苷酸分离良好,结果基本一致,表明柱温在(35±5)℃范围内,耐用性符合要求。
2)不同流速考察
分别在流速为0.9,1.0,1.1 mL/min时,进行马钱苷酸含量的测定,考察不同流速对含量测定的影响。结果表明,以不同流速进行同一样品的定量检测,马钱苷酸分离良好,结果基本一致,表明流速在(1.0±0.1)mL/min范围内,耐用性符合要求。
3)不同检测波长考察
分别在检测波长为235,240,245 nm时,进行马钱苷酸含量的测定,考察不同检测波长对含量测定的影响。结果表明,以不同检测波长进行同一样品的定量检测,马钱苷酸分离良好,结果基本一致,表明波长在(240±5)nm范围内,耐用性符合要求。
4)不同流动相初始比例考察
分别在流动相(乙腈-0.1%磷酸溶液)初始比例为8∶92,9∶91,10∶90(体积比,下同)时,进行马钱苷酸含量的测定,考察不同流动相初始比例对含量测定的影响。结果表明,不同流动相初始比例进行同一样品的定量检测,马钱苷酸分离良好,结果基本一致,表明流动相溶液中乙腈初始体积分数在(9±1)%范围内,耐用性符合要求。
5)不同色谱柱考察
分别采用不同色谱柱(Agilent Eclipse Plus C18,4.6 mm×250 mm,5 μm;Waters Symmetry C18,4.6 mm×250 mm,5 μm;Thermo Scientific AcclaimTM 120 C18,4.6 mm×250 mm,5 μm)对马钱苷酸含量进行测定,考察不同色谱柱对含量测定的影响。结果表明,不同色谱柱进行同一样品的定量检测,马钱苷酸分离良好,结果基本一致,耐用性符合要求。
6)不同色谱仪考察
使用不同液相色谱仪(Waters Alliance e2695,LC-15C,1260 Infinity Ⅱ)对马钱苷酸含量进行测定,考察不同色谱仪对含量测定的影响。结果表明,不同色谱仪进行同一样品的定量检测,马钱苷酸分离良好,结果基本一致,耐用性符合要求。
2.5 鉴别方法
2.5.1 对照品溶液制备
取当药苷对照品,加甲醇制成每1 mL含0.5 mg的溶液,作为对照品溶液。
2.5.2 供试品溶液制备
取本品标准汤剂0.2 g,研细,加甲醇5 mL,超声处理15 min,滤过,滤液作为供试品溶液。
2.5.3 薄层色谱条件
使用硅胶GF254薄层色谱板作为薄层色谱板,以乙酸乙酯-甲醇-水(体积比10∶2∶1)为展开剂,点样量为2~4 μL,在波长为254 nm的紫外光灯下检视。供试品色谱中,在与对照品色谱相应的位置上,显现相同颜色的斑点。
2.6 鉴别方法学考察
2.6.1 专属性考察
取糊精0.2 g,按照2.3.3项供试品溶液制备方法制备阴性样品溶液,分别吸取阴性样品溶液、当药苷对照品溶液与供试品溶液各3 μL,按上述薄层色谱条件展开,检视,如图2所示。结果表明,阴性样品溶液在对照品和供试品溶液相对应位置上不显现相同斑点,故辅料对双参标准汤剂的薄层色谱鉴别无干扰,专属性良好,可用于标准汤剂和配方颗粒的鉴别。
2.6.2 耐用性考察
1)不同品牌硅胶板
采用不同品牌(分别由烟台市化学工业研究所、青岛海洋化工有限公司、德国默克公司提供)的硅胶GF254薄层色谱板,考察双参标准汤剂的展开情况。结果表明,不同品牌的薄层色谱板对双参标准汤剂的鉴别无影响。
2)不同温度
分别在展开温度为20,25,30 ℃时,考察双参标准汤剂展开情况。结果表明,温度为20~30 ℃时对双参标准汤剂的鉴别无影响。
3)不同展开剂比例
分别使用比例为9∶3∶1,10∶2∶1,11∶1∶1的乙酸乙酯-甲醇-水的展开剂,考察双参标准汤剂的展开情况。结果表明,展开剂比例微调对双参标准汤剂的鉴别无影响。
4)不同点样量
分别采用2,3,4 μL点样量,考察双参标准汤剂的展开情况。结果表明,点样量的微小变化对双参标准汤剂的鉴别无影响。
1 铸造工艺设计
3 结果分析及讨论
3.1 马钱苷酸含量测定结果
取15批双参标准汤剂膏粉,分别按2.3.3项方法制备供试品溶液,测定结果如表3所示。
3.2 鉴 别
各取3批双参饮片、标准汤剂、配方颗粒,分别按2.5项方法进行薄层展开,测定结果如图3所示。
由图3显示,双参饮片、标准汤剂、配方颗粒的薄层色谱鉴别图谱斑点和位置一致,表明从饮片到配方颗粒薄层色谱鉴别图谱物质传递一致。
3.3 双参饮片—标准汤剂—配方颗粒量值传递分析
3批双参饮片、15批标准汤剂、3批配方颗粒的出膏率、马钱苷酸含量及含量转移率均值见表4和表5。由表4中15批标准汤剂数据分析可知,不同产地的双参标准汤剂的出膏率、马钱苷酸含量及含量转移率均存在较大差异;表5中3批配方颗粒出膏率、马钱苷酸含量及含量转移率结果表明,双参配方颗粒出膏率、马钱苷酸含量及含量转移率均较稳定,且双参成品的马钱苷酸含量及含量转移率均高于标准汤剂。
由表6可知,除云南双柏外,由相同产地不同批次的双参饮片制得的标准汤剂,其出膏率、马钱苷酸含量及含量转移率均较稳定;云南双柏不同批次的饮片制得的标准汤剂出膏率较稳定,而马钱苷酸在饮片、标准汤剂中的含量及含量转移率均差异较大。
3批双参配方颗粒的出膏率均值为18.7%,马钱苷酸含量均值为41.1 mg/g,马钱苷酸含量转移率均值为43.1%,均在15批标准汤剂均值±3SD范围内。
4 结 语
本文通过采用高效液相色谱法和薄层色谱法,首次建立了彝药双参中马钱苷酸含量测定方法和薄层色谱鉴别方法,明确了饮片—标准汤剂—配方颗粒的物质基础传递规律,为双参配方颗粒质量评价提供了方法,可为双参配方颗粒质量控制的完善、科学提供技术支持。具体结论如下。
1)采用安捷伦1260Ⅱ高效液相色谱仪与Waters Symmetry C18柱(4.6 mm×250 mm,5 μm),以乙腈-0.1%磷酸溶液为流动相进行梯度洗脱,检测波长为240 nm,流速为1 mL/min,柱温为30 ℃,建立马钱苷酸含量测定方法;以当药苷为对照品,以乙酸乙酯-甲醇-水(体积比为10∶2∶1)为展开剂,置于紫外光灯(254 nm)下检视,建立薄层色谱鉴别方法。以上方法均具有较高的稳定性及可信度。
2)取15批双参饮片进行标准汤剂制备,确定了双参标准汤剂的出膏率(13.7%~20.1%)、马钱苷酸含量(25.7~53.1 mg/g)及含量转移率(28.8%~47.3%);进行3批双参配方颗粒的中试制备,配方颗粒出膏率均值为18.7%,马钱苷酸含量均值为41.1 mg/g,马钱苷酸含量转移率均值为43.1%,均在15批标准汤剂均值±3SD范围内;3批配方颗粒出膏率、马钱苷酸含量及含量转移率同其标准汤剂基本一致,饮片—标准汤剂—配方颗粒薄层色谱物质传递一致,表明从双参饮片—标准汤剂—配方颗粒有合理的物质传递规律。
3)弥补了双参标准汤剂和配方颗粒研究的空白,以标准汤剂为桥接,初步探索了制备双参配方颗粒的可行性,为少数民族用药现代化提供了较好的范例。
15批双参标准汤剂的出膏率、马钱苷酸含量及其转移率均存在较大差异,这表明云南省不同地区间的药材存在较大差异,这可能是受地理环境、生长条件的影响[18-23],今后将对不同产地造成差异的影响因素做进一步探究。另外,由于时间和条件所限,笔者未对指纹/特征图谱进行研究,也有待进一步探索。
参考文献/References:
[1]
王小庆.药用植物双参中环烯醚萜类[J].临床医药文献电子杂志,2019,6(64):173.
[2] 云南省食品药品监督管理局.云南省中药材标准:第二册·彝族药[M].2005版.昆明:云南科技出版社,2005:25-26.
[3] 桂萧,王福生.药用植物双参中环烯醚萜类成分研究[J].中国民族民间医药,2018,27(22):37-40.
GUI Xiao,WANG Fusheng.Study on iridoids of medicinal plants Triplostegia glandulifera[J].Chinese Journal of Ethnomedicine and Ethnopharmacy,2018,27(22):37-40.
[4] 陈雅凤,张祖珍,王福生.药用植物双参正丁醇部位化学成分研究[J].大理大学学报,2017,2(4):9-11.
CHEN Yafeng,ZHANG Zuzhen,WANG Fusheng.Study on chemical components from n-butanol fraction of medicinal plants Triplostegia glandulifera[J].Journal of Dali University,2017,2(4):9-11.
[5] 李彩艺,谢文静,王福生.不同分子量双参多糖抗氧化活性研究[J].中国民族民间医药,2020,29(8):34-36.
LI Caiyi,XIE Wenjing,WANG Fusheng.Study on the antioxidant activity of polysaccharides from Triplostegia glandulifera with different molecular weight[J].Chinese Journal of Ethnomedicine and Ethnopharmacy,2020,29(8):34-36.
[6] 张祖珍,陈雅凤,王福生.药用植物双参的三萜类成分研究[J].大理大学学报,2017,2(4):6-8.
ZHANG Zuzhen,CHEN Yafeng,WANG Fusheng.Study on trierpenoid compositions of medicinal plants Triplostegia glandulifera[J].Journal of Dali University,2017,2(4):6-8.
[7] KOCSIS ,SZAB L F,PODNYIB.New bis-iridoids from dipsacus laciniatus[J].Journal of Natural Products,1993,56(9):1486-1499.
[8] 任慧,徐巧林,董丽梅,等.南美蟛蜞菊中的酚酸类化学成分[J].热带亚热带植物学报,2015,23(4):469-473.
REN Hui,XU Qiaolin,DONG Limei,et al.Phenolic compounds from Wedelia trilobata (L.) Hitchc.[J].Journal of tropical and subtropical botany,2015,23(4):469-473.
[9] WANG Liqin,ZHAO Youxing,ZHOU Lu,et al.Lignans from Gnetum montanum Markgr. f. megalocarpua[J].Chemistry of Natural Compounds,2009,45(3):360-361.
[10]周乐,王宁,杨维霞,等.秦岭龙胆的化学成分研究[J].西北农林科技大学学报(自然科学版),2004,32(1):89-92.
ZHOU Le,WANG Ning,YANG Weixia,et al.The chemical consitituents of Gentiana apiata N.E.Br.[J].Journal of Northwest University of A&F(Natural Science Edition),2004,32(1):89-92.
[11]FENG Tao,CAI Xianghai,DU Zhizhi,et al.Iridoids from the bark of Alstonia scholaris[J].Helvetica Chimica Acta,2008,91(12):2247-2251.
[12]刘晓波,郭美仙,李龙星,等.双参降血糖作用的研究[J].云南中医中药杂志,2008,29(5):49-50.
LIU Xiaobo,GUO Meixian,LI Longxing,et al.Study on the hypoglycenmic effect of Triplostegia glandulifera Wall.[J].Yunnan Journal of Traditional Chinese Medicine and Materia Medica,2008,29(5):49-50.
[13]刘晓波,郭美仙,施贵荣,等.双参降血糖作用机制研究[J].安徽农业科学,2012,40(33):16111-16112.
LIU Xiaobo,GUO Meixian,SHI Guirong,et al.Studies on hypoglycemic mechanism of Triplostegia glandulifera Wall.[J].Journal of Anhui Agricultural Sciences,2012,40(33):16111-16112.
[14]刘晓波,郭美仙,徐静,等.双参对小鼠抗应激作用的实验研究[J].现代医药卫生,2008,24(9):1265-1266.
LIU Xiaobo,GUO Meixian,XU Jing,et al.Study on the anti-stimulation action of Triplostegia glandulifera Wall[J].Journal of Modern Medicine & Health,2008,24(9):1265-1266.
[15]米丹,李彩艺,杨宗斌,等.响应面法优化双参多糖的提取工艺研究[J].大理大学学报,2020,5(2):43-49.
MI Dan,LI Caiyi,YANG Zongbin,et al.Research on extraction technology of polysaccharides from Triplostegia glandulifera by response surface methodology[J].Journal of Dali University,2020,5(2):43-49.
[16]李扬.马钱苷对脂质代谢及ApoCⅢ诱导的NF-κB信号通路的影响[D].长春:吉林大学,2016.
LI Yang.Influence of Loganin on Lipid Metabolism and NF-κB Signaling Induced by ApoCⅢ[D].Changchun:Jilin Univer-sity,2016.
[17]王菲菲,张聿梅,郑笑为,等.环烯醚萜类化合物的结构和生物学活性研究进展[J].中国药事,2019,33(3):323-330.
WANG Feifei,ZHANG Yumei,ZHENG Xiaowei,et al.Research progress of the structure and biological activities of iridoids compounds[J].Chinese Pharmaceutical Affairs,2019,33(3):323-330.
[18]支雅婧,甄亚钦,郗仲玟,等.基于UPLC-ESI-Q-TOF-MS/MS技术快速鉴定彝族药双参的化学成分[J].中国药学杂志,2022,57(19):1611-1620.
ZHI Yajing,ZHEN Yaqin,XI Zhongwen,et al.Identification of chemical constituents in Triplostegia glandulifera Wall by UPLC-ESI-Q-TOF-MS/MS[J].Chinese Pharmaceutical Journal,2022,57(19):1611-1620.
[19]成万华,杨晓雪,蔡红娟,等.双参颗粒促进心肌梗死大鼠心肌血管生成的机制[J].心脏杂志,2023,35(4):389-395.
CHENG Wanhua,YANG Xiaoxue,CAI Hongjuan,et al.Mechanism of Shuangshen Granules promoting myocardial angiogenesis in rats with myocardial infarction[J].Chinese Heart Journal,2023,35(4):389-395.
[20]亓润智,米雪,赵雨薇,等.双参颗粒对肺癌小鼠肿瘤相关巨噬细胞的抑制作用[J].中华中医药杂志,2021,36(5):2652-2656.
QI Runzhi,MI Xue,ZHAO Yuwei,et al.Inhibitory effects of Shuangshen Granules on tumor-associated macrophages in mice with lung cancer[J].China Journal of Traditional Chinese Medicine and Pharmacy,2021,36(5):2652-2656.
[21]魏华民,俞静,郭秋均,等.肺转移前微环境体外模型的建立与双参颗粒干预机制[J].世界中医药,2021,16(6):906-910.
WEI Huamin,YU Jing,GUO Qiujun,et al.Establishment of an in vitro model of microenvironment before lung metastasis and the intervention mechanism of Shuangshen Granule[J].World Chinese Medicine,2021,16(6):906-910.
[22]姜丽萍,侯会芳,王振波,等.复方双参颗粒中人参皂苷含量测定[J].人参研究,2019,31(4):11-16.
JIANG Liping,HOU Huifang,WANG Zhenbo,et al.Determination of ginsenoside content in compound granules from red ginseng and sea cucumber[J].Ginseng Research,2019,31(4):11-16.
[23]李桂荣,侯会芳,尚金燕,等.复方双参颗粒制备方法的研究[J].人参研究,2019,31(4):5-7.
LI Guirong,HOU Huifang,SHANG Jinyan,et al.Study on the preparation method of compound granules about red ginseng and sea cucumber[J].Ginseng Research,2019,31(4):5-7.
[24]付佳,苑广信,安丽萍,等.双参颗粒剂的制备[J].时珍国医国药,2018,29(3):598-600.
[25]王萌,解红刚,黄能听,等.经典名方完带汤复方制剂关键质量属性及量值传递研究[J].西部中医药,2023,36(3):68-77.
WANG Meng,XIE Honggang,HUANG Nengting,et al.Research on key quality attributes and quantity transfer of classical formula Wandai Tang compound preparation[J].Western Journal of Traditional Chinese Medicine,2023,36(3):68-77.
[26]万莹莹,杜微波,陈敬然,等.金银花饮片—标准汤剂量质传递研究[J].河北工业科技,2022,39(2):129-134.
WAN Yingying,DU Weibo,CHEN Jingran,et al.Study on quantity-quality transfer from Lonicera Japonica Flos to standard decoction[J].Hebei Journal of Industrial Science and Technology,2022,39(2):129-134.
[27]郭秀丽,宋成程,肖扬鑫,等.麸炒茅苍术及其不同物化形式标准汤剂中挥发油的量质传递规律分析[J].中国实验方剂学杂志,2023,29(12):168-174.
GUO Xiuli,SONG Chengcheng,XIAO Yangxin,et al.Analysis of quality value transmitting of volatile oil in bran-processed Atractylodes lancea and its standard decoction with different physicochemical forms[J].Chinese Journal of Experimental Traditional Medical Formulae,2023,29(12):168-174.
[28]窦志华,许波,居宇峰,等.栀子标准汤剂量值传递规律研究[J].中草药,2021,52(23):7162-7175.
DOU Zhihua,XU Bo,JU Yufeng,et al.Study on law of quality value transmitting of Gardeniae Fructus standard decoction[J].Chinese traditional and herbal drugs,2021,52(23):7162-7175.
[29]严露,蒲婧哲,管悦琴,等.百蕊草药材与标准汤剂量值传递规律研究及分析[J].中草药,2023,54(4):1098-1105.
YAN Lu,PU Jingzhe,GUAN Yueqin,et al.Study and analysis on transmission law of quantity value between Thesii Herba and standard decoction[J].Chinese Traditional and Herbal Drugs,2023,54(4):1098-1105.
[30]王相,孙帅,王鑫国,等.以标准汤剂为基准的小红参配方颗粒量值传递研究[J].中国药物警戒,2023,20(8):891-898.
WANG Xiang,SUN Shuai,WANG Xinguo,et al.Quantitative transfer relationships of Rubia yunnanensis Diels formula granules based on standard decoctions[J].Chinese Journal of Pharmacovigilance,2023,20(8):891-898.
[31]马智玲,陈敬然,杜微波,等.基于UPLC指纹图谱的西洋参饮片、标准汤剂、配方颗粒的质量相关性研究[J].河北工业科技,2023,40(5):387-396.
MA Zhiling,CHEN Jingran,DU Weibo,et al.Study on the quality correlation of American Ginseng decoction pieces,standard decoctions and formula granules based on UPLC fingerprint[J].Hebei Journal of Industrial Science and Technology,2023,40(5):387-396.
[32]耿彦梅,高晗,李雪利,等.枳实标准汤剂质量研究[J].河北工业科技,2021,38(1):63-70.
GENG Yanmei,GAO Han,LI Xueli,et al.Study on quality of Aurantii Fructus Immaturus standard decoction[J].Hebei Journal of Industrial Science and Technology,2021,38(1):63-70.
[33]国家药监局.国家药监局关于发布《中药配方颗粒质量控制与标准制定技术要求》的通告[EB/OL].(2021-01-26)[2023-11-10].https://www.gov.cn/zhengce/zhengceku/2021-02/11/content_5586817.htm.
[34]国家药典委员会.中华人民共和国药典:四部[M].2020版.北京:中国医药科技出版社,2020:482.
