肺结核患者氟喹诺酮类耐药影响因素预测模型的构建与验证:基于LASSO-Logistic回归模型
2024-07-09秦娅莉陈静李军王明栋欧维正邱继瑶彭燕清
秦娅莉 陈静 李军 王明栋 欧维正 邱继瑶 彭燕清


【摘要】 背景 利福平耐药/耐多药结核病(RR/MDR-TB)治疗困难,治愈率低,且传染性强,氟喹诺酮类(FQs)作为治疗RR/MDR-TB的核心药物,耐药趋势严峻,对FQs影响因素进行分析有助于提高RR/MDR-TB的治愈率,并控制准广泛耐药(pre-XDR)和广泛耐药结核病的发生。目的 分析住院肺结核患者FQs耐药情况及影响因素,构建FQs耐药危险因素的列线图(Nomogram)预测模型并进行验证。方法 回顾性选取于2021年1月—2022年2月在贵阳市公共卫生救治中心住院且有药物敏感试验结果的583例肺结核患者为研究对象。根据治疗史将患者分为初治组(296例)和复治组(287例);根据FQs耐药情况将患者分为FQs耐药组(63例)和FQs敏感组(520例)。分析患者对13种抗结核药物总耐药分布情况,比较FQs耐药组与FQs敏感组肺结核患者的基线特征。采用LASSO回归模型筛选特征变量后,行多因素Logistic回归分析FQs耐药的独立危险因素,并构建Nomogram预测模型;采用受试者工作特征(ROC)曲线下面积(AUC)、校准曲线对其进行验证。结果 583例患者中FQs敏感520例,耐药63例,耐药率为10.81%,仅次于一线抗结核药异烟肼、利福平、链霉素、乙胺丁醇总耐药率(36.36%、32.76%、21.61%、12.86%)。复治组患者利福平、异烟肼、乙胺丁醇、链霉素、左氧氟沙星、莫西沙星、利福平耐药(RR)、耐多药(MDR)、pre-XDR耐药率高于初治组(P<0.05)。FQs耐药组患者其他民族、复治、艾滋病、吸毒史、空洞、咯血、不规则抗结核史、MDR占比高于FQs敏感组(P<0.05)。LASSO回归筛选出6个变量:民族、治疗史、艾滋病、吸毒史、咯血、MDR;多因素Logistic回归分析结果显示,其他民族(OR=2.313,95%CI=1.153~4.640,P=0.018)、复治(OR=1.892,95%CI=1.005~3.560,P=0.048)、咯血(OR=1.941,95%CI=1.087~3.465,P=0.025)、MDR(OR=3.342,95%CI=2.398~7.862,P<0.001)是肺结核患者FQs耐药的独立危险因素;Logistic回归方程Logit(P)=-3.571+0.838×民族+0.638×治疗史+0.663×咯血+1.468×MDR,基于此构建风险Nomogram预测模型,AUC为0.796(95%CI=0.717~0.876),Bootstrap法验证平均绝对误差为0.015,通过Hosmer-Lemeshow拟合优度检验,预测模型有较好的校准能力(χ2=3.426,P=0.489)。结论 肺结核患者FQs耐药率较高,其他民族、复治、咯血、MDR是肺结核患者FQs耐药的独立危险因素,构建Nomogram预测模型对于肺结核患者FQs耐药具有较好的预测价值,能够为临床诊断耐药结核病及为RR/MDR-TB制订合理治疗方案提供新思路。
【关键词】 结核,肺;氟喹诺酮类;结核分枝杆菌;药物敏感试验;广泛耐药结核;耐多药结核;危险因素;列线图
【中图分类号】 R 521 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0909
Construction and Validation of a Predictive Model of Influencing Factors for Fluoroquinolone Resistance in Patients with Pulmonary Tuberculosis:Based on the LASSO-Logistic Regression Model
QIN Yali1,CHEN Jing1,2*,LI Jun1,WANG Mingdong3,OU Weizheng3,QIU Jiyao2,PENG Yanqing2
1.School of Public Health/the Key Laboratory of Environmental Pollution Monitoring and Disease Control,Ministry of Education,Guizhou Medical University,Guiyang 561113,China
2.Department of Tuberculosis,Guiyang Public Health Clinical Center,Guiyang 550003,China
3.Department of Laboratory,Guiyang Public Health Clinical Center,Guiyang 550003,China
*Corresponding author:CHEN Jing,Chief physician;E-mail:chenjingfk@sina.cn
【Abstract】 Background Rifampicin-resistant/multidrug-resistant tuberculosis(RR/MDR-TB)is featured by challenges in the treatment,low cure rate,and high infectivity. Fluoroquinolones(FQs),as the core drugs for the treatment of RR/MDR-TB,have a severe trend of resistance. Analyzing influencing factors for FQs can help to increase the cure rate of RR/MDR-TB and to control the occurrence of the pre-extensive drug resistance(pre-XDR)and extensive drug resistance. Objective To analyze the drug resistance of FQs in hospitalized patients with pulmonary tuberculosis and the influencing factors,and to construct and validate a Nomogram prediction model for the risk factors of drug resistance of FQs. Methods A total of 583 patients with pulmonary tuberculosis who were hospitalized in Guiyang Public Health Clinical Center from January 2021 to February 2022 and tested for drug sensitivity were retrospectively selected as study subjects. They were divided into the initial treatment group(296 patients)and the retreatment group(287 patients)according to the history of previous treatment. Moreover,they were divided into the FQs-resistant group(63 patients)and FQs-sensitive group(520 patients)according to their FQs-resistance status. The distribution of total resistance to 13 antituberculosis drugs in 583 patients was analyzed,and the baseline characteristics of patients in the FQs-resistant group and FQs-sensitive group were compared. After screening the characteristic variables using least absolute shrinkage and selection operator(LASSO)regression model,multivariate Logistic regression was performed to analyze the independent risk factors for the resistance of FQs. A Nomogram prediction model was constructed,and its performance was validated by calculating the area under the curve(AUC)of receiver operating characteristic(ROC),and plotting the calibration curve. Results Among 583 patients,520 cases were sensitive to FQs and 63 cases were resistant(resistance rate of 10.81%). The resistance rate of FQs was secondary to the total resistance rate of first-line antituberculosis drugs,including the isoniazid(36.36%),rifampicin(32.76%),streptomycin(21.61%),and ethambutol
(12.86%). The resistance rates of rifampicin,isoniazid,ethambutol,streptomycin,levofloxacin,moxifloxacin and rifampicin resistance(RR),multidrug resistance(MDR),and pre-XDR were significantly higher in patients of the retreatment group than those of the initial treatment group(P<0.05). The proportions of patients with other ethnic,retreatment,acquired immunodeficiency syndrome(AIDS),history of drug abuse,cavitation,hemoptysis,history of irregular anti-TB and MDR were significantly higher in the FQs-resistance group than those of the FQs-sensitive group(P<0.05). Through LASSO regression,six variables of ethnicity,treatment history,AIDS,drug abuse history,hemoptysis,and MDR were screened out as influencing factors. Multivariate Logistic regression analysis showed that other ethnic(OR=2.313,95%CI=1.153-4.640,P=0.018),retreatment(OR=1.892,95%CI=1.005-3.560,P=0.048),hemoptysis(OR=1.941,95%CI=1.087-3.465,P=0.025),and MDR(OR=3.342,95%CI=2.398-7.862,P<0.001)were the independent risk factors for FQs resistance in patients with pulmonary tuberculosis. Logistic regression equation Logit(P)=-3.571+0.838×ethnicity+
0.638×treatment history+0.663×hemoptysis+1.468×MDR. Based on which a risk Nomogram prediction model was constructed with an AUC of 0.796(95%CI=0.717-0.876). The Bootstrap method validated the mean absolute error of 0.015,and the predictive model had good calibration ability by the Hosmer-Lemeshow goodness-of-fit test(χ2=3.426,P=0.489). Conclusion Our findings suggest a high resistant rate of FQs in patients with pulmonary tuberculosis. Other ethnic,retreatment,hemoptysis,and MDR are independent risk factors for FQs resistance in patients. The constructed Nomogram prediction model has a good predictive value for FQs resistance in patients with pulmonary tuberculosis. Our study offers new insights into the clinical diagnosis of drug-resistant tuberculosis and the development of rational treatment regimens for RR/MDR-TB.
【Key words】 Tuberculosis,pulmonary;Fluoroquinolones;Mycobacterium tuberculosis;Drug susceptibility testing;Extensively drug-resistant tuberculosis;Multidrug-resistant tuberculosis;Risk factors;Nomograms
耐药结核病仍然是全球结核病控制工作所面临的严峻问题。WHO报道2022年全球约有41万人罹患利福平耐药/耐多药结核病(RR/MDR-TB),但仅有43%的患者得以确诊而纳入治疗。RR/MDR-TB治疗困难,治愈率低,且传染性强,疗程相对敏感结核病要长[1-2]。
氟喹诺酮类(FQs)中左氧氟沙星和莫西沙星是治疗RR/MDR-TB首选的核心药物,主要抑制结核分枝杆菌(MTB)DNA解旋酶A亚单位,阻止DNA复制与转录,从而达到杀灭MTB的作用[3]。FQs作为新一代广谱抗菌药,对革兰阳性、阴性菌也有抗菌作用,近年来FQs被广泛用于临床抗感染治疗中,导致FQs耐药性增加致使RR/MDR-TB治疗复杂。若在耐多药(MDR)基础上MTB对FQs耐药,就会成为准广泛耐药(pre-XDR),甚至广泛耐药(XDR),治疗更困难更复杂[4]。目前耐药结核病诊断主要依靠表型药物敏感试验和基因型检测;表型药物敏感试验仍是耐药结核病诊断金标准,但耗时较长,易延误治疗。分子生物学检测主要包括Xpert MTB/RIF、基因芯片技术和荧光PCR熔解曲线法,虽快速简便,但Xpert MTB/RIF只能检测利福平,基因芯片技术只能检测利福平和异烟肼,荧光PCR熔解曲线法除可检测利福平、异烟肼外,还可检测FQs耐药性,但由于试剂盒可能存在局限性、耐药机制复杂性、异质性耐药等原因,以及经济、医疗水平差异性,部分地区只能诊断RR/MDR-TB,导致患者FQs耐药信息仍不能明确诊断。
近年来,诸多学者将列线图(Nomogram)预测模型应用于各项临床研究中,具有良好预测价值;尽管有学者报道FQs耐药的影响因素,但构建Nomogram预测模型的研究相对匮乏。本研究基于LASSO回归模型筛选特征变量,构建FQs耐药风险预测Nomogram模型并进行验证,与药敏试验相结合,可为临床准广泛耐药结核病(pre-XDR-TB)及RR/MDR-TB的诊断及治疗方案的合理制订提供新思路。
1 对象与方法
1.1 研究对象
回顾性选取2021年1月—2022年2月于贵阳市公共卫生救治中心住院且有药物敏感试验结果的583例肺结核患者为研究对象。纳入标准:符合《肺结核诊断(WS+288-2017)》标准[5],痰培养结果为阳性,且菌种鉴定为MTB,患者临床分离株均进行传统表型药物敏感试验。排除标准:一般人口学资料、实验室检查资料、影像学资料不完整者。本研究经贵阳市公共卫生救治中心伦理委员会批准(20220322),因研究为回顾性研究,豁免研究对象知情同意。
1.2 研究方法
1.2.1 资料收集:从电子病历系统收集患者以下资料:年龄、性别、民族、吸烟史、饮酒史、结核接触史、粉尘接触史、初治复治情况、合并肺外结核情况、耐药情况、抗结核情况、糖尿病、高血压、艾滋病、吸毒史、胸部CT是否合并空洞、症状伴咯血、发热等。
1.2.2 MTB培养及菌种鉴定:将患者痰液或肺泡灌洗液标本加1~2倍体积4%NaOH处理,消化后的标本均匀接种于罗氏固体培养基斜面上,每周观察1次,发现有菌落生长则报告阳性,若8周末结束仍无细菌生长则报告阴性。分离的菌株接种于对硝基苯甲酸(PNB)/噻吩-2羟酸肼(TCH)培养基上,非MTB生长迅速,1周左右可见生长,生长缓慢的分枝杆菌4周报告结果。若PNB培养基上无菌落生长,TCH培养基上有菌落生长,则为人型MTB;PNB和TCH培养基上均有菌落生长,则为非MTB。实验操作严格按照《结核病实验检验规程》[6]执行。
1.2.3 传统表型药物敏感试验:采用微孔板法进行药物敏感试验,主要由药敏培养基和药敏测试板组成,药敏测试板提供不同种类及浓度的药物,将一定量的菌接种到培养液混匀后分装至药敏测试板培养,药物敏感性结果根据各含药孔、对照孔的生长判断。本研究收集了4种一线和9种二线结核药物药敏结果,药物浓度分别为:异烟肼0.2 μg/mL、利福平0.25 μg/mL、乙胺丁醇2.5 μg/mL、链霉素1.0 μg/mL、左氧氟沙星1.0 μg/mL、莫西沙星0.25 μg/mL、阿米卡星1.0 μg/mL、卷曲霉素2.5 μg/mL、卡那霉素2.5 μg/mL、克拉霉素4.0 μg/mL、丙硫异烟肼10.0 μg/mL、对氨基水杨酸2.0 μg/mL、氯法齐明2.0 μg/mL。药物敏感试验检测步骤根据分枝杆菌药敏检测试剂盒(培养法)说明书进行。每批次的培养、菌种鉴定和药物敏感试验均以MTB标准菌株 H37Rv(ATCC25277)作为对照。
1.3 耐药结核病相关定义
利福平耐药结核病(RR-TB):结核病患者感染的MTB对利福平耐药(包含对其他药耐药);耐多药结核病(MDR-TB):结核病患者感染的MTB至少对异烟肼和利福平同时耐药;pre-XDR-TB:在MDR基础上同时对任意一种FQs耐药;广泛耐药结核病(XDR-TB):在MDR基础上同时对任意一种FQs以及至少一种A组药物(贝达喹啉、利奈唑胺)耐药。
1.4 分组
根据患者治疗史将583例肺结核患者分为初治组(296例)和复治组(287例)。
根据患者FQs耐药(对左氧氟沙星和莫西沙星任意一种耐药)情况将583例肺结核患者分为FQs耐药组(63例)和FQs敏感组(520例)。
1.5 统计学方法
采用SPSS 26.0和R 4.3.0进行统计学分析。计数资料以[例(%)]表示,比较采用χ2检验或Fisher's确切概率法。以7∶3比例随机为训练组408例和验证组175例,采用R 4.3.0 “glmnet”包进行LASSO回归筛选变量,基于此构建肺结核患者FQs耐药影响因素的多因素Logistic回归模型,并利用GraphPad Prism 8绘制森林图,采用R 4.3.0“rms”包构建FQs耐药风险Nomogram预测模型;采用受试者工作特征(ROC)曲线下面积(AUC)评估模型预测价值,Bootstrap法进行验证,采用Hosmer-Lemeshow检验模型的拟合度。以双侧检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 耐药分布情况
583例肺结核患者中,初治患者296例(50.77%),复治患者287例(49.23%);13种药物全部敏感为297例,传统药物敏感试验结果显示,在初复治肺结核患者中抗结核药物总耐药率顺位:异烟肼(36.36%)>利福平(32.76%)>链霉素(21.61%)>乙胺丁醇(12.86%)>莫西沙星(10.46%)>左氧氟沙星(10.12%)>克拉霉素(5.49%)>卷曲霉素(3.40%)=卡那霉素(3.40%)>对氨基水杨酸(2.92%)>氯法齐明(2.74%)>阿米卡星(2.57%)>丙硫异烟肼(0.34%)。FQs耐药率为10.81%,在复治患者FQs耐药率16.03%(46/287)显著高于初治患者5.74%(17/296)。RR耐药率为4.50%,MDR耐药率为21.27%,pre-XDR耐药率为5.83%,XDR耐药率为1.20%。
复治组肺结核患者利福平、异烟肼、乙胺丁醇、链霉素、左氧氟沙星、莫西沙星、RR、MDR、pre-XDR耐药率高于初治组,差异有统计学意义(P<0.05);两组肺结核患者阿米卡星、卷曲霉素、卡那霉素、克拉霉素、丙硫异烟肼、对氨基水杨酸、氯法齐明、XDR耐药率比较,差异无统计学意义(P>0.05),见表1。
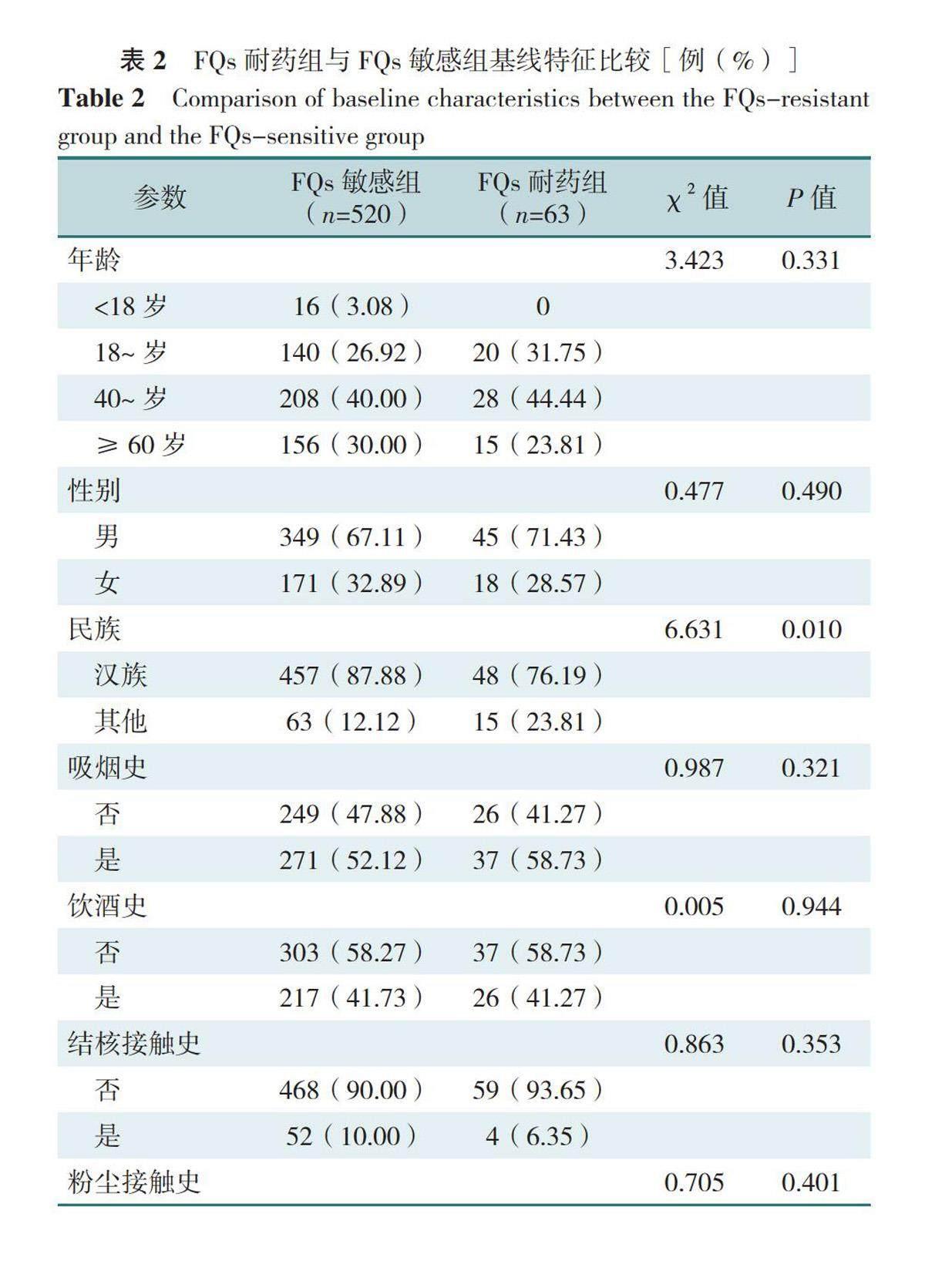
2.2 FQs耐药组与FQs敏感组基线特征比较
583例肺结核患者中男394例(67.58%)、女189例(32.42%),平均年龄为(48.5±17.8)岁;FQs敏感患者520例(89.19%)、耐药患者63例(10.81%)。两组肺结核患者年龄、性别、吸烟史、饮酒史、结核接触史、粉尘接触史、糖尿病、高血压、合并肺外结核比较,差异无统计学意义(P>0.05);FQs耐药组肺结核患者其他民族、复治、艾滋病、吸毒史、空洞、咯血、不规则抗结核、MDR占比高于FQs敏感组,差异均有统计学意义(P<0.05),见表2。
2.3 LASSO回归模型进行FQs耐药影响因素筛选
基于文献支持、研究目标、数据可获得性选择了20个变量(年龄、性别、民族、吸烟史、饮酒史、结核接触史、粉尘接触史、治疗史、糖尿病、高血压、艾滋病、吸毒史、抗结核情况、合并肺外结核、MDR、咳嗽咳痰、盗汗、发热、咯血、胸部CT伴空洞)纳入LASSO回归模型对特征变量进行筛选,通过10次折叠交叉验证来选择最佳λ值,当λ为0.017时,共筛选出最佳变量6个(民族、治疗史、艾滋病、吸毒史、咯血、MDR),见图1A、1B。
2.4 肺结核患者FQs耐药影响因素的多因素Logistic回归分析
将上述LASSO回归模型筛选出的6个因素民族(赋值:汉族=0,其他民族=1)、治疗史(赋值:初治=0,复治=1)、艾滋病(赋值:否=0,是=1)、吸毒史(赋值:否=0,是=1)、咯血(赋值:否=0,是=1)、MDR(赋值:否=0,是=1)作为自变量,以肺结核患者FQs耐药情况为因变量(赋值:敏感=0,耐药=1)进行多因素Logistic回归分析,结果显示,其他民族、复治、咯血、MDR是肺结核患者FQs耐药的独立危险因素(P<0.05),见表3。
2.5 Nomogram预测模型的构建
根据多因素Logistic回归模型分析结果构建回归方程Logit(P)=-3.571+0.838×民族+0.638×治疗史+0.663×咯血+1.468×MDR,基于此,建立FQs耐药影响因素的Nomogram预测模型;该模型每个变量的端点向上作一条垂直线,对应上方分值,将每个变量的分数相加得出总分,总分向下作一垂线对应最底部预测概率即可得到FQs耐药发生的风险,见图2。
2.6 Nomogram预测模型的评价与验证
采用ROC曲线评估Nomogram预测模型效能,AUC为0.796(95%CI=0.717~0.876),该模型有较好的预测效果(图3A)。采用Bootstrap法内部重复抽样1 000次进行验证,平均绝对误差为0.015;采用Hosmer-Lemeshow拟合优度检验对预测模型的校准能力进行评估,结果表明,χ2=3.426,P=0.489>0.05,模型的预测值与实际观测值之间差异无统计学意义,预测模型具有较好的校准能力,说明有较好的拟合度(图4A)。再以验证组的数据进行外部验证,Nomogram预测模型的AUC为0.719(95%CI=0.591~0.846),外部验证结果有良好的区分度,见图3B、4B。
3 讨论
中国是RR/MDR-TB高负担国家之一,其传染性强,治疗难度大。WHO将FQs推荐作为治疗RR/MDR-TB首选核心药物,近年来,随着FQs在临床上广泛使用,尤其是我国呼吸和结核领域的滥用,耐药率呈逐年上升趋势。若在RR/MDR-TB基础上发生FQs耐药,则发展成pre-XDR-TB,甚至XDR-TB,诊疗周期变长,治愈率降低,对耐药结核病的防控构成严重威胁[1,4]。由此,除对FQs进行快速检测外,分析其耐药情况及耐药影响因素至关重要。过去有研究表明FQs耐药受多种因素影响,但预测耐药发生的临床预测模型等方面研究仍相对匮乏,本研究通过LASSO回归模型筛选变量,从而构建Nomogram预测模型并验证,可为临床的诊疗提供重要参考价值。
本研究583例肺结核患者,RR、MDR、pre-XDR、XDR耐药率分别为4.50%、21.27%、5.83%、1.20%,与珠海市一项研究结果相近[7],RR耐药率低于天津[8]、云南[9],但MDR、XDR耐药率均高于天津[8]、云南[9]、河南[10]等地区的研究;由于医疗条件、经济水平不同,耐药结核病也存在一定地域差异性,贵州省是全国结核病高发省份,耐药结核病的问题也相对严峻。本研究FQs耐药率为10.81%,仅低于一线抗结核药异烟肼、利福平、链霉素、乙胺丁醇耐药率(36.36%、32.76%、21.61%、12.86%),与既往研究者结果相似[8,11];SONG等[12]的中国MDR MTB耐药特性的一项研究提示FQs耐药率在MDR-TB中较高,莫西沙星和左氧氟沙星耐药率高达40%。FQs耐药的严峻性给RR/MDR-TB的治疗带来了困难与挑战[13]。
LASSO回归是一种基于惩罚函数的模型,可有效压缩回归系数,使用LASSO回归能够筛选出最具有代表性的预测因子,可处理具有复共线性数据有偏估计的问题。本研究LASSO-Logistic回归分析结果显示,其他民族、复治、咯血、MDR是肺结核患者FQs耐药的独立危险因素。贵州省是少数民族分布比较集中的省份之一,可能由于经济、文化水平的落后、语言交流的障碍,住院患者在出院后误认为是痊愈出院,而对结核病规范化全程治疗知晓匮乏;在甘肃一项MDR影响因素分析中显示,少数民族是MDR的危险因素(OR=2.56,95%CI=1.24~5.28),但未明确表明是FQs耐药的危险因素[14],该观点还需增加样本量后待研究证实。本研究复治患者FQs耐药率(16.03%)显著高于初治患者(5.74%),复治患者是FQs耐药的危险因素,与既往研究结果一致[15-17]。这可能与抗结核药常引起各种不良反应使患者难以耐受,未满疗程自行停药有关;或是复治患者在反复治疗过程中,发生交叉感染,与耐药结核病人的接触发生耐药[18]。肺结核患者常合并肺部空洞,空洞波及肺部血管,致患者咯血。有研究表明,肺部空洞越多,越容易发生耐药可能,考虑此类患者含大量MTB,耐药菌株发展成优势菌,增加相互传播的机会[11,19-20]。本研究结果显示,MDR-TB患者更易发生FQs耐药,FQs作为广谱抗菌药,对常见病原体有较好的抗菌活性,被广泛应用于抗感染治疗中;MDR-TB患者在治疗前可能暴露过FQs治疗,或是本身治疗困难,致依从性差,导致耐药[18,21]。呼吁临床医生治疗肺结核患者时,参照FQs药敏检测和耐药特征制订规范化治疗,警惕pre-XDR-TB与XDR-TB的发生。
本研究在LASSO回归模型的基础上筛选变量,行多因素Logistic回归分析,通过构建Nomogram预测模型,可将复杂的多因素Logistic回归分析结果可视化,从而通过简单图形展示,来计算FQs耐药发生的预测概率。采用ROC曲线评估模型的效能,AUC为0.796(95%CI=0.717~0.876),这与张奇等[22]研究中构建的粉尘工人肺功能异常的风险预测模型结果接近,说明Nomogram模型具有较好的预测价值。本文通过绘制校准曲线,Hosmer-Lemeshow拟合优度检验来评价预测模型的校准能力,P>0.05,预测模型有较好的校准能力,本研究外部验证也表现出较好的区分度,Nomogram模型可为FQs耐药的发生提供参考价值,临床工作者可根据模型进行个性化的预测,对预测结果给予高风险人群健康宣教与干预,提示患者在治疗过程中要早期、联合、规律、适量、全程用药,进而降低FQs耐药率。若不能明确FQs是否耐药时,该模型对临床诊断性耐药有一定参考价值。
本研究也存在一定局限性,患者均来自同一医院的住院患者,对于FQs耐药影响因素的分析代表性有限,可在今后研究中增加多家医院及样本量的研究。由于患者信息通过医院病历系统获得,未记录研究对象在入院前是否使用过FQs药物,这对于预测FQs耐药具有重要参考意义。
综上所述,其他民族、复治、咯血、MDR是肺结核患者FQs耐药的独立危险因素,基于LASSO-Logistic构建Nomogram模型预测FQs耐药具有较好的预测价值。应加强FQs耐药危险因素的研究,对于只能检测利福平和异烟肼耐药的地区,以及FQs耐药检测不能明确诊断时,该模型能够为临床诊断耐药结核及RR/MDR-TB制订合理治疗方案提供新思路,提高RR/MDR-TB的治愈率,并针对危险因素采取有效的干预措施,从而控制pre-XDR-TB和XDR-TB的发生。
作者贡献:秦娅莉负责数据收集、整理、分析,撰写论文;陈静负责设计方案,研究指导,论文修订;李军负责研究指导,审阅文章;王明栋、欧维正负责获取数据及核对数据;邱继瑶、彭燕清负责临床资料解释,文章指导。
本文无利益冲突。
秦娅莉:https://orcid.org/0009-0004-8565-3234
陈静:https://orcid.org/0009-0002-8644-9425
参考文献
World Health Organization. Global tuberculosis report 2023[R]. Geneva:World Health Organization,2023.
NAHID P,MASE S R,MIGLIORI G B,et al. Treatment of drug-resistant tuberculosis. An official ATS/CDC/ERS/IDSA clinical practice guideline[J]. Am J Respir Crit Care Med,2019,200(10):e93-142. DOI:10.1164/rccm.201909-1874ST.
CHEN T C,LU P L,LIN C Y,et al. Fluoroquinolones are associated with delayed treatment and resistance in tuberculosis:a systematic review and meta-analysis[J]. Int J Infect Dis,2011,15(3):e211-216. DOI:10.1016/j.ijid.2010.11.008.
詹建,游国庆,何霞,等. 两种结核分枝杆菌氟喹诺酮类药物耐药性检测方法比较及不一致原因初探[J]. 中国防痨杂志,2023,45(11):1058-1063. DOI:10.19982/j.issn.1000-6621.20230161.
中华人民共和国国家卫生和计划生育委员会. 肺结核诊断(WS+288-2017)[S]. 中华人民共和国卫生行业标准,2017.
赵雁林,逄宇. 结核病实验室检验规程[M]. 北京:人民卫生出版社,2015:174-277.
朱红琼,丁立,黄雅怡,等. 2018年珠海市某医院227株结核分枝杆菌药敏特征分析[J]. 现代预防医学,2020,47(11):2053-2057.
赵慧,王志锐,巨韩芳,等. 2020年天津市肺结核耐药流行病学特征及影响因素分析[J]. 疾病监测,2023,38(1):57-63. DOI:10.3784/jbjc.202206210286.
茹浩浩,陈连勇,杨星,等. 2020年云南省肺结核病例耐药监测分析[J]. 中国预防医学杂志,2022,23(10):787-791. DOI:10.16506/j.1009-6639.2022.10.011.
朱岩昆,苏茹月,常文静,等. 河南省1074株结核分枝杆菌药敏特征分析[J]. 现代预防医学,2022,49(18):3409-3414. DOI:10.20043/j.cnki.MPM.202202395.
于海娟,赵梅,王佳月,等. 肺结核患者结核杆菌耐药情况及耐多药结核病的危险因素[J]. 中国感染控制杂志,2020,19(1):58-62. DOI:10.12138/j.issn.1671-9638.20205260.
SONG Z X,LIU C F,HE W C,et al. Insight into the drug-resistant characteristics and genetic diversity of multidrug-resistant Mycobacterium tuberculosis in China[J]. Microbiol Spectr,2023,11(5):e0132423. DOI:10.1128/spectrum.01324-23.
WANG Z R,SUN R,MU C,et al. Characterization of fluoroquinolone-resistant and multidrug-resistant Mycobacterium tuberculosis isolates using whole-genome sequencing in Tianjin,China[J]. Infect Drug Resist,2022,15:1793-1803. DOI:10.2147/IDR.S361635.
马玲,辜吉秀,李晴,等. 甘肃省初治肺结核患者耐药现状及耐多药影响因素分析[J]. 中华流行病学杂志,2022,43(7):1093-1098. DOI:10.3760/cma.j.cn112338-20211117-00896.
ZHAO Y L,XU S F,WANG L X,et al. National survey of drug-resistant tuberculosis in China[J]. N Engl J Med,2012,
366(23):2161-2170. DOI:10.1056/NEJMoa1108789.
PUNGA V V,JAKUBOWIAK W M,DANILOVA I D,et al. Prevalence of extensively drug-resistant tuberculosis in Vladimir and Orel regions,Russia[J]. Int J Tuberc Lung Dis,2009,13(10):1309-1312.
赵江南. 结核分枝杆菌对氟喹诺酮耐药现状及危险因素的回顾性临床分析[D]. 济南:山东大学,2015.
石文卉,初乃惠. 耐药肺结核患者氟喹诺酮类药物耐药情况及影响因素[J]. 中国防痨杂志,2021,43(9):905-909. DOI:10.3969/j.issn.1000-6621.2021.09.009.
MULU W,MEKONNEN D,YIMER M,et al. Risk factors for multidrug resistant tuberculosis patients in Amhara National Regional State[J]. Afr Health Sci,2015,15(2):368-377. DOI:10.4314/ahs.v15i2.9.
RUMENDE C M. Risk factors for multidrug-resistant tuberculosis[J]. Acta Med Indones,2018,50(1):1-2.
LIU C H,YANG N,WANG Q,et al. Risk factors associated with fluoroquinolone-resistant tuberculosis in a Beijing tuberculosis referral hospital[J]. Respirology,2011,16(6):918-925. DOI:10.1111/j.1440-1843.2011.01990.x.
张奇,杨志辉,杨甲飞,等. 粉尘作业工人肺功能异常风险预测模型的建立与验证[J]. 现代预防医学,2023,50(21):3878-3882,3894. DOI:10.20043/j.cnki.MPM.202304363.
(收稿日期:2024-02-28;修回日期:2024-04-13)
(本文编辑:康艳辉)
