方兴未艾的太赫兹生物医学传感器
2024-07-08赵振宇张雪莲
赵振宇 张雪莲
摘要:太赫兹生物医学传感器在当前研究中属于一个热点,其工作原理主要依托人工周期性电磁媒介或二维材料构建电磁亚波长结构,与入射的太赫兹波相互作用时,引发类似表面等离子体共振现象,产生的局域电磁场增强效应对周围的介电环境敏感,从而改变太赫兹光谱中共振的品质因子与谐振频率,实现对生物分子的高灵敏度检测和分析。围绕近几年的研究现状,从生物传感器的类型及其在生物医学等领域的应用分别加以阐述,讨论了太赫兹生物医学传感器所面临的挑战和发展前景,旨在提供一些有价值的建议。
关键词:太赫兹波;太赫兹超构材料;太赫兹生物医学;太赫兹生物传感器;高灵敏度检测
中图分类号: O 439 文献标志码: A
Terahertz medical biosensors in the ascendance
ZHAO Zhenyu,ZHANG Xuelian
(Mathematics & Science College, Shanghai Normal University, Shanghai 200234)
Abstract: Terahertz biomedicalsensoris a hot spot in the current research. Its implementation method is mainly based on the use of metamaterials or two-dimensional materials to construct electromagnetic subwavelength structures. When terahertz waves interact with the structures, they cause phenomena similar to surface plasmon resonance and generate local electromagnetic field enhancementeffects. Theenhancedelectricfieldimprovestheinteractionbetweenlightand biological samples, resulting in a change in spectral response, enabling highly sensitive detection and analysis of biomolecules. Based on the research status in recent years, this paper expounds the types of biosensors and their applications in biomedicine and other fields, and discusses the future challenges and development prospects. It hopes to provide some valuable suggestions.
Keywords: terahertz wave; terahertz metamaterial; terahertz biomedicine; terahertz biosensors; high sensitivity detection
引言
近年来,太赫兹生物传感器作为一种新兴技术而备受瞩目,其利用太赫兹波段的电磁波谱和超构表面的独特特性,为生物传感领域带来了革命性突破。作为电磁波谱的一部分,太赫兹波跨越中红外和微波之间的区域,频率范围为0.1~10 THz,对应的波长范围为30~3000μm[1]。太赫兹波段具有特殊的电磁特性:(1)相较于可见光和近红外波段,太赫兹波具有更长的波长、更深的穿透深度和更少的散射[2],这使得它能够穿透样品并且不易被生物组织散射,从而实现对样品内部的非破坏性检测;(2)太赫兹波段的光子能级较低,不会对生物样品造成电离相关的危害;(3)许多复杂分子在太赫兹波段内具有特定的集体振动和旋转模式,会产生独特的特征光谱[3],使得太赫兹波在生物传感器中具有独特的优势。与此同时,超构材料的引入为太赫兹生物传感器的设计带来了新的可能性。超构材料是具有周期性亚波长结构的人造电磁介质,具有天然材料所没有的特性,其电磁特性取决于组件的形状、几何形状或方向[4-5]。超构材料的亚波长结构可以被设计成在太赫兹频率下呈现类似金属表面等离子体的电磁共振特性,例如,通过构造周期性的微结构或金属纳米结构来实现。表面等离子体共振(surface plasmon resonance ,SPR)对邻近介质在可见光和红外区域的光学性质非常敏感,已被广泛应用于蛋白质、农药、酶和核酸等生物活性物质的定量检测中[6-7]。
太赫兹生物传感器的基本原理是:设计基于超构材料或二维材料的不同类型的电磁亚波长结构,在太赫兹波的作用下,当光与这些亚波长结构相互作用时,可以引发类似于 SPR 的现象,从而产生局域电磁场的增强效应;在传感器表面产生的增强电场,使光物质与生物样品之间的相互作用得以提高,导致光谱响应发生强烈变化,从而实现对生物分子的高灵敏度检测和分析。近几十年来,随着太赫兹理论和新材料技术的完善和发展,太赫兹光谱及成像技术已广泛应用于通信[8]、生物医学[9]、食品安全[10]、农业[11]等各个领域。现在,研究人员在生物传感器方面取得了重大科学突破,而微流控技术也已经广泛应用于传感和检测领域[12-14],太赫兹传感技术结合微流控技术,可以实现对样品的精确控制和处理,为生物传感研究带来了新的发展机遇。
本文讨论了太赫兹生物传感器的进展。首先回顾了不同材料和结构类型太赫兹传感器的发展,包括金属材料、非金属材料和混合材料;接着展示了近年来太赫兹生物传感器在生物医学领域的应用;最后讨论了太赫兹生物传感器所面临的挑战和应用前景。
1 传感器的分类
超构材料独特的表面传感特性启发了研究人员用其构建不同材料的亚波长结构,并进一步扩大了太赫兹时域光谱(THz-TDS)技术的应用范围[15]。在回顾不同材料和结构类型的超构表面传感器件的研究进展之前,先对普遍适用于太赫兹传感的关键参数进行简单的介绍:灵敏度为相对于折射率变化的频移;品质因子 Q 反映了传感器的谐振特性, Q 因子越大,谐振曲线越尖锐,谐振损耗越小,则传感器的灵敏度和分辨率越高[16];品质因数(figure of merit ,FOM)为灵敏度与透射光谱半高全宽之比。
1.1 金属材料
在太赫兹生物传感器设计中,考虑到金属材料的延展性、抗腐蚀性、抗氧化性和经济性,常采用的有黄金、铝、铜等。通过调整微结构的几何尺寸,基于金属微结构的传感器件就可以改变太赫兹波在传输过程中的电场分布,从而产生显著的电场增强效果。金属微结构可分为两种类型:一类是在平坦的金属表面刻蚀周期性几何单元阵列,形成金属孔阵列( metal hole array,MHA);另一类是以开口谐振环为代表的超构材料单元周期性排列形成超构表面。后者是太赫兹领域的研究热点之一。
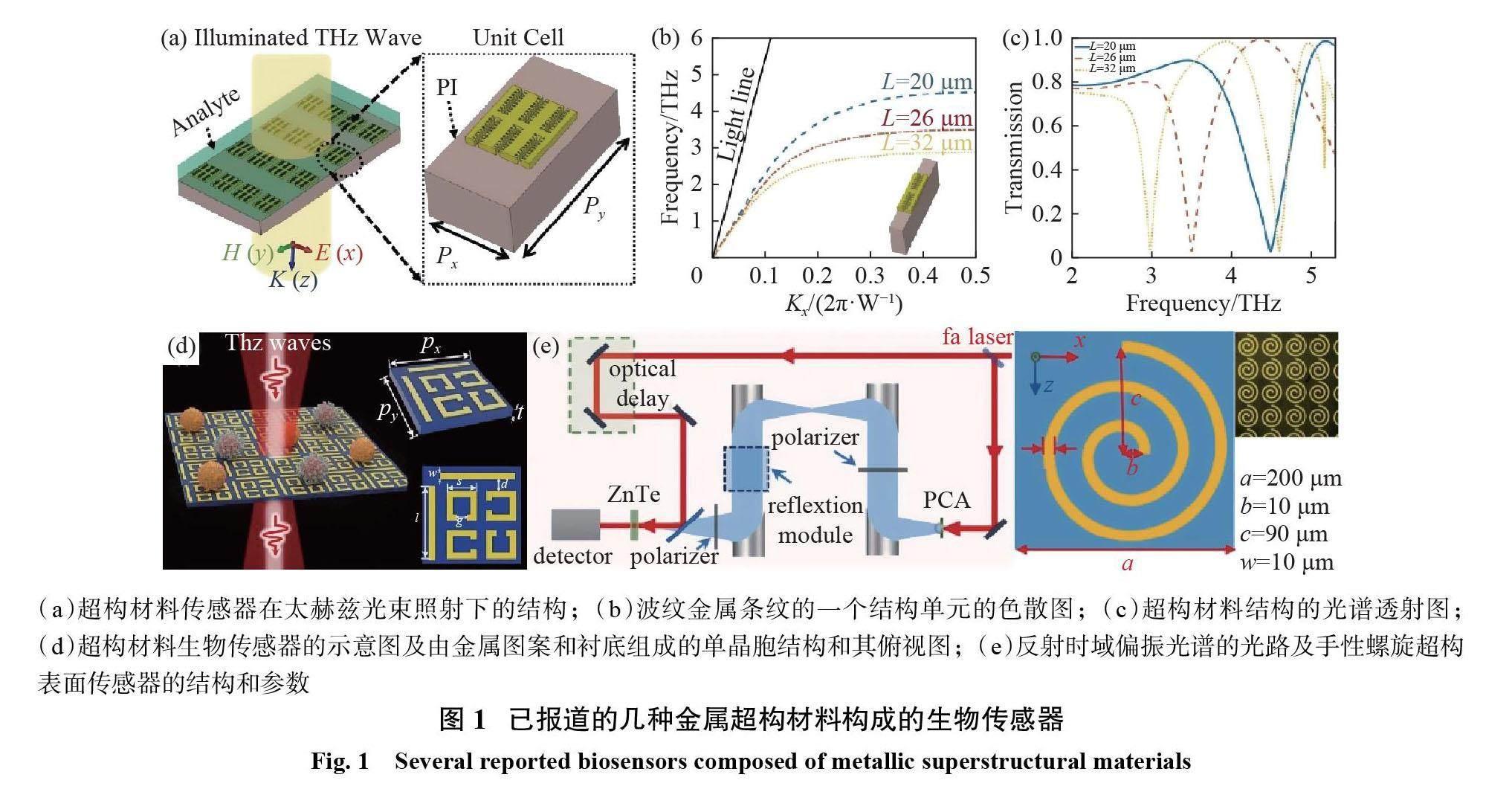
2006年,Miyamaru等[17]基于人工表面等离子体激元(surface plasmon polaritons, SPPs),利用 MHA 来感知太赫兹周围电介质环境的变化。此后,其他研究人员相继提出了各种形式的孔阵列金属微结构用于相关物质的传感检测[18-20]。由于开槽技术的限制,简单孔阵列的金属表面主要用于识别不同折射率的物质。2008年,第1个太赫兹超构材料传感器在生物传感领域得到了详细讨论。 OHARA 等[21]的研究说明了在传感优化过程中有许多重要性的因素,如衬底的组成、环的几何形状、分析物组成等。随着超构材料理论和技术的发展,人们提出了更加灵敏的太赫兹传感模型。2019年,Niknam 等[22]提出了一种新型的双波纹结构太赫兹传感器,如图1(a)所示。该传感器的最大灵敏度为1.75 THz /RIU,其色散图(图1(b))和光谱透射图(图1(c))证明了电磁场与金属之间的相互作用在光学频率上具有类似于表面等离子体的行为。
超构表面克服了三维结构超构材料电磁损耗大的局限性,其元素结构周期性地排列在二维平面上,具有三维超构材料的电磁特性。根据金属微单元的电磁特性和形状,可将超构表面分为环形超构材料、手性超构材料、法诺共振超构材料、电致透明超构材料等。金属亚波长结构具有较强的有限电磁场和尖锐的光谱共振特性。通过设计该结构尺寸,可以增强局部场与介质的相互作用,提高 Q 因子[23]。因此,该研究也成为太赫兹传感的研究热点。高 Q 法诺共振是入射电磁波与分析物层强相互作用的结果,是一种很有前途的高灵敏度折射率检测方法[1,24]。完美的超构材料吸收体在短时间内能够有效地将光能储存在其内部,从而显著提升光与被分析物的相互作用。此外,在常见的高介电基底中,接地设计能够消除电场衰减的影响。
2021年, Zhang 等[25]将由切丝和开口谐振环组成的超构表面生物传感器(图1(d)),用于胶质瘤细胞的分子分类和癌症检测,其理论灵敏度达到496.01 GHz/RIU。同年,Yang 等[26]提出了基于2个同心开口谐振环的三维超构材料传感,通过改变开口谐振环与衬底之间的距离,使传感器具有可调谐的单共振和双共振特性。其灵敏度从0.18 THz/RIU 提高到1.12 THz/RIU。此外,基于手性材料传感器的太赫兹传感方法也受到研究者的青睐[27-28]。2021年, Zhang 等[27]提出了一种基于太赫兹反射的时域偏振光谱系统(图1(e)左图)及手性超构表面(图1(e)右图)的太赫兹传感新方法。该传感器对不同氨基酸样品的传感精度可达1×10?5 g/mL,为极性液体分析物的传感提供了新的思路。
上述太赫兹传感器件具有独特的电磁特性,有望成为灵敏的生物传感器的优秀平台。虽然设计出优秀的亚波长结构需要在高 Q 因子和低能量损失之间找到平衡,但也必须考虑到制造工艺和成本等因素。
1.2 非金属材料
金属材料大的损耗会导致谐振模式的品质因子降低,使得基于金属材料的生物医学传感器的灵敏度相对较低。非金属材料相较于金属材料损耗小,品质因子较高,故而灵敏度也会更高。除金属材料外,硅、金属氧化物、二维材料等非金属材料也适用于太赫兹亚波长结构的构建[29-35]。硅和二维材料,如石墨烯、 MoS2、碳纳米管(CNTs)等具有独特的电学和光学特性,作为潜在的太赫兹超构材料受到了广泛的关注。
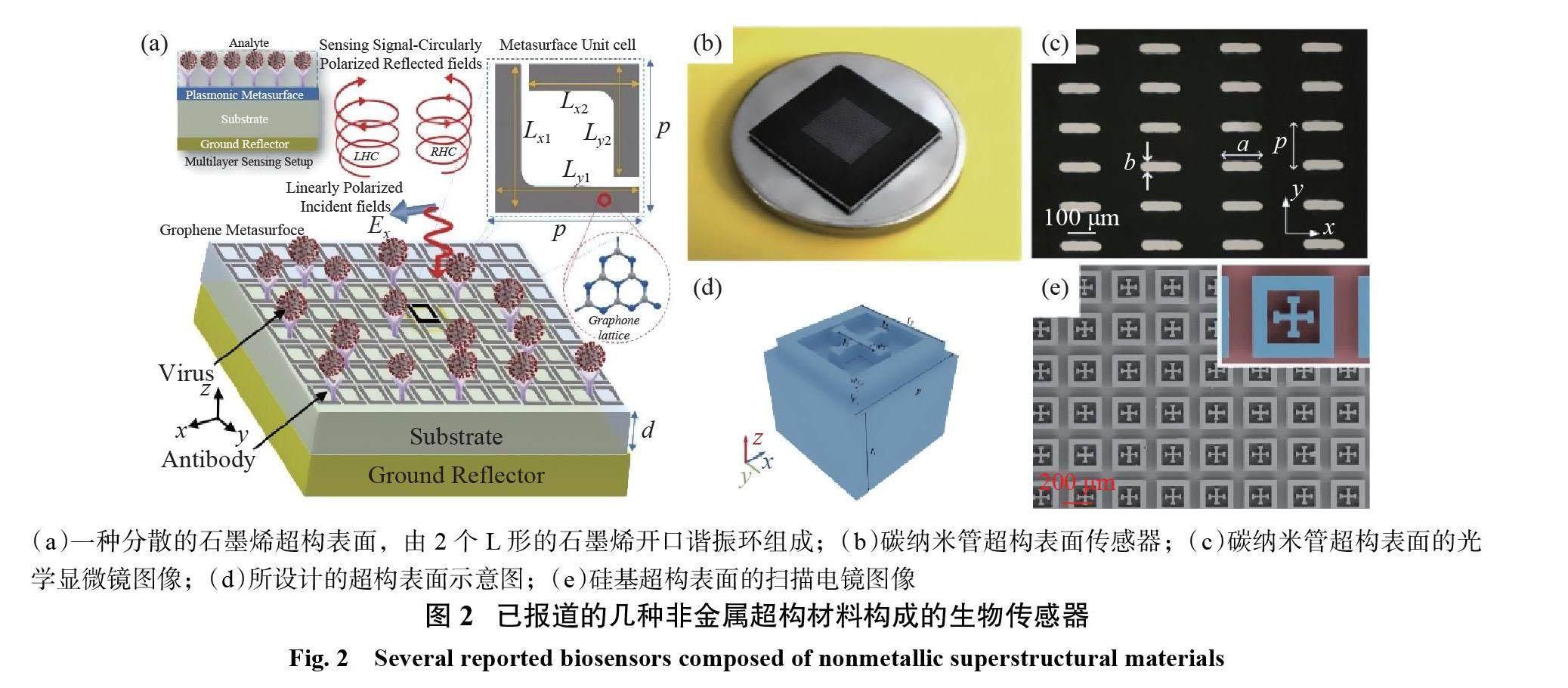
石墨烯作为研究人员发现的第一个二维原子晶体,是目前在太赫兹光电子学领域研究最为成熟的材料[36]。与相同厚度的金开口谐振环相比,高掺杂石墨烯的开口谐振环表现出更强的电磁响应,并且增强的电磁场被限制在比入射波长小2个数量级的范围内[37]。2021年,Amin 等[32] 设计了一个由2个周期性 L 形石墨烯开口谐振环组成的色散石墨烯超构表面,见图2(a),用于产生手性表面电流,以区分具有相似折射率的不同类型的病毒。仿真结果表明,不同图案的二维材料可以产生不同的共振响应。有研究表明,石墨烯等新材料器件具有独特的吸收特性和波长调节灵活性[33]。例如,由周期性放置的同心石墨烯环和圆盘阵列组成的超构材料吸收体表现出双波段吸收特性,并且可以通过改变石墨烯的费米能级来灵活调整其吸收峰的波长。当吸收器界面介质折射率发生变化时,模式 I 和模式 II 的灵敏度分别为5.0μm/RIU 和15.0μm/RIU[38]。与石墨烯相比,MoS2具有更高的调制效率、场约束能力和光吸收效率[39-40]。基于 MoS2材料的太赫兹传感也引起了人们的广泛关注。果蔬农药残留会对人体健康造成威胁,因此残留农药的检测是非常重要的。2020年, Wang 等[29]提出了一种支持 SPPs 的碳纳米管亚波长结构超构表面,见图2(b),可用于农残检测。他们先将利用低压化学气相沉积法(LP-CVD)制备的碳纳米管薄膜转移到衬底上,再通过激光加工技术将碳纳米管薄膜制成周期性矩形孔径阵列结构(图2(c))。将不同浓度的农药溶液滴到传感器表面,其最小检测灵敏度为2.0×10?3,重复性测量误差为0.13%。
硅也引起了研究人员的极大兴趣,因为硅亚波长结构可以克服常见金属和贵金属的本征吸收损耗以及二维材料较差的适用性[41]。2020年, Zhong 等[31]提出了一种基于全介质超构表面的高 Q 法诺谐振特性的超灵敏专用传感器。超构表面由 SiO2衬底上的多对倾斜硅棒组成。综合介电损耗和 Q 因子的模拟结果,将硅棒的倾斜角选定为15°。该传感器的 FOM 为11.1,大于部分基于金属结构的超构表面传感器的 FOM。2022年,Hu 等[35]设计了一种硅基超构表面,见图2(d)和(e),它由耶路撒冷十字柱和方形环形柱组成。这种结构设计通常用于金属超构表面,可在其周围激发一个强的局域电磁场,以增强光与物质的相互作用。实验结果表明,该结构共振幅值与农药浓度具有良好的相关性。苯甲酰和三环唑的检测灵敏度分别为0.0017和0.0015。随后,该团队提出了由2个相对的 T 形柱组成的全硅太赫兹超构表面芯片,在芯片表面实现了偶极子共振和表面等离子体极化共振[34]。所设计的全硅等离子体超构表面器件对苏云金芽孢杆菌蛋白传感的幅值变化和频率变化的灵敏度分别为6.9×10?4和8.4×10?2 GHz。经过一系列的实验证明,该传感器对湿度、温度、时间段具有良好的稳定性。与二维材料相比,由硅等有机材料制成的太赫兹传感器具有成本低,性能稳定,可重复使用等优点,拥有广阔的应用前景[41]。
太赫兹技术的应用范围正在不断扩大,尤其是在红外波段。在这个波段,太赫兹传感器通过材料的振动模式与传感器的共振模式耦合形成 Fano 共振特征,实现了纳米厚度的红外传感[42]。与此同时,新型的太赫兹材料,如3D 拓扑绝缘体,也在太赫兹技术的研究中引起了广泛关注,因为它们能够通过产生拓扑等离子体来操纵太赫兹辐射[43]。
1.3 混合材料
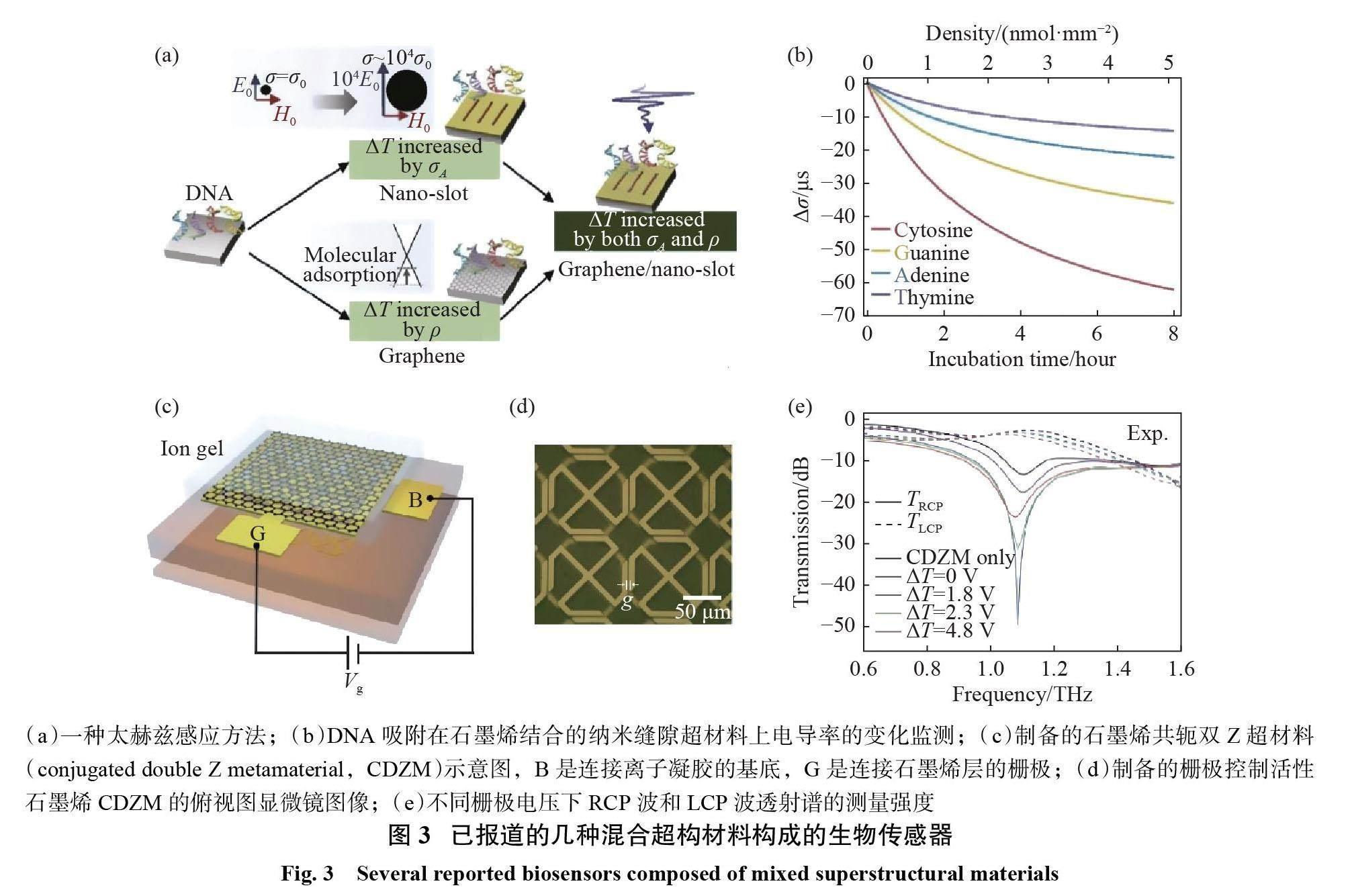
金属材料和非金属材料的结构相对固定,相应的生物医学传感器的谐振模式的频率和共振强度不易调谐。混合材料结合了几种人工电磁材料的优点,具有良好的太赫兹传感特性。由混合材料构成的生物传感器可以通过外加电压进行调谐,同时其结构的强共振特性进一步增强了光与物质之间的相互作用[39]。通过优化金属材料和二维材料的组成,亚波长结构的可调性和灵敏度得到了显著提高[44]。虽然这是一个相对复杂的方案,但混合材料(图3(a))已经越来越受到人们的关注[41,45-46]。目前,有关石墨烯基杂化材料的研究最多,如通过控制石墨烯的费米能级,可以动态调节共振频率[45,47]。
为提高太赫兹超构材料的灵敏度,满足生物医学研究应用的要求,2021年,Zhou 等[48]提出了石墨烯–超构表面太赫兹混合微流控装置,见图3(b)~(d),成功检测了100 nmol 的 DNA 短序列。该装置可增强生物分子与太赫兹波的相互作用,有效减小样品溶液体积,从图3(e)中不同栅极电压下 RCP 波和 LCP 波透射谱的测量强度比较可知,谐振频率为1.1 THz 时,裸 CDZM阵列对 RCP 波的透射幅度约为20%,且栅极电压ΔV 决定了石墨烯的透射率水平。混合材料可以结合多种人造磁性材料的优点,具有良好的超构材料特性,可更好地适用于生物医学科学和环境监测中。
未来,除了利用上述技术进行传感外,还将从传感维度进一步深入研究,如圆二色性测量、各向异性偏振测量、光声技术等[49-52]。这些技术与 SPPs技术相结合,有望解决更多的太赫兹传感问题,如支持更多指纹特征和克服吸水问题,为太赫兹在生物传感中的应用铺平道路。
2 传感器的应用
太赫兹波所具有的独特特征频率,使其成为生物医学领域检测中一种有趣的新兴技术选择。它在生物传感应用方面也具有很大的应用潜力。近5年来,太赫兹传感器已被应用于蛋白质、核酸和组织的检测[53-55]。根据太赫兹传感的主要应用领域,生物分子检测、细胞和病毒检测以及组织检测来分别介绍其相应的最新应用趋势。
2.1 生物分子检测
太赫兹辐射作为一种新型检测技术,对弱分子间相互作用敏感,使其具备了在生物分子检测中应用的可能性[56]。实际上,它在电磁频谱中的独特位置,加上借鉴了其他波段的传感概念,更加促进了生物传感器研究在这个领域的迅速发展。
超构材料表面功能化使传感器能够进行特异性免疫检测[57-58],各种疾病标志物的检测是此类检测的典型应用之一。2022年,Zeng 等[59]提出了一种修饰在太赫兹超构表面生物传感器上的适配体,见图4(a)。它由两个金属开口谐振环阵列组成,用于检测人表皮生长因子受体2(HER2,乳腺癌的典型标记),检测限(limit of detection,LOD)达到0.1 ng/mL。功能修饰步骤为:依次添加 AuNPs―H 溶液―APT-HB5溶液―BSA 溶液―HER2溶液,见图4(b)。不同浓度 HER2的光谱检测结果如图4(c)所示。在实验中,重复性良好的结果对于验证该生物传感器的可靠性和稳定性至关重要,这有助于确保其在实际生物检测应用中的可靠性和准确性。
2022年, Wang 等[60]提出一种可以反复用于检测患者外泌体的太赫兹生物传感器。首先用3–氨基丙基三乙氧基硅烷(APTES)酰胺化不同尺寸金属丝结构组成的超构表面;然后自组装一层 AuNPs;最后在固定特异性抗体后阻断非特异性位点。外泌体与抗体结合后可被特异性试剂解离。实验结果表明,10次重复实验的谐振频率差小于3 GHz。在此基础上,如果与微流控技术进一步结合,此类传感器将会有更广阔的应用前景。在最新的研究进展中,Men 等[61]报道了一种全介电超构材料太赫兹生物传感器,其在0.82谐振峰值处表现出高 Q 因子,其值为35。他们设计并制造了具有电磁感应透明效应的结构,以执行太赫兹响应的米氏共振。该生物传感器对细胞因子白细胞介素2(IL-2)的检测限为100 pg/mL,IL-2浓度对数在100 pg/mL 至1μg/ mL 范围内呈线性响应。这项研究暗示了该生物传感器在血清细胞因子检测中的重要潜力,并在细胞因子释放综合征的临床检测中具有潜在应用。
核酸分子(DNA ,RNA)的检测和分化比蛋白质分子更具挑战性,因为它们通常只在几个片段上存在差异[62]。由于太赫兹石墨烯超构材料具有良好的光电性能和吸附性能,近年来,相关研究取得了不错的进展。例如, MicroRNA (miRNA)由于与亲代肿瘤细胞的相互作用密切而被认为是一种很有前途的非侵入性肿瘤诊断生物标志物。Zhan 等[63]利用由环形凹槽包围的金盘阵列组成的太赫兹生物传感器(图4(d))和金纳米颗粒的扩增,实现了对 miRNA 的高特异性和高灵敏度检测,LOD 降至84 amol/L,线性传感范围为1 fmol/L 至100 mol/L。同时,太赫兹超构材料生物传感器用于临床样品检测的可靠性提升了其临床应用潜力。
虽然太赫兹超构材料在生物分子检测中显示出了一定的应用前景,但血清等水性溶剂会强烈吸收太赫兹波,干扰检测。为了避免这种干扰,2023年, Zhang 等[64]提出并演示了一种超薄、柔性、基于生物凝胶的超构材料,可以专门检测太赫兹波通过水溶液中生物分子的传输。它可检测水中的葡萄糖,灵敏度为0.0446 dL/mg,检测限为1.64 mg/dL,也可检测人血清中的葡萄糖。因此,他们提出了一种实时检测葡萄糖和潜在其他生物分子的策略。这项研究展示了一种基于 AAPBA 水凝胶的超薄、柔性太赫兹超构材料,其具有快速响应时间,可以在水溶液、人体血清和人体汗液中检测到葡萄糖。这一系统可以作为可穿戴设备用于无创实时血糖监测,为糖尿病的长期管理提供了新的可能性。
目前,减少介质的太赫兹损耗是当前生物传感器探索的方向之一。除了对微流控器件材料电磁损耗的研究外,衬底的几何设计和材料选择也显著影响着超构材料生物传感器的性能。在这种情况下, Wu 等[65]比较了基于 Si (ε=11.56)和石英(ε=4)两种不同衬底的链亲和素琼脂糖无标记特异性传感器。结果证实,基于石英衬底的超构表面具有更高的灵敏度,从而证明了太赫兹生物传感器衬底材料在生物传感器设计中的重要性。 Zhou 等[66]提出了一种新型的太赫兹超构材料生物传感器,该传感器由适配体水凝胶功能化制成(见图4(f))。与采用低吸收介质的策略不同,他们成功解决了人类α–凝血酶(h-TB)在水环境中的检测问题,血清样本中的 LOD 为0.4 pmol/L。这项研究表明,该传感器的性能优于采用适配体功能化的太赫兹超构材料。
目前太赫兹生物分子传感的探测灵敏度还有待提高,传感范围主要在微米尺度上。另一方面,对太赫兹电场具有强约束的超构材料器件的缺乏,阻碍了超构材料结构共振与生物分子旋转/振动模式耦合的建立。同时,复杂的制造工艺也限制了太赫兹生物分子传感的进一步应用,几何形状和组成复杂的器件难以制造,传感器的一致性和可重复性无法保证。现有太赫兹探测装置及系统性能还不能满足相关的实验探测要求。研究这些限制和不足,对于进一步完善太赫兹传感器是非常必要的。
2.2 细胞和病毒检测
与正常细胞相比,病变细胞中的水分含量会发生变化。因此,太赫兹生物传感器可利用太赫兹辐射的水敏感特性,为癌症、肿瘤等疾病的诊断和治疗开辟新的途径[15]。2021年,Zhang 等[67]在等离子体超构表面上培养3种类型的肺癌细胞(图5(a)),采用用于肺癌细胞识别的太赫兹环形超构表面(图5(b))生物传感器进行辐射检测。该传感器在0°~30°斜入射角范围内具有良好的传感稳定性,理论灵敏度高达485.3 GHz/RIU。图5(c)显示了 Calu-1(蓝色)、A427(绿色)和95D(紫色)3种不同浓度细胞频率和透射率的变化,3个完全分离的区域进一步证实了超构材料生物传感器在细胞识别方面的巨大潜力。
在过去的几年中,人们提出了更为精细、复杂的几何结构设计。其目的是在有限尺寸结构的几个特定点上实现更大的电场约束,并试图提高设计结构的灵敏度[25,54]。例如,前文提到的被用于胶质瘤细胞分子分类的,由切割导线和开口谐振环组成的复合图案超构表面生物传感器[25],该复合图案具有较高的谐振 Q 因子,可在亚波长超构材料结构周围产生较高的场增强,每毫升细胞的最大实验灵敏度接近248.75 kHz。由于太赫兹电磁波对包括水在内的极性物质极其敏感,并且对极性材料反应明显,因此可考虑使用太赫兹波电磁成像来诊断基底细胞癌。2023年,Hamza等[68]提出了一种生物传感器结构,它能够完全吸收两个独立频段,即0.78 THz 和0.904 THz的能量。该设计展示了两个显著的吸收峰,吸收率超过99.5%。研究人员对其偏振角,电场和磁场分布,表面电流分布以及功率流进行了深入的研究,以确保其能够高灵敏度地区分健康皮肤和非黑色素瘤皮肤癌。
以病毒为代表的微生物与人类的许多疾病密切相关。因此,如何实现对微生物快速有效的检测成为人们越来越关注的问题。虽然有些方法,如质谱法或分子法,减少了检测所需的时间,但它们在 POCT 中的应用仍然面临着一些困难。基于太赫兹波段人工电磁亚波长结构的生物传感器是一个新兴的替代方案。并且,在获得所需的太赫兹传感结果后,可对传感器结构进行杀菌处理,处理后的传感器可恢复到原始状态,说明太赫兹生物传感器具备可重复使用的性能。
2021年, Zhou 等[48]设计了一种基于石墨烯–超构表面复合材料的太赫兹 SPR 传感器,用于检测食源性病原体大肠杆菌 O157:H7的 DNA 序列,该传感器实现了100 nmol/L DNA 溶液的选择性检测。Ahmadivand等[69]已经证明,胶体纳米颗粒集成等离子体生物传感器(图5(d))具有优异的传感特性,可以检测约13 kDa的低分子量生物分子。在此基础上,他们实现了 SARS- CoV-2刺突蛋白的飞秒检测, LOD 可以达到 4.2 fmol/L 左右[57]。他们先将 SARS-CoV-2 Spike S1抗体与活化的 AuNPs结合,然后特异性捕获 SARS-CoV-2 Spike 蛋白,见图5(f)。图5(e)为 SARS-CoV-2刺突蛋白(4~12 fmol)的透射光谱测量图。2023年,Guan 等[70]提出了一种由双切线(DCW)和四开口环谐振器(QSR)组成的超构材料生物传感器,在太赫兹范围内实现了与偏振无关的等离子体诱导透明(PIT)效应。模拟显示,当分析物厚度为14μm 时,PIT 透明度显示出高达146.7 GHz 的峰值偏移。随着分析物的折射率从1.0增加到1.6,生物传感器的理论灵敏度经计算为281.25 GHz/RIU。此外,研究还探索了所提出的 DCW/QSR 生物传感器在噬菌体病毒检测中的应用。模拟结果表明,DCW/QSR 生物传感器可作为检测 PRD1和 MS2等病毒的有效传感平台。这些发现进一步证实了高灵敏度超构材料生物传感器在生物传感领域的巨大应用潜力,为无标记生物医学检测提供了一种实用且经济有效的方法。
现有研究表明,太赫兹生物传感器可以检测多层/单层细胞[54, 67, 71-72],并且灵敏度已经达到单细胞检测水平[73]。
2.3 组织检测
如引言中所述,太赫兹辐射对生物样品无损害,且由于其光子能量低,可被安全地应用于生物医学检测。在过去的20年中,太赫兹成像已经被成功地用于区分大脑和皮肤等的异常组织[74-76]。然而,由于生物组织中其他环境因素的干扰,部分有效的光谱信息会被掩盖。特别是对于早期癌变组织,其与正常组织差别不大,因此传统的检测方法在早期癌症诊断中仍然存在挑战。因而对高灵敏度和高分辨率的太赫兹生物传感器提出了需求。
到目前为止,病理切片是太赫兹组织检测的主要对象,离临床实际应用还有很大的距离。Alibakhshikenari等[77]提出了一种基于平面天线超构材料的微波医学成像系统,用于检测生物组织中的肿瘤。该系统由排列在乳房模型周围的多个天线组成,可用于测量乳房异常组织的透射和反射信号,并能准确定位肿瘤。
Lee 等[78]提出了一种基于纳米槽阵列超构材料结构的太赫兹成像平台,它对无脱水过程的真实生物样品的对比度高,见图6(a)。采用光刻技术在高电阻率硅片上制备厚度为150 nm 的Au 纳米槽阵列(基本纳米槽的长度 l =60μm,每个纳米槽的宽度 w =500 nm ,相邻纳米槽之间的横向间隔Px =40μm,纵向间隔Py =10μm)传感芯片。将具有相同横切面的小鼠脑切片分别置于裸硅芯片和纳米槽芯片上进行成像和分析。与仅模糊描绘大脑皮层、丘脑等解剖结构的裸Si 图像(图6(b))相比,纳米缝隙图像(图6(c))的对比度更高,纳米槽在脑组织中的大脑皮层和丘脑中的同一区域的反射率分别提高了2.4倍和4.0倍(图6(b))。此外,阿尔茨海默症模型的太赫兹监测结果表明,该技术将促进无创诊断成像技术的发展。2022年,Roh等[79]提出了一种基于开口谐振环的新型超构材料成像技术(图6(d)),用于小鼠脑组织的成像检测。基于超构材料的太赫兹图像对脑组织不同部位的边界更为明显(图6(g))。随着太赫兹技术的发展,光学衍射极限和超分辨能力有望得到提高,同时结合微流控技术的优势,其在太赫兹生物传感器平台上可实现高通量检测[80-81]。
3 结论与展望
简要回顾了基于人工电磁亚波长结构的太赫兹传感器的主要类型及其在生物传感器中的应用,整理了人工 SPPs从超构材料的最初概念到实际应用的发展过程。随着太赫兹科学技术的不断发展,各种有趣的概念可以引入到太赫兹频率,推动进一步探索,以填补太赫兹生物传感应用的空白。
太赫兹超构表面的电场增强区域主要集中在开口环或金属尖端附件处,这意味着局部电场不能被充分利用。因此,下一步的研究方向是通过进一步优化传感结构来提高传感灵敏度,同时要考虑结构简单,便于制造,加工和操作便捷等实际应用需求。
太赫兹超构材料的生物传感器主要分为金属材料、非金属材料和混合材料这几类。其中在非金属材料中,以石墨烯为代表的二维材料对于太赫兹的传感应用更是近年来广泛研究的热点。但二维材料的表面损伤会直接影响其光电特性,因此,基于无损制造方法的新型二维材料结构将进一步推动太赫兹生物传感器的应用。分层超构材料可以弥补跨尺度频带传感的不足,并且可以通过调整超原子的尺寸来扩展其他频率区域。基于柔性超构材料的传感器具有优异的柔韧性、拉伸性和超薄性,因此适合结构变形的主动控制,为实现频率可调谐超构材料提供了途径。
使用不同材料构建的太赫兹生物传感器来实现高灵敏度定性检测也是未来的研究方向之一。狄拉克材料在等离子体和光子学方面的巨大潜力将推动新型太赫兹生物传感器的发展。综上所述,太赫兹生物传感器已经取得了可喜的成果,低成本、稳定和可重复使用是其进一步探索创新的指南。
参考文献:
[1] AHMADIVAND A, GERISLIOGLU B, AHUJA R, etal.Terahertzplasmonics:Theriseoftoroidalmetadevices towards immunobiosensings[J]. MaterialsToday, 2020, 32:108–130.
[2] VAFAPOURZ,KESHAVARZA,GHAHRALOUDH. Thepotentialofterahertzsensingforcancerdiagnosis[J]. Heliyon, 2020, 6(12): E05623.
[3] RYDER M R, VAN DE VOORDE B, CIVALLERI B,etal.Detectingmolecularrotationaldynamicscomplementing the low-frequency terahertz vibrations inazirconium-basedmetal-organicframework[J]. Physical Review Letters, 2017, 118(25):255502.
[4] CHEN H T, PADILLA W J, ZIDE J M O, et al. Active terahertzmetamaterialdevices[J].Nature,2006, 444(7119):597–600.
[5] SOUKOULISCM,LINDENS,WEGENERM. Negativerefractiveindexatopticalwavelengths[J]. Science, 2007, 315(5808):47–49.
[6] JEBELLI A, OROOJALIAN F, FATHI F, et al. Recent advances in surface plasmon resonance biosensors for microRNAsdetection[J].Biosensorsand Bioelectronics, 2020, 169:112599.
[7] RIBEIROJA,SALESMGF,PEREIRACM. Electrochemistry combined-surface plasmon resonance biosensors: Areview[J]. TrACTrendsinAnalytical Chemistry, 2022, 157:116766.
[8] TARBOUSHS,SARIEDDEENH,CHENH,etal. TeraMIMO: A channel simulator for wideband ultra- massiveMIMOterahertzcommunications[J]. IEEE Transactions on Vehicular Technology, 2021, 70(12):12325–12341.
[9] GONG A P, QIU Y T, CHEN X W, et al. Biomedical applicationsofterahertztechnology[J].Applied Spectroscopy Reviews, 2020, 55(5):418–438.
[10] FENGCH,OTANIC.Terahertzspectroscopy technology as an innovative technique for food: Current state-of-the-Art research advances[J]. Critical Reviews in Food Science and Nutrition, 2021, 61(15):2523–2543.
[11] AFSAH-HEJRI L, AKBARI E, TOUDESHKI A, et al. Terahertzspectroscopyandimaging: Areviewon agricultural applications[J]. Computers and Electronics in Agriculture, 2020, 177:105628.
[12] SHANG Y T, XIANG X R, YE QH, et al. Advances in nanomaterial-based microfluidic platformsforon-site detectionoffoodbornebacteria[J]. TrACTrendsin Analytical Chemistry, 2022, 147:116509.
[13] FATTAHIZ,HASANZADEHM. Nanotechnology- assistedmicrofluidicsystemsforchemicalsensing, biosensing,andbioanalysis[J]. TrACTrendsin Analytical Chemistry, 2022, 152:116637.
[14] CHEN S Y, SUN Y C, FAN F F, et al. Present status of microfluidicPCRchipinnucleicaciddetectionand futureperspective[J]. TrACTrendsinAnalytical Chemistry, 2022, 157:116737.
[15] CHENGD,ZHANGB,LIUG,etal. Terahertzultrasensitive biosensing metamaterial and metasurfacebasedonspoofsurfaceplasmonpolaritons[J].InternationalJournal ofNumericalModelling:Electronic Networks, Devices and Fields, 2020, 33(3):e2529.
[16] CHENX,FANWH. Ultrasensitiveterahertzmetamaterial sensor based on spoof surface plasmon[J].Scientific Reports, 2017, 7(1):2092.
[17] MIYAMARUF,HAYASHIS,OTANIC,etal.Terahertzsurface-waveresonantsensorwithametalhole array[J]. Optics Letters, 2006, 31(8):1118–1120.
[18] LEE S H, LEE D, CHOI M H, et al. Highly sensitiveandselectivedetectionofsteroidhormonesusingterahertzmolecule-specific sensors[J].AnalyticalChemistry, 2019, 91(10):6844–6849.
[19] TIAN Z, HAN J G, LU X C, et al. Surface plasmonenhanced terahertz spectroscopicdistinguishingbetweenisotopes[J]. ChemicalPhysicsLetters, 2009,475(1/3):132–134.
[20] RAO L, YANG D X, ZHANG L,etal. Designandexperimentalverificationof terahertzwidebandfilterbased on double-layered metal hole arrays[J]. AppliedOptics, 2012, 51(7):912–916.
[21] OHARA J F, SINGH R, BRENER I, et al. Thin-filmsensing with planar terahertz metamaterials: sensitivityand limitations[J]. Optics Express, 2008, 16(3):1786–1795.
[22] NIKNAMS,YAZDIM,AMLASHISB. Enhancedultra-sensitive metamaterial resonance sensor based ondouble corrugated metal stripe for terahertz sensing[J].Scientific Reports, 2019, 9(1):7516.
[23] KUMAR A, GUPTA M, PITCHAPPA P, et al. Activeultrahigh-Q (0.2×106) THz topological cavities on achip[J]. Advanced Materials, 2022, 34(27):2202370.
[24] YAN X, YANG M S, ZHANG Z, et al. The terahertzelectromagneticallyinducedtransparency-likemetamaterials for sensitive biosensors in the detectionof cancer cells[J]. Biosensors and Bioelectronics, 2019,126:485–492.
[25] ZHANG J, MU N, LIU L H, et al. Highlysensitivedetection of malignant glioma cells using metamaterial-inspiredTHzbiosensor basedonelectromagneticallyinduced transparency[J]. Biosensors and Bioelectronics,2021, 185:113241.
[26] YANGJH,LINYS. Designoftunableterahertzmetamaterialsensorwithsingle-anddual-resonancecharacteristic[J]. Nanomaterials, 2021, 11(9):2212.
[27] ZHANG Z Y, ZHONG C Z, FAN F, et al. Terahertz polarizationandchiralitysensingforaminoacid solution based on chiral metasurface sensor[J]. Sensors and Actuators B: Chemical, 2021, 330:129315.
[28] FAN F, ZHONG C Z, ZHANG Z Y, et al. Terahertz chiralsensingandmagneto-opticalenhancementfor ferromagnetic nanofluids in the chiral metasurface[J]. Nanoscale Advances, 2021, 3(16):4790–4798.
[29] WANG Y, CUI Z J, ZHANG X J, et al. Excitation of surfaceplasmonresonanceonmultiwalledcarbon nanotubemetasurfacesforpesticidesensors[J]. ACS Applied Materials & Interfaces, 2020, 12(46):52082–52088.
[30] CHEN F, CHENG Y Z, LUO H. Temperature tunable narrow-band terahertz metasurface absorber based on InSbmicro-cylinderarraysforenhancedsensing application[J]. IEEE Access, 2020, 8:82981–82988.
[31] ZHONG Y J, DU L H, LIUQ,etal. Ultrasensitive specific sensor based on all-dielectric metasurfaces in theterahertz range[J]. RSC Advances, 2020, 10(55):33018–33025.
[32] AMIN M, SIDDIQUI O, ABUTARBOUSH H, et al. A THzgraphenemetasurfaceforpolarizationselective virus sensing[J]. Carbon, 2021, 176:580–591.
[33] RODRIGOD,LIMAJO,JANNERD,etal. Mid- infraredplasmonicbiosensingwithgraphene[J]. Science, 2015, 349(6244):165–168.
[34] CUI Z J, WANG Y, SHI Y Q, et al. Significant sensing performance of an all-silicon terahertz metasurface chip for Bacillus thuringiensis Cry1Ac protein[J]. Photonics Research, 2022, 10(3):740–746.
