香菇菌丝热胁迫响应及耐热综合评价
2024-07-01刘萌林辰壹吴瑞曹爽梁志豪张若楠
刘萌 林辰壹 吴瑞 曹爽 梁志豪 张若楠


摘要:为研究不同香菇菌株菌丝对热胁迫的响应,综合评价其耐热性,筛选出关键指标,以9个香菇菌株为试验材料,在菌丝生长期分别进行25 ℃常温培养(CK)和37 ℃热胁迫处理,测定不同处理下菌丝的生长速度、干重、硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)、蛋白质羰基(protein carbonyl,PCO)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、漆酶、羧甲基纤维素酶、半纤维素酶及淀粉酶的生理活性,并通过相关性分析、主成分分析、隶属函数及聚类分析进行耐热性综合评价。结果表明,热胁迫后菌丝的生长速度、干重较CK极显著下降,而TBARS 、PCO含量和SOD、CAT、漆酶、羧甲基纤维素酶、半纤维素及淀粉酶活性较CK极显著上升,POD活性较CK显著上升。其中,新秋 7的生长速度和漆酶、半纤维素、淀粉酶活性的降幅及TBARS含量的增幅最大,分别为66.55%、82.42%、46.03%、75.27%、23.64%;109的干重降幅最大,为77.81%;808的PCO含量增幅最大,为43.77%;212的SOD、POD活性增幅最大,分别为CK的1.64、4.48倍;久香秋 7的CAT增幅最大,为49.90%;1513的羧甲基纤维素酶活性降幅最大,为60.87%。相关性分析表明,SOD与POD活性呈极显著正相关;POD活性与TBARS含量呈极显著负相关。以耐热性综合评价D 值进行排序分类,将9个菌株划分为3个类群,Ⅰ类包含212、久香秋7、238和0912;Ⅱ类包含9608、808、1513和109;Ⅲ类仅包含新秋7;3个类群的耐热性表现为Ⅰ>Ⅱ>Ⅲ。经逐步回归分析建立了最佳回归模型,筛选出菌丝生长速度、TBARS含量及SOD和 POD活性为耐热性关键鉴定指标,可快速鉴定菌丝的耐热能力。以上研究结果为南疆地区选育耐热香菇核心种质提供理论依据。
关键词:香菇;热胁迫;生长速度;硫代巴比妥酸反应物;抗氧化酶
doi:10.13304/j.nykjdb.2023.0796
中图分类号:S646.1+2 文献标志码:A 文章编号:10080864(2024)05009011
香菇(Lentinula edodes)作为一种高产、高效栽培作物,在我国经济作物中占据重要地位[1]。据统计,2020年我国香菇产量为1 188.21万t,占全国食用菌总产量的29.26%,产业发展迅速[2]。新疆南疆地区在香菇生产期存在环境温度高、设施可控性差等问题,导致香菇生产出现越夏栽培困难、春季栽培时间短及秋季无法提前制棒等问题,严重降低了香菇生产茬次,限制了茬口安排。随着“温室效应”逐渐增强,极端高温天气出现的频率大大提高,对香菇生产造成极大威胁,导致其大面积烂棒甚至绝收[3]。香菇菌丝生长的最适温度为24~27 ℃[1],且菌丝生长期为温度最敏感时期,此时遭遇高温将严重影响基质的养分代谢,进一步影响出菇的产量和品质[4-6]。香菇菌丝的耐热性由多途径调控[7],是个复杂的性状,其中产量、生理和形态性状受胁迫影响变化最显著[8],因此通过形态指标、菌丝产量及其生理特征进行耐热性评价、建立菌丝耐热鉴定体系,对挖掘适宜当地资源和气候特点的优质菌株尤为重要,可为当地引种和相关高产栽培提供理论及技术依据,对促进当地香菇产业持续健康发展具有现实意义。
高温逆境下香菇生长响应是多元的、复杂的,高温抑制香菇菌丝生长,造成活性氧(reactiveoxygen species,ROS)大量积累,破坏细胞膜稳定性,造成一系列生理紊乱[2]。高温胁迫生成的ROS 导致氨基酸侧链被氧化,使蛋白质羰基(protein carbonyl,PCO)含量增加,并攻击膜系统,使膜脂脂肪的不饱和键被过氧化,造成硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)含量增加[9]。TBARS包含了大部分氧化伤害产生的醛酮类物质,因而可作为衡量脂质过氧化的重要指标[10]。王波等[4]研究发现,香菇菌丝在30 ℃的生长速度明显低于26 ℃。刘兵[11]研究发现,高温胁迫使香菇菌丝的漆酶(laccases)、羧甲基纤维素酶(carboxy methyl cellulase)和淀粉酶(amylase)活性显著降低,且随着高温胁迫时间的延长,胞外酶活性逐渐降低,进而影响菌丝在基质中生长。周莎莎等[12]研究发现,经40 ℃高温胁迫后香菇菌丝的生长量明显降低,超氧化物歧化酶(super oxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)活性有不同程度的提高,表明高温胁迫激发了菌丝抗氧化酶防御系统。高温是香菇生产实践中面临的重要逆境胁迫,严重制约其产业发展,因此,提高香菇菌丝耐热性、筛选耐热性评价和鉴定指标、探索和构建菌丝耐热评价方法具有重要意义。
本研究以菌丝生长时期作为耐热关键期,选取9个不同香菇菌株为供试材料,以南疆苹果木粉为培养基质模拟香菇生产的营养环境,设置热胁迫和对照处理,通过比较不同处理下各菌株的形态、菌丝生长和生理等相关指标,探究不同香菇菌株的耐热性,明确热胁迫下香菇菌丝内部的生理过程变化特点。结合相关性分析、主成分分析、隶属函数分析、聚类分析及逐步回归分析结果筛选香菇耐热性评价的关键指标,以期为耐热性香菇菌株种质资源的创制、高产高效栽培提供理论和技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
供试香菇菌株包括808、新秋7、0912、久香秋7、1513、212、9608、109及238共9个。其中,808为和田地区生产用菌株,由墨玉县树上老菌菌业有限公司提供;新秋7、0912、久香秋7、1513、212、9608、109及238菌株均由湖北省农业科学院经济作物研究所提供。
1.1.2 供试材料
选取南疆和田地区当年修剪苹果木枝桠,自然晒干后作为主料,要求新鲜、洁净、干燥、无虫、无霉、无异味。将主料和辅料麸皮打碎成粉末,过30~50目筛备用。
1.1.3 供试培养基
苹果木屑固体培养基配方为:苹果木屑粉78 g,麸皮粉20 g,葡萄糖2 g,琼脂20 g,加蒸馏水至1 000 mL,121 ℃灭菌30 min备用。
1.2 试验方法
1.2.1 菌丝培养及热胁迫处理
灭菌后的培养基倒入90 mm 的培养皿中制平板,每皿25 mL。打孔器取6 mm活化的菌种(菌落边缘处)置于平板中央,用封口膜封好培养皿边缘,并做好标记。热胁迫处理(HT)为25 ℃恒温培养箱中黑暗培养6 d,置于37 ℃高温条件下处理24 h,之后再转入25 ℃下恢复培养6 d;以25 ℃常温培养[11]为对照(CK)。
1.2.2 菌丝生长速度测定及形态观察
采用十字交叉法[4]测定菌丝直径。于菌丝热胁迫处理后及恢复培养第6天分别测定菌丝直径,计算菌丝的生长速度(mm·d-1)[4],同时观察菌丝形态变化。
1.2.3 干重的测定
取恢复培养6 d的9个菌株菌丝置于滤纸上,在60 ℃的烘干箱中烘干至恒重,测定干重,重复5次,取平均值。
1.2.4 抗氧化酶及氧化产物的测定
分别取9个菌株37 ℃热胁迫24 h及对照的菌丝各1 g,液氮研磨,冰浴条件下加入2.5 mL 50 mmol·L-1磷酸缓冲液(pH 7.0)混匀,在4 ℃下7 200 r·min-1 离心15 min,取上清液进行抗氧化酶和氧化产物含量的测定。参照Kong等[13]方法测定TBARS含量,参照Levine等[14]方法测定PCO含量,采用氮蓝四唑法[15]测定SOD活性,采用比色法[16]测定CAT活性,采用愈创木酚法[17]测定POD活性。
1.2.5 胞外酶活性的测定
取恢复培养6 d及对照的菌丝和培养基混合体1 g,研钵研磨后转到试管,并加入蒸馏水定容至10 mL,25 ℃浸提4 h后过滤,4 000 r·min-1离心10 min,吸取上清液。采用邻联甲苯胺法[18]测定漆酶活性,采用DNS法测定羧甲基纤维素酶、半纤维素酶和淀粉酶活性[19]。30 min内1 g干培养物改变0.1个光密度值的酶活力为1 U。
1.3 数据处理及评价方法
采用Excel 2010 软件整理数据,采用SPSS25.0 软件进行方差分析、相关性分析、主成分分析、隶属函数分析及聚类分析。各指标的相对值和相对变化率的计算公式[2021]如下。
相对值=处理组测定值/对照组测定值×100% (2)
相对变化率=(处理组测定值?对照组测定值)/对照组测定值×100% (3)
按特征值大于1或累计贡献率大于80%的准则提取主成分,利用隶属函数将每个主成分上各菌株各主成分的得分值进行标准化[21];然后计算各综合指标的权重;进一步计算各菌株的耐热综合评价值(D 值),并以D 值进行聚类分析[2223];选用D 值作为因变量,11个生长和生理指标相对值作为自变量进行逐步回归分析,建立最优回归方程[24]。
2 结果与分析
2.1 热胁迫下的响应指标分析
热胁迫下,各菌株的菌丝较CK稀疏,且产生了“氧化应激”圈(图1),9个香菇菌丝的生长速度和干重、TBARS和PCO含量及SOD、CAT、漆酶、羧甲基纤维素酶、半纤维素酶、淀粉酶活性与CK均存在极显著差异,POD 活性与CK存在显著差异(表1~3),表明热胁迫对9个香菇菌丝的形态、生长和生理指标均产生不同程度的影响。
在热胁迫下,9个香菇菌丝的生长速度、干重均较CK大幅度降低(表1),其中,新秋7生长速度的降幅最大,为66.55%。109干重的降幅最大,为77.81%。TBARS、PCO 含量及SOD、CAT、POD 活性较CK 大幅度上升(表2),其中,新秋 7 的TBARS含量和808的PCO含量增幅最大,分别为23.64% 和43.77%;212 的SOD、POD 活性增幅最大,分别为CK 的1.64、4.48 倍,但其TBARS 含量的增幅最小,为4.84%;久香秋 7的CAT活性增幅最大,为49.90%。热胁迫后,9个菌丝的胞外酶活性较CK均有大幅度下降(表3),其中,新秋 7的漆酶、半纤维素、淀粉酶活性降幅最大,分别为82.42%、46.03%、75.27%;1513的羧甲基纤维素酶降幅最大,为60.87%。综上所述,高温胁迫后各菌株的生长、形态和生理指标均表现出不同程度的差异,表明不同菌株的代谢能力和温度适应能力存在差异。
2.2 相对指标值及相关性分析
为了减少不同菌株自身代谢能力和高温适应能力不同对耐热性评价的干扰,计算了热胁迫后9个菌株菌丝响应指标的相对值(表4),发现各值在不同菌株间变化幅度不同,说明无法根据某个单一指标的相对值直接判断其耐热性,需对各指标进行相关性分析,再进一步综合评价。此外,在热胁迫下,各响应指标相对值的变异系数在5.35%~35.86%,差异较大。由此可以看出,9个菌株的耐热性差异较大,且试验所选取的响应指标可用于耐热评价。
相关性分析(图2)表明,SOD与POD活性呈极显著正相关;半纤维素酶活性与干重呈显著正相关;POD活性与TBARS含量呈极显著负相关。由此表明,在热胁迫后菌丝SOD与POD活性、半纤维素酶活性与菌丝干重等指标间的响应表现具有一致性,而POD活性与TBARS含量则相反,表明TBARS含量的降低是通过SOD与POD活性共同协作完成的。此外,其他指标间也存在不同程度的相关性。
2.3 不同香菇菌株耐热性综合评价
在热胁迫响应中,由于各指标间具有相关性,会导致选择的指标在指标评价体系整体中具有相似的功能,掩盖了各指标本身在指标体系整体中所具有的差异性,使各指标所反映的耐热性信息存在不同程度的交叉与重叠现象。因此,无法用某一指标进行耐热性评价,需要在此基础上利用主成分分析法、隶属函数法等将相关性指标整合成独立的综合指标进行评价。
2.3.1 基于各响应指标相对值的主成分分析
主成分分析结果(表5)表明,以特征值大于1为原则,得到2个主成分,方差解释率分别为66.06%和14.20%,累计贡献率为80.26%,说明2 这个主成分可代表11个性状的大部分信息。2个主成分(Z1和Z2)对应的相关系数特征向量如下所示。
Z1 = 0.312X1-0.357X2-0.119X3+0.355X4+0.349X5+0.303X6+0.267X7+0.210X8+0.322X9+0.330X10+0.305X11 (4)
Z2 = 0.033X1+0.094X2+0.663X3+0.173X4+0.038X5-0.070X6+0.142X7-0.538X8+0.262X9-0.179X10+0.322X11 (5)
式中,X1代表生长速度;X2代表TBARS含量;X3 代表PCO 含量;X4 代表SOD 活性;X5 代表POD活性;X6代表CAT活性;X7代表漆酶活性;X8代表羧甲基纤维素酶活性;X9 代表半纤维素酶活性;X10代表淀粉酶活性;X11代表干重。
2.3.2 隶属函数值分析
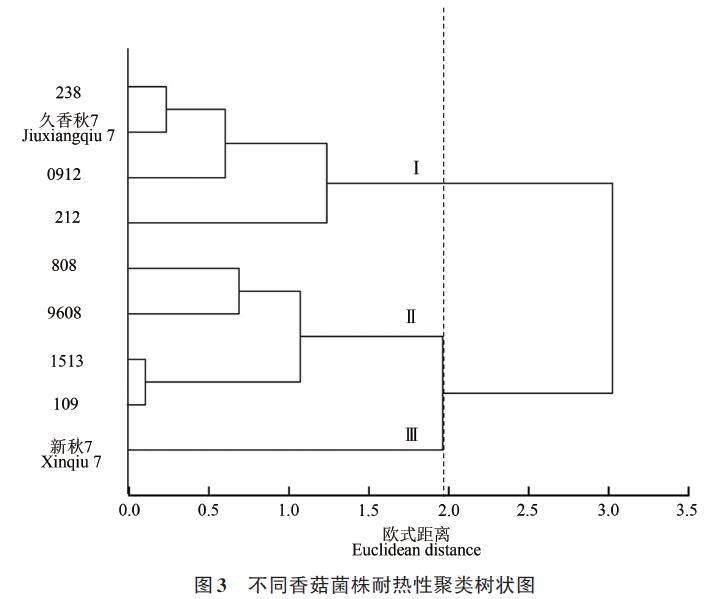
通过主成分分析得到2个主成分及其对应的特征向量,计算出其得分值和隶属函数值。然后根据各成分贡献率计算各主成分的权重,2个主成分的权重分别为0.82、0.18。根据权重和隶属函数值,计算出各材料的综合得分值(D),D 值为各材料的耐热能力,D 值越大,表明该菌株的耐热性越高。由表6可知,9个菌株的D 值表现为212>久香秋7>238>0912>9608>808>1513>109>新秋7。
2.3.3 聚类分析
根据D 值进行聚类分析,将9个香菇菌株耐热能力分为3个类群,如图3所示。类群Ⅰ包含212、久香秋7、238 和0912,其D 值≥0.68;类群Ⅱ包含9608、808、1513和109(0.31≤D≤0.53);类群Ⅲ仅包含新秋7,其D 值≤0.10。此外,菌丝的生长速度、TBARS 含量及SOD、POD 活性在不同类群间差异较大,其中,类群Ⅰ上述4个指标的相对值分别为43%~55%、104%~109%、236%~264%和135%~150%;类群Ⅱ分别为37%~43%、109%~117%、116%~191% 和119%~130%;类群Ⅲ分别为34%、124%、107%及106%。
2.4 回归模型的建立和耐热评价指标的筛选
采用多元逐步回归分析方法,以综合评价值(D)为因变量,以各响应指标相对值为自变量建立最优回归方程,预测香菇耐热性鉴定的数学回归模型如下所示。
D=0.532+0.005X1-0.01X2+0.002X4+0.004X5 (6)
式中,X1、X2、X4、X5分别代表生长速度、TBARS含量及SOD、POD 活性的相对值,该方程的R2=0.997,F=604.10,达到极显著性水平(P<0.01),表明这4个指标为耐热性鉴定的关键响应指标。
将9个香菇菌株的上述4个关键指标的相对值代入方程,得到9个菌株的耐热性预测值,分别为0.765、0.444、0.944、0.101、0.705、0.315、0.311、0.546和0.781,排序与主成分分析一致;将预测值与主成分分析的综合评价值(D)进行相关性分析,可得出二者的相关系数r 为0.998,呈极显著相关(P<0.01),说明该回归方程对香菇菌丝的耐热性预测具有较好的可靠性。
3 讨论
3.1 菌丝的热胁迫响应
当生物体处于高温胁迫下,细胞会受到损伤甚至死亡,并产生一系列复杂的包括形态、生理生化的响应[2526]。本研究表明,热胁迫处理明显抑制菌丝的生长速度和生物量,其生长速度较CK降低33.45%~69.19%,干重降低22.19%~51.17%,由此表明,热胁迫对菌丝生长速度的影响略大于菌丝生物量。同时,热胁迫会引起机体氧化还原系统紊乱,产生大量ROS积累,造成氧化损伤,生物体通过激活自身抗氧化防御系统进行氧化应激行为[7]。本研究发现,热胁迫处理后菌丝的SOD、CAT、POD 活性上升,其中,212 的酶活性增幅较大,且TBARS含量的增长较少,表明在热胁迫后菌株会通过提高抗氧化酶活性以此降低高温造成的膜脂过氧化损伤,这与王倩等[27]研究结果一致。此外,本研究还发现,在解除热胁迫后,常温恢复培养的香菇菌丝分泌胞外代谢酶的能力较对照组显著下降,这与刘兵[11]研究结果一致。热胁迫后,香菇菌丝通过提高抗氧化酶活性、降低TBARS含量等生理响应,有利于菌丝恢复生长。
3.2 菌丝的耐热评价方法及关键指标的筛选
选育香菇耐热品种至关重要,而高效的评价、鉴定方法是开展耐热品种选育工作的基础[24,28]。为筛选适宜的评价指标,前人开展了大量相关研究。赵妍等[5]利用杂交方法选育香菇耐高温菌株时发现,菌丝生长速度为耐高温菌株筛选的重要指标。周莎莎等[12]研究表明,菌丝TBARS、超氧阴离子含量及SOD、CAT、POD等抗氧化酶活性可作为筛选菌丝耐热能力的标准。宋爽等[8]对不同香菇种质的耐热性评价后,将SOD、CAT、POD活性及丙二醛(malonaldehyde,MDA)、脯氨酸含量等生理指标的耐热系数标准化后进行聚类分析,将808划分为耐热能力较弱的菌株。本研究在进行耐热性评价时,采用指标相对值进行评价,可以有效地克服品种本身差异所带来的影响,更准确地对不同品种的耐热性进行客观评价;此外,采用相关性分析、主成分分析、隶属函数分析及聚类分析等方法,弥补了用单一指标或单一分析方法进行耐热评价的不足,能更准确地反映香菇的耐热能力,经评价将808划分为中等耐热能力的菌株;同时,本研究采用多元逐步回归分析建立了菌丝耐热性的回归模型,筛选出高温胁迫后菌丝的生长速度、SOD活性、POD活性和TBARS含量为关键鉴定指标,为快速评价香菇的耐热性提供了参考性状,有利于提高耐热品种的选育效率。
参 考 文 献
[1] 边银丙.食用菌栽培学[M].第3版.北京:高等教育出版社,2017:37-38.
[2] 曹斌“. 十四五”时期推进我国香菇产业高质量发展的前景和实现路径[J].食用菌学报,2020,27(4):25-34.
CAO B. Prospects and implementation path of promoting highqualitydevelopment of Lentinula edodes industry in Chinaduring the“ 14th five-year” plan period [J]. Acta Edulis Fungi,2020, 27(4):25-34.
[3] 曹现涛.香菇菌棒腐烂病香菇木霉鉴定与发生规律初步研究[D].武汉:华中农业大学,2015.
CAO X T. Preliminary study on Trichoderma spp. identificationand incidence regularity associated with Lentinula edodescultivation bag rot disease [D]. Wuhan: Huazhong AgriculturalUniversity, 2015.
[4] 王波,唐利民,熊鹰,等.香菇菌株菌丝和子实体生长耐高温试验研究[J].吉林农业大学学报,2004,26(2):145-147.
WANG B, TANG L M, XIONG Y, et al .. Test on themophilicstability of mycelia and fruitbody growth of Lentinula edodes [J]. J.Jilin Agric.Univ., 2004,26(2):145-147.
[5] 赵妍,王丽宁,蒋俊,等. 利用杂交方法选育香菇耐高温菌株[J].分子植物育种,2016,14(11):3145-3153.
ZHAO Y, WANG L N, JIANG J, et al .. Breeding thermotolerantstrains of xianggu mushroom (Lentinula edodes) byhybridization method [J]. Mol. Plant Breed., 2016, 14(11):3145-3153.
[6] SHEN Y Y, CAI W M, ZHOU S H, et al .. Phenotype analysisof mycelia growth regeneration after heat stress in a Lentinulaedodes F-2 population [J]. J. Hortic. Sci. Biotechnol., 2017, 92(4):397-403.
[7] 常婷婷,赵妍,杨焕玲,等. 食药用菌高温胁迫应答研究进展[J].食用菌学报,2021,28(1):124-134.
CHANG T T, ZHAO Y, YANG H L, et al .. Research progresson heat stress response in edible and medicinal fungi [J]. ActaEdulis Fungi, 2021, 28(1):124-134.
[8] 宋爽,荣成博,严冬,等.不同香菇栽培种质耐热性评价[J].北方园艺,2020(1):117-121.
SONG S, RONG C B, YAN D, et al .. Heat resistanceevaluation of different Lentinula edodes cultivars [J]. NorthernHortic., 2020(1):117-121.
[9] 刘秀明,邬向丽,张金霞,等.白灵侧耳栽培种质对高温胁迫的反应研究[J].菌物学报,2015,34(4):640-646.
LIU X M, WU X L, ZHANG J X, et al .. Heat stress response ofcultivated Pleurotus eryngii var. Tuoliensis germplasms [J].Mycosystema, 2015, 34(4):640-646.
[10] BORSANI O, VALPUESTA V, BOTELLA M A. Evidence for arole of salicylic acid in the oxidative damage generated byNaCl and osmotic stress in Arabidopsis seedlings [J]. PlantPhysiol., 2001, 126(3):1024-1030.
[11] 刘兵.γ-氨基丁酸和海藻糖对高温胁迫香菇菌丝胞外酶活性的影响[D].晋中:山西农业大学,2017.
LIU B. Effect of GABA and trehalose on the activity ofexoenzyme induced by heat stress in mycelia of Lentinusedodes [D]. Jinzhong: Shanxi Agricultural University, 2017.
[12] 周莎莎,王刚正,罗义,等.生长素及其类似物增强香菇耐高温性的研究[J].菌物学报,2018,37(12):1723-1730.
ZHOU S S , WANG G Z, LUO Y, et al.. Auxin and auxinanalogues enhancing the thermotolerance of Lentinula edodes[J]. Mycosystema, 2018, 37(12):1723-1730.
[13] KONG W W, HUANG C Y, CHEN Q, et al .. Nitric oxidealleviates heat stress-induced oxidative damage in Pleurotuseryngii var. Tuoliensis [J]. Fungal Genet. Biol. 2012, 49(1):15-20.
[14] LEVINE R L, WILLIAMS J A, STADTMAN E R, et al ..Carbonyl assay for determination of oxidatively modifiedproteins [J]. Methods Enzymol., 1994, 233:346-357.
[15] BEAUCHAMP C, FRIDOVICH I. Superoxide dismutase:improved assays and an assay applicable to acrylamide gels [J].Anal. Biochem., 1971, 44(1):276-287.
[16] AEBI H. Catalase in vitro [J]. Methods Enzymol., 1984, 105:121-126.
[17] VELIKOVA V, YORDANOV I, EDREVA A. Oxidative stressand some antioxidant systems in acid rain-treated bean plants:protective role of exogenous polyamines [J]. Plant Sci., 2000,151(1): 59-66.
[18] 张维瑞,刘盛荣,周修赵,等.不同状态培养基下pH对香菇、滑菇及金针菇漆酶活性的影响[J]. 热带作物学报,2020,41(11):2232-2236.
ZHANG W R, LIU S R, ZHOU X Z, et al .. Effects of pH onlaccase activity of Lentinula edodes, Pholiota nameko, andFlammulina velutipes grown in different state media [J]. Chin.J. Trop. Crops, 2020, 41(11):2232-2236.
[19] 张权.香菇胞外酶活性变化规律和农艺性状研究[D].新乡:河南科技学院,2016.
ZHANG Q. Study on the change regularity of extracellularenzyme activity and agronony characters of Lentinula edodes [D].Xinxiang: Henan Institute of Science and Technology, 2016.
[20] 王萌,赵曾菁,赵虎,等.基于隶属函数和聚类分析法的广西韭菜地方种质资源耐热性评价[J]. 西南农业学报,2023,36(3):541-549.
WANG M, ZHAO Z J, ZHAO H, et al .. Evaluation of heattolerance of leek local germplasm resources in Guangxi basedon membership function and cluster analysis [J]. SouthwestChina J. Agric. Sci., 2023, 36(3):541-549.
[21] 张宇君,赵丽丽,王普昶,等.燕麦萌发期抗旱指标体系构建及综合评价[J].核农学报,2017,31(11):2236-2242.
ZHANG Y J, ZHAO L L, WANG P C, et al .. Construction andcomprehensive evaluation of drought resistance index systemin oatmea during germination [J]. J. Nucl. Agric. Sci., 2017,31(11):2236-2242.
[22] 李春红,姚兴东,鞠宝韬,等.不同基因型大豆耐荫性分析及其鉴定指标的筛选[J]. 中国农业科学,2014,47(15):2927-2939.
LI C H, YAO X D, JU B T, et al .. Analysis of shade-toleranceand determination of shade-tolerance evaluation indicators indifferent soybean genotypes [J]. Sci. Agric. Sin., 2014, 47(15):2927-2939.
[23] 于崧,郭潇潇,梁海芸,等.不同基因型绿豆萌发期耐盐碱性分析及其鉴定指标的筛选[J]. 植物生理学报,2017,53(9):1629-1639.
YU S, GUO X X, LIANG H Y, et al .. Analysis of salinealkalinetolerance and screening of identification indicators atthe germination stage among different mung bean genotypes [J].Plant Physiol. J., 2017, 53(9):1629-1639.
[24] 苏小雨,高桐梅,张鹏钰,等.基于主成分分析及隶属函数法对芝麻苗期耐热性综合评价[J].作物杂志,2023(4):52-59.
SU X Y, GAO T M, ZHANG P Y, et al .. Comprehensiveevaluation of heat resistance of sesame seedlings based onprincipal component analysis and membership functionmethod [J]. Crops, 2023(4):52-59.
[25] GUPTA S K, KUMAR R, SARKAR B, et al .. Priming alleviateshigh temperature induced oxidative DNA damage and repairusing apurinic/apyrimidinic endonuclease (Ape1 L) homologuein wheat (Triticum aestivum L.) [J]. Plant Physiol. Biochem.,2020, 156: 304-313.
[26] LOKA D A, TERHUIS D M, BAXEVANOS D, et al .. Singleand combined effects of heat and water stress and recovery oncotton (Gossypium hirsutum L.) leaf physiology and sucrosemetabolism [J]. Plant Physiol. Biochem., 2020, 148:166-179.
[27] 王倩,黄建春,卜乐男,等.双孢蘑菇对高温胁迫的响应及耐热机理[J].菌物学报,2021,40(6):1400-1412.
WANG Q, HUANG J C, BU L N, et al .. The response andthermotolerant mechanism of Agaricus bisporus under hightemperature stress [J]. Mycosystema, 2021, 40(6):1400-1412.
[28] 陈立松,刘星辉.植物抗热性鉴定指标的种类[J].干旱地区农业研究,1997,15(4):74-79.
CHEN L S, LIU X H. Kinds of identification index for plantheat resistance [J]. Agric. Res. Arid Areas, 1997, 15(4):74-79.
(责任编辑:张冬玲)
基金项目:国家重点研发计划项目( 2021YFD1100607);新疆维吾尔自治区现代农业产业技术体系项目(XJARS-07);大学生创新训练计划项目(XJAU2022555)。
