不同光质对多肋藻配子体生长发育的影响
2024-07-01陈书秀李晓捷王伟伟赵聚萍
陈书秀 李晓捷 王伟伟 赵聚萍


摘 要:以多肋藻(Costaria costata)雌雄配子体为材料,研究了蓝光、白光、红光对配子体生长发育的影响。结果表明:光质对多肋藻配子体的生长发育有显著的影响(P<0.05),雌配子体在蓝光条件下相对生长率(5.62%)显著高于红光(3.37%),但与白光下的相对生长率(4.94%)无显著差异;雄配子体在白光下的相对生长率(8.71%)最高,显著高于红光(6.73%),但与蓝光下的相对生长率(7.74%)无显著差异。相同光质条件下,雄配子体相对生长率显著高于雌配子体。整个培养周期过程中,红光条件下,配子体均未发育。相同培养天数下,蓝光组的发育率显著高于白光组。随着培养天数的增加,白光组和蓝光组的发育率均有显著的提高,白光组于第28天达到最大值21.13%,蓝光组于第20天达到最大值67.73%。
关键词:多肋藻(Costaria costata);配子体;生长;发育;光质
多肋藻(Costaria costata)是一种一年生海洋藻类,主要分布在太平洋北部沿岸的浅海区,在亚洲主要分布在日本北海道和朝鲜半岛的沿海水域,并已在韩国和日本栽培[1-2]。多肋藻于1992年引入中国,在华北海域进行了育苗和养殖实验[3]。目前,大连和荣成沿海都在进行小规模海上养殖[4-5]。多肋藻生长繁殖速度快,在海洋环境恢复和海洋森林建设中具有重要的作用[6]。除了其对鲍鱼和海胆等海洋动物的饵料价值之外,C.costata还被认为是海藻酸、海藻多糖和岩藻多糖的重要来源,广泛用于食品加工行业、生物技术和医药领域[7-8]。因此,预计未来对多肋藻的需求将会增加。
目前,多肋藻育苗主要采用传统的种菜采苗方式,即利用成熟的多肋藻叶状体放散游孢子后发育成幼孢子体的方式进行育苗培养。这种方法有一些缺点,如耗时长、受季节限制和常见性病害多发。利用配子体无性系直接发育成幼孢子体进行育苗培育的方法,可使室内培养时间缩短一半,生产成本降低一半。室内培养时间的缩短,可以有效减少畸形和孢子分离疾病的发生[9-10]。对海带目的许多物种培养研究表明,海藻配子体产生卵子和精子,涉及营养细胞向繁殖细胞的转化,营养生长和生殖生长是拮抗过程[11-12]。海带配子体可以通过抑制诱导条件进行无性繁殖,也可以通过提供适当的条件诱导产生生殖细胞。从营养生长到生殖发育的变化归因于各种环境因素,包括温度、光量、光质、光周期和营养素[13-15]等,其中光质对海带等大型褐藻的配子体生长发育起着至关重要的作用。Shi等[16]研究发现蓝光下海带配子体生长速度显著高于红光,且蓝光是配子体的发育受精的必要条件之一。隋晓伟等[17]研究结果表明:蓝光最利于海带配子体生长发育,红光仅对配子体生长有促进作用。
多肋藻的生理生化、生长发育及海水养殖方面已经做了很多研究[18-23]。有关光质对多肋藻配子体生长发育的影响研究较少,付刚[24]研究发现,光质对多肋藻胚孢子的萌发无显著影响,红光可促进雌配子体的营养生长,蓝光更利于配子体成熟发育。本研究在实验室中评估了光质对多肋藻雌配子体生长发育的影响,旨在优化配子体发育条件,促进配子体快速同步发育。
1 材料与方法
1.1 试验材料
将多肋藻雌雄配子体细胞团进行物理切割并用60 μm孔径的筛绢过滤,获得50~100 μm细胞段,制备成细胞悬浊液备用。
1.2 试验方法
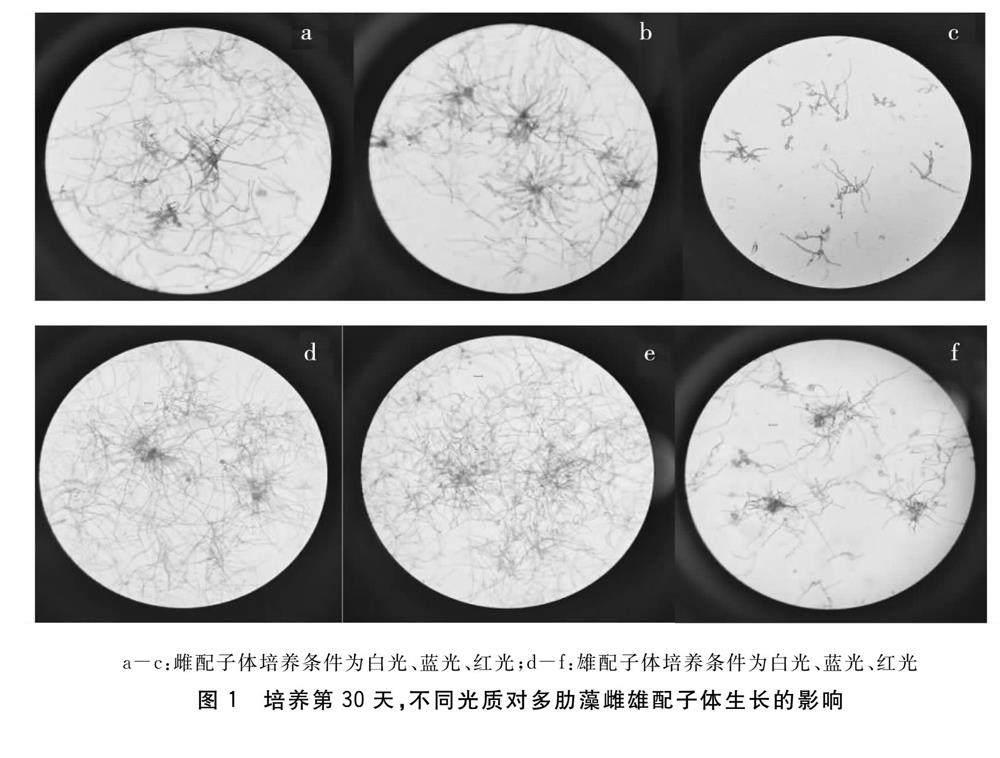
1.2.1 生长试验 取适量的雌、雄配子体悬浊液分别加入到培养皿中,放置在白光、蓝光和红光三种不同波长的光线下培养,其他条件为NO-3-N 4 mg/L、PO3-4-P 0.4 mg/L,光照强度40 μmol·m-2·s-1,温度10 ℃,盐度31‰,光照周期均为24L∶0D。每个光质组设置3个平行。经过30 d的培养,拍照,采用ImageJ进行数据统计,根据初始配子体平均长度(L0)和试验结束时配子体平均总长度(L1)计算相对生长速率(RGR,%·d-1)。相对生长速率计算:RGR=100[ln(L1)-ln(L0)]/t,其中t为试验天数,d。
1.2.2 发育试验 雌、雄配子体细胞悬浊液2∶1(体积比)进行混合后,取适量加入到培养皿中,配子体细胞段附着于培养皿底部,每个100×视野中含有20~30个细胞段。发育条件设置白光、蓝光和红光3种不同波长的光线,其他条件均为NO-3-N 4 mg/L、PO3-4-P 0.4 mg/L、C6H5FeO7-Fe 0.1 mg/L,光照强度30 μmol·m-2·s-1,温度10 ℃,盐度31‰,光照周期均为12L∶12D。每个光质组设置3个平行。每3~4 d观察拍照,统计卵囊形成及排卵的雌配子体和幼孢子体数量,计算配子体发育率。
1.3 数据处理
采用双因素方差分析检验光质和性别差异对多肋藻配子体生长的影响,并检验光质和培养天数对配子体发育的影响。相同性别和相同培养天数下进行单因素方差分析并采用LSD进行差异显著性分析。显著水平设为P<0.05。所有统计分析采用SPSS24.0软件并用Excel软件作图。
2 结果
2.1 不同光质对多肋藻配子体生长的影响
光质及性别差异对多肋藻配子体的生长有显著的影响(P<0.05),但两者相互作用对配子体生长的影响不显著(P=0.192>0.05)。雌配子体在蓝光条件下相对生长率(5.62%)显著高于红光(3.37%),但与白光下的相对生长率(4.94%)无显著差异;雄配子体在白光下的相对生长率(8.71%)最高,显著高于红光(6.73%),但与蓝光下的相对生长率(7.74%)无显著差异(见表1和图1)。相同光质条件下,雄配子体相对生长率显著高于雌配子体(表1和图1)。
2.2 不同光质对多肋藻配子体发育的影响
在试验周期内,红光组的多肋藻配子体仅营养生长,不发育,无卵囊形成,外观形态变化见图2a-c。培养第10天,蓝光条件下即出现卵囊及排卵现象(图2de),第13天,白光组才开始出现排卵现象,蓝光组已经出现幼孢子体(图2f)。第16天,蓝光条件下,发育率达61.56%,其中小苗占30%以上,白光条件下的发育率仅为21.13%(图3)。
方差分析结果表明,光质、培养天数及两者的相互作用对多肋藻配子体发育率有显著的影响(P<0.001)。整个培养周期过程中,红光条件下,配子体均未发育。表2多重比较结果显示,相同培养天数下,蓝光组的发育率显著高于白光组。随着培养天数的增加,白光组和蓝光组的发育率均有显著的提高,白光组于第28天达到最大值21.13%,蓝光组于第20天达到最大值67.73%。
3 讨论
由于海水地域性差异,导致了不同海域不同水深的光谱结构不同,海藻长期对环境的适应与进化,从而形成了不同的海藻色素和不同的光质适应机制[25-26]。大量研究表明,不同光质(白、蓝、红、绿光)对藻类的光合效率、生长发育以及生化代谢等均可产生显著的影响。例如,López-Figueroa等[27]研究发现,在紫菜(Porphyra umbilicalis)中,叶绿素的积累和藻蓝蛋白的合成主要是由红光引起的,藻红蛋白的合成主要受绿光的刺激。蓝光可促进硬石莼(Ulva rigida)、长珊瑚藻和海头红(Plocamium cartilagineum)叶绿素的积累速率。Saavedra等[28]研究发现,角毛藻(Chaetoceros sp.)在蓝光下的生长速度和叶绿素含量显著高于白光。Gong等[29]研究发现蓝光可提高解石莼(Ulva lactuca)的相对生长率,而红光会降低解石莼的相对生长率。Bird等[30]研究发现,蓝光可促进真江蓠(Gracilaria vermiculophylla)的氨基酸合成。Kang等[31]研究结果表明,红光能够提高长茎葡萄蕨藻(Caulerpa lentillifera)生长速率。刘洪艳等[32]研究也发现绿光培养条件下紫球藻(Porphyridium cruentum)生物产量、藻胆素、可溶性总蛋白的含量最高,而红光条件下生长最缓慢。Godínez-Ortega等[33]研究发现绿光促进海膜(Halymenia floresii)的生长和叶绿素a、α-胡萝卜素和叶黄素的合成,蓝光促进藻蓝蛋白合成。隋晓伟等[17]研究发现,蓝光和绿光可促进海带配子体生长。本试验结果表明,配子体在红光条件下相对生长率显著低于蓝光和白光,蓝光和白光条件下相对生长率无显著差异;相同光质条件下,雄配子体相对生长率显著高于雌配子体。
有些海藻在不同生活史阶段对光质的响应也存在差异,例如,小球藻(Chlorella) 突变体处于休眠细胞阶段时,蓝光可促进对氨基酸的吸收;处于生长阶段时,蓝光却对氨基酸的吸收起到抑制作用[34]。Wang等[35-36]研究了不同光质对海带(Saccharina japonica)早期发育的影响,结果表明,光质对游动孢子的附着和萌发影响不大,蓝光可促进卵母细胞形成、幼孢子体的生长和细胞分裂。Lüning等[37]研究发现糖海带Saccharina latissima配子发育需要蓝光,并提供了通过抑制蓝光而使配子体无性生长的方法。Drueh等[38]测定了13种海带孢子在无蓝光条件下的生殖反应。他们发现大多数物种在没有蓝光的条件下配子体不会发育,但是3种潮间带物种在有或没有蓝光的情况下配子体均可发育。本试验结果表明,与白光相比,蓝光促进了多肋藻配子体向孢子体的发育。这与付刚[24]的研究结果一致。
参考文献:
[1] SELIVANOVA O N, ZHIGSDLOVA G G, HANSEN G I. Revision of the systematics of algae in the order Laminariales (Phaeophyta) from the Far-Eastern seas of Russia on the basis of molecular-phylogenetic data[J]. Russian Journal of Marine Biology, 2007, 33:278-289.
[2] SOHN C H. Developments on two newly cultivated species Capsosiphon fulvescens and Costaria Costata in Korea[J]. Journal of Phycology,2003,39:53-54.
[3] 张泽宇,陈树科,蒋晖.Costaria costata的室内培养与栽培试验[J].大连水产学院学报,1992(Z1):39-47.
[4] 李国梁,汪文俊,李宝贤,等.基于MaxEnt模型和ArcGIS预测多肋藻在中国海域的适生分布特征[J].中国水产科学,2021,28(12):1588-1601.
[5] 梁广津,潘金华,张壮志,等.多肋藻夏苗培育及养殖技术[J].河北渔业, 2017 (6): 36-39+43.
[6] KANG J K, PHAM B N, LEE C G, et al. Biosorption of Cd2+, Cu2+, Ni2+, Pb2+ by four diferent macroalgae species (Costaria costata, Hizikia fusiformis, Gracilaria verrucosa, and Codium fragile)[J]. International Journal of Environmental Science and Technology, 2023,20:10113-10122.
[7] ERMAKOVA S, SOKOLOVA R, KIM S M, et al. Fucoidans from brown seaweeds Sargassum hornery, Eclonia cava, Costaria costata: structural characteristics and anticancer activity[J]. Applied Biochemistry and Biotechnology, 2011,164:841-850.
[8] LIU N N, WU X, FU X T, et al. Characterization of polysaccharides extracted from a cultivated brown alga Costaria costata during the harvest period[J]. Journal of ocean university of China,2018,17:1209-1217.
[9] LI X J, ZHANG Z Z, QU S C, et al. Improving seedless kelp (Saccharina japonica) during its domestication by hybridizing gametophytes and seedling-raising from sporophytes[J].Scientific Report,2016(6):21255.
[10] LI D P, ZHOU Z G, LIU H H, et al. A new method of Laminaria japonica strain selection and sporeling raising by the use of gametophyte clones[J]. Hydrobiologia, 1999,398:473-476.
[11] BOLTON J J, LEVITT G J, Light and temperature requirementsfor growth and reproduction in gametophytes of Ecklonia maxima (Alariaceae: Laminariales) [J].Marine Biology,1985,87:131-135.
[12] CARNEY L T, EDWARDS M S. Role of nutrient fluctuations and delayed development in amerophyte reproduction by Macrocystis pyrifera (Phaeophyceae) in southern California[J]. Journal of Phycology,2010,46:987-996.
[13] MARTINS N, TANTTU H, PEARSON G A, et a1. Interactions of daylength, temperature and nutrients affect thresholds for life stage transitions in the kelp Laminaria digitata(Phaeophyceae)[J]. Botanica Marina, 2017, 60(2): 109-121.
[14] MORELISSEN B,DUDLEY B D,GEANGE S W.Gametophyte reproduction and development of Undaria pinnatifida under varied nutrient and irradiance conditions[J].Journal of Experimental Marine Biology and Ecology,2013,448:197-206.
[15] IWAI H,FUKUSHIMA M,MOTOMURA T.Effect of iron complexes with seawater extractable organic matter on oogenesis in gametophytes of a brown macroalga (Saccharina japonica)[J]. Journal of Applied Phycology, 2015,27(4):1583-1591.
[16] SHI H Z,BRESSAN R.RNA extraction [J].Methods in Molecular Biology,2006,323:345-348.
[17] 隋晓伟,任伟,闫文华,等.光质对海带配子体生长发育影响的研究[J].海洋科学,2011,35(4):33-36.
[18] FU G, LIU J D, WANG G G, et al. Early development of Costaria costata (C. Agardh) Saunders and cultivation trials[J].Chinese Journal of Oceanology and Limnology,2010,28(4):731-737.
[19] 孙娟,潘金华,张壮志,等.温度和光照强度对多肋藻(Costaria costata)配子体生长影响研究[J].渔业研究,2019, 41(1):11-17.
[20] 赛珊,赵楠,罗世菊,等.多肋藻雌配子体种质保存和扩培的温光条件研究[J].水产养殖,2021, 42(5):24-28.
[21] 李国梁,汪文俊,李宝贤,等.光强对多肋藻小孢子体生长及抗氧化生理的影响[J].中国水产科学,2022, 29(12):1778-1787.
[22] 李国梁,汪文俊,李宝贤,等.温度对多肋藻小孢子体生长及抗氧化生理的影响[J].中国水产科学,2022, 29(9):1300-1311.
[23] BORLONGAN I A, MATASUMOTO K, NAKAZAKI Y, et al. Photosynthetic activity of two life history stages of Costaria costata (Laminariales, Phaeophyceae) in response to PAR and temperature gradient[J].Phycologia,2018,57 (2):159-168.
[24] 付刚.多肋藻(Costaria costata)生理生态学研究[D].青岛:中国海洋大学,2009.
[25] 任毛飞,毛桂玲,刘善振,等.光质对植物生长发育、光合作用和碳氮代谢的影响研究进展[J].植物生理学报,2023, 59( 7):1211-1228.
[26] RüDIGER W,LPEZ-FIGUEROA F.Photoreceptors in algae [J].Photochemistry and Photobiology, 1992, 55(6): 949-954.
[27] L PEZ-FIGUEROA F,NIELL F X.Effects of light quality on chlorophyll and biliprotein accumulation in seaweeds [J]. Marine Biology,1990,104(2):321-327.
[28] SAAVEDRA M D P S,VOLTOLINA D.The chemical composition of Chaetoceros sp. (Bacillariophyceae) under different light conditions[J].Comparative Biochemistry and Physiology Part B: Comparative Biochemistry,1994,107(1):39-44.
[29] GONG J Y,LIU Z W,ZOU D H.Growth and photosynthetic characteristics of Gracilaria lemaneiformis (Rhodophyta) and Ulva lactuca ( Chlorophyta) cultured under fluorescent light and different LED light[J].Journal of Applied Phycology,2020,32(5):3265-3272.
[30] BIRD K T,DAWES C J,ROMEO J T.Light quality effects on carbon metabolism and allocation in Gracilaria verrucosa[J].Marine Biology,1981,64(2):219-223.
[31] KANG L K,HUANG Y J,LIM W T et al.Growth, pigment content, antioxidant activity and phytoene desaturase gene expression in Caulerpa lentillifera grown under different combinations of blue and red light-emitting diodes[J].Journal of Applied Phycology,2020,32:1971-1982.
[32] 刘洪艳,潘伶俐,施定基.不同光质对紫球藻生长及藻胆素含量的影响[J].天津科技大学学报, 2007,22(1):26-28.
[33] GODINEZ-ORTEGA J L,SNOEIJS P,ROBLEDO D,et al.Growth and pigment composition in the red alga Halymenia floresii cultured under different light qualities[J].Journal of Applied Phycology,2008,20(3):253-260.
[34] KAMIYA A,SAITOH T.Blue-light-control of the uptake of amino acids and of ammonia in Chlorella mutants[J].Physiologia Plantarum,2002,116(2):248-254.
[35] WANG W J,SUN T,WANG F J.Effect of blue light on early sporophyte development of Saccharina japonica (Phaeophyta)[J].Marine Biology,2010,157(8):1811-1817.
[36] WANG W J,SUN X T,WANG G C,et al.Effect of blue light on indoor seedling culture of Saccharina japonica (Phaeophyta)[J].Journal of Applied Phycology,2010,22(6):737-744.
[37] LNING K,DRING M J.Reproduction, growth and photosynthesis of gametophytes of Laminaria saccharina grown in blue and red light[J].Marine Biology,1975, 29(3):195-200.
[38] DRUEHL L D,BOAL R.Manipulations of the Laminarialean life-cycle and its consequences for kombu mariculture[M]//LEVRIG T.International Seaweed Symposium (Xth),Proceedings, Gteborg, Sweden,1981: 575-580.
Effects of different light quality on the growth and development of gametophyte of Costaria costata
CHEN Shuxiu,LI Xiaojie,Wang Weiwei,ZHAO Juping
(Shandong Oriental Ocean Group Co.Ltd., National Algae and Sea Cucumber Engineering Technology Research Center, Algae in Shandong Province Key Laboratory of Genetic Breeding and Cultivation Technology, Yantai 264003, China
)
Abstract:The effects of blue light, white light and red light on the growth and development of female and male gametophytes of Costaria costata were studied. The results showed that the RGR (relative growth rate) of female gametophyte under red light (3.37%) was significantly lower than that under blue light (5.62%), the RGR of male gametophyte under white light (8.71%) was higher than that under red light (6.73%), but there was no significant difference with that under blue light (7.74%). Under the same light quality, the RGR of female gametophyte was significantly lower than that of male gametophyte. The gametophytes did not develop under red light during the whole culture period. The development rate of blue light group was significantly higher than that of white light group under the same culture days. With the increase of culture days, the growth rate of white-light group and blue-light group increased significantly. The maximum value of white-light group was 21.13% on the 28th day, and that of blue-light group was 67.73% on the 20th day.
Key words:Costaria costata; gametophyte; growth; development; light quality
(收稿日期:2024-04-24)
