果型和抗性基因协同对番茄黄化曲叶病毒带毒量的影响
2024-06-29米国全,唐艳领,马凯,张春奇,蔡毓新,荆艳彩,牛莉莉,李红波,朱永,陈绘利,史宣杰
米国全,唐艳领,马凯,张春奇,蔡毓新,荆艳彩,牛莉莉,李红波,朱永,陈绘利,史宣杰

摘 要:以12份番茄种质为试材,其具有2类果实大小和3种不同抗性基因,通过检测番茄黄化曲叶病毒病田间抗性和带毒量指标,探索果实大小、抗病基因与田间抗性、带毒量之间的关系。结果显示,在自然传毒情况下,所有番茄材料都能检测到病毒感染。在番茄定植后28 d,小果型番茄M8(I)、M5(I)、M3(I)、M7(I)、M9(I)和M11(HR)带毒量均较低,大果型番茄M6(S)、M10(S)、M4(S)和M2(S)带毒量均较高,且小果型番茄田间发病率明显低于大果型番茄。除了Ty-1/ty-1单基因抗性不受番茄果实大小影响外,携带其他单基因或聚合基因抗性的番茄种质均与果实大小有关。在此节点上,带毒量越高抗性越弱,带毒量越低抗性越强。总体来说,在遭受番茄黄化曲叶病毒侵染时,小果型番茄田间抗性强于大果型番茄。
关键词:番茄;果实大小;带毒量;黄化曲叶病毒;抗性
中图分类号:S641.2 文献标志码:A 文章编号:1673-2871(2024)06-037-08
Synergistic effect of fruit shape and resistance genes on the titer of virus carried by tomato yellow leaf curl virus
MI Guoquan1, TANG Yanling1, MA Kai1, ZHANG Chunqi2, CAI Yuxin3, JING Yancai1, NIU Lili1, LI Hongbo2, ZHU Yong2, CHEN Huili3, SHI Xuanjie1
(1. Vegetable Research Institute, Henan Academy of Agricultural Sciences, Zhengzhou 450002, Henan, China; 2. Luoyang Academy of Agricultural and Forestry Sciences, Luoyang 471023, Henan, China; 3. Henan Qingfa Seeds Co., Ltd., Zhengzhou 450002, Henan, China)
Abstract: In this study, 12 tomato germplasm with 3 different resistance genes and two kinds of fruit sizes were selected as samples to reveal the relationship between fruit size, resistance genes and field resistance and virus concentration of tomato yellow leaf curl virus. The results showed that in the case of natural transmission, virus infection can be detected in all tomato materials. On the 28th day after tomato seedlings were planted, the viral loads of small-fruit tomatoes M8(I), M5(I), M3(I), M7(I), M9(I)and M11(HR) were low, while those of large-fruit tomatoes M6(S), M10(S), M4(S)and M2(S)were high, and the incidence of infection in small-fruit tomatoes was significantly lower than that in large-fruit tomatoes. In addition to Ty-1/ty-1 single gene resistance was not affected by tomato fruit size, tomato germplasm carrying other single gene or polymeric gene resistance was related to fruit size. At this node, the higher the amount of poison, the worse the resistance, and the lower the amount of poison, the stronger the resistance. In general, the field resistance of small fruit tomatoes was higher than that of large fruit tomatoes when infected with tomato yellow leaf curl virus.
Key words: Tomato; Fruit size; Virus concentration; Tomato yellow leaf curl virus; Resistance
番茄是世界上广泛种植的一种蔬菜作物,也是我国主栽的蔬菜作物之一。烟粉虱传播的番茄黄化曲叶病毒(tomato yellow leaf curl virus,TYLCV)病是限制番茄生产的最重要病害之一[1]。培育抗病品种是控制番茄黄化曲叶病毒病的有效方法和手段之一。迄今为止,已在野生番茄中定位到7个独立遗传的主要抗性基因,包括S. chilense(Ty-1、Ty-3、Ty-3a、Ty-4和Ty-6),S. habrochaites syn. L. hirsutum(Ty-2)和S. peruvianum(Ty-5)。Ty-1和Ty-2基因表现为完全显性或接近完全显性,而Ty-3则表现出更多的加性效应。Ty-1、Ty-2、Ty-3和Ty-3a已被广泛应用于对抗单组分和双组分双生病毒的抗性育种中,Ty-4、Ty-5和Ty-6抗性基因尚未被开发[2]。由于Ty基因一般表现为显性,单基因F1杂种抗性基因的作用不如纯合系。因此,如果要使杂种表现为抗性有效,要么双亲都具有抗性,要么双亲包含多个抗性基因[3]。
TYLCV的潜伏期较短,一般7~10 d就开始表现发病症状[4]。TYLCV感病植株主要表现为叶片卷曲、皱缩、黄化、植株矮化等[5]。该病自20世纪90年代传入中国[6],呈现逐年加重、自南向北蔓延的趋势,加强番茄黄化曲叶病毒病的病原鉴定和检测,制定防治策略和培育抗病毒品种成为当前十分重要的任务[7]。目前,关于番茄种质资源的抗性研究较多的是抗性基因[1,8]。笔者在生产实践中发现,在自然感病情况下,小果型番茄整体对TYLCV抗性明显高于大果型番茄,甚至出现免疫级别的种质,而大果型番茄尤其是粉果番茄,能够对TYLCV有免疫能力的极少,为了探明其中的原因,以小果型和大果型番茄为试验材料,通过田间抗病性表现和带毒量检测来探究番茄果型、抗性基因以及带毒量对番茄生产实践的影响。
前人的研究方法以饲养烟粉虱离体接种[9]、带有TYLCV的菌液韧皮部接种[10-11]为主。笔者利用田间带毒烟粉虱对番茄种质进行自然侵染感病,明确番茄果实大小与抗病性之间的关系,以期指导抗性种质资源的筛选、评价以及抗TYLCV番茄品种的选育。
1 材料与方法
1.1 材料
供试的番茄种质12份,包含8份小果型番茄(M1、M3、M5、M7、M8、M9、M11、M12)和4份大果型番茄(M2、M4、M6、M10),详见表1。
1.2 试验设计
试验于2021年在河南现代农业研究开发基地日光温室内进行。利用秋延茬口提前45 d在大棚中种植辣椒[12]用以自然传毒和饲养烟粉虱,辣椒中间留出空地用于定植番茄。2021年6月中旬采用50孔育苗穴盘进行基质育苗,每个番茄种质播种一个穴盘,将播种后的穴盘放置于设有防虫网的隔离连栋温室中,常规育苗。待番茄苗长到5~6叶期时,定植于辣椒中间空地。试验共设3个重复,每个重复每个番茄品种定植1行,随机区组排列,每行定植12株。大棚内以烟粉虱自由繁殖方式传毒,试验期间不喷施杀虫剂,常规水肥管理。
1.3 测试项目与方法
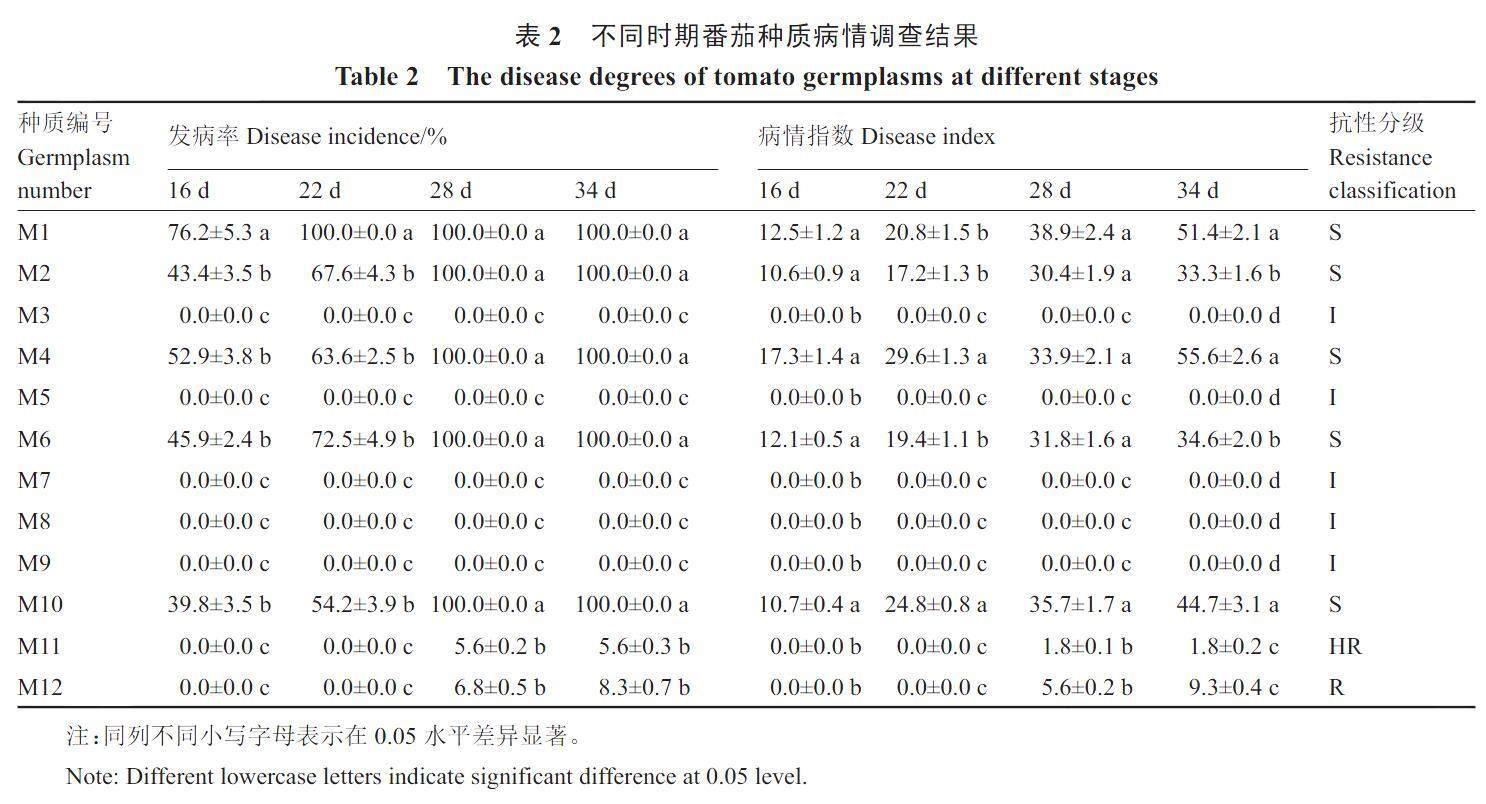
1.3.1 田间抗病性调查与鉴定 番茄定植后,每天定时观察植株发病情况。调查定植后16、22、28和34 d田间发病情况。结合申书兴[13]、田兆丰等[14]的方法将病情分为6个级别。0 级:不发病,无症状;1级:新叶叶片轻黄化;3级:1/2叶片黄化、边缘上卷;5级:2/3叶片重黄化、矮小、少数叶片畸形;7级:叶片全部黄化、植株明显矮化;9级:叶片严重畸形缩小,植株严重矮化,甚至枯死。
病情指数=[∑(各级病株数×该病级值)/(调查总株数×最高病级数)]×100。
根据通用的番茄病毒病群体分级标准,将各种质的番茄植株分为免疫(I,不表现症状,病情指数0)、高抗(HR,0<病情指数≤2)、抗病(R,2<病情指数≤15)、中抗(MR,15<病情指数≤30)、感病(S,30<病情指数≤100);并将I、HR、R 及MR 归为抗病,将S 归为感病。
1.3.2 番茄叶片带毒量测定 在定植后的0 d及16、22、28和34 d进行取样,采集每个番茄种质顶端新鲜叶片,混合取样,3次重复。液氮速冻,-80 ℃冰箱保存备用。采用CTAB法提取番茄的总DNA[15]。根据NCBI数据库中TYLCV(GenBank: AM282874.1)的基因组信息,设计引物,TYLCV2-F:GAAACGACCAGTCTGAGGCTGTAATGTC,TYLCV2-R:AAGAAACCAATAAGGCGTAAGCGTGTAG,扩增长度为322 bp。构建TYLCV标准质粒:将PCR扩增的特异条带回收、克隆,将该DNA片段克隆到pMD19-T载体上,提取质粒,并通过测序验证目的片段的正确性,测定浓度后进行拷贝数换算,将其作为TYLCV检测的阳性标准品。荧光定量PCR反应体系:qPCR 预混液 Mix 5 μL,正反向引物(10 μmol·L-1)各0.5 μL,模板1 μL,RNase Free ddH2O补足至10 μL。荧光定量PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30,72 ℃延伸1 min,40个循环。待检测的DNA样品的质量浓度,利用超微量分光光度计调整为100 ng·μL。
1.4 数据处理
试验数据采用Excel 2010进行统计整理,计算平均值和标准差;利用SPSS 17.0进行显著性分析。
2 结果与分析
2.1 不同番茄种质田间抗病性调查与鉴定
定植后16 d和22 d调查结果如表2显示,有5个番茄种质表现出发病症状,其中包括小果型番茄M1和大果型番茄M2、M4、M6和M10,这5个番茄种质在28 d发病率均达到100%,病情指数分别为38.9、30.4、33.9、31.8和35.7,均达到感病级别;小果型番茄M3、M5、M7、M8和M9在整个试验过程中,均未表现出发病症状,抗性级别为免疫;小果型番茄M11和M12在28 d的发病率分别为5.6%和6.8%,病情指数分别为1.8和5.6,在整个试验过程中,抗性级别分别为高抗和抗病。
2.2 烟粉虱侵染对不同番茄种质绝对带毒量的影响
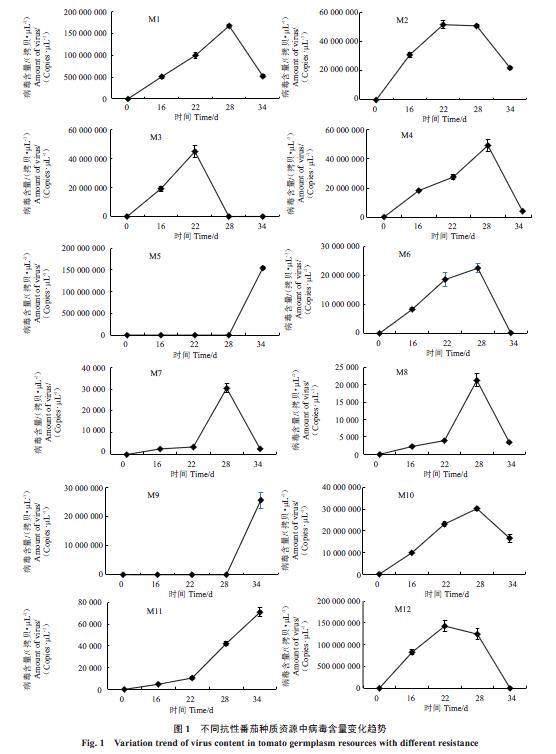
对于均具有Ty-1/ty-1抗性基因的M1和M2(表1),叶片中绝对带毒量差异明显(图1),小果型番茄M1带毒量峰值出现在定植后的28 d,而大果型番茄M2带毒量峰值出现在定植后的22 d,但M1在定植后16 d的带毒量已接近M2峰值,M1带毒量最大值超出M2带毒量最大值3.23倍,在田间抗性鉴定方面,M1和M2都表现为感病,但M2病情指数比M1低,这与2个种质带毒量表现一致,即带毒量越大,田间抗病表现越差,病情指数越高。表明Ty-1/ty-1抗性基因的田间抗病性表现并不受果型的影响,而与带毒量有一定关系。
番茄种质M3和M4均具有Ty-2/ty-2抗性基因(表1),叶片带毒量差异并不明显,小果型番茄M3带毒量峰值出现在22 d,而大果型番茄M4带毒量峰值出现在28 d,M4带毒量最大值比M3带毒量最大值高10%。M3在定植后28 d,带毒量急剧下降,仅为其峰值的1/1773,而M4在定植后34 d,带毒量也快速下降,约为其峰值的1/12。在田间抗性表现上,M3表现为免疫,M4表现为感病。表明在带毒量基本相同的情况下,具有Ty-2/ty-2抗性基因的小果型番茄具有更强的田间抗病能力,而大果型番茄却表现较差。
对于均具有Ty-1/ty-1和Ty-3a/ty-3抗性基因的M5和M6(表1),叶片中绝对带毒量变化趋势差异明显(图1)。小果型番茄M5在定植后28 d内带毒量一直保持在很低水平,随后快速上升,34 d带毒量比28 d增加约6644倍。大果型番茄M6带毒量峰值出现在28 d,与M5在 28 d带毒量相比,高出了约968倍。而M5带毒量最大值比M6带毒量最大值高出了6.87倍。在田间抗性表现上,M5表现为免疫,M6表现感病。表明具有Ty-1/ty-1和Ty-3a/ty-3抗性基因的小果型番茄具有更强的田间抗病能力,而大果型番茄却表现较差。M10具有Ty-3a/ty-3抗性基因,与M6带毒量变化趋势一致,在定植后16、22、28和34 d,M10带毒量分别比M6高出1.19倍、1.24倍、1.34倍和93.89倍,这说明聚合2个抗性基因的M6带毒量明显小于携带1个抗性基因的M10,对于同样是大果型番茄的M6和M10来说,多个抗性基因聚合对抑制番茄病毒复制有明显效果。
小果型番茄种质M7和小果型番茄种质M9均具有Ty-2和Ty-3抗性基因(表1),叶片中带毒量变化趋势明显不同(图1)。M7在定植22 d内带毒量较低,28 d达到最大值,随后迅速下降,而M9在定植28 d内带毒量较低,34 d带毒量急剧上升,M9在16和22 d,带毒量分别比M7增加了1.65倍和2.73倍,且M9带毒量最大值比M7带毒量最大值高出约847倍。这表明,小果型番茄M7对病毒的抵御能力强于小果型番茄M9。小果型番茄M8具有Ty-1/Ty-1、Ty-2/Ty-2和Ty-3/Ty-3抗性基因,带毒量变化趋势与M7基本一致(图1),28 d达到峰值,M8带毒量最大值比M7带毒量最大值下降了43%,这可能是聚合3种抗性基因优于聚合2种抗性基因的一种表现。在田间抗性表现上,M7、M8和M9都表现为免疫,没有病毒病田间表观症状。
小果型番茄M11和M12均不具有Ty-1、Ty-2和Ty-3抗性基因(表1),但田间抗性分别表现出HR和R。定植后,M11和M12带毒量变化趋势有所不同(图1),M11带毒量随着侵染时间的延长,呈逐渐上升趋势,在34 d仍处于上升趋势,而M12在22 d达到峰值,随后逐渐下降。从带毒量来说,M12在16、22和28 d,带毒量分别比M11高出约17 601倍、13 647倍和2955倍。这表明,小果型番茄种质尽管不具有这3个抗性基因,且带毒量很高,但依然表现为田间抗病。
从整体来看,有6份番茄种质(M1、M4、M6、M7、M8和M10)带毒量峰值出现在28 d,有3份(M2、M3和M12)出现在22 d,随后呈现下降趋势;另外,有3份番茄种质(M5、M9和M11)带毒量一直呈上升趋势。这表明大多数参试番茄在定植后,植株内部的防御体系能够快速有效地阻止病毒的进一步繁殖。
从图2可以看出,在定植后的不同时期,不同抗性番茄种质资源中带毒量差异明显。结合田间抗性鉴定结果(表1),除了M12以外,其他番茄种质28 d带毒量基本与田间抗性鉴定结果保持一致。大果型番茄M2、M4、M6和M10在定植后28 d,都携带大量的病毒,感病的小果型M1带毒量最高,而高抗的小果型M12在定植28 d后带毒量急剧下降,其他小果型番茄种质在28 d带毒量都很低。这表明,在定植后28 d,小果型番茄的带毒量一般要明显低于大果型番茄,表现与田间抗性鉴定结果较为一致。因此,可以采用定植后自然传毒28 d时番茄叶片中的带毒量来评价番茄种质对TYLCV的抗性。一般来说,带毒量越高,田间抗性越弱;带毒量越低,田间抗性越强。
3 讨论与结论
TYLCV是具有孪生颗粒形态的植物DNA病毒[16]。该病毒最早于20世纪50年代后期在阿拉伯半岛西北部等地区被发现,随后在世界范围内大面积暴发,近年来,该病毒已在我国多个省份大范围暴发[17-18]。目前,我国每年TYLCV发生面积超过20万hm2,年经济损失达数十亿元,而且正以年增长20%的速度蔓延,已经严重威胁到我国番茄产业的可持续发展[19]。
在番茄定植后,通过自然传毒方式,所有番茄材料都能检测到病毒感染,但不同抗性番茄种质携带病毒数量和田间抗性表现却有所不同。田兆丰等[20]采用田间大棚自然传毒的方式评估了不同番茄品种对TYLCV的抗性水平,移栽8周后,大果型抗性粉果番茄品种发病率介于50%~85%之间,而小果型抗性樱桃番茄品种发病率介于0~30%之间。代惠洁等[21]的研究表明,大果型番茄TYLCV田间发病率为40%~100%,而小果型樱桃番茄八喜田间发病率仅为6.7%,同时八喜番茄ToCV(番茄褪绿病毒)+TYLCV复合田间发病率为0。这表明小果型番茄品种田间发病率明显低于大果型番茄品种,这与本试验田间表现结果较为一致。
在本研究中,仅包含Ty-1/ty-1单基因的M1和M2并不能有效抑制病毒的扩繁,田间植株病症明显,该基因的抗性表现受果实大小影响较小,同时也表明Ty-1单基因抗性已不能满足河南当地秋延茬设施番茄栽培的要求。Ty-2/ty-2抗性基因并不会因为番茄果实大小而影响叶片带毒量,但小果型番茄M3在田间抗性表现上明显强于大果型番茄M4;而聚合Ty-1/ty-1和Ty-3a/ty-3抗性基因的番茄带毒量却会受到果实大小的明显影响,小果型番茄表现出很强的田间抗性,田间抗性表现也明显优于大果型番茄,这与李亚茹等[22]研究的Ty-3a在小果型樱桃番茄中田间抗性强于大果型番茄的结果一致。
番茄果型也会影响到Ty-2和Ty-3基因的聚合抗性,与小果型番茄M9(单果质量91 g)相比,小果型番茄M7(单果质量5 g)带毒量明显较低,田间抗性表现明显强于小果型番茄M9。而聚合Ty-1/Ty-1、Ty-2/Ty-2和Ty-3/Ty-3抗性基因的小果型番茄M8与M7相比带毒量下降了43%,表明小果型结合抗性基因聚合所表现出来的抗性叠加效应更增强了番茄种质的田间抗性。因此,抗性基因聚合和果型对番茄抗病毒能力都有一定的影响。
骆巧娟[23]研究发现,不含抗病基因的6744樱桃番茄在田间表现出一定抗病能力,可能与其较高的防御酶活性和较高的抗氧化酶基因表达量有关,在TYLCV病毒侵染后,6744樱桃番茄叶片中的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、多酚氧化酶(PPO)、过氧化物酶(POD)以及苯丙氨酸解氨酶(PAL)都表现出很高的活性,同时CAT、SOD、POD和抗坏血酸过氧化物酶(APX)等基因表达量上升,使其防御能力增强。这可能是M11和M12在缺少Ty-1、Ty-2和Ty-3抗病基因的情况下高抗TYLCV的原因,在病毒侵染初期,防御的酶促反应较早地催化诱导酚类物质积累而表现出抗病[17]。与大果型番茄相比,小果型番茄表现出的田间抗性可能与逆境下较高的防御体系有关。也有报道显示[24],TYLCV的侵染,诱导番茄植株水杨酸、茉莉酸和冠菌素3种信号途径都参与了抵抗TYLCV的防御反应,可能小果型番茄通过这3种信号途径,抑制TYLCV复制的能力更强。
在番茄抗TYLCV育种中,Ty-1、Ty-2和Ty-3/Ty-3a基因被认为是抗TYLCV的主效基因[2,25]。目前,我国的番茄抗性品种主要是基于Ty-1和Ty-3的抗性基因,含有复合抗病基因型Ty-1/ty-1、Ty-3a/ty-3群体在田间全部表现抗病[1,26],均包含有纯合Ty-1、Ty-3基因的抗性材料一般具有免疫表现[17]。而本试验的M3(Ty-2/ty-2)、M5(Ty-1/ty-1,Ty-3a/ty-3)、M7(Ty-2/ty-2,Ty-3/Ty-3)、M8(Ty-1/Ty-1,Ty-2/Ty-2,Ty-3/Ty-3)和M9(Ty-2/Ty-2,Ty-3/Ty-3)5份免疫材料均为小果型番茄,说明多抗基因的聚合抗性在小果型番茄中表现优异。
Ty-1是番茄上最早发现的抗性基因,大多数耐 TYLCV 的番茄种质含有该基因,田间通常表现为耐病[27],同时携带Ty-1和Ty-3或Ty-3a基因的番茄种质均表现高抗[28],含有Ty-2和Ty-3a杂合基因型的材料抗病性显著高于只含有Ty-3a杂合基因型的材料[29],只含有Ty-3基因的材料以表现抗病为主,单独携带Ty-2基因的材料表现中抗。本研究结果显示,定植后28 d,参试番茄种质依据带毒量从小到大排序为M8(Ty-1/Ty-1,Ty-2/Ty-2,Ty-3/Ty-3)<M5(Ty-1/ty-1,Ty-3a/ty-3)<M3(Ty-2/ty-2)<M7(Ty-2/ty-2,Ty-3/Ty-3)<M9(Ty-2/Ty-2,Ty-3/Ty-3)<M11(ty-1/ty-1,ty-2/ty-2,ty-3/ty-3)<M6(Ty-1/ty-1,Ty-3a/ty-3)<M10(Ty-3a/ty-3)<M4(Ty-2/ty-2)<M2(Ty-1/ty-1)<M12(ty-1/ty-1,ty-2/ty-2,ty-3/ty-3)<M1(Ty-1/ty-1)。本研究结果与前人的研究结果基本一致。说明抗性基因聚合抗性对病毒的抑制作用明显,小果型番茄带毒量总体低于大果型番茄,小果型番茄田间抗性总体高于大果型番茄。
目前,聚合抗性和免疫抗性多出现在小果型番茄种质中,如何将小果型番茄这种田间抗病能力转化到大果型番茄中,可能并不仅仅是聚合抗病基因的问题,小果型番茄所表现出来的田间抗病能力还有待于进一步深入研究。
参考文献
[1] 米国全,陈梦莹,史艳艳,等.番茄种质资源黄化曲叶病毒病抗性的鉴定与评价[J].河南农业科学,2017,46(5):77-83.
[2] 田兆丰,刘伟成,厚凌宇,等.不同番茄品种对番茄黄化曲叶病毒的抗病性分析[J].中国农业科学,2016,49(14):2850-2856.
[3] DHALIWAL M S,JINDAL S K,SHARMA A,et al.Tomato yellow leaf curl virus disease of tomato and its management through resistance breeding:A review[J].Journal of Horticultural Science and Biotechnology,2020,95(4):425-444.
[4] 廖锦钰,黄莉萍,张战泓,等.番茄褪绿病毒与番茄黄化曲叶病毒复合侵染对番茄褪绿病毒传播的影响[J].植物保护,2021,47(3):89-95.
[5] HANSSEN I M,LAPIDOT M,THOMMA B P H J.Emerging viral diseases of tomato crops[J].Molecular Plant-Microbe Interactions,2010,23(5):539-548.
[6] 刘玉乐,蔡健和,李冬玲,等.中国番茄黄化曲叶病毒:双生病毒的一个新种[J].中国科学(C辑:生命科学),1998,28(2):148-153.
[7] 白晓娟,李亚栋,王国华,等.番茄黄化曲叶病毒石家庄分离物的分子鉴定及序列分析[J].园艺学报,2015,42(1):167-173.
[8] 林铭,胡鸿,杜永臣,等.番茄黄化曲叶病毒的实时荧光定量PCR检测[J].中国蔬菜,2013(2):20-26.
[9] 郭广君,孙帅,王孝宣,等.番茄抗B型烟粉虱相关叶表腺毛性状及其次生代谢物质分析[J].园艺学报,2016,43(8):1493-1503.
[10] 袁伟,万红建,王荣青,等.番茄黄化曲叶病毒的定量分析[J].分子植物育种,2015,13(3):574-580.
[11] 朱云聪,邓宇芳,何顺,等.基于Real-time PCR监测番茄黄化 曲叶病毒在番茄植株中的动态变化[J].植物病理学报,2014,44(4):363-369.
[12] LEGARREA S,BARMAN A,DIFFIE S,et al.Virus accumulation and whitefly performance modulate the role of alternate host species as inoculum sources of tomato yellow leaf curl virus[J].Plant Disease,2020,104(11):2958-2966.
[13] 申书兴.园艺植物育种学实验指导[M].北京:中国农业大学出版社,2018.
[14] 田兆丰,卢向阳,厚凌宇,等.番茄黄化曲叶病毒病抗性材料的筛选鉴定[J].科技导报,2014,32(12):31-35.
[15] 王关林,万宏箔.植物基因工程原理与技术[M].2版.北京:科学出版社,1998.
[16] BROWN J K,ZERBINI F M,NAVAS-CASTILLO J,et al.Revision of Begomovirus taxonomy based on pairwise sequence comparisons[J].Arhives of Virology,2015,160(6):1593-1619.
[17] 刘放,魏小红,张小芳,等.不同番茄材料黄化曲叶病毒病抗性评价及抗性基因检测[J].西北农业学报,2020,29(12):1905-1912.
[18] 张升,何伟,杨华,等.新疆发生番茄黄化曲叶病毒病[J].新疆农业科学,2012,49(1):105-107.
[19] 张前荣,李大忠,朱海生,等.番茄黄化曲叶病毒研究进展[J].分子植物育种,2017,15(9):3709-3716.
[20] 田兆丰,刘伟成,谢欢.不同番茄品种对番茄黄化曲叶病毒的抗病性鉴定[J].植物保护学报,2013,40(1):56-60.
[21] 代惠洁,程琳,竺晓平,等.烟粉虱传播的番茄褪绿病毒和番茄黄化曲叶病毒对不同番茄品种的复合侵染[J].植物保护学报,2017,44(3):453-459.
[22] 李亚茹,王银磊,赵丽萍,等.不同抗病基因型番茄对番茄黄化曲叶病毒的抗病性鉴定[J].西南农业学报,2016,29(11):2609-2614.
[23] 骆巧娟.樱桃番茄黄化曲叶病毒病的鉴定及果实营养特性的研究[D].兰州:甘肃农业大学,2019.
[24] 李甜.番茄与番茄黄化曲叶病毒的互作机理研究[D].太原:山西农业大学,2021.
[25] 郑积荣,王慧俐.番茄黄化曲叶病毒病抗性鉴定与遗传分析[J].浙江农业科学,2010,22(4):444-447.
[26] 付蓉蓉,刘杨,陈火英.番茄黄化曲叶病的Ty-1和Ty-3抗性基因的PCR鉴定[J].分子植物育种,2011,9(9):1647-1652.
[27] 李英梅,杨艺炜,刘晨,等.陕西番茄黄化曲叶病毒病绿色防控新思路[J].陕西农业科学,2021,67(11):110-114.
[28] 甘桂云,李韦柳,林仲,等.番茄抗黄化曲叶病材料引进及评价[J].长江蔬菜,2020(6):69-71.
[29] 杨晓慧,国艳梅,王孝宣,等.番茄抗黄化曲叶病基因与基因工程研究最新进展[J].园艺学报,2012,39(11):2283-2290.