瓜类炭疽病研究进展
2024-06-29柯佩佩,卿东山,戴思慧,蔡雁平,孙小武
柯佩佩,卿东山,戴思慧,蔡雁平,孙小武

摘 要:炭疽病是一种世界性葫芦科作物的真菌病,主要危害黄瓜、西瓜、甜瓜和冬瓜等。近年来,我国瓜类蔬菜作物的设施种植面积逐年增加,炭疽病危害程度也不断加深,严重影响了瓜类蔬菜的产量和品质,制约了产业效益和瓜农生产的积极性。通过对国内外黄瓜、西瓜、甜瓜和冬瓜生产过程中炭疽病的发病规律、抗炭疽病种质资源现状、病原菌分子生物研究以及抗病育种等方面进行阐述和分析,为瓜类炭疽病研究提供思路,也为瓜类作物高效生产提供参考。
关键词:瓜类作物;炭疽病;基因定位;抗性育种
中图分类号:S642+S65 文献标志码:A 文章编号:1673-2871(2024)06-001-08
Research progress of melon anthracnose
KE Peipei, QING Dongshan, DAI Sihui, CAI Yanping, SUN Xiaowu
(Engineering Research Center for Horticultural Crop Germplasm Creation and New Variety Breeding, Ministry of Education/College of Horticulture, Hunan Agricultural University, Changsha 410128, Hunan, China)
Abstract: Anthracnose is a worldwide fungal disease of cucurbit crops, mainly harming cucumber, watermelon, melon and wax gourd. In recent years, the facility planting area of melon vegetable crops in China has been increased, and anthracnose damage has been worsened, seriously affecting the yield and quality of melon vegetables, and restricting the industrial benefits and the enthusiasm of melon farmers in production. The authors elaborated and analyzed melon anthracnose through the incidence pattern of anthracnose during the production of cucumber, watermelon, melon and waxgourd at home and abroad, the current status of anthracnose-resistant germplasm resources, the molecular biology research of the pathogenic bacteria and the breeding of resistance to the disease, to provide ideas for the study of anthracnose as well as references to the efficient production of melon-based crops.
Key words: Melon crop; Anthracnose; Assignment of genes; Resistance breeding
黄瓜、西瓜、甜瓜和冬瓜是世界范围内重要的葫芦科园艺作物,在我国各地都有栽培[1-2]。作为人们日常饮食中常见的蔬菜作物,这些瓜类均含有丰富的维生素和氨基酸,具有良好的营养、药用和经济价值[3]。
但黄瓜、西瓜、甜瓜和冬瓜等瓜类作物在生产中受到诸多病害的侵扰,其中炭疽病是传播最为广泛的病害之一。1867年,意大利科学家首次在葫芦上观察到炭疽病[4],后来又报道了甜瓜和西瓜炭疽病。随后在19世纪末欧洲出现了多篇关于炭疽病的报道,并且在1889-1904年,美国科学家也陆续报道了西瓜、葫芦、甜瓜上的炭疽病[5]。近年来,炭疽病在我国普遍发生,其中设施栽培和南方湿热多雨地区尤其严重,给瓜类产业带来巨大的损失[6]。据报道,西瓜炭疽病发病率为10%~100%,造成的产量损失在50%左右[7]。甜瓜炭疽病发病严重时可造成减产80%以上。中国北方保护地栽培的黄瓜炭疽病发病严重时可造成产量损失10%~20%,在南方地区造成的损失更大。
1 瓜类炭疽病概述
1.1 瓜类炭疽病症状
炭疽病可以发生在黄瓜、西瓜、甜瓜和冬瓜的整个生长期。在苗期发生炭疽病时瓜类子叶会出现圆形褐色病斑,幼茎的基部也会受害缢缩至幼苗猝倒;西瓜、甜瓜成株期感病,真叶初期出现圆形黄色斑点,后变为黑褐色同心轮纹病斑,再后期多个病斑连成一片至叶片穿孔和枯死[8],冬瓜、黄瓜成株期发病时茎部还会有红色黏稠物质出现[9]。叶柄、茎蔓染病时,会出现由黄褐色变为黑褐色的病斑,随着病情加重最终茎蔓枯死[10]。果实感病时,表皮出现暗绿色油渍状小斑点,严重时出现凹陷且易龟裂的轮纹病斑,潮湿时还会出现红色或粉红色物质[10-11](图1)。
1.2 炭疽病原菌的种类
炭疽病菌种类繁多,且分类多样。当根据寄主特异性定义植物病原菌时,炭疽病菌大约有700种,1957年von Arx 根据形态特征将炭疽病原菌重新分类为11个种群[12],1992年Sutton[13]又通过大量研究鉴别将其扩展至39种。早期植物病原真菌种类是根据植物病害特异性进行分类的,导致同个菌种会出现多个种名。如现在使用的瓜类刺盘孢菌(Colletotrichum orbiculare)曾被认为是引起葫芦和大豆炭疽病的一种真菌,将其命名为Colletotrichum lagenarium[5]。后来在对炭疽病真菌的比较研究中,这种观点被否定,研究者重新将豆类炭疽病命名为Volutella citrulli。目前,国内外研究表明C. karstii、C. scovillei、C. gloesporioides、C. incanum、C. magnum、C. orbiculare、C. gloeosporioides f. sp. cucurbitae和C. Truncatum 8种炭疽菌属真菌均能引起瓜类炭疽病[14-15]。有研究发现,C. gloesporioides为引起澳大利亚、巴西、中国、日本和美国茶树炭疽病的主要病原菌[16]。2008年有研究者报道了C. scovillei所引起的辣椒炭疽病[17-18]。有学者首次在利马豆上发现C. truncatum,后续在菜豆、花生、苜蓿、辣椒等植物上也发现了此类病菌[19]。2011年我国在兰科万代兰属(Vanda sp.)植物上检测到C. karstii病菌[20]。起初,美国首次报道了C. magnum(Ga. magna)可以引起瓜类炭疽病,后来在西瓜、南瓜、番瓜和甜瓜等葫芦科植物上也发现了该种炭疽病菌[14]。2014年,C. incanum首次在美国的大豆上被分离出来并命名,后来我国靳俊媛等[21]在西瓜上发现并鉴定出了该种大豆炭疽菌,目前C. incanum和C. truncatum是大豆炭疽病最常见的病原菌。
在现代分子检测中,C. orbiculare被认为是炭疽病菌的复合体,但在其分类上仍存在许多争议,且在许多有关炭疽病的报道中对其提出了不同命名[5]。2022年Goh等[22]在马来西亚的西瓜果实上提取出了新的炭疽病菌,经研究鉴定此病菌与发表的Colletotrichum spp.描述相匹配,随后将其命名为斯科维尔炭疽菌。
1.3 瓜类炭疽病菌形态学特征
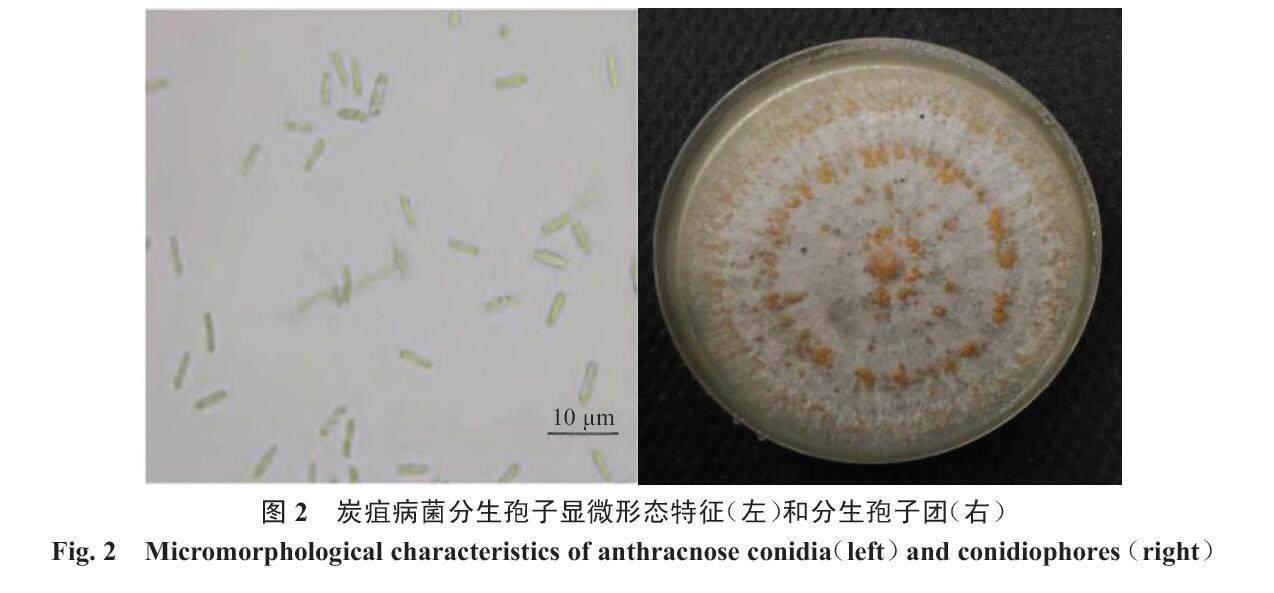
菌丝体最初表现为无色、薄壁、有间隔且呈均匀的圆柱形,随后菌丝体发生聚集、分枝、缠绕,进而长出一层分生孢子。孢子从分生孢子顶端萌发,陆续堆积在一起形成粉红色的黏稠簇。其中,孢子是单细胞,呈透明状,为长圆形或卵形,具有2~3个横膈膜,分生孢子盘有黑褐色的刚毛,分生孢子梗为无色(图2)。
炭疽病菌在PDA培养基上生长时,会形成菌落同时伴随形态改变。生长2~3 d,长出绒毛状乳白色圆形菌落;3~5 d,菌落颜色会由乳白色变成粉红色,中心深边缘浅;5~7 d,菌落颜色变成深灰色,且边缘有一圈淡粉色晕圈;15 d后,菌落出现红褐色黏稠孢子团[23]。
1.4 炭疽病的发病原因及发病规律
1.4.1 发病原因 目前已知的与瓜类炭疽病发病相关的因素有很多。其一,因人们对瓜类果实品质的要求不断提高,瓜类品种与日俱增,不同品种对炭疽病的抗性有差异,生产上存在一些对炭疽病抗性差的品种。其二,不同瓜类及品种之间与抗病性密切相关的的多酚氧化酶(PPO)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等的活性差异大,致使对炭疽病抗性呈现较大差异。其三,炭疽病原菌生存能力强,菌体能在土壤越冬或黏着在种子表面存活下来,这些带菌的土壤和种子均可成为侵染源,在条件适宜时再以孢子的形态通过多种传播途径侵染寄主[24]。
1.4.2 发病规律 在瓜类炭疽病的发病过程中,温度、湿度和降雨是影响炭疽病生长的主要因素。研究发现炭疽病在10~30 ℃均可发生,在25 ℃、湿度大于70%的生长环境中,炭疽病的发病速度最快,温度过高和过低都会阻止炭疽病的生长和繁衍[23]。在适宜的温度条件下,湿度越大,病菌潜伏期越短,发病越快[10]。
1.5 炭疽病菌营养生活方式和侵染策略
炭疽菌属真菌,在不同植物寄主发育的不同阶段会表现出不同的营养生活方式。一些病原菌在不同时期会出现半活体营养型、死体营养型、内生型3种营养生活方式[25]。而有些病原菌会以腐生的生活方式在土壤和有机质中获取营养生存。
属于半活体营养型的炭疽菌属真菌,它们定殖于宿主组织时需要借助细胞内的半活体营养。在侵入宿主细胞的过程中,初级菌丝会首先做出反应且伴随初级侵染囊泡的形成。如寄主出现短暂的无症状,半活体营养型会转化为死体营养型,且有次级菌丝产生,此时菌丝分泌的多样裂解酶能加快寄主组织的死亡[26]。
相比于半活体营养型,死体营养型炭疽菌分生孢子或皮下菌丝会帮助其潜藏于寄主体内,时机成熟时转化为活体或半活体的方式来汲取营养,最终在炭疽菌定殖前杀死植物组织,此后炭疽菌获得的营养物质为寄主植物死亡细胞的有机物[27]。现阶段致病性炭疽菌侵染寄主细胞主要有希金斯炭疽菌(C. higginsianum)、瓜类炭疽菌(C. orbiculare)和禾生炭疽菌(C. graminicola)3种模式种[19]。
瓜类炭疽菌是一种半活体营养真菌。病原体在识别宿主植物表皮细胞上的物理和化学信号后,通过激活细胞内的通路来驱动感染程序[28]。在感染瓜类作物的初始阶段,炭疽菌以生物营养病原体形式存在,维持宿主细胞的存活,进入坏死阶段后,从死亡的宿主细胞中获取营养[29]。炭疽菌通过黑化附着胞的外源介导入侵(TMI)和菌丝尖端入侵(HTE)2种方式侵入寄主叶片。在TMI过程中时,炭疽菌侵入近轴表皮。孢子附着在植物表面萌发产生胚管,进一步形成黑化的附着胞。附着胞通过角质层和细胞壁直接进入植物表皮细胞,而不是由气孔进入[5]。炭疽菌分泌的细胞壁降解酶和附着胞所产生的高浓度渗透活性化合物能破坏植物的表皮细胞壁,方便附着胞进入细胞内部,形成穿透菌丝。与在营养丰富的培养基上形成的菌丝不同,该病原菌最初形成生物营养渗透菌丝,后者从活的寄主细胞和分泌效应蛋白中获取营养资源,从而抑制寄主的防御反应。穿透后,炭疽菌胞内菌丝在宿主细胞内发育,在细胞水平上通过细胞内定殖感染。此时胞内菌丝生长在植物细胞质膜和细胞壁之间。然后侵染进入坏死性阶段,胞内菌丝会产生继发性坏死性菌丝,从死亡的宿主细胞内获取营养。在这个阶段真菌定殖并降解宿主细胞,导致植物细胞坏死和出现可见症状。HTE是独立于黑化的附着胞外的一种入侵方式,主要是在植物伤口部位发生的一种形态反应,且HTE的侵染频率受到碳水化合物营养物质的正向调节,同时可能会受到真菌有丝分裂原活化蛋白激酶(MAPK)级联的构成性抑制,表明2种入侵策略在致病过程中存在同一种传感系统触发侵染组织发生形态反应[30]。
1.6 瓜类炭疽病病原菌种类的鉴定
1.6.1 炭疽病的分离纯化与培养 在田间采集具有明显炭疽病症状的病叶,利用常规的病原真菌分离法,接种病菌于PDA培养基中,放置恒温箱中培养。待其生长出菌丝时,挑取至新的培养基中培养。如此3~4次转接后,使菌种得到纯化[31]。为获得试验所用的大量瓜类炭疽菌孢子悬浮液,可在PDA培养基或产孢速度快的西瓜皮培养基上培养。
1.6.2 炭疽病菌的鉴定方法 瓜类炭疽病主要是由炭疽菌属(Colletotrichum spp.)所引发的一种真菌性病害。19世纪30年代国外研究者通过寄主种类和形态鉴定出引起美国西瓜炭疽病的病原菌为Colletotrichum lagenarium[19]。虽然此方法在当时易被接受认可,但准确性得不到保证。
随着测序技术的发展,多基因系统发育学被用于物种的鉴定,使物种的划分更加准确和完善。现如今国内外研究者通过多基因联合分析并结合形态学特征观察,已确定引起西瓜炭疽病的病原菌为C. magnum、C. orbiculare、C. karstii、C. scovillei、C. incanum、C. gloesporioides[14,22-23,32-33]。
1.7 瓜类炭疽病菌接种方法
早在20世纪90年代,我国研究者用喷雾法和点滴法比较在西瓜苗期接种炭疽病的接种效率和稳定性,结果表明,用喷雾法接种时效率最高[34]。2019年孙玉燕等[35]在西瓜炭疽病菌离体叶接种鉴定中,总结出离体叶片接种具有不损伤植株、接种标准一致、节省菌液等优点。2022年黄蔚等[33]在西瓜新炭疽病原菌分子鉴定研究中,利用刺伤接种法,完成了接种观察试验,为瓜类炭疽病接种体系的完善提供了宝贵经验。目前,已知的瓜类炭疽病试验的接种方法有叶片涂刷接种法、刺伤法、喷雾法、菌饼打孔法和离体叶片接种法5种。相比涂刷接种法、刺伤法和菌饼打孔法损伤植株、接种工作量大的缺点,常用的喷雾接种法具有不损伤植株、工作效率高等优点,但也有可能会出现接种标准不一致的情况。因此研究者需根据试验内容选择合适的接种方法。
1.8 瓜类炭疽病生理小种
瓜类炭疽病菌是一个复杂且多样的病原体,对不同的瓜类作物有不同的致病性。目前,已报道的7个瓜类炭疽病生理小种中,1、2、3生理小种分布最广,危害最重[11]。其余4个生理小种致病性特点表现为生理小种4可致病所有鉴别寄主;生理小种5对西瓜寄主的致病性略高于黄瓜寄主;生理小种6对西瓜寄主的致病性强于厚皮甜瓜寄主;生理小种7和生理小种3相似,仅对黄瓜品种Pixie的致病性较弱[24]。
2 瓜类抗炭疽病分子生物学
2.1 瓜类炭疽病抗性遗传规律
1937年国外研究者首次进行了炭疽病抗性的遗传研究,后续研究报道多见于西瓜抗感材料中[4]。Raymond等[36]利用3个西瓜抗病材料与2个西瓜感病材料杂交及回交,发现抗病对感病为显性且抗性受一对单基因控制。1980年Suvanprakorn等[37]利用Sowell[38]报道的2号生理小种的PI系抗性材料与感性材料杂交,发现PI材料对小种2的抗性均为单基因显性遗传,但后来有研究发现品系R309的抗性为多基因显性遗传。2007年,王慧哲等[39]发现黄瓜在炭疽病的侵染下所呈现出的抗性是由单隐基因控制,而感病基因为不完全显性。
2.2 瓜类炭疽病抗性基因
19世纪50年代国外科学家便开始了瓜类炭疽病抗性基因的研究工作,并获得初步成果。1955年Barnes和Epps发现了PI197087和易感黄瓜杂交产生的F1表现出中间抗性。因此,他们认为PI197087的抗性是由几个主要基因控制的[40]。在随后的研究中又发现PI175111的抗性是由一个显性基因控制的,Robinson等[41]后来将其命名为Ar基因。进入20世纪,唐建辉等[42]利用RAPD扩增,在Colletorichum属的24个ITS区段进行克隆和测序,并利用RAPD转SCAR标记技术重新设计引物检测C. orbiculare。随后,李淑菊等[43]和王惠哲等[44]利用AFLP标记技术将与黄瓜抗炭疽病有关基因的一个共显性,成功地转换为简单实用的SCAR标记。2014年,牛晓伟等[45]以西瓜抗病材料PI189225和感病材料Black Diamand为亲本杂交后再自交得到的F1、F2、F3为炭疽病生理小种1的接种材料,并利用分子标记技术得到与抗炭疽病基因Rco-1连锁的3个AFLP标记。2018年Pan等[46]通过对黄瓜品种Gy14的抗病数量性状位点(QTL)定位和进一步的图谱克隆,确立了抗性位点的候选基因,并明确Gy14对炭疽病的抗性是由STAYGREEN(CsSGR)控制的。2019年,Jeong等[47]对抗性材料P1DrHs7250接种炭疽病,发现其对炭疽病1号生理小种的抗性由单显性基因控制,并获得1个位于富亮氨酸重复域的分子标记,同时对89种植物的1007个同源物进行鉴定,获得1个可以确定对外源病毒入侵有抗性的保守基序。2022年Matsuo等[48]利用高抗黄瓜品种NR28和其他2个抗性品种、3个感性品种为研究对象,对在日本分布的多种C. orbiculare菌株的抗性进行了研究,经CAPS标记分析得出3个抗性品种的抗性基因与2号生理小种cl001017的抗性等位基因为纯合子的结论。
2.3 瓜类炭疽病的致病基因
植物病原真菌能通过多种方式侵染植物,其携带大量致病基因。在侵染过程中这些基因会参与形成侵染结构、降解植物细胞壁、信号级联等生物学过程[49-50]。
形成侵染结构时,C. gloeosporioides中的COM1(CgCOM1)基因、C. orbiculare中的CoHox3和CoHox1基因、C. gloeosporioides中的蛋白激酶A(PKAR)、C. graminicola中的尿囊素基因和C. lindemuthianum中的slnCl1基因等均参与附着胞的形成[51-53]。而附着胞的形成与成熟需黑色素参与,因此C. orbiculare中有关黑色素合成的PKS1、SCD1和THR1基因对炭疽病菌形成侵染结构也是至关重要的[54]。随后病原菌在侵染植物寄主时会产生细胞壁裂解酶从而顺利侵入植物体内,如C. cocodes中的CcpelA、C. lindemuthianum中的pecC1l、C. gloeosporioides中的pelB均为关键的果胶裂解酶基因[55-56]。当病原真菌在植物体内进行信号级联反应时,会有相对应的基因参与完成,如C. lagenarium 中的WHI2(WHIsky-2)、CoIra1、CoRas2和CoPag1基因均通过MAPK信号通路发挥其致病作用[57-59]。此外侵染瓜类作物的主要炭疽病菌C. orbiculare在完成侵染过程中表达的基因还包括287个蛋白酶编码基因、327个细胞壁降解酶和700个小分泌蛋白(SSPs)等[60]。在转录组学和基因组学研究中发现,C. orbiculare在完成致病效应时会产生多种效应因子,其中包括乙烯诱导肽样蛋白1(NLP1)、DN3、诱导坏死分泌蛋白1(NIS1)、MC69、抑制烟草免疫的SIB1和SIB2[61-63]。
3 瓜类炭疽病抗性育种
自19世纪末,育种家便开展瓜类抗炭疽病育种工作。目前,国内外已知的西瓜抗炭疽病品种有富宝、富光、新富宝、西农8号、抗病948、京抗2号、京抗3号、K-643、K-1298、K-2814、K-4598、光玉绿、南都绿、都锦、Icebox、SSDL、Congo、Charleston Gary、Kleckley Hybrid、Black Kleckley、Charleston Gary、Fairfax、PI271778、PI189225、AU-Producer、AU-Jubilant等[11]。
关于葫芦科其他瓜类抗炭疽病品种国内外也有报道。早期Barnes和Epps在研究中发现了5个对炭疽病具有中等抗性的黄瓜PI系,随后美国生产的19个黄瓜品系中,PI197087抗炭疽病的9个品系(2A、G421、Gy14、Gy3、Gy8、H19、Poinsett76、SC50和WI2757)被广泛应用于黄瓜新品种选育中[64]。Goode等[65]在美国北卡罗来纳州东部发现了南瓜抗炭疽病材料Butternu;谢双大等[66]从12份黄瓜抗病鉴定材料中筛选出2份高抗炭疽病材料;王惠哲等[67]在21份黄瓜高代自交系材料中筛选出3份高抗炭疽病材料(43-1-2、0735和Q6);Ge等[68]在抗性和易感甜瓜感染炭疽菌诱导防御反应的差异研究中所用的甜瓜材料Gankezaomi对炭疽病有很强的抗性;2022年Matsuo等[69]在不同瓜类品种对炭疽病抗性研究中发现,南瓜品种中的Gammirak和Eeotbae抗性较强,并确定了1个黄瓜抗病种质Ban Kyur。此外,上海农科院培育出新抗炭疽病南瓜品种锦绣。目前,我国拥有津研4号、早青2号、夏丰1号、中农5号、夏青2号等优质抗炭疽病黄瓜品种;齐甜1号、黄糖罐等抗炭疽病甜瓜品种;蓉抗41号、江心4号、强雌系A4、丰乐粤农节瓜等抗炭疽病冬瓜品种。
4 瓜类炭疽病的防治
近年来,随着瓜类作物在我国种植面积不断扩大,炭疽病成为瓜类作物的主要病害之一。因此坚持预防为主,综合防治,采用有效的防治措施是瓜类作物种植过程中的重要工作。常用的防治方法有:(1)选用抗(耐)病品种。根据瓜类种植地的环境和发病率选择合适的抗病品种,如我国现用的优质抗炭疽病品种西农8号、美抗9号、津研4号、早青2号、抗41号、江心4号等。(2)种子处理。播种时选择饱满、大小均匀的种子,随后置种子于40%福尔阿林、50%多菌灵等药剂中浸种5~10 min消毒灭菌,用清水冲洗干净后再进行催芽播种。此外,还可以温汤浸种,水温控制在55~60 ℃,时间控制在15 min左右。(3)合理轮作。可以将葫芦科作物与玉米、小麦、花生等其他作物在发病严重地区实行至少3年的轮作种植,逐渐减少土壤中存留的炭疽病菌[70]。(4)加强田间管理。选择砂质土壤,做好排水通风工作,此外还需要合理施肥,及时处理有病害的叶果。(5)采后处理。瓜类果实成熟采摘后,对田间进行翻土整理,并且采用杀菌剂浇灌、闷棚杀菌等方式进行杀菌消毒。(6)化学防治。发病初期可以用5%肟菌·戊唑醇水分散粒剂,1500~2000倍液喷雾防治;或用25%的吡唑醚菌酯乳油混10%苯醚甲环唑水分散剂1000倍液喷雾,7~10 d喷施1次,连续防治2~3次[71]。(7)诱导抗性。在黄瓜或者西瓜受炭疽病侵染前3 d施用7.2 mmol·L-1的锰离子溶液,以促进植物组织木质素、活性氧和胼胝质的积累,减少炭疽病菌对植物细胞的诱导死亡[72]。(8)生物防治。选用枯草芽孢杆菌、2%抗酶菌素(120)水剂200倍液、2%武夷菌素(BO-10)水剂150倍液、大蒜素微乳剂300~500倍液等生物防治剂对瓜类炭疽病都有较好的生物防治效果[73]。总之,对于瓜类炭疽病,要早预防、早发现、早防治且结合多种预防措施,才能达到有效防治的目的。
5 问题与展望
5.1 问题
目前,国内外对瓜类炭疽病的研究领域多集中在病原菌培养、病害防治、抗性鉴定等方面,对西瓜等瓜类炭疽病基因的定位、基因克隆、种质资源引进、优质资源利用等方面的研究较少,且存在一些问题与不足:
(1)我国的葫芦科瓜类作物虽然种植面积较大,但抗炭疽病的种质资源相对匮乏,没有充分利用世界种质资源库发掘出更多抗病品种,且关于葫芦科炭疽病的研究多集中在西瓜作物上,其他瓜类作物研究较少。
(2)炭疽病种类丰富多样,目前对瓜类炭疽病生理小种的分化鉴定仍采用国外的材料为鉴别寄主,国内缺少一套自主研发、快速有效鉴别瓜类炭疽病生理小种的程序标准,不利于国内开展瓜类抗炭疽病种质资源筛选工作。
(3)对瓜类炭疽病抗性遗传、抗性机制的研究及抗炭疽病基因精细定位等分子生物学方面的研究不够深入,限制了瓜类作物抗炭疽病的育种效率。
5.2 展望
(1)加强对国内外优质抗病种质资源的搜集与利用,选取适当的种质材料对炭疽病抗病基因进行精细定位和克隆,开发抗病相关分子标记,进而提高育种效率,缩短育种年限。
(2)建立全国瓜类产区瓜类作物的炭疽病菌库,为我国瓜类炭疽病的鉴定提供支持。
(3)通过基因组学、转录组学等现代分子生物学技术,研究瓜类作物与炭疽病菌之间的作用,以及瓜类作物抗病的分子机制,为抗病育种和生物防治提供新的思路和策略。
(4)深入研究瓜类炭疽病原菌的生物学特征和致病机制,有助于更准确地预测病害的发生和流行,为制定有效的防治措施提供科学依据。
(5)研究和开发针对瓜类炭疽病的生物防治技术,有助于降低病害发生风险,同时减少化学农药对环境和人体的危害。
(6)研究开发新型高效、低毒的化学药剂,以及研究药剂的合理使用方法和轮换策略以延缓病原菌抗药性的产生。
参考文献
[1] 刘慧颖,冯翠,吉茹,等.瓜类作物辐射花粉诱导双单倍体技术研究进展[J].长江蔬菜,2023(18):37-40.
[2] 刘君璞,马跃.中国西瓜甜瓜发展70年暨科研生产协作60年回顾与展望[J].中国瓜菜,2019,32(8):1-8.
[3] 戴思慧,孙小武,熊兴耀,等.西瓜综合利用研究进展及深加工发展趋势[J].中国园艺文摘,2010,26(10):57-59.
[4] PRAKASH B B,TAKSHAY P,EDGAR C,et al.Dissection of race 1 anthracnose resistance in a watermelon (Citrullus lanatus var. lanatus) biparental mapping population[J].Euphytica,2022,218(11):1-12.
[5] PATEL T,QUESADA-OCAMPO L M,WEHNER C T,et al.Recent advances and challenges in management of Colletotrichum orbiculare,the causal agent of watermelon anthracnose[J].Horticulturae,2023,9(10):1132.
[6] 王鑫宇.南瓜炭疽病病原菌鉴定及种质资源抗性评价[D].哈尔滨:东北农业大学,2023.
[7] 梅丽艳,王喜庆,贾云鹤,等.西瓜炭疽病症状观测及发生危害调查[J].黑龙江农业科学,2016(12):55-58.
[8] 刘阳,谢露露,张思远,等.西瓜主要病害抗病育种研究进展[J].中国蔬菜,2022(3):17-28.
[9] 张丽娜.广藿香提取物对黄瓜炭疽病菌抑制作用研究[D].哈尔滨:黑龙江大学,2023.
[10] 唐爽爽,刘志恒,余朝阁,等.辽宁省西瓜炭疽病病原菌鉴定及生物学特性研究[J].植物保护,2014,40(4):38-44.
[11] 郜森,王恩煜,杨小振,等.西瓜炭疽病及抗性育种研究进展[J].中国瓜菜,2021,34(5):1-7.
[12] CANNON P F, DAMM U,JOHNSTON P R,et al.Colletotrichum - current status and future directions[J].Studies in Mycology,2012,73(1):181-213.
[13] SUTTON B C.The genus Glomerella and its anamorph Colletotrichum[J].Colletorichum Biology,Pathology and Control,1992:1-26.
[14] DAMM U,SATO T,ALIZADEH A,et al.The Colletotrichum dracaenophilum,C. magnum and C. orchidearum species complexes[J].Studies in Mycology,2019,92:1-46.
[15] DAMM U,CANNON P F,WOUDENBERG J H,et al.The Colletotrichum acutatum species complex[J].Studies in Mycology,2012,73(1):37-113.
[16] LIU F,WEIR BS,DAMM U,et al.Unravelling Colletotrichum species associated with Camellia:employing ApMat and GS loci to resolve species in the C. gloeosporioides complex[J].Persoonia,2015,35:63-86.
[17] THAN P P,JEEWON R,HYDE K D,et al.Characterization and pathogenicity of Colletotrichum species associated with anthracnose on chilli (Capsicum spp.) in Thailand[J].Plant Pathology,2008,57(3):562-572
[18] JELEV Z J,BOBEV S G,MINZ D,et al.First report of anthracnose fruit rot caused by Colletotrichum acutatum on pepper and tomato in bulgaria[J].Plant Disease,2008,92(1):172.
[19] 郭珍.西瓜炭疽病病原菌种类多样性及Colletotrichum magnum致病相关基因分析[D].武汉:华中农业大学,2023.
[20] YOUG Y L,CAI L,YU Z N,et al.Colletotrichum species on Orchidaceae in Southwest China[J].Cryptogamie Mycologie,2011,32(3):229-253.
[21] 靳俊媛,王友贤,刘倩,等.西瓜新炭疽病菌的鉴定、生物学特性及药剂敏感性研究[J].中国瓜菜,2022,35(8):18-26.
[22] GOH K S,BALASUBRAMANIAM J,SANI S F,et al.First report of Colletotrichum scovillei causing anthracnose on watermelon (Citrullus lanatus) in Malaysia[J].Plant Disease,2022,106(9):2022.
[23] 唐宁安.西瓜抗炭疽病基因的分子标记研究[D].浙江金华:浙江师范大学,2013.
[24] 张慧青,孙玉燕,范敏.西瓜炭疽病研究进展[J].浙江农业科学,2020,61(2):292-295.
[25] PRUSKY D,ALKAN N,MENGISTE T,et al.Quiescent and necrotrophic lifestyle choice during postharvest disease development[J].Annual Review of Phytopathology,2013,51(1):155-176.
[26] WHARTON P S,JULIAN A M,OCONNELL R J.Ultrastructure of the infection of Sorghum bicolor by Colletotrichum sublineolum[J].Phytopathology,2001,91(2):149-158.
[27] OCONNELL R J,THON M R,HACQUARD S,et al.Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses[J].Nature Genetics,2012,44(9):1060-1065.
[28] KODAMA S,ISHIZUKA J,MIYASHITA I,et al.The morphogenesis-related NDR kinase pathway of Colletotrichum orbiculare is required for translating plant surface signals into infection-related morphogenesis and pathogenesis[J].PLoS Pathogens,2017,13(2):e1006189.
[29] GAN P,IKEDA K K,IRIEDA H,et al.Comparative genomic and transcriptomic analyses reveal the hemibiotrophic stage shift of Colletotrichum fungi[J].New Phytologist,2013,197(4):1236-1249.
[30] HIRUMA K,ONOZAWA-KOMORI M,TAKAHASHI F,et al.Entry mode-dependent function of an indole glucosinolate pathway in Arabidopsis for nonhost resistance against anthracnose pathogens[J].Plant Cell,2010,22(7):2429-2443.
[31] 魏春华,郜森,甘露,等.西瓜炭疽病接种技术规程[J].中国瓜菜,2019,32(1):45-47.
[32] DAMM U,CANNON P F,WOUDENBERG J H C,et al.The Colletotrichum boninense species complex[J].Studies in Mycology,2012,73(1):1-36.
[33] 黄蔚,崔丽红,谢王超,等.西瓜新炭疽病病原菌分子鉴定及其生物学特性初探[J].中国农学通报,2022,38(1):131-136.
[34] 刘莉,王鸣.西瓜种质资源苗期对炭疽病抗性的研究[J].中国西瓜甜瓜,1990,3(1):9-13.
[35] 孙玉燕,范敏,何艳军.西瓜炭疽病菌离体叶片接种鉴定技术[J].浙江农业科学,2019,60(8):1460-1462.
[36] HAMMERSCHMIDT R,BONNEN A M,BERGSTROM G C,et al.Association of epidermal lignification with nonhost resistance of cucurbits to fungi[J].Canadian Journal of Botany,1985,63(12):2393-2398.
[37] SUVANPRAKORN K,NORTON J D.Inheritance of resistance to race 2 anthracnose in watermelon[J].Journal of the American Society fou Horticultural Science,1980,105(6):862-865.
[38] SOWELL G J,RHODES B B,NORTON J D.New sources of resistance to watermelon anthracnose[J].Journal of the American Society for Horticultural Science,1980,105(2):197-199.
[39] 王惠哲,李淑菊,刘秀峰,等.与黄瓜抗炭疽病相关基因连锁的AFLP标记的筛选[J].园艺学报,2007,34(1):213-216.
[40] BARNES W C,EPPS W M.Progress in breeding cucumbers resistant to anthracnose and downy mildew[J].Proceedings American Society of Horticultural Science ,1955,65:409-415
[41] ROBINSON R W, MUNGER H M, WHITAKER T W,et al. Genes of the Cucurbitaceae1[J].HortScience,1976,11(6):554-568.
[42] 唐建辉,王伟,王源超.西瓜炭疽病菌Colletotrichum orbiculare的分子检测[J].中国农业科学,2006,39(10):2028-2035.
[43] 李淑菊,王惠哲,霍振荣,等.黄瓜抗炭疽病相关基因AFLP标记的SCAR转换[J].园艺学报,2008,35(1):123-126.
[44] 王惠哲,管炜,李淑菊.与黄瓜抗炭疽病相关基因连锁的基因片段及SCAR标记[J].华北农学报,2011,26(1):200-203.
[45] 牛晓伟,唐宁安,范敏,等.西瓜抗炭疽病的遗传分析和抗性基因定位研究[J].核农学报,2014,28(8):1365-1369.
[46] PAN J S,TAN J Y,WANG Y H,et al.STAYGREEN (CsSGR) is a candidate for the anthracnose (Colletotrichum orbiculare) resistance locus cla in Gy14 cucumber[J].Theoretical and Applied Genetics,2018,131(7):1577-1587.
[47] JEONG Y J,SEO M,HERSH C P,et al.An evolutionarily conserved non-synonymous SNP in a leucine-rich repeat domain determines anthracnose resistance in watermelon[J].Theoretical and Applied Genetics,2019,132(2):473-488.
[48] MATSUO H,MINE K,SANO T,et al.Resistance of a previously screened old japanese watermelon cultivar to diverse anthracnose strains and its inheritance[J].Horticulture Journal,2022,91(3):375-381.
[49] JIAO W L,YU H L,CONG J,et al.Transcription factor SsFoxE3 activating SsAtg8 is critical for sclerotia,compoud appressoria formation,and pathogenicity in sclerotinia sclerotiorum[J].Molecular Plant Pathology,2022,23(2):204-217.
[50] GONG Z W,NING N,LI Z Q,et al.Two Magnaporthe appressoria-specific (MAS) proteins,MoMas3 and MoMas5,are required for suppressing host innate immunity and promoting biotrophic growth in rice cells[J].Molecular Plant Pathology,2022,23(9):1290-1302.
[51] KUMAR B M,SINGH A,PAREEK M,et al.Host-induced silencing of the Colletotrichum gloeosporioides conidial morphology 1 gene (CgCOM1) confers resistance against Anthracnose disease in chilli and tomato[J].Plant Molecular Biology,2020,104(4/5):381-395.
[52] YOKOYAMA A,IZUMITSU K,IRIE T,et al.The homeobox transcription factor CoHox1 is required for the morphogenesis of infection hyphae in host plants and pathogenicity in Colletotrichum orbiculare[J].Mycoscience,2019,60(2):110-115.
[53] NOGUEIRA G B,DOS SANTOS L V,DE QUEIROZ C B,et al.The histidine kinase slnCl1 of Colletotrichum lindemuthianum as a pathogenicity factor against Phaseolus vulgaris L.[J].Microbiological Research,2019,219:110-122.
[54] TSUJI G,SUGAHARA T,FUJII I,et al.Evidence for involvement of two naphthol reductases in the first reduction step of melanin biosynthesis pathway ofitalic Colletotrichum lagenarium[J].Mycological Research,2003,107(7):854-860.
[55] BEN-DANIEL B H,BAR-ZVI D,TSROR L.Pectate lyase affects pathogenicity in natural isolates of Colletotrichum coccodes and in pelA gene-disrupted and gene-overexpressing mutant lines[J].Molecular Plant Pathology,2012,13(2):187-197.
[56] CNOSSEN-FASSONI A,BAZZOLLI D M S,BROMMONSCHENKEL S H,et al.The pectate lyase encoded by the pecCl1 gene is an important determinant for the aggressiveness of Colletotrichum lindemuthianum[J].Journal of Microbiology,2013,51(4):461-470.
[57] KEN H,YASUYUKI K.Ras GTPase activating protein CoIra1 is involved in infection-related morphogenesis by regulating cAMP and MAPK signaling pathways through CoRas2 in Colletotrichum orbiculare[J].PloS One,2014,9(10):e109045.
[58] KUBO Y,HARATA K,KODAMA S,et al.Development of the infection strategy of the hemibiotrophic plant pathogen,Colletotrichum orbiculare,and plant immunity[J].Physiological and Molecular Plant Pathology,2016,95:32-36.
[59] KODAMA S,ISHIZUKA J,MIYASHITA,et al.The morphogenesis-related NDR kinase pathway of Colletotrichum orbiculare is requiredfor translating plant surface signals into infection-related morphogenesis and pathogenesis[J].PLoS Pathogens,2017,13(2):e1006189.
[60] GAN P,IKEDA K,IRIEDA H,et al.Comparative genomic and transcriptomic analyses reveal the hemibiotrophic stage shift of Colletotrichum fungi[J].New Phytologist,2013,197(4):1236-1249.
[61] ZHANG R,ISOZUMI N,MORI M,et al.Fungal effector SIB1 of Colletotrichum orbiculare has unique structural features and can suppress plant immunity in Nicotiana benthamiana[J].Journal of Biological Chemistry,2022,297(6):101370.
[62] IRIEDA H,MAEDA H,AKIYAMA K,et al.Colletotrichum orbiculare secretes virulence effectors to a biotrophic interface at the primary hyphaleck via exocytosis coupled with SEC22-Mediated traffic[J].The Plant Cell,2014,26(5):2265-2281.
[63] YOSHINO K,IRIEDA H,SUGIMOTO F,et al.Cell death of Nicotiana benthamiana is induced by secreted protein NIS1 of Colletotrichum orbiculare and is suppressed by a homologue of CgDN3[J].Molecular Plant-microbe Interactions,2012,25(5):625-636.
[64] WANG Y H,TAN J Y,WU Z M,et al.STAYGREEN,STAY HEALTHY:A loss-of-susceptibility mutation in the STAYGREEN gene provides durable,broad-spectrum disease resistances for over 50 years of US cucumber production[J].New Phytologist,2019,221(1):415-430.
[65] GOODE M J.Physiologic specialization in Colletotrichum lagenarium[J].Plant Disease Reporter,1956,40:741.
[66] 谢双大,朱天圣,陈桂珍,等.黄瓜抗炭疽病的苗期人工接种鉴定方法研究初报[J].中国蔬菜,1988(1):28-30.
[67] 王惠哲,李淑菊,杨瑞环,等.黄瓜枯萎病、炭疽病、褐斑病、黑星病苗期抗源材料筛选试验[J].农业科技通讯,2013(8):118-121.
[68] GE Y H,GUEST D I,BI Y.Differences in the induction of defence responses in resistant and susceptible muskmelon plants infected with Colletotrichum lagenarium[J].Journal of Phytopathology,2014,162(1):48-54.
[69] MATSUO H,SUGIYAMA M,YOSHIOKA Y.Identification of a new source of resistance to anthracnose in cucumber in Japan[J].Horticulture Journal,2022,91(1):49-57.
[70] 翁一强,卓婷婷.海南万宁市西瓜主要病害的防治[J].长江蔬菜,2022(18):69-70.
[71] 王艳华,张锦东.黄瓜炭疽病的发生、传播与防治[J].农业工程技术,2021,41(8):41-42.
[72] ESKANDARI S,HOFTE H,ZHANG T.Foliar manganese spray induces the resistance of cucumber to Colletotrichum lagenarium[J].Journal of Plant Physiology,2020,246:153129.
[73] 程维舜,田守胜,祝菊红,等.10%大蒜素微乳剂对西瓜炭疽病防治效果[J].东北农业科学,2021,46(5):56-58.
