不同转食策略对花斑副沙鳅仔鱼和稚鱼生长及存活率的影响
2024-06-25刘旭魏杰王永明史晋绒谢碧文
刘旭 魏杰 王永明 史晋绒 谢碧文

收稿日期:2023-02-28
基金项目:内江师范学院科研项目(2021YB18);内江师范学院创新团队项目(2021TD03);重庆市科研机构绩效激励引导专项(cstc2022jxjl80009)
作者简介:刘 旭(2000-),男,四川遂宁人,在读硕士研究生,研究方向为鱼类资源调查,(电话)15282578038(电子信箱)liuxu07x@163.com;通信作者,王永明(1985-),男,山西太原人,副教授,硕士,主要从事鱼类形态及繁殖生物学研究,(电子信箱)wym8188@126.com。
刘 旭,魏 杰,王永明,等. 不同转食策略对花斑副沙鳅仔鱼和稚鱼生长及存活率的影响[J]. 湖北农业科学,2024,63(5):113-117.
摘要:为研究不同转食策略对花斑副沙鳅(Parabotia fasciata)仔鱼和稚鱼生长及存活率的影响,探寻其最佳转食策略,设置5个转食起始点,分别为孵化出膜后第7天(W7组)、第9天(W9组)、第11天(W11组)、第13天(W13组)和第15天(W15)组,设计5个转食过渡时间,分别为2 d(W9-1组)、4 d(W9-2组)、6 d(W9-3组)、8 d(W9-4组)和10 d(W9-5组)。结果表明,孵化出膜23 d时,W13组试验鱼存活率最高,为83.33%,明显高于其余各组;孵化出膜11~15 d、15~19 d时,各组试验鱼特定生长率无显著差异(P>0.05),孵化出膜19~23 d时,W13组试验鱼特定生长率显著小于其余各组(P<0.05);W15组试验鱼体长和体重明显高于其余各组。W9-5组试验鱼存活率明显高于其余各组,孵化出膜25 d时,W9-5组试验鱼存活率为89.30%;孵化出膜21~25 d时,W9-1、W9-2组试验鱼特定生长率明显高于其余各组(P<0.05);W9-5组试验鱼体长和体重最大,其次是W9-4组,其余各组试验鱼体长和体重都随转食过度时间的缩短而降低。综合分析,推荐花斑副沙鳅仔鱼和稚鱼在孵化出膜13 d时开始转食,且以8 d作为转食的最佳过渡时间。
关键词:花斑副沙鳅(Parabotia fasciata);转食策略;仔鱼和稚鱼;生长;存活率
中图分类号:S965 文献标识码:A
文章编号:0439-8114(2024)05-0113-05
DOI:10.14088/j.cnki.issn0439-8114.2024.05.020 开放科学(资源服务)标识码(OSID):
The effect of different food conversion strategies on the growth and survival rate of larvae and juveniles of Parabotia fasciata
LIU Xu1,2, WEI Jie1, WANG Yong-ming1, SHI Jin-rong1, XIE Bi-wen1
(1. School of Life Sciences/Key Laboratory of Sichuan Province for Fishes Conservation and Utilization in the Upper Reaches of the Yangtze River, Neijiang Normal University, Neijiang 641100,Sichuan, China;2.College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China)
Abstract: To investigate the effects of different food conversion strategies on the growth and survival rate of larvae and juveniles of Parabotia fasciata, and to explore the optimal food conversion strategy, 5 starting points for food conversion were set, namely the 7th day (W7 group), 9th day (W9 group), 11th day (W11 group), 13th day (W13 group), and 15th day (W15) groups after hatching out of the membrane, and 5 transition times for food conversion were designed, namely 2 days (W9-1 group), 4 days (W9-2 group), 6 days (W9-3 group), 8 days (W9-4 group), and 10 days (W9-5 group). The results showed that after hatching out of the membrane for 23 days, the W13 group had the highest survival rate of 83.33%, which was significantly higher than the other groups;after hatching out of the membrane for 11-15 days and 15~19 days, there was no significant difference in the specific growth rate of experimental fish among the groups (P>0.05). However, after hatching out of the membrane for 19~23 days, the specific growth rate of experimental fish in the W13 group was significantly lower than that in the other groups (P<0.05);the body length and weight of fish in the W15 group were significantly higher than those in the other groups. The survival rate of experimental fish in the W9-5 group was significantly higher than that in the other groups. After hatching for 25 days, the survival rate of experimental fish in the W9-5 group was 89.30%;after hatching out of the membrane for 21~25 days, the specific growth rate of experimental fish in the W9-1 and W9-2 groups was significantly higher than that in the other groups (P<0.05);the W9-5 group had the largest body length and weight, followed by the W9-4 group. The body length and weight of the other experimental groups decreased with the shortening of the transition time. Based on comprehensive analysis, it was recommended that the food conversing of larvae and juveniles of Parabotia fasciata started after hatching out of the membrane for 13 days, with 8 days as the optimal transition time for feeding.
Key words: Parabotia fasciata; food conversion strategy; larvae and juveniles fish; growth; survival rate
随着中国水产养殖生产规模日益扩大,集约化程度不断提高,鱼种的需求量逐渐增加,而充足的鱼种供应是规模化生产的有力保障。转食作为养殖生产中鱼类早期生活史的必经过程,其饵料的选择及投喂策略对鱼类早期的生长和存活至关重要,是养殖业苗种培育及自然资源繁衍保护的重要研究内容之一[1,2]。目前,对鱼类转食的研究主要为集中转食和联合投喂2个方面。Brito等[3]认为直接转食常因转食日龄或策略不当而导致仔鱼存活率低和生长发育不良;郭忠娣等[1]研究发现,特定转食起点和过渡时间可以提高胭脂鱼(Myxocyprinus asiaticus)仔鱼、稚鱼的生长率和存活率。易建华等[4]研究表明,鱼类转食常受转食过渡方式、过渡时间长短、饵料营养成分及仔鱼、稚鱼生理状态等的影响。
花斑副沙鳅(Parabotia fasciata)隶属于鲤形目(Cypriniformes)沙鳅科(Botiidae)副沙鳅属(Parabotia),在长江干(支)流、黑龙江、珠江等水系均有分布[5]。其具有怀卵量大、生长快、适应力强等特点,为中国特有鱼类和产区经济鱼类[6, 7]。近年来,受水利工程建设、环境污染和过度捕捞等影响,其原有产卵场和索饵场被破坏,自然资源量急剧下降,市场需求旺盛,人工养殖应运而生。如何提高养殖条件下花斑副沙鳅苗种的生长率和存活率是亟待解决的问题。目前对于花斑副沙鳅的研究集中在胚胎发育[8]、年龄与生长[7]、形态分类学[9]、繁殖生态学[6]、肌肉营养[10]等方面,尚无转食方面的相关研究。因此,本研究通过不同转食起点和过渡时间对花斑副沙鳅仔鱼、稚鱼生长及存活率的影响试验,探讨花斑副沙鳅苗种生产中最适转食策略,为联合投喂应用于实际育苗生产奠定理论基础。
1 材料与方法
1.1 试验材料
试验用鱼选自长江上游鱼类资源保护与利用四川省重点实验室,为同一批人工繁殖、孵化4 d至平游期的花斑副沙鳅仔鱼。
1.2 研究方法
1.2.1 试验设计 选取规格一致、健康无伤的花斑副沙鳅仔鱼3 000尾,平均分成5组,每组3个重复,每个重复200尾鱼,于90 L养殖桶中饲养。
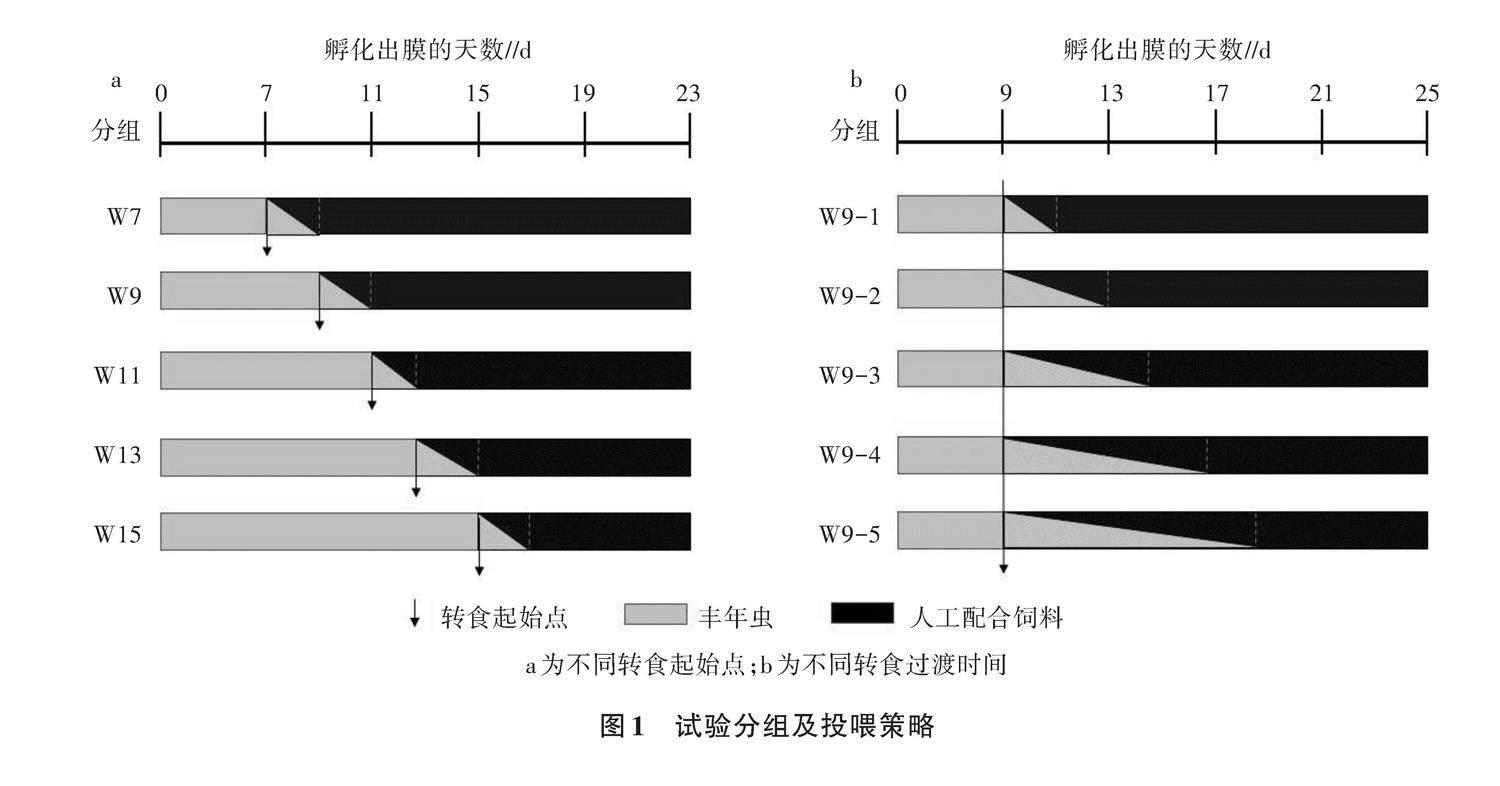
试验一:不同转食起始点对花斑副沙鳅仔鱼、稚鱼生长及存活率的影响。
将转食过渡时间设为2 d,按照转食起始点的不同,分别设定转食起始点为孵化出膜后第7天(W7组)、第9天(W9组)、第11天(W11组)、第13天(W13组)和第15天(W15)组,如图1a所示。
试验二:不同转食过渡时间对花斑副沙鳅仔鱼、稚鱼生长及存活率的影响。
将转食起始点设为孵化出膜后第9天,按照转食过渡时间长短不同,分别设定转食过渡时间为2 d(W9-1组)、4 d(W9-2组)、6 d(W9-3组)、8 d(W9-4组)和10 d(W9-5组),如图1b所示。
在转食过渡时间采用渐进方式投喂,即逐步减少丰年虫的投喂量,同时逐步增加人工配合饲料的投喂量,直至全部转食人工配合饲料[11,12]
1.2.2 养殖管理 水温保持在(26.5±1.0) ℃,pH 6.6~7.2,溶解氧大于7 mg/L,氨氮小于0.02 mg/L,水源为曝气自来水。采取饱食投喂方式,每天分别于7:00、12:00和18:00定时投喂3次,并于喂食后2 h将饵料残渣及粪便吸出,吸取水量控制在总水量的30%左右并及时补充新水。每天观察鱼苗情况,及时清理死鱼,并做好记录。
1.2.3 试验饵料 试验用丰年虫购于无棣海吉水产有限公司;人工配合饲料为实验室鱼苗专用饲料,营养成分如表1所示。
1.3 数据采集
在投喂前2 h取样,每个平行组随机取10尾,采用JA1003A型电子天平(天津天马衡基仪器有限公司)测定体重(精确至0.001 g),Nikon SMZ1500型体式显微镜拍摄,Motic Images Advanced 3.2软件测量体长(精确至0.01 mm)。
根据测量及统计数据计算特定生长率(Specific growth rate,SGR)和成活率(Survival rate,SR),计算公式如下。
SGR=ln(Wt/W0)/t×100% (1)
SR=Mt/M0×100% (2)
式中,W0表示初始体重(mg);Wt表示终末体重(mg);M0表示试验开始时仔鱼、稚鱼数量(尾);Mt表示试验结束时仔鱼、稚鱼存活数(尾);t表示试验周期(d)。
1.4 数据分析
试验数据均采用平均数±标准差表示,利用SPSS 19.0分析软件进行单因素方差分析(One-Way ANOVA)及Duncan氏多重比较,以P < 0.05表示差异显著。
2 结果与分析
2.1 不同转食起始点对花斑副沙鳅仔鱼、稚鱼的影响
2.1.1 不同转食起始点花斑副沙鳅仔鱼、稚鱼的存活率 由图2可知,相同过渡时间,不同转食起始点对花斑副沙鳅仔鱼、稚鱼存活率的影响存在一定差异。孵化出膜11 d时各组试验鱼存活率均下降明显;孵化出膜15 d时W7组试验鱼存活率最低。孵化出膜23 d时W13组试验鱼存活率最高,为83.33%,明显高于其余各组。
2.1.2 不同转食起始点花斑副沙鳅仔鱼、稚鱼的特定生长率 由表2可知,各组试验鱼的特定生长率随着养殖时间的延长逐渐下降,且同一时间段内不同组间试验鱼的特定生长率存在一定差异。孵化出膜7~11 d时,W15组试验鱼特定生长率最高,其特定生长率与W11和W13无显著差异(P>0.05),但显著大于W7和W9组(P<0.05);孵化出膜11~15 d、15~19 d时,各组试验鱼特定生长率无显著差异(P>0.05);孵化出膜19~23 d时,W13组试验鱼特定生长率显著小于其余各组(P<0.05)。
2.1.3 不同转食起始点花斑副沙鳅仔鱼、稚鱼的体长 由图3可知,孵化出膜7 d时,各组试验鱼体长基本相同;孵化出膜11~23 d时,W13、W15组试验鱼体长明显大于W7、W9、W11组。孵化出膜23 d时,W15组试验鱼体长最大,为18.46 mm,W7组试验鱼体长最小,为13.91 mm。
2.1.4 不同转食起始点花斑副沙鳅仔鱼、稚鱼的体重 由图4可知,孵化出膜11 d时,率先引入饲料和生物饵料联合投喂的W7、W9组试验鱼的体重较小;随着各组试验鱼均完成转食,W15组试验鱼体重增长最快,明显大于其余各组。
2.2 不同转食过渡时间对花斑副沙鳅仔鱼、稚鱼的影响
2.2.1 不同转食过渡时间花斑副沙鳅仔鱼、稚鱼的存活率 由图5可知,孵化出膜13 d时,各组试验鱼存活率差异较小。随着养殖时间的延长,W9-5组试验鱼存活率明显高于其余各组,孵化出膜25 d时,W9-5组试验鱼存活率为89.30%。
2.2.2 不同转食过渡时间花斑副沙鳅仔鱼、稚鱼的特定生长 由表3可知,孵化出膜9~13 d时,未完全转食的W9-3、W9-4、W9-5组试验鱼特定生长率无显著差异(P>0.05),但显著高于已完成转食的W9-1、W9-2组(P<0.05);孵化出膜13~17 d时,未完全转食的W9-5组试验鱼特定生长率与刚完成转食的W9-4组差异不显著(P>0.05),但显著高于W9-1、W9-2和W9-3组(P<0.05);孵化出膜17~21 d时,各组试验鱼特定生长率无显著差异(P>0.05);孵化出膜21~25 d时,W9-1、W9-2组试验鱼特定生长率明显高于其余各组(P<0.05)。
2.2.3 不同转食过渡时间花斑副沙鳅仔鱼、稚鱼的体长 由图6可知,孵化出膜13 d时,各组试验鱼体长差异较小,随着养殖时间的延长,W9-5、W9-4组试验鱼体长明显高于其余各组,孵化出膜25 d时,W9-5组试验鱼体长为18.17 mm。
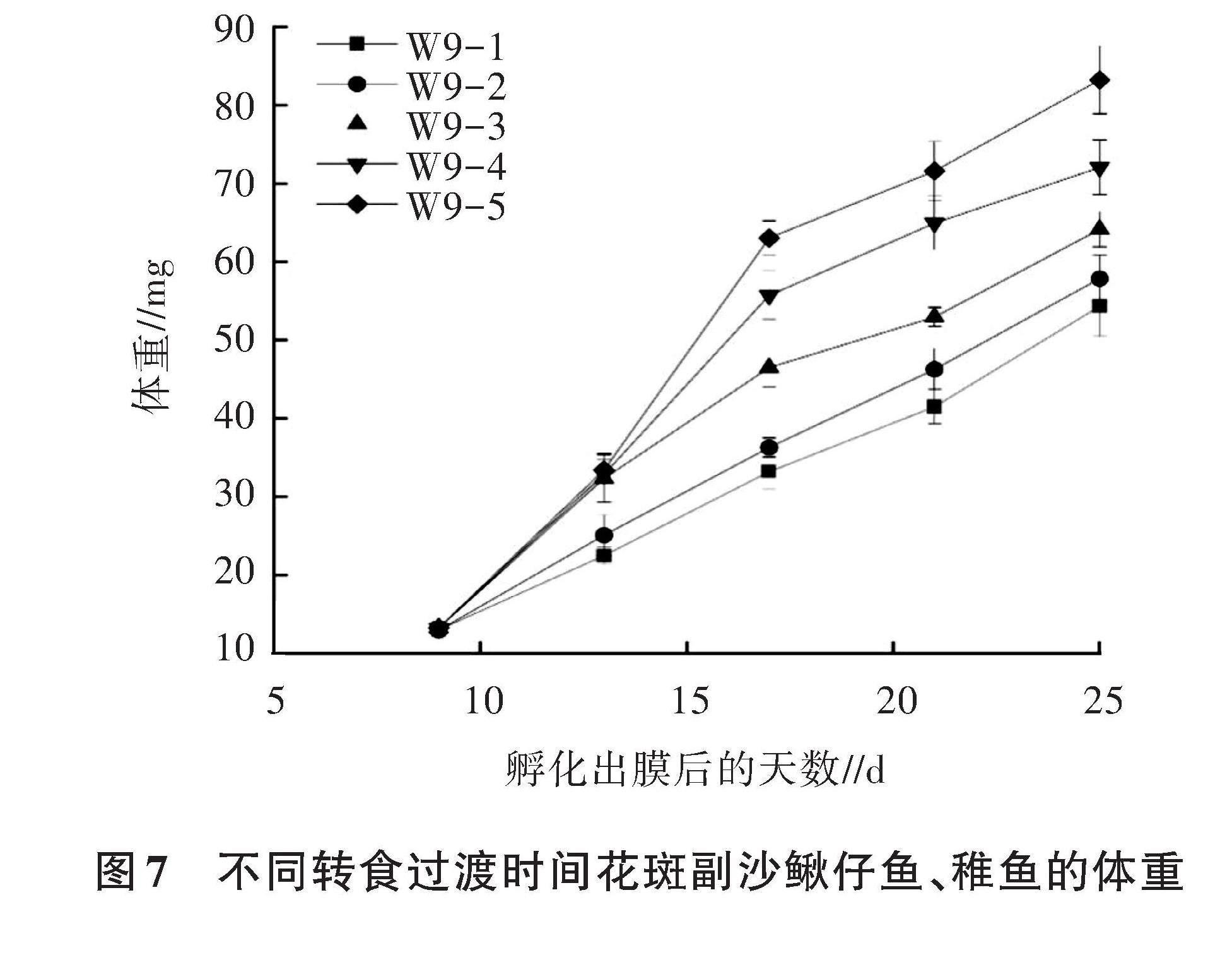
2.2.4 不同转食过渡时间花斑副沙鳅仔鱼、稚鱼的体重 由图7可知,孵化出膜13 d时,W9-3、W9-4和W9-5组试验鱼体重差异较小,这3组试验鱼体重高于W9-1、W9-2组。随着养殖时间的延长,W9-5组试验鱼体重明显高于其余各组。孵化出膜25 d时,各组试验鱼体重从大到小依次为W9-5组 (83.26 mg)、W9-4组(72.08 mg)、W9-3组(64.16 mg)、W9-2组(57.88 mg)和W9-1组(54.35 mg)。
3 讨论
3.1 不同转食起始点对花斑副沙鳅仔鱼、稚鱼生长和存活率的影响
研究表明,转食起始点的提前或延后会影响鱼苗的生长和存活,如太平洋鳕(Gadus macrocephalus)[13]、黑线鳕(Melanogrammus aeglefinus)[14]、绿背菱鲽 (Rhombosolea tapirina)[15]、舌齿鲈(Dicentrarchus labrax)[16]、小锯盖鱼(Centropomus parallelus)[17]等。本研究结果也证实了这一点,花斑副沙鳅仔鱼、稚鱼转食起始时间点越晚,存活率相对越高,W7组(转食起始时间点为孵化出膜后第7天)试验鱼存活率最低,W13组(转食起始时间点为孵化出膜后第13天)试验鱼存活率最高。特定生长率、体长和体重也表现为随着转食起始点延后逐渐增加的趋势。究其原因可能与转食起始点太早、仔鱼、稚鱼的消化系统发育未完全成熟、缺乏消化营养物质的酶、无法完全消化吸收饲料内的营养物质有关。微粒饲料受加工工艺的影响,在组成种类方面有较大差异,可能对仔鱼、稚鱼的消化吸收有负面影响[1]。Pedro等[18]在对塞内加尔鳎(Solea senegalensis)的研究中发现,转食时间并不是越晚越好,鱼类长时间摄食生物饵料一方面可能导致转食试验的失败,另一方面在成本上有较大的投入。Ruyet等[19]对金头鲷(Sparus aurata)仔鱼、稚鱼转食的研究发现,金头鲷初次投喂前3个月中生物饵料的干物质量仅占总投喂量的1.6%,而花费却占总养殖费用的50%。综合考虑,花斑副沙鳅仔鱼、稚鱼的最佳转食起点为孵化出膜后第13 天。
3.2 不同转食过渡时间对花斑副沙鳅仔鱼、稚鱼生长和存活率的影响
不同转食过渡时间会影响鱼类对生物饵料和人工微粒饲料的消化吸收,进而影响鱼类的生长和存活。在对胭脂鱼[1]和绿背菱鲽[15]的研究中发现,转食过渡时间在一定程度上影响仔鱼、稚鱼的生长和存活。本研究发现,花斑副沙鳅仔鱼、稚鱼在转食过渡时间为10 d(W9-5组)时,体长和体重最大,其次是W9-4组(转食过渡时间为8 d),其余各组试验鱼体长及体重都随转食过度时间的缩短而降低。研究表明,在联合投喂的基础上,转食过渡时间的长短对鱼苗生长尤为重要,因为转食过程中,生物饵料自身携带的消化酶可在一定程度上帮助鱼苗消化吸收微粒饲料中的营养成分[20,21],且生物饵料的游动性视觉效果还可促进鱼苗对微粒饲料的摄食[22]。若转食过渡时间太短,则无法实现生物饵料对鱼苗摄食的促进功能,但转食过渡时间过长,生物饵料需求量大,成本增加,不适合人工大规模繁殖,并且还会引起鱼苗转食推迟或者增加转食难度。综合考虑,花斑副沙鳅仔鱼、稚鱼最佳转食过渡时间为8 d。
参考文献:
[1] 郭忠娣, 刘亚秋, 黄 静, 等. 不同转食策略对胭脂鱼仔鱼和稚鱼生长及存活率的影响[J]. 水产学报, 2016, 40(1): 64-72.
[2] 殷名称. 鱼类早期生活史研究与其进展[J]. 水产学报,1991, 15(4): 348-358.
[3] BRITO R,ROSAS C,CHIMAL M E,et al. Effect of different diets on growth and digestive enzyme activity in Litopenaeus vannamei[J]. Aquaculture research, 2001, 32(4): 257-266.
[4] 易建华,?郭忠娣,?刘本祥, 等. 转食和联合投喂对胭脂鱼仔稚鱼生长和消化能力的影响[J]. 水生生物学报,2016,40(2): 64-72.
[5] 丁瑞华. 四川鱼类志[M]. 成都: 四川科学技术出版社, 1994.100-102.
[6] 杨明生,李建华,黄孝湘. 澴河花斑副沙鳅的繁殖生态学研究[J]. 水利渔业,2007, 27(5): 84-85.
[7] 杨明生. 花斑副沙鳅的年龄和生长特征[J]. 孝感学院学报, 2009, 29(6): 17-19.
[8] 杨明生.花斑副沙鳅的胚胎发育观察[J]. 淡水渔业,2004,34(6):34-36.
[9] 杨军山, 陈毅峰. 副沙鳅属系统发育分析[J]. 动物分类学报, 2004, 29(2): 173-180.
[10] 伍远安, 梁志强, 袁希平, 等. 花斑副沙鳅肌肉营养成分分析与评价[J]. 淡水渔业, 2011, 41(1): 87-91.
[11] 吴兴兵,杨德国,朱永久, 等. 不同开口饵料对四川裂腹鱼仔鱼生长和成活率的影响[J].淡水渔业, 2014, 44(6): 9-12, 23.
[12] PARMA L, BONALDO A, MASSI P, et al. Different early weaning protocols in common sole (Solea solea L.) larvae:Implications on the performances and molecular ontogeny of digestive enzyme precursors[J]. Aquaculture, 2013, 414(2): 26-35.
[13] BASKERVILLE B,KLING L J. Early weaning of Atlantic cod (Gadus morhua) larvae onto a microparticulate diet[J]. Aquaculture, 2000, 189(1-2): 109-117.
[14] HAMLIN H J, KLING L J. The culture an d early weaning of larval haddock (Melanogrammus aeglefinus) using a microparticulate diet[J]. Aquaculture, 2001, 201(1-2): 61-72.
[15] HART P R, PURSER G J. Weaning of hatchery-reared greenback flounder (Rhombosolea tapirina Günther) from live to artificial diets: Effects of age and duration of the changeover period[J]. Aquaculture,1996, 145: 171-181.
[16] CAHU C L, INFANTE J. Early weaning of sea bass (Dicentrarchus labrax) larvae with a compound diet: Effect on digestive enzymes[J]. Comparative biochemistry and physiology part A physiology, 1994, 109(2): 213-222.
[17] ALVES T T, CERQUEIRA V R, BROWN J A. Early weaning of fat snook (Centropomus parallelus Poey 1864)larvae[J]. Aquaculture, 2006, 253: 334-342.
[18] PEDRO C J,FERNáNDEZ-DI?AZ C. Influence of co-feeding larvae with live and inert diets on weaning the sole Solea senegalensis onto commercial dry feeds[J]. Aquaculture,1999,174(3):255-263.
[19] RUYET J P, ALEXANDRE J C, THéBAUD L, et al. Marine fish larvae feeding:Formulated diets or live prey[J]. Journal of the world aquaculture society, 2007, 24(2): 211-224.
[20] KOLKOVSKI S, KOVEN W, TANDLER A. The mode of action of anemia in enhancing utilization of microdiet by gilthead sea bream Sparus aurata larvae[J]. Aquaculture, 1997, 155(1): 193-205.
[21] KOLKOVSKI S, ARIELI A, TANDLER A. Visual and chemical cues stimulate microdiet ingestion in sea bream larvae[J]. Aquaculture international, 1997, 5(6): 527-536.
[22] ROSENLUND G, STOSS J, TALBOT C. Co-feeding marine fish larvae with inert and live diets[J]. Aquaculture, 1997, 155: 183-191.
