不同外源激素处理对翅柃种子发芽的影响
2024-06-23马尚李雨朦王富河
马尚 李雨朦 王富河
摘要 为了提高翅柃种子的发芽率,以翅柃种子为材料,通过采用不同外源激素浸种,以探索促进翅柃种子萌发的方法。对翅柃种子的表型性状进行测定;用TTC染色法测定种子生活力;选用不同浓度(50、100、150、200 mg/L)的赤霉素(GA3)、吲哚乙酸(IAA)、萘乙酸(NAA)分别浸种1、2 h,对翅柃种子进行激素浸种处理,以清水浸种1、2 h为对照,在25 ℃恒温条件下观测翅柃种子的萌发情况。结果表明:翅柃种子呈三角形或不规则菱形,长0.8~1.0 mm,宽0.5~1.0 mm;翅柃种子生活力很低,仅为8%;翅柃种子经不同浓度激素处理后发芽率、发芽势、发芽时间有显著差异,NAA 150 mg/L浸种2 h发芽率7%,GA3 100 mg/L浸种时间1 h发芽率2%,IAA 200 mg/L浸种1 h发芽率4%,其余处理组合发芽率较低或均无发芽种粒。
关键词 翅柃;种子发芽;外源激素;发芽率
中图分类号 S722.3 文献标识码 A 文章编号 0517-6611(2024)11-0101-05
doi:10.3969/j.issn.0517-6611.2024.11.022
开放科学(资源服务)标识码(OSID):
Effects of Different Exogenous Hormone Treatments on Seed Germination of Eurya alata
MA Shang1,LI Yu-meng2,WANG Fu-he2
(1. Forestry Bureau of Pingqiao District, Xinyang, Henan 464100;2.Xinyang Agriculture and Forestry College,Xinyang,Henan 464100)
Abstract In order to improve the germination rate of Eurya alata seeds, we used different exogenous hormones to immerse the seeds in order to explore ways to promote the germination of Eurya alata seeds. The seed viability of Eurya alata was determined by TTC staining, and different concentrations of gibberellin (GA3),indole-3-acetic acid (IAA) and naphthylacetic acid (NAA) were used, seeds were soaked in water for 1 h and 2 h, respectively, and the germination of Eurya alata seeds was observed at 25 ℃. The results showed that the seeds were triangular or irregular rhombus, 0.8-1.0 mm in length and 0.5-1.0 mm in width.The germination percentage, germination potential and germination time of Eurya alata seeds treated with different concentrations of hormones were significantly different. The germination percentage of seeds treated with NAA 150 mg/L for 2 h was 7%, and that of seeds treated with GA3 100 mg/L for 1 h was 2%, the germination rate of seeds soaked with IAA 200 mg/L for 1 h was 4%, and other treatments have lower germination rates or no seeds germinated.
Key words Eurya alata;Seed germination;Exogenous hormones;Germination rate
基金项目 中央财政林业科技推广项目(GTH〔2020〕15号)。
作者简介 马尚(1988—),男,河南信阳人,工程师,从事园林、经济林栽培、林业生产技术推广研究。
收稿日期 2023-08-17
翅柃(Eurya alata)为山茶科(Theaceae)柃属(Eurya Thunb),常绿灌木或小乔木,雌雄异株,鲜叶可以制作成新型的信阳茶饮品,其功效神奇,但产量小,口感独特,因而价格昂贵,市场少见[1]。
信阳大茶沟当地茶农用翅柃古茶树的鲜嫩叶制作绿茶,当地群众称之为三棱枝茶、神仙茶,具有鲜浓、爽口、甜醇、芳香的口感特征,是不同于现有信阳茶的新品种“茶”,主要分布于信阳市浉河区境内鸡公山大茶沟[2]。信阳大茶沟翅柃古茶树的发现,填补了河南省没有古茶树的空白[3]。国外仅报道过同属中的尾尖叶柃(Eurya acuminata)、米碎花(Eurya chinecsis)、柃木(Eurya japonica)的栽培和繁殖方式,并应用于庭院绿化[4]。目前国内对柃属植物的研究报道多集中在翅柃作为蜜源植物或作为园林绿化树种2个方向[5]。
近年来,外源激素法对揭示种子休眠和萌发的调控机理具有重要作用,成为促进种子发芽研究的重要手段[6]。为了提高种子发芽率,生产中常采用外源激素浸种。叶青雷等[7]研究不同外源激素对桑树种子发芽的影响,研究表明,用GA3浸种处理可以有效解除秋雨桑种子休眠,促进其萌发。在一定浓度范围内,随着GA3浓度升高,秋雨桑种子发芽率显著提高。赵莹等[8]研究不同外源激素处理对长白松种子发芽的影响,选用不同浓度吲哚丁酸(IAA)、萘乙酸(NAA)及赤霉素(GA3)浸种 1、2 h对长白松种子进行预处理,以清水浸种1、2 h为对照,结果表明,用外源激素处理可以有效地提高长白松种子的发芽率和发芽势。因此,研究不同外源激素处理对翅柃种子发芽的影响是有必要的。经调查,信阳大茶沟翅柃古茶树结实量较大,但周边没有幼树或幼苗分布,说明翅柃种子在野外自然状态下很难正常萌发成苗;为了加快对这类野生资源开发[9],提高种子发芽率,该试验用GA3、IAA、NAA 3种外源激素对种子进行处理,共设置50、100、150、200 mg/L 4个浸种浓度,采用1、2 h 2个浸种时间,对照清水浸种,以筛选出较佳的激素浓度和浸种时间,找出促进翅柃种子发芽的最佳方法,探究不同外源激素及浸种时间对翅柃种子发芽率的影响。
1 材料与方法
1.1 试验材料
以翅柃种子为试验材料,于2022年9月在信阳大茶沟采摘,用于浸种的GA3、IAA、NAA、测定种子生活力的TTC以及用于消毒的高锰酸钾由信阳农林学院林学楼实验室提供。由于前期信阳农林学院林学院实验室已开展了翅柃发芽试验,结果表明种子只在25 ℃条件下才会发芽,因此设置试验温度为恒温25 ℃。
1.2 试验方法
1.2.1 试验设计。
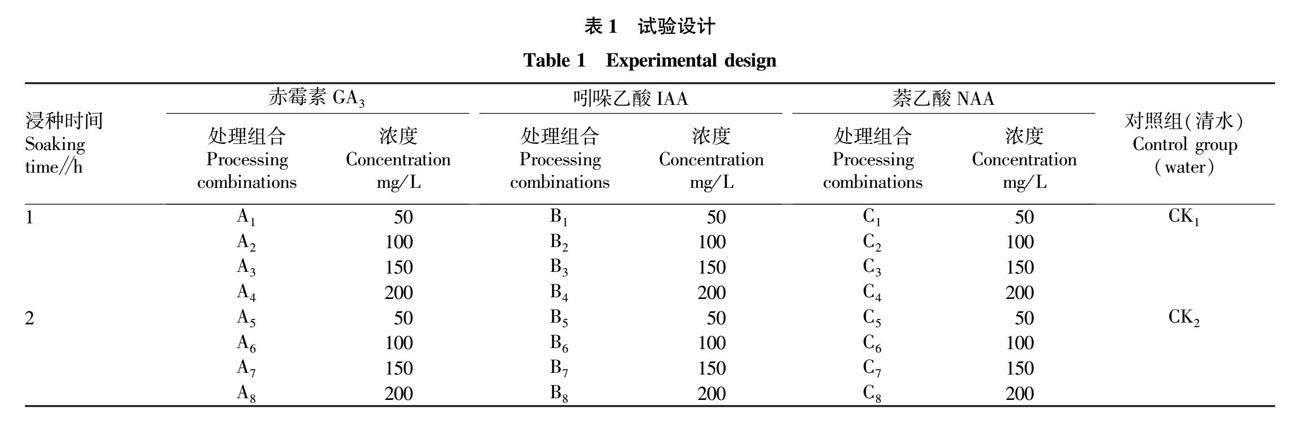
选用不同浓度的GA3、IAA、NAA对翅柃种子进行1、2 h浸种处理,观察翅柃种子在25 ℃恒温下的发芽情况。试验共设26个处理,每个处理100粒种子。试验设计见表1。
以清水浸种1、2 h为对照组(CK1、CK2)。浸种处理后取出种子均匀摆放在培养皿中,培养皿中铺设滤纸作为芽床[10]。放在25 ℃恒温箱中培养,每天喷洒少量蒸馏水保持种子湿润,记录发芽天数及发芽情况[11]。
1.2.2 消毒处理。
选用成熟度较好的果实,取出种子作为试验材料,选取种子100粒,共26组,将种子从果实中取出后,清水冲洗,用配制好的0.75%高锰酸钾溶液对种子进行3~4 h的浸种消毒。消毒后用清水冲洗5~6次,直至种子表面无高锰酸钾残留[12]。同时将需要用到的试验仪器清洗干净,放入无菌锅内灭菌。
1.2.3 激素处理。
将需要用到的GA3、IAA、NAA配制成相应的浓度,对翅柃种子分别进行1、2 h浸种,以清水浸种1、2 h为对照[13]。贴好标签,标明浸种浓度和浸种时间[14]。
1.2.4 试验方法。
将种子进行消毒,把需要用到的培养皿、镊子、烧杯、滤纸等放入灭菌锅内灭菌,将溶液配制成相应的浓度对种子进行浸种。培养皿中铺2层浸透水的滤纸,作为芽床[15]。将处理过后的种子整齐地摆放在培养皿中,贴好标签,注明日期及溶液浓度和浸种时间。放入25 ℃恒温箱中,每日喷水,保持芽床湿润。记录始发芽天数、发芽时长和每日发芽率。以种子发芽至胚根突破种皮为准[16]。以连续5 d无新种子萌发为发芽结束日期[17]。若出现新发芽种子,则适当延长发芽日期。
1.2.5 种子性状测定。
测定翅柃种子的表型性状,分别测定翅柃果实和种子的纵径、横径、单粒重和千粒重。随机选取翅柃种子,用精准游标卡尺测量种子的横径和纵径,1/1 000精准电子天平测种子重量,重复4次,以其平均值作为最终数据。采用百粒法测千粒重。
1.2.6 种子生活力测定。
种子生活力是指用化学或物理方法测定的种子的潜在发芽能力。根据国家标准《林木种子检验规程》( GB 2772—1999),采用TTC染色法检验种子生活力,随机选取100粒种子,清水浸种2 h后切开种子,将胚从顶端沿中线切成两半,取一半放入配制好的1.0% TTC溶液中,使其染色。染色后将种子清洗干净,对染色情况进行观察。有生活力的种子胚变成红色,而没有生活力的种子胚则不变色。
种子生活力按以下公式计算:
种子生活力=有生活力的种子数/供试种子总数×100%
1.2.7 种子发芽指标测定。
对翅柃种子进行发芽指标测定,试验结束后,计算翅柃种子在25 ℃恒温下的发芽率、发芽势、平均发芽时间及发芽指数。研究不同激素及其不同浓度处理下对种子萌发的影响[18]。
发芽率=供试种子发芽数/供试种子数×100%[19]
发芽势=规定时间内供试种子的发芽数/供试种子数×100%[19]
发芽指数:GI=∑(Gt/Dt)
式中:Gt为在t日内的发芽种子数;Dt为Gt所对应的发芽天数。
2 结果与分析
2.1 种子性状
对翅柃果实和种子的横径、纵径、单粒重、千粒重进行性状测定,结果见表2。由表2可知,翅柃的果实和种子较小,单个果实或种子之间差异不大,翅柃果实长3~5 mm,宽2~4 mm,成熟的果实呈灰褐色,为圆球形,表面有网纹。单个果实中有12~22粒种子,种子呈三角形或不规则菱形,长0.8~1.0 mm,宽0.5~1.0 mm,种子之间无显著差异。
2.2 种子生活力
用TTC染色法测定翅柃种子生活力,结果如图1所示。翅柃种子生活力表现较差,只有8%。
2.3 种子发芽率
2.3.1 GA3对翅柃种子发芽的影响。
在不同浓度和浸种时间下,用GA3对种子进行处理,观察分析种子在25 ℃恒温下发芽率的变化。由表3可知,GA3处理和对照组的发芽率、发芽势、发芽指数差异不大。处理A2的发芽率最高,为2%。处理A3、A6、A7发芽率为1%,与CK1、CK2相同,其余均无发芽种粒,相比较而言,种子发芽效果不显著。这说明GA3对促进翅柃种子萌发没有明显的效果。发芽势方面,除处理A2、A3,其余处理组合前期发芽势明显呈弱势状态,均无发芽种粒。处理A3,前期发芽势稳定,后期呈弱势。
从图2可以看出,GA3处理翅柃种子发芽率不高,发芽率最高的处理组合为浸种浓度100 mg/L,浸种时间1 h,发芽率为2%,随着浸种时间的延长及浸种浓度的升高,发芽率下降,浓度为100 mg/L,浸种时间为2 h时,发芽率为1%,较同一浓度下浸种时间为1 h降低1百分点;浓度为150 mg/L,浸种1、2 h,发芽率均为1%,较对照没有区别。浸种浓度为50和200 mg/L时,均无发芽种粒,表明GA3浓度过高或过低抑制种子萌发。试验数据表明,GA3对促进翅柃种子萌发效果不明显,不同处理浓度浸种1、2 h发芽率差异不大。
采用GA3不同浓度对种子进行1、2 h浸种处理,观察GA3处理下翅柃种子不同时间发芽率。从图3可以看出,翅柃种子发芽时间不整齐,同一浸种浓度不同浸种时间的始发芽天数差异明显,而发芽率相差不大,GA3处理翅柃种子最早发芽处理组合为A2和A3,发芽时间最早,22 d开始发芽。最晚发芽的处理组合为A7,48 d开始发芽。发芽高峰主要集中在30 d以后,34 d A2处理发芽率为2%。40 d时,A6处理的种子开始发芽。到了48 d,A7处理的种子开始发芽,此后没有新的种子发芽。试验表明,GA3处理翅柃种子同一浓度下浸种2 h的种子始发芽天数较长,而不同浓度浸种时间为1 h发芽天数较短。结果表明,同一浓度下的GA3溶液浸种时间缩短,最早发芽天数也缩短。
2.3.2 IAA对翅柃种子发芽的影响。
IAA不同浓度下对翅柃种子进行1、2 h的浸种处理,分析其在25 ℃恒温下发芽率的变化。发芽鉴定结果见表4。
由表4可知,IAA处理对促进翅柃种子萌发的效果不明显,处理B1、B2、B3、B5、B6、B7、B8均无发芽种粒,发芽率为0,较对照组发芽率降低,难以有效促进种子萌发,甚至抑制萌发。浸种浓度上升为200 mg/L时,处理B4的发芽率为4%,明显高于对照组发芽率。同一浸种浓度条件下IAA浸种1 h种子萌发效果较好,浸种2 h无发芽种粒,表明浸种时间过长抑制种子萌发。这说明IAA对解除种子休眠没有明显的效果,处理浓度偏小,处理时间过长都会抑制种子萌发。结果表明,处理浓度为200 mg/L,浸种时间为1 h可有效促进种子萌发,处理浓度过低,处理时间过长都会抑制种子萌发,说明IAA处理只有在一定浓度一定浸种时间下才能促进种子萌发。用第30天的种子发芽个数计算种子发芽势,可以看出,处理B4发芽势一直处于稳定状态,其余处理组合发芽势明显呈弱势状态,均无发芽种粒。
从图4可以看出,不同浓度IAA不同时间浸种发芽效果差异明显,不同浓度IAA浸种2 h均无发芽种粒,发芽率为0,表明浸种时间过长抑制种子萌发。低浓度IAA浸种1 h也无发芽种粒,表明低浓度IAA浸种时间较短也会抑制种子萌发。当IAA浓度增加到200 mg/L时,浸种时间为1 h,发芽率为4%,与同一浓度下浸种时间为2 h相比,差异明显。结果表明,IAA既能促进种子萌发又能抑制种子萌发,高浓度IAA浸种1 h有利于种子萌发。
用不同浓度IAA浸种1、2 h,观察翅柃种子在不同时间的发芽率。从图5可以看出,处理B4为唯一发芽组,20 d开始发芽,36 d发芽率为4%,36~54 d发芽率均为4%,其余处理组合均无发芽种粒。试验表明,IAA处理翅柃种子发芽时间较短,IAA浸种处理可以有效地缩短种子的萌发时间。浸种浓度为200 mg/L,浸种时间为1 h,可以有效打破翅柃种子休眠,缩短发芽时间,提高种子发芽率。
2.3.3 NAA对翅柃种子发芽的影响。
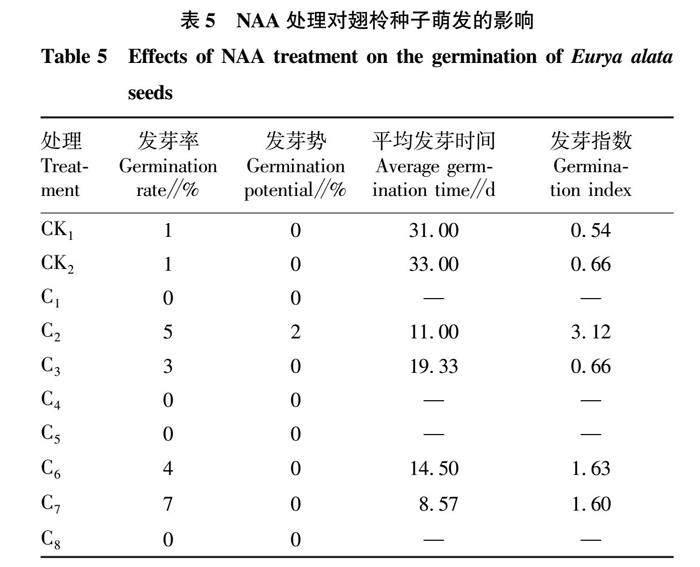
NAA不同浓度下对种子进行1、2 h的浸种处理,观察分析种子在25 ℃恒温下发芽率的变化,发芽鉴定结果见表5。由表5可知,NAA浸种处理对翅柃种子萌发效果明显,发芽率较对照组有明显提高,发芽率最高为处理C7(150 mg/L浸种2 h),发芽率为7%,与对照组相比,发芽率有了大幅提高。其次是处理C2(100 mg/L浸种1 h),发芽率为5%。处理C1、C4、C5、C8均无发芽种粒,表明NAA既能促进种子萌发,又能抑制种子萌发,浸种浓度及浸种时间对种子萌发有着极大影响,NAA一定浓度会抑制种子萌发,促进种子萌发效果最好的处理为C7,同种激素处理下发芽率表现为C7>C2>C6>C3。当浸种浓度为50和200 mg/L时,均无发芽种粒,发芽率为0,难以有效解除种子休眠,甚至抑制种子发芽。
用第30天的种子发芽个数计算种子发芽势,可以看出,处理C2发芽势呈稳定状态,处理C3(150 mg/L浸种1 h)、C6(100 mg/L浸种2 h)、C7(150 mg/L浸种2 h)试验前期发芽势呈弱势,试验后期迅速发芽,发芽势呈强势状态。其余各浓度种子发芽势均呈弱势。
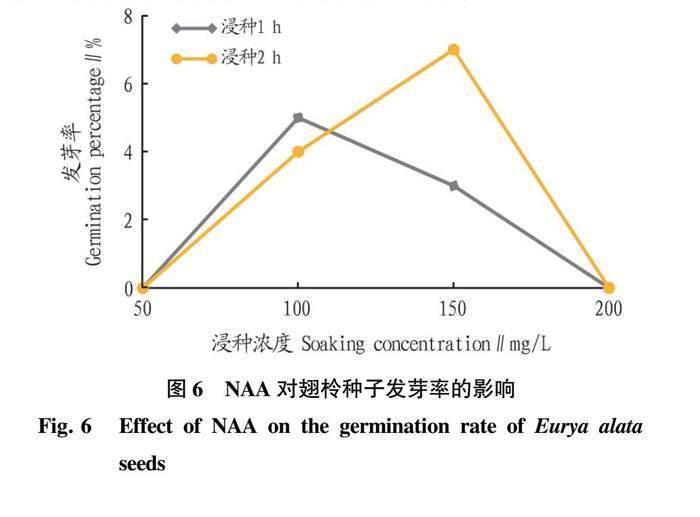
从图6可以看出,不同浓度NAA对翅柃种子进行1、2 h浸种处理发芽率差异明显,试验数据表明,浸种时间为2 h的发芽率明显高于浸种时间为1 h的发芽率,发芽率最高为150 mg/L浸种2 h,发芽率为7%,较同一浓度下浸种时间为1 h的发芽率明显提高。而浓度为100 mg/L时,不同浸种时间发芽率差异仅为1%。处理浓度为50和200 mg/L时,无发芽种粒。试验结果表明,NAA处理不仅促进了种子萌发,还能抑制种子萌发,且种子只在一定浓度一定浸种时间下才能发芽,浓度过高或过低则抑制种子萌发。
采用NAA不同浓度浸种1、2 h对翅柃种子进行处理,观察翅柃种子不同时间发芽率。从图7可以看出,NAA浸种处理翅柃种子发芽率
大部分超过对照组,发芽率表现良好。NAA处理翅柃种子最早发芽处理组合为C2,28 d开始发芽,发芽率为2%,最晚发芽处理组合为C7,46 d开始发芽,63 d时发芽结束,发芽延续期为35 d。萌发初期种子发芽率差异不大,发芽高峰主要集中在36 d以后,发芽较缓慢。36 d后,陆续有新种子发芽,到了54 d,处理C5发芽率为5%,此后该处理没有新种子发芽。处理C7的种子在46 d开始发芽,始发芽率为3%,58 d时,发芽率为7%,为发芽率最高组合。试验表明,NAA不具备缩短种子发芽时间的效果。
3 讨论与结论
3.1 讨论
该试验对翅柃种子性状及萌发特征进行调查分析,用GA3、IAA、NAA对翅柃种子进行处理,开展翅柃种子在25 ℃恒温下的发芽试验,研究不同激素处理对翅柃种子萌发产生的影响。
(1)千粒重可以反映种子饱满度,间接反映种子的大小和养分含量等,与种子发芽有直接或间接的关系,翅柃种子千粒重只有0.076 g,说明种子内所含营养物质很少。单个果实或种子之间性状无明显差异,种子很小,只有1 mm。
(2)翅柃种子生活力表现较差,仅为8%。
(3)发芽试验结果表明,激素处理对种子萌发效果显著,不同浓度激素处理下种子的发芽率存在差异。其中,GA3处理对促进翅柃种子萌发没有明显的效果,IAA、NAA都具有促进和抑制种子萌发的特性。
(4)翅柃种子发芽延续时间较长,且不整齐,可能与外界环境有关,如温度、光照、水分等以及在秋冬季不易萌发相关。
3.2 结论
该试验数据可以看出,翅柃种子的生活力不高,因此发芽率也不高。发芽率是衡量种子萌发能力的重要指
标,但由于翅柃种子发芽延续时间较长,且不规则,在不同激素处理,不同浸种浓度,不同浸种时间下种子发芽率并不完
全一致。激素处理可有效提高种子发芽率,但增加幅度不随
激素浓度及浸种时间的增加而增大,只有在一定浓度和时间范围内,激素处理才能提高种子活力,促进种子萌发。该试验结果表明,150 mg/L NAA浸种2 h发芽效果最好,发芽率为7%。不同处理对发芽率的促进效果依次为C7>C2>B4>C6>C3>A2>A3>A6>A7>CK。
该试验结果表明,外源激素处理对打破翅柃种子休眠起着重要作用,只有经过一定浓度和浸种时间的处理,才能提高翅柃种子的发芽率。不同种类和浓度的外源激素对翅柃种子的影响也不相同,因此要选择合适的浸种激素和浸种浓度。NAA是该研究促进种子萌发的重要外源激素,激素浓度为150 mg/L,浸种时间为2 h时,可促进翅柃种子萌发,提高翅柃种子发芽率。
参考文献
[1]杨乐,乔良,赵师成,等.信阳翅柃古茶的主要营养成分分析[J].福建茶叶,2019,41(5):11-12.
[2] 赵师成,阎腾飞.信阳大茶沟翅柃古茶树生态学特性研究[J].信阳农林学院学报,2016,26(3):99-103.
[3] 王富河,赵师成,申明海,等.信阳大茶沟翅柃古茶树植物学、生态学特征及其资源现状、保护和利用调查[J].河南农业科学,2016,45(8):43-48.
[4] 潘健,程家寿,汤庚国.翅柃扦插繁殖技术研究[J].林业科技,2005,30(5):52-54.
[5] 王富河,赵师成,阎腾飞,等.信阳大茶沟翅柃古茶茶叶品质评价[J].河南农业科学,2016,45(7):44-48.
[6] 何兴佳,曾双,袁丽伟,等.不同浓度外源激素浸种对西葫芦种子萌发及幼苗生长的影响[J].北方园艺,2018(21):6-12.
[7] 叶青雷,李志,王立志,等.不同外源激素对桑树种子发芽的影响[J].黑龙江农业科学,2015(11):78-80.
[8] 赵莹,金慧,尹航,等.不同外源激素处理对长白松种子发芽能力的影响[J].北华大学学报(自然科学版),2017,18(6):722-726.
[9] 潘健. 柃属植物资源及繁殖技术的研究[D].南京:南京林业大学,2004.
[10] 刘华,蒋齐,李如来,等.不同植物激素对甘草种子萌发的影响研究[J].宁夏农林科技,2013,54(2):19-21.
[11] 李晓宇,蔺吉祥,穆春生,等.外源植物激素对羊草种子形成及萌发的影响[J].中国农学通报,2012,28(23):11-14.
[12] 刘广超,田晓玲,王孟军,等.不同激素处理对百合花杜鹃种子萌发的影响[J].贵州林业科技,2020,48(2):24-26,56.
[13] 刘兴,马萧萧,杨晓,等.不同激素处理对刺萼龙葵种子萌发的影响[J].河南农业,2019(35):24-25.
[14] 马红媛,梁正伟,黄立华,等.4种外源激素处理对羊草种子萌发和幼苗生长的影响[J].干旱地区农业研究,2008,26(2):69-73.
[15] 凌莉芳,李莲芳,杨文君,等.激素浸种对不同家系滇青冈种子发芽的影响[J].种子,2018,37(11):11-15.
[16] 阿依买木·沙吾提,吐尔逊江·买提玉苏甫.不同处理对荠菜种子休眠与萌发的影响[J].北方园艺,2009(5):84-85.
[17] 龙治坚,范理璋,徐刚,等.外源激素对珍稀濒危植物距瓣尾囊草种子萌发的影响[J].种子,2015,34(3):27-29,35.
[18] 翟书华,杨晓虹.不同激素处理对海菜花种子萌发特性的影响[J].种子,2017,36(8):72-74.
[19] 闫艳华.不同外源激素处理对曼陀罗种子萌发及幼苗生长的影响[J].北方园艺,2020(23):115-122.
