即食肉制品中分离的科氏葡萄球菌科氏亚种HT-26及其快速检测分子标识筛选
2024-06-17钱澄倩杜宇辉纪耀勇黄艳蒙李贤信
钱澄倩 杜宇辉 纪耀勇 黄艳蒙 李贤信
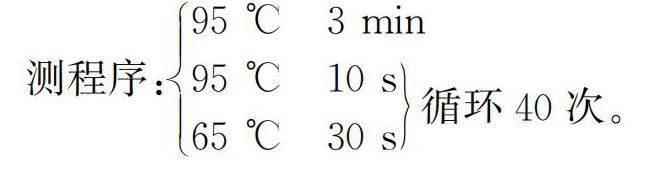
摘要:科氏葡萄球菌是一种皮肤共生菌,但在一定条件下也可引起炎症和疾病,常分布于人类、畜牧动物、食品等环境中。该研究从市售即食肉制品中分离得到一株科氏葡萄球菌HT-26,经分析鉴定该菌株属于科氏葡萄球菌科氏亚种(SCC)。由于SCC与其近源菌种的基因组序列相似度高,因此SCC的快速特异性检测存在一定困难。该研究基于比较基因组学分析找到4段SCC特异性序列,并筛选和验证得到一对高效特异性检测引物,可实现最低27 CFU/mL浓度的SCC检测,且可有效应用于即食肉制品中,最低检测限可达115 CFU/g。对即食肉制品或其他食品实行SCC的快速特异性检测可加强调味品中微生物污染防治监控,进一步加强食品安全保障。
关键词:科氏葡萄球菌;科氏葡萄球菌科氏亚种;SCC;qRT-PCR;即食肉制品
中图分类号:TS251.5
文献标志码:A
文章编号:1000-9973(2024)06-0157-05
Staphylococcus cohnii subsp. cohnii HT-26 Isolated from Instant Meat
Products and Screening of Its Rapid Detection Molecular Marker
QIAN Cheng-qian1,2,3, DU Yu-hui1, JI Yao-yong3,
HUANG Yan-meng3, LI Xian-xin2,3,4*
(1.School of Biological Science and Engineering, South China University of Technology,
Guangzhou 511400, China; 2.Foshan Haitian Flavoring & Food Co., Ltd., Foshan 528000,
China; 3.Branch Office of Tianyan (Tianjin) High-Tech Co., Ltd., Foshan 528000,
China; 4.Foshan Haitian (Gaoming) Flavoring & Food Co., Ltd.,
Foshan 528500, China)
Abstract: Staphylococcus cohnii is a kind of skin symbiotic bacterium, but it can also cause inflammation and diseases under certain conditions. It is commonly distributed in the environments such as humans, livestock and food. In this study, a strain of Staphylococcus cohnii HT-26 is isolated from commercially available instant meat products. After analysis, it is identified that the strain belongs to Staphylococcus cohnii subsp. cohnii (SCC). Due to the high similarity of genomic sequences between SCC and its close-related species, there are certain difficulties in the rapid and spectific detection of SCC. In this study, based on comparative genomics analysis, four SCC specific sequences are found, and a pair of efficient specific detection primers is screened and verified, which can achieve SCC detection at the minimum concentration of 27 CFU/mL and can be effectively applied in instant meat products, with the minimum detection limit of 115 CFU/g. Implementing rapid and specific SCC detection on instant meat products or other foods can strengthen the prevention and monitoring of microbial contamination in seasonings and further enhance food safety assurance.
Key words: Staphylococcus cohnii; Staphylococcus cohnii subsp. cohnii; SCC; qRT-PCR; instant meat products
收稿日期:2023-12-30
基金项目:广东省调味食品生物发酵先进技术企业重点实验室开放基金项目(2017B030302002)
作者简介:钱澄倩(1992—),女,博士,研究方向:微生物检测技术和分子机制。
*通信作者:李贤信(1984—),男,工程师,硕士,研究方向:食品安全检测技术。
科氏葡萄球菌(Staphylococcus cohnii)是凝固酶阴性葡萄球菌中的一种革兰氏阳性菌,于1975年被正式划分并命名[1],广泛分布于多种食品样本,如猪肉、鸡肉、鱼类制品、芝士等[2-4]中,在一定条件下可引起人体感染并引发脑膜炎、菌血症等疾病[5-6],且具有多种耐药性[7-8],已逐渐引起世界卫生组织的关注。
科氏葡萄球菌根据表型特征差异又细分为两个亚种:科氏亚种(Staphylococcus cohnii subsp.cohnii,SCC)和解脲亚种(Staphylococcus cohnii subsp.urealyticum,SCU)[9]。随着比较基因组学分析和系统发育分析的发展,SCU被独立划分为解脲葡萄球菌(Staphylococcus urealyticus,SU),而科氏葡萄球菌重新细分为两个亚种:科氏亚种(SCC)和巴氏亚种(Staphylococcus cohnii subsp. barensis,SCB)[10]。科氏葡萄球菌为物种复合群,其近源菌种SU和亚种SCC、SCB的全基因组序列具有高度相似性,为SCC的特异性快速检测带来较大困难。
随着食品和调味品行业的发展,越来越多的即食型肉制品进入消费者市场。生产过程中除常规优势生产菌株的参与之外,往往也会引入一些污染菌种。从市售的火腿、中式腊肠中曾分离出多种葡萄球菌[11-13],经生化反应鉴定为表皮葡萄球菌、溶血性葡萄球菌等条件致病菌。本研究从市售即食肉制品中分离得到一株科氏葡萄球菌HT-26,经分析鉴定该菌株属于科氏葡萄球菌科氏亚种(SCC)。
目前,食品和调味品生产企业、产品质量监督检验局等单位通常按照中华人民共和国国家标准检验方法进行菌落总数、大肠菌群、致病菌(包括志贺氏菌、沙门氏菌、金黄色葡萄球菌)的通用型检测[14],检测耗时长且缺少对特定品类中特定微生物的检测和风险预警。本研究基于比较基因组学筛选得到了科氏葡萄球菌科氏亚种SCC的特异性分子标识,并开发了针对SCC的快速检测方法,可在4 h内完成即食肉制品中SCC的快速检测,有助于加强肉制品及相关调味品生产过程中的微生物安全监控。
1 材料和方法
1.1 材料
即食肉制品样本:购自佛山各大商超。
菌株:HT-26、HT-17、HT-23、HT-11、HT-13、HT-15、HT-24为实验室保藏菌种;Staphylococcus urealyticus DSM 6718购自DSM菌种保藏中心。
1.2 试剂
平板计数琼脂(PCA)培养基:广东环凯生物科技有限公司;SYBR Green Mix:Bio-Rad Laboratories;细菌基因组DNA提取试剂盒:西安天隆科技有限公司;无酶水:上海碧云天生物技术股份有限公司;引物:安升达(南京)生命科学技术有限公司。
1.3 主要仪器与设备
恒温培养振荡器、恒温培养箱 北京东联哈尔仪器制造有限公司;全自动核酸提取仪 西安天隆科技有限公司;荧光定量PCR仪 Bio-Rad Laboratories。
1.4 方法
1.4.1 样本收集和菌株分离纯化
从佛山各大商超购买不同品牌及类型的即食肉制品共计65个,根据GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法对各样本进行菌落培养。逐一挑取培养皿上所有可见菌落并进行平板划线,将划线后的平板倒置于37 ℃恒温培养箱中静置培养48 h,待形成可见菌落后继续挑取1~2个单菌落进行平板划线。共重复3次平板划线操作,在第3次划线平板上各挑取1个单菌落进行菌种鉴定、培养和保藏。
1.4.2 菌种测序和鉴定
分别取待鉴定菌株纯培养液各10 mL,于12 000 r/min离心5 min,弃上清液后保留菌体沉淀,并将菌体沉淀样本寄送至北京诺禾致源科技股份有限公司进行细菌框架图测序和分析。利用本地化BLAST对各分离株框架序列进行比对分析,完成各分离株的初步菌种鉴定。
1.4.3 系统发育分析和特异序列片段筛选
下载NCBI基因组数据库中科氏葡萄球菌和解脲葡萄球菌类别下的所有基因组,共计95个,与HT-26基因组序列一起进行单拷贝直系同源核心基因分析。利用OrthoFinder 2软件寻找96个基因组中的同源蛋白组,并提取出核心基因群、辅助基因群和菌株特异基因群序列。根据单拷贝核心基因中的单核苷酸多态性,利用MEGA 7软件构建最大似然树。
对96个基因组中的蛋白编码序列进行TBLASTn比对检索,筛选科氏葡萄球菌科氏亚种特异的编码蛋白序列,一致性≥60%,E值<1e-10。随后将筛选得到的蛋白序列结果进行TBLASTn在线比对验证,剔除出现在其他菌种中的同源结果序列后得到科氏葡萄球菌科氏亚种的特异序列片段。
1.4.4 荧光定量PCR检测
利用全自动核酸提取仪(GeneRotex 96)及其配套细菌基因组DNA提取试剂盒(西安天隆科技有限公司,货号T031(XZHC))提取待检样本DNA,具体操作步骤和程序设置按照试剂盒说明书进行,最后将提取的DNA转移至无菌无酶离心管中备用。将提取的DNA与对应检测引物按比例混合后进行实时荧光定量PCR检测,每个检测设置3个平行,体系配比:SYBR Green Mix:5μL;上游引物F:0.5μL;下游引物R:0.5μL;无酶水:1μL;DNA模板:3μL。
以96孔板为检测载体,待体系加装完毕后进行封膜,并通过瞬时离心使孔壁上的溶液流至底部。随后将待检测的96孔板放入实时荧光定量PCR仪进行检测,检测程序:95 ℃ 3 min
95 ℃ 10 s
65 ℃ 30 s循环40次。
2 结果与分析
2.1 HT-26菌株的分离鉴定和系统进化分析
从65个即食肉制品样本中共分离纯化得到40株菌株。基因组框架图测序和比对结果表明31株(75%)属于芽孢杆菌属,4株(10%)属于葡萄球菌属,其中HT-26初步比对鉴定结果为科氏葡萄球菌。
对NCBI公共数据库中下载的50个包含HT-26在内的科氏葡萄球菌(SC)基因组和46个解脲葡萄球菌(SU)基因组进行比对分析并构建系统发育树,见图1。
由图1可知,该系统发育树中形成了3个主要进化簇:SU、SCC、SCB。框线标注的为本研究分离纯化得到的科氏葡萄球菌HT-26,在系统发育树上位于SCC进化簇中,表明HT-26属于科氏葡萄球菌科氏亚种(SCC)。
2.2 SCC的特异性分子标识筛选
通过生物信息学比对分析找到了SCC亚种的特异性基因序列,这些特异性序列保守存在于所有SCC基因组中,但不存在于其他菌种(亚种)基因组中。共筛选得到4段SCC特异性序列(见表1),可作为SCC特异性快速检测分子标识的候选基因片段。基于Q1~Q4 4段序列,设计并合成了5对实时荧光定量PCR引物,引物序列见表2。
利用上述5对引物对HT-26的DNA及阴性对照样本进行检测,检测结果见表3和图2。
由表3和图2可知,引物对P2和P4在HT-26 DNA样本中的检测灵敏度低,虽然P5在HT-26 DNA样本中的检测灵敏度高,但是其在阴性对照中存在非特异性扩增,因此以上3对引物不可用于SCC的快速检测。P1和P3均可实现阳性样本的灵敏检测,且不存在非特异性扩增,所以这两对引物均可作为SCC快速检测的候选引物。本研究选取检测灵敏度更高的P3进行后续检测验证。
2.4 SCC快速检测引物的特异性验证
用2.3中筛选得到的P3分别检测HT-26、SU DSM 6718、HT-17、HT-23、HT-11、HT-13、HT-15、HT-24和阴性对照的过夜纯培养液核酸提取物,检测结果见表4和图3,仅HT-26出现扩增曲线和Ct值,其他非SCC菌均无检出,表明P3具有良好的SCC特异性,可用于SCC的快速检测。
2.5 SCC快速检测引物的检测限
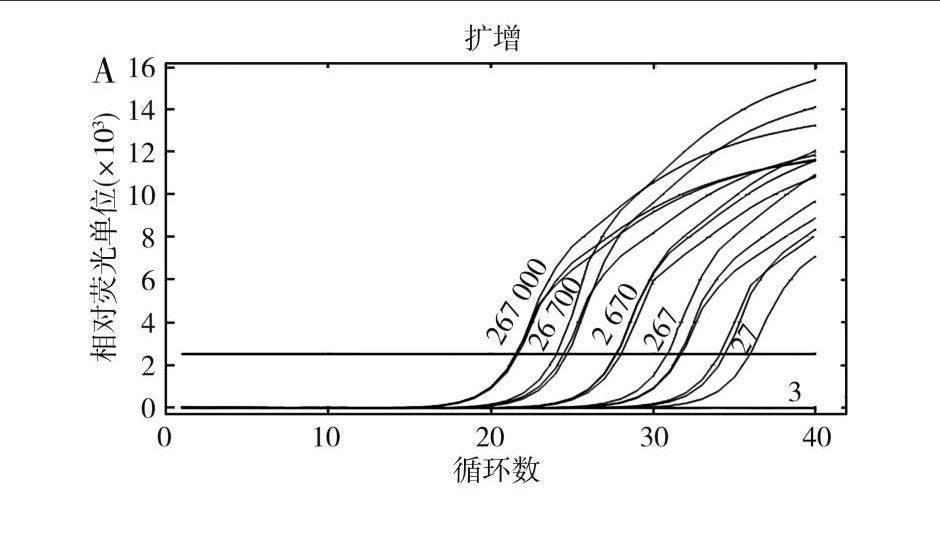
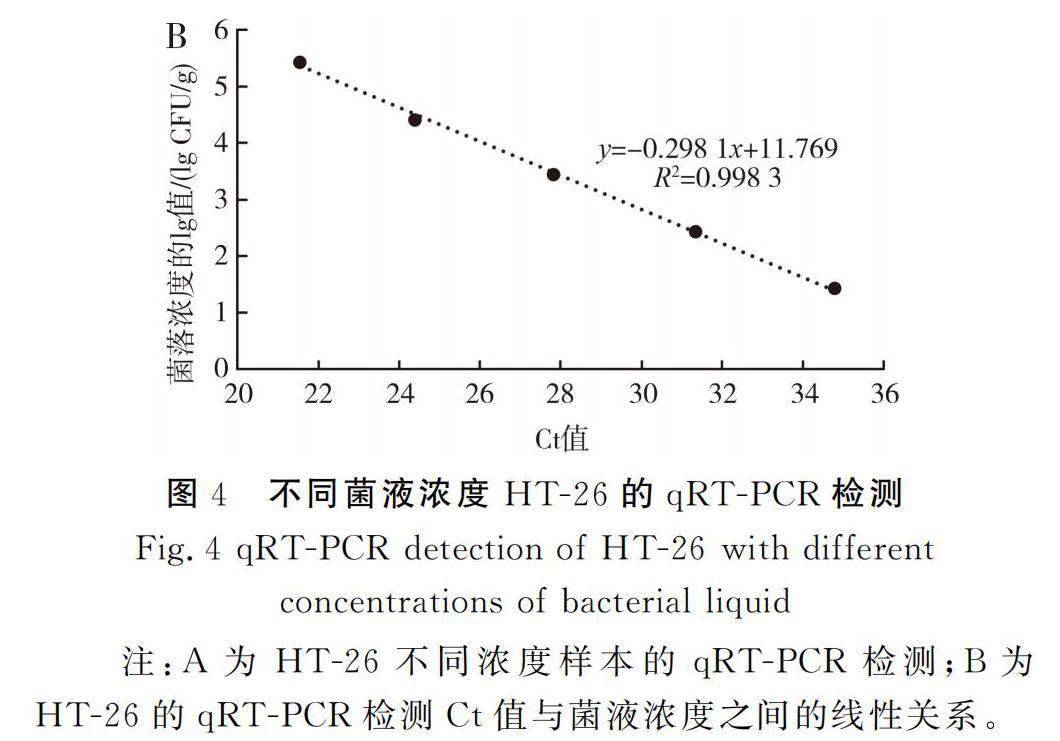
对HT-26纯培养菌液进行十倍梯度稀释并提取DNA作为检测模板,利用P3进行qRT-PCR检测。各样本菌液浓度和检测Ct值见表5和图4中A,检测结果表明P3可有效检测到27 CFU/mL及以上菌液浓度样本,且Ct值与菌液浓度间存在较好的线性关系,R2>0.99(见图4中B),表明P3在SCC快速检测中效果稳定,最低检测限可达27 CFU/mL。
2.6 即食肉制品中SCC的快速检测
为验证P3是否能够在即食肉制品这类具有复杂背景干扰的样本中实现SCC的准确检测,本研究将HT-26纯培养稀释液反添加于无菌即食肉制品均质中并进行平板菌落计数和qRT-PCR检测,以无菌即食肉制品为阴性对照。平板菌落计数结果显示即食肉制品中HT-26反添加后菌液浓度为115 CFU/g,对该阳性样本进行3次独立重复取样和qRT-PCR实验,3次检测均出现特异性扩增曲线(见图5),平均Ct值为33.70,SD=0.198,C.V.=0.59%,同时阴性对照样本中无扩增。以上结果表明,特异性引物P3可实现即食肉制品样本中SCC的快速稳定检测,最低检测限为115 CFU/g。
3 结论
本研究从65个市售即食肉制品样本中分离得到一株科氏葡萄球菌并命名为HT-26,经基因组测序和系统发育分析确定HT-26属于科氏葡萄球菌科氏亚种(SCC)。通过生物信息学比对分析找到了4个SCC特异性序列片段,并设计和筛选出了一对可用于SCC特异性快速检测的qRT-PCR引物(F:5′-GATGCTCC-AGGGGAAGAGTT-3′;R:5′-ACTTCTTCTGCGTCG-TTTTTGT-3′)。该对引物在SCC纯菌培养液中最低可检测到27 CFU/mL菌液浓度样本,在即食肉制品中最低检测限为115 CFU/g,且可在4 h内完成检测,所需时间仅为传统培养法(48 h)的8%,有助于高效监控肉制品生产过程中各环节、物料、环境、人员等的SCC污染风险,加强食品安全检测和监督,保障产品安全。
除即食肉制品外,本研究开发的SCC快速特异性qRT-PCR检测引物也可应用于其他食品相关产品和场景。近几年,国内学者从猪、鸭、鸡、貂等不同畜禽源中均分离得到科氏葡萄球菌[15-20],除貂以外,猪、鸭和鸡均为日常肉源,源头污染可能会引发科氏葡萄球菌的食源性感染。因此,本研究成果可应用于禽畜养殖场,在帮助确认病体禽畜微生物感染源的同时也可有效监控食用肉源的微生物安全风险,从源头上降低科氏葡萄球菌的食品污染风险。同时,随着健康消费需求的升级,调味品行业也在不断推陈出新。畜产动物风味天然浓缩提取物在逐渐替代化学合成物,多类复合调味酱中直接添加肉颗粒以增加风味和营养,鱼肉熬制的鱼露、鱼酱等调味品也为消费者提供了更多选择。此外,日渐火热的预制菜行业也离不开禽畜类肉制品。因此,当今与禽畜渔业联系更为紧密的调味品行业和新兴预制菜行业也可将本研究成果应用于相关原料、生产环境及产品中的科氏葡萄球菌风险监控。
不同品类待测样本的组分背景差异可能会对扩增引物产生干扰,因此当本研究所述的检测引物不适用于某些待检样本时,亦可通过本研究所述的4个科氏葡萄球菌科氏亚种特异性片段筛选其他引物序列。
综上所述,本研究通过比较基因组学分析和实验验证,筛选得到了科氏葡萄球菌科氏亚种的特异性检测分子标识,为食品和调味品行业中该风险菌种的快速特异性检测提供了可选方法和参考,有助于进一步加强微生物风险把控,保障食品安全。
参考文献:
[1]SCHLEIFER K H, KLOOS W R. Isolation and characterization of Staphylococci from human skin. I.Amended descriptions of Staphylococcus epidermidis and Staphylococcus saprophyticus and descriptions of three new species: Staphylococcus cohnii, Staphylococcus haemolyticus, and Staphylococcus xylosus[J].International Journal of Systematic & Evolutionary Microbiology,1975,25(1):50-61.
[2]DEETAE P, BONNARME P, SPINNLER H E, et al. Production of volatile aroma compounds by bacterial strains isolated from different surface-ripened French cheeses[J].Applied Microbiology and Biotechnology,2007,76(5):1161-1171.
[3]DEVI K R, DEKA M, JEYARAM K. Bacterial dynamics during yearlong spontaneous fermentation for production of ngari, a dry fermented fish product of Northeast India[J].International Journal of Food Microbiology,2015,199:62-71.
[4]ZENG Z L, WEI H K, WANG J, et al. High prevalence of Cfr-producing Staphylococcus species in retail meat in Guangzhou, China[J].BMC Microbiology,2014,14(1):151.
[5]SZCZUKA E, JABNON'SKA L, KAZNOWSKI A. Coagulase-negative Staphylococci: pathogenesis, occurrence of antibiotic resistance genes and in vitro effects of antimicrobial agents on biofilm-growing bacteria[J].Journal of Medical Microbiology,2016,65(12):1405-1413.
[6]MENDOZA-OLAZAR?N S, GARCIA-MAZCORRO J F, MORF?N-OTERO R, et al. Draft genome sequences of two opportunistic pathogenic strains of Staphylococcus cohnii isolated from human patients[J].Standards in Genomic Sciences,2017,12(1):49.
[7]MOAWAD A A, HOTZEL H, AWAD O, et al. Evolution of antibiotic resistance of coagulase-negative Staphylococci isolated from healthy turkeys in Egypt: first report of linezolid resistance[J].Microorganisms,2019,7(10):476.
[8]SONG Y, LYU Y, CUI L, et al. cfr-mediated linezolid-resistant clinical isolates of methicillin-resistant coagulase-negative Staphylococci from China[J].Journal of Global Antimicrobial Resistance,2017,8:1-5.
[9]KLOOS W E, WOLFSHOHL J F. Staphylococcus cohnii subspecies: Staphylococcus cohnii subsp. cohnii subsp. nov. and Staphylococcus cohnii subsp. urealyticum subsp. nov.[J].International Journal of Systematic Bacteriology,1991,41(2):284-289.
[10]LAVECCHIA A, CHIARA M, DE VIRGILIO C, et al. Comparative genomics suggests a taxonomic revision of the Staphylococcus cohnii species complex[J].Genome Biology and Evolution,2021,13(4):20.[11]于长青,任泊晓,张丽娜,等.传统发酵肉制品中葡萄球菌的分离、纯化和筛选[J].中国农学通报,2006(11):343-346.
[12]赵九飞,刘章武.发酵肉制品中葡萄球菌的分离、鉴定[J].中国调味品,2011,36(3):87-90.
[13]郑培君,郑琳,齐明,等.分离自广式腊肠的葡萄球菌对腊肠色泽形成的影响[J].中国调味品,2014,39(7):42-46,66.
[14]万红梅,万凤英,黄琼,等.德阳市调味品微生物检测结果与分析[J].中国调味品,2011,36(4):87-88.
[15]董文龙,王琦,王巍,等.猪源科氏葡萄球菌的分离与鉴定[J].中国兽医学报,2017,37(3):475-478.
[16]杜旭升,李根,成子强.鸭传染性皮炎的诊断与控制[C]//中国兽医病理学2017年学术研讨会暨兽医病理学分会第九次全国会员代表大会论文集,2017:197-207.
[17]杨军.鸭源葡萄球菌分离鉴定、毒力基因检测及与致病性相关性研究[D].武汉:华中农业大学,2014.
[18]关乃瑜,魏成威,赵丽丽,等.貂源科氏葡萄球菌的分离鉴定与系统发育分析[J].中国兽医科学,2015,45(8):787-793.
[19]朱利霞,王洪彬,赵希艳,等.水貂科氏葡萄球菌和缓慢葡萄球菌混合感染的病原分离鉴定与药敏试验[J].动物医学进展,2019,40(10):115-121.
[20]李根,韩林臻,杜旭升,等.商品肉鸡中J亚群禽白血病病毒与科氏葡萄球菌、肠炎沙门氏菌的混合感染[C]//中国畜牧兽医学会兽医病理学分会、中国病理生理学会动物病理生理专业委员会、中国实验动物学会实验病理学专业委员会2016年学术研讨会论文集,2016:82.
