水稻矮秆迟抽穗突变体d534 的性状及其对赤霉素的敏感性分析
2024-06-16曾建光刘桃李孙林娟袁定阳黄钰博金晨钟谭炎宁
曾建光 刘桃李 孙林娟 袁定阳 黄钰博 金晨钟 谭炎宁


摘要:水稻半矮秆突变体在株型改良和高产育种中具有重要价值。前期通过辐射诱变籼稻品种五山丝苗(R534)获得了半矮秆且抽穗期延迟突变体d534,分析了d534 的表型、遗传模式和GA3敏感性。大田性状分析发现,和野生型R534相比,d534 的抽穗期延迟了7 d,株高下降了29.22 cm,降幅为26.86%。d534 的穗及倒1至倒5节都明显缩短,长度分别为野生型的71.27%、68.75%、70.18%、85.17%、77.86%和71.18%,说明d534 的目的基因调控穗及茎节的伸长。遗传分析发现,d534 的矮化和迟抽穗性状受同一核基因控制,呈隐性遗传。内源GA3含量测定发现,一叶一心期d534 茎中GA3含量为0.17 ng·g?1,比R534降低了60.47%,表明d534 的矮化与内源GA3合成不足有关。用25和50 mg·L?1外源GA3处理一叶一心期幼苗5 d,d534 的株高比未处理组(0 mg·L?1 GA3)增加了71.76%和74.98%,且超过了未处理组R534的株高,说明外源GA3能回补d534 的株高表型;qRT-PCR分析发现,与R534相比,d534 茎和叶中OsGA20ox2 和OsGA3ox2 基因表达水平均显著下调,表明d534 内源GA3合成不足可能与OsGA20ox2 和OsGA3ox2 基因表达水平下调有关。明确了d534 是茎节缩短且内源GA3积累不足的矮化突变体,为解析d534 半矮秆性状形成的生物学机理奠定了基础。
关键词:水稻;d534 突变体;半矮秆;迟抽穗;赤霉素
doi:10.13304/j.nykjdb.2023.0649
中图分类号:S511,Q78 文献标志码:A 文章编号:1008‐0864(2024)03‐0007‐08
水稻经济产量由生物学产量和收获指数共同决定,株型改良是水稻高产育种的重要内容。与高秆品种相比,半矮秆品种收获指数较高,耐肥、抗倒性较强,便于机械化收割,已在生产上得到了大面积应用[1]。半矮秆品种的推广应用引领了“第一次绿色革命”,我国半矮秆水稻育种研究始于20世纪五六十年代。1959年,华南农业科学研究所(现广东省农业科学院)利用‘矮仔占与‘广场13杂交培育出半矮秆优质稻品种‘广场矮,随后又选育出‘珍珠矮‘广解9‘广陆矮系列高产优质半矮秆水稻矮生品种,并在华南地区大面积推广[2]。1966年,国际水稻研究所利用‘低脚乌尖与‘皮泰杂交,成功培育出优良的半矮秆品种‘IR8,使东南亚的水稻产量显著提高[3]。
水稻的半矮化主要与赤霉素的合成不足或信号转导受阻有关。赤霉素的生物合成以牻牛儿基牻牛儿基焦磷酸为前体,先后经内根-古巴焦磷酸合成酶(copal pyrophosphat esynthase,CPS)、内根-贝壳衫烯合成酶(ent-kaurene synthase,KS)、内根-贝壳衫烯氧化酶(ent-kaurene oxidase,KO)和内根-贝壳衫烯酸氧化酶(ent-kaurenoic acid oxidase,KAO)等的作用逐步转变为GA12,GA12再经相关氧化酶催化形成GA3和GA1等不同形式的赤霉素[4]。在水稻中,D35编码KO酶,该基因突变将显著降低GA12的水平而产生极端矮秆表型[5];SD1[6]和D18[7]基因分别编码GA20氧化酶(GA20ox)和GA3氧化酶(GA3ox),其突变将导致活性GA不足而产生半矮秆表型。赤霉素信号转导通路涉及信号感知、转导及下游基因的响应过程,其核心模块是GAGID1-DELLA[8]。GID1 是可溶性GA 受体蛋白,GID1 突变将导致植株对外源GA 不敏感[9];GID2参与DELLA 蛋白的泛素化降解,GID2 突变将抑制下游GA 响应基因的表达,导致株高极端矮化[10]。
目前,已经利用多种诱变技术获得了大量的水稻矮化、半矮化突变体,借助这些突变体实现了对赤霉素代谢途径和株高遗传调控网络的深入认识。研究发现,矮化可能伴发分蘖数[11]、叶型[12]、叶色[13]等性状的变异,但引发花期变异的现象少有报道。本课题组前期通过辐射诱变五山丝苗(R534)获得了矮化且抽穗延迟的突变体d534,但d534 的生理和遗传机制还不清楚。为此,本研究对d534 的表型、遗传和赤霉素敏感性进行了分析,以期为揭示水稻株高降低的形态学和生理学成因奠定基础。
1 材料与方法
1.1 试验材料
五山丝苗(R534)是我国南方稻区常用的籼稻恢复系[14],2018年委托湖南省农业生物辐照工程技术研究中心利用0.30 KGY剂量的60Co-γ辐射R534的成熟种子。参照谭炎宁等[15]的种植和收获方法,从M2中筛选到1株半矮秆单株,连续自交4代得到稳定遗传株系,命名为d534。
1.2 表型考查
2022年6月1日,在长沙县黄花镇试验基地同批播种野生型R534和半矮秆突变体d534,6月21日单本移栽大田,每个材料种50株。记载材料的抽穗期;成熟期选取5个单株,测量有效穗和各单株主分糵的株高,分别统计穗和各茎节的长度及主茎各茎节的直径。
1.3 遗传分析
2021年3月—2022年9月,在海南三亚和湖南长沙试验基地分别种植d534 与R534 正交(d534/R534)和反交(R534/d534)后的F1和F2群体。统计F1、F2 群体中突变型(矮化迟抽穗)、野生型(正常株高正常花期)单株的数量,并运用卡方检验(χ20.05≤3.84)分析突变型与野生型单株的理论分离比[16],推测遗传方式。
1.4 内源GA3含量测定
采用液相色谱- 串联质谱法(liquidchromatography tandem mass spectrometry, LC-MS/MS)[17]比较分析R534和突变体d534 的内源GA3含量。采集一叶一心期野生型的茎和叶,液氮研磨,以预冷的甲醇浸提0.1 g 样品16 h,4 000 r·min?1离心15 min,吸取上清于10 mL 容量瓶中,加入2 mL甲醇并用超纯水稀释至刻度线,即得母液。取4 mL母液过混合型阴离子交换固相萃取柱,以甲酸甲醇洗脱后吹干,补超纯水至0.5 mL,混匀过滤后待上机分析。
1.5 GA3敏感性测定
选取饱满一致的R534和d534 种子各300粒浸种催芽,在光照培养室(光照16 h,28 ℃/黑暗8 h,22 ℃)中用木村B营养液(联迈生物)培养至一叶一心期;然后使用GA3均匀喷雾处理幼苗,以质量浓度0 mg·L?1 为对照组,设置25 和50mg·L?12个处理组。每隔5 d喷施1次GA3,共喷施2次;取5株测量喷施前和喷施后的株高取平均值,计算相对增长率,每个处理重复3次。
1.6 基因表达分析
利用 Trizol提取R534和d534 一叶一心期幼苗茎和叶的RNA,反转录获得cDNA(北京索莱宝科技有限公司),利用引物GA20-F/R(F: 5-TACTACAGGGAGTTCTTCGCGGACAGCA-3;R:5-TGTGCAGGCAGCTCTTATACCTCCCGTT-3)和GA3-F/R(F: 5-CCTTCTTCTCCAAGCTCATGT-3;R:5-CTCCTTGTGAAACTCCTCCATC-3)进行实时荧光定量PCR(real-time quantitative PCR,RTqRCR)检测。反应程序为:95 ℃ 10 min;95 ℃15s,62 ℃ 20 s,72 ℃ 20 s,40 个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s;40 ℃ 30 s。重复检测 3次,采用2?ΔΔCT法[18]确定OsGA20ox2 和OsGA3ox2 基因在2个材料茎和叶中的相对表达量。
1.7 数据统计
采用SPSS23.0 软件单因素方差分析法,对R534和d534 的主要农艺性状差异、内源GA3含量差异、外源GA3处理下株高表型差异和不同器官中OsGA20ox2 和OsGA3ox2 基因表达差异进行显著性分析。
2 结果与分析
2.1 d534 的主要农艺性状分析
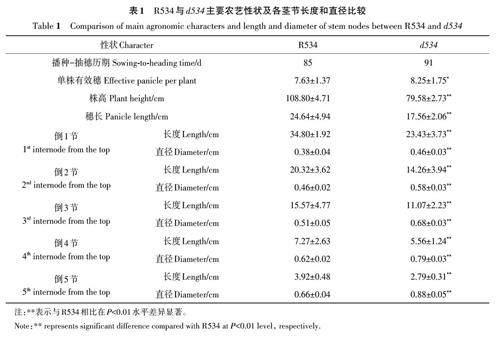
同期播种R534和d534,R534在 8月24日抽穗,d534 在8月31日抽穗,比R534抽穗期延迟了7 d(图1)。d534 单株有效穗增加,比R534增加了0.7个(表1)。株高由穗长和茎长共同决定,茎长受茎节数目和各茎节长度的影响。d534 成熟植株的株高为79.58 cm,较野生型R534 降低了29.22 cm,降幅为26.86%(图1,表1)。d534 穗长为17.56 cm,较R534 下降了7.08 cm,降幅达到28.73%;d534 与R534均具有5个茎节,并且d534各茎节的长度与R534相比显著降低,其中倒1节和倒2 节下降了11.37 和6.06 cm,降幅分别达到了31.25% 和29.82%,倒3、4、5 节较R534 分别下降了4.5、1.71、1.13 cm(表1),表明d534 突变体穗和所有茎节都发生缩短。另外,与R534 相比,d534 各茎节直径出现不同程度的增加,倒3、4、5节增加明显,分别增加了0.17、0.17和0.22 cm,增幅达到33.33%、27.41%和33.33%(表1),倒1节和倒2 节较R534 分别增加了0.08 和0.12 cm,d534的茎节配置特点暗示其可能具有抗倒伏利用潜力。
2.2 d534 的遗传分析
d534 与野生型R534正交后的35个F1植株和反交后的26个F1植株都表现为野生型(正常株高且正常花期)表型;正交 F2群体分离了342个突变型(矮化晚花)和989个野生型(正常株高且正常花期)单株,没有重组出矮化且正常花期、正常株高且迟抽穗类型单株;类似地,反交F2 群体中也只出现突变型和野生型2种表型,未见有重组类型单株,说明矮化与迟抽穗受同一基因控制(表2)。经卡方检测,突变型与野生型单株的理论分离比符合1:3(χ2 0.05 ≤3.84),表明矮化迟抽穗表型受1个细胞核隐性基因控制(表2)。
2.3 d534 内源GA3含量分析
取一叶一心期幼苗分析了d534 和R534的茎和叶中GA3 含量。野生型R534 茎中GA3 含量为0.43 ng·g?1,d534 为0.17 ng·g?1,较野生型降低了60.47%,差异极显著。d534 叶中GA3含量为1.25ng·g?1,与R534(1.33 ng·g?1)相当,二者间差异不显著(表3)。表明d534 的苗期矮化与茎中内源GA3合成不足有关。
2.4 d534 对GA3敏感性分析
在一叶一心期不施GA3条件下,d534 和R534的株高呈现明显差异,d534 为11.32 cm,较野生型R534(14.14 cm)下降了19.94%(表4)。经25 和50 mg·L?1GA3 处理5 d 后,d534 株高分别达到23.51 和23.88 cm,较对照组(0 mg·L?1 GA3)增加了7.22 和7.59 cm,相对增长率分别为44.32% 和46.59%;处理10 d后,d534 较对照组增长了15.32和16.01 cm,相对增长率为71.76% 和74.98%,说明d534 对外源GA3 敏感。在相同处理条件下,d534 对GA3 的敏感性要明显强于R534,比如,d534 在25和50 mg·L?1GA3 处理10 d后的相对增长率比野生型R534(61.78% 和65.18%)增加了9.98%和9.80%。还注意到,经25 mg·L?1 GA3处理5或10 d后d534 的株高都超过了未施GA3的R534同期生长幼苗株高(图2),表明外源GA3 能回补d534 的株高表型。
2.5 OsGA20ox2 和OsGA3ox2 基因表达水平分析
通过实RT-qPCR 分析,比较了d534 和R534间OsGA20ox2 和OsGA3ox2 基因的相对表达量。与R534 相比,d534 茎中OsGA20ox2 和OsGA3ox2表达水平显著下调,降幅分别为87.74% 和88.14%,差异极显著;同时期d534 叶中OsGA20ox2 和OsGA3ox2 基因表达量仅为R534的24.02% 和49.88%(图3)。表明d534 内源GA3 合成不足可能与OsGA20ox2 和OsGA3ox2 基因表达水平下调有关。
3 讨论
我国水稻育种经历了从高秆到半矮秆的过程,目前生产上使用的半矮秆水稻品种株高为90~120 cm[19],鉴定更优良的半矮秆基因对于选育高产抗倒品种具有重要意义。根据矮化程度可将矮秆资源分为半矮秆、矮秆和极端矮秆3 种类型[20]。矮秆和极端矮秆水稻成熟期株高低于野生型的50%,但过度矮化导致其生物学产量和经济产量显著降低而丧失利用价值[21]。半矮秆突变体的株高适当降低,能较好地协调高产与倒伏之间的矛盾而具有应用潜力[22]。d534 是辐射诱变优良常规稻品种五山丝苗(R534)获得的矮壮型突变体,其成熟期株高为R534的72.22%,基部茎节显著增粗(表1),具有抗倒伏利用潜力。
不同矮化突变体的茎节缩短特性有所不同:虽然d35、sd1 和d18 的所有茎节都发生缩短,但各茎节的缩短程度有差异;d35 倒1 节缩减幅度最大[23],sd1 倒2节和倒3节明显缩短[24],d18 减少了1个茎节且所有茎节显著缩短[25]。d534 和R534均为5个茎节,与R534相比,d534 倒1节缩短最明显,缩减幅度为31.25%(图1B,表1),其矮化机制与d35 相似但与sd1 不同。d534 各茎节长度缩短的同时茎节直径有所增加,且越靠近水稻基部的茎节直径增加幅度越明显(表1),暗示d534 的矮化有利于增强其抗倒伏能力。
赤霉素是调控水稻株高的重要激素,由赤霉素代谢途径紊乱所致的水稻矮化突变体既可能对赤霉素敏感,也可能对赤霉素钝感。赤霉素敏感型突变体是因赤霉素的生物合成途径受阻而内源赤霉素积累不足所致,若补充外源赤霉素可完全或部分恢复至野生型表型;赤霉素钝感型突变体可能与赤霉素信号转导通路受阻有关。半矮秆突变体sd1[26]和d18[27]的株高分别较其野生型降低了33.73%和51.12%,茎中GA20和GA3的含量分别降低了48.14% 和62.36%,与赤霉素合成途径中GA20氧化酶和GA3氧化酶编码基因突变有关。本研究中,d534 株高较野生型降低了27.78%,茎中GA3 的含量较野生型降低了60.47%,苗期喷施GA3 后株高显著增加(表4、图2),表明d534 属于赤霉素敏感型突变体,其矮化表型可能与GA3生物合成途径受到抑制有关。GA20氧化酶和GA3氧化酶编码基因在植物赤霉素生物合成途径中起重要作用,参与调控植株高度或茎节伸长[28]。本研究中,d534 茎和叶中OsGA20ox2 和OsGA3ox2 表达水平明显低于R534,这种表达差异可能影响了d534 内源GA3的生物合成进而导致植株矮化。
水稻矮化可能伴随其他重要农艺性状的改变。d53 突变体株高较野生型降低且产生大量分蘖;D53 是感知和响应SL信号的关键因子,该基因的突变降低了茎基部中OsCKX9 的表达量,促进细胞分裂素积累,使分蘖增强[11]。本研究中,d534 分蘖能力较R534有所增强,暗示d534 矮杆基因对分蘖具有正向的促进作用。受GA诱导的的MYB 转录因子基因GAMYB 是miR319 下游靶基因,gamyb 突变体在营养生长期生长发育不受影响,但转入生殖生长期后各节间缩短、开花延迟[29]。本研究中,与R534相比,d534 突变体的开花期推迟了7 d,暗示d534 的目的基因导致株高矮化的同时还一因多效的影响了有关开花调控基因的表达。
参考文献
[1] JENNINGS P R. Plant type as a rice breeding objective [J].
Crop Sci., 1964, 4(1):13-15.
[2] 余汉勇,魏兴华,王一平,等.等位酶和SSR标记研究水稻矮
仔占衍生品种的遗传差异[J].中国水稻科学, 2004(6):3-8.
YU H Y, WEI X H, WANG Y P, et al .. Morphological,
allozyme and SSR markers were used to study the genetic
diversity of rice dwarf accounted derivatives [J]. Chin. J. Rice
Sci., 2004(6):3-8.
[3] PENG S, CASSMAN K G, VIRMANI S S, et al .. Yield
potential trends of tropical rice since the release of IR8 and the
challenge of increasing rice yield potential [J]. Crop Sci., 1999,
39(6):1552-1559.
[4] LANGE T, PIMENTA LANGE M J. The multifunctional
dioxygenases of gibberellin synthesis [J]. Plant Cell Physiol.,
2020, 61 (11):1869-1879.
[5] ITOH H, TATSUMI T, SAKAMOTO T, et al .. A rice semidwarf
gene, Tan-Ginbozu (D35), encodes the gibberellin
biosynthesis enzyme, ent-kaurene oxidase [J]. Plant Mol. Biol.,
2004, 54(4):533-547.
[6] SPIELMEYER W, ELLIS M H, CHANDLER P M, et al ..
Semidwarf (sd-1),‘ green revolution rice, contains a defective
gibberellin 20-oxidase gene [J]. Proc. Natl. Acad. Sci. USA,
2002, 99(13):9043-9048.
[7] SAKAMOTO T, MORINAKA Y, ISHIYAMA K, et al .. Genetic
manipulation of gibberellin metabolism in transgenic rice [J].
Nat. Biotechnol., 2003, 21(8):909-913.
[8] SUN T P. The molecular mechanism and evolution of the GAGID1-
DELLA signaling module in plants [J]. Curr. Biol., 2011,
21(9):R338-R345.
[9] YOSHIDA H, TANIMOTO E, HIRAI T, et al .. Evolution and
diversification of the plant gibberellin receptor GID1 [J]. Proc.
Natl. Acad. Sci. USA, 2018, 115 (33):E7844-E7853.
[10] GOMI K, SASAKI A, ITOH H, et al .. GID2, an F-box subunit
of the SCF E3 complex, specifically interacts with
phosphorylated SLR1 protein and regulates the gibberellindependent
degradation of SLR1 in rice [J]. Plant J., 2004,
37(4):626-634.
[11] FANG Z, JI Y, HU J, et al .. Strigolactones and brassinosteroids
antagonistically regulate the stability of the D53-OsBZR1
complex to determine FC1 expression in rice tillering [J]. Mol.
Plant, 2020, 13(4):586-597.
[12] WEN X, SUN L, CHEN Y, et al .. Rice dwarf and low tillering
10 (OsDLT10) regulates tiller number by monitoring auxin
homeostasis [J/OL]. Plant Sci., 2020, 297: 110502 [2023-11-
29]. https://doi.org/10.1016/j.plantsci.2020.110502.
[13] CHEN D, QIU Z, HE L, et al .. The rice LRR-like 1 protein
YELLOW AND PREMATURE DWARF 1 is involved in leaf
senescence induced by high light [J]. J. Exp. Bot., 2021, 72(5):
1589-1605.
[14] 黄道强,周少川,李宏.优质稻新品种五山丝苗的选育及利
用[J].广东农业科学, 2011, 38(9):15-16.
HUANG D Q, ZHOU S C, LI H. Breeding and utilization of
new high quality rice variety wushan silk seedling [J].
Guangdong Agric. Sci., 2011, 38(9):15-16.
[15] 谭炎宁,杨 震,袁定阳.γ 射线诱变籼稻保持系 T98B 突变体
的鉴定与农艺性状分析[J]. 激光生物学报, 2019, 28(3):
274-280.
TANG Y N, YANG Z, YUAN D Y. Identification and
agronomic traits analysis of γ -ray mutagenesis of maintainer
line T98B in indica rice [J]. Acta Laser Biol. Sin., 2019, 28(3):
274-280.
[16] CHEN Z, LIN T, WANG K. A powerful variant-set association
test bbased on chi-square distribution [J]. Genetics, 2017,
207(3):903-910.
[17] MULLER M, MUNNE-BOSCH S. Rapid and sensitive
hormonal profiling of complex plant samples by liquid
chromatography coupled to electrospray ionization tandem
mass spectrometry [J]. Plant Methods, 2011, 7:37.
[18] KENNETH J, LIVAK, THOMAS D, et al .. Analysis of relative
gene expression data using real-time quantitative PCR and the
2?ΔΔCT method [J]. Methods, 2001, 25 (4):402-408.
[19] 袁隆平.选育超高产杂交水稻的进一步设想[J].杂交水稻,
2012, 27(6):1-2.
YUAN L P. Further ideas on breeding super high yield hybrid
rice [J]. Hybrid Rice, 2012, 27(6):1-2.
[20] 谷福林,翟虎渠,万建民,等.水稻矮秆性状研究及矮源育种
利用[J].江苏农业学报, 2003(1):48-54.
GU F L, DI H Q, WAN J M, et al .. Studies on rice dwarf traits
and utilization of dwarf source breeding [J]. Jiangsu J. Agric.
Sci., 2003(1):48-54.
[21] FERRERO-SERRANO ?, CANTOS C, ASSMANN S M. The
role of dwarfing traits in historical and modern agriculture with
a focus on rice [J/OL]. Cold Spring Harb Perspect Biol., 2019,
11(11):a034645 [2023-11-29]. https://doi.org/10.1101/cshperspect.
a034645
[22] NIU Y, CHEN T, ZHAO C, et al .. Improving crop lodging
resistance by adjusting plant height and stem strength [J/OL].
Agronomy, 2021, 11(12): 2421 [2023-11-29]. https://doi.org/
10.3390/agronomy11122421.
[23] ITOH H, UEGUCHI-TANAKA M, SATO Y, et al .. The
gibberellin signaling pathway is regulated by the appearance
and disappearance of SLENDER RICE1 in nuclei [J]. Plant
Cell, 2002, 14(1):57-70.
[24] BISWAS S, TIAN J, LI R, et al .. Investigation of CRISPR/Cas9-
induced SD1 rice mutants highlights the importance of
molecular characterization in plant molecular breeding [J]. J.
Genet. Genom., 2020, 47(5):273-280.
[25] AOKI T, KITANO H, KAMEYA N, et al .. Accelerated shoot
overgrowth of rice mutant ao-1 is epistatic to gibberellinsensitive
and -insensitive dwarf mutants [J]. J. Plant Res.,
2002, 115(3):195-202.
[26] ANGIRA B, ADDISON CK, CERIOLI T, et al .. Haplotype
characterization of the sd1 semidwarf gene in united states rice [J].
Plant Genome, 2019, 12 (3):1-9.
[27] ITOH H, UEGUCHI-TANAKA M, SENTOKU N, et al ..
Cloning and functional analysis of gibberellin 3β-hydroxylase
genes that are differently expressed during the growth of rice [J].
Proc. Natl. Acad. Sci. USA, 2001(98):8909-8914.
[28] XUE Y, ZHANG Y, SHAN J, et al .. Growth repressor gmRAV
binds to the gmGA3ox promoter to negatively regulate plant
height development in soybean [J/OL]. Int. J. Mol. Sci., 2022,
23(3):1721 [2023-11-29]. https://doi.org/10.3390/ijms23031721.
[29] WANG R, YANG X, GUO S, et al .. MiR319-targeted OsTCP21
and OsGAmyb regulate tillering and grain yield in rice [J]. J.
Integr. Plant Biol., 2021, 63(7):1260-1272.
(责任编辑:温小杰)
