苹果PRE6-like基因的克隆及在花青素合成中的功能分析
2024-06-15黄娟娟黄亚萍李文芳毛娟陈佰鸿
黄娟娟 黄亚萍 李文芳 毛娟 陈佰鸿
DOI:10.13925/j.cnki.gsxb.20240068
摘 要:【目的】通过验证苹果非典型成员多效唑抗性蛋白基因(PRE6-like)的功能,探索其在花青素生物合成中的调控作用。【方法】基于俄矮2号芽变枝条果皮转录组测序结果,筛选获得花青素合成相关调节基因MdPRE6-like,对其进行生物信息学分析,克隆CDS并构建过表达载体,瞬时表达金冠苹果果实,遗传转化苹果愈伤和拟南芥进行功能验证。【结果】MdPRE6-like cDNA全长279 bp,编码92个氨基酸,相对分子质量10 450.75 Da,理论等电点(pI)为6.41,含有HLH结构域,亚细胞定位预测结果为细胞核。组织特异性表达分析表明,MdPRE6-like基因在花、果皮中的表达量显著高于根和叶。瞬时表达金冠苹果表明,MdPRE6-like显著促进了金冠苹果果皮注射部位花青素的积累,并显著提高了花青素合成通路相关结构基因的表达水平。MdPRE6-like基因在苹果愈伤组织和拟南芥过表达表明,转基因苹果愈伤组织和拟南芥叶脉中的花青素含量显著高于野生型,且花青素合成通路结构基因表达水平上调。【结论】MdPRE6-like基因能够正向调控花青素的合成和积累,为后续MdPRE6-like基因参与改良苹果果实品质提供理论参考。
关键词:苹果;MdPRE6-like;花青素合成;遗传转化;表达水平
中图分类号:S661.1 文献标志码:A 文章编号:1009-9980(2024)05-0812-12
收稿日期:2024-01-31 接受日期:2024-02-29
基金项目:国家重点研发计划(2022YFD1602106);甘肃省教育厅“双一流”重点科研项目(GSSYLXM-02);甘肃省科技重大专项(22ZD6NA045)
作者简介:黄娟娟,女,在读硕士研究生,研究方向为果树栽培技术与调控机制研究。E-mail:2645265817@qq.com
*通信作者 Author for correspondence. E-mail:bhch@gsau.edu.cn
果 树 学 报 2024,41(5): 812-823
Journal of Fruit Science
Cloning of PRE6-like gene and analysis of its function in anthocyanin synthesis in apple
HUANG Juanjuan, HUANG Yaping, LI Wenfang, MAO Juan, CEHN Baihong*
(College of Horticulture, Gansu Agricultural University, Lanzhou 730070, Gansu, China)
Abstract: 【Objective】 The PREs gene, also known as the polyoxazole resistance gene, belongs to the basic/helix-loop-helix (bHLH) transcription factor family. It lacks a DNA binding domain and typically forms homodimers or heterodimers to regulate the expression of target genes, thereby influencing plant morphology, cell size, pigment metabolism and response to abiotic stress. This study aimed to verify the function of the atypical member of the polyoxazole resistance protein gene (PRE6-like) in apple and explore its regulatory role in anthocyanin biosynthesis. 【Methods】 The Oregon Spur Ⅱ, which is highly prone to bud mutation, exhibits significantly improved fruit color compared to the original variety. A new mutant strain of the Oregon Spur Ⅱ apple was discovered, which exhibits early and intense coloring, with a reddish fruit surface at maturity, and stable variation traits. Based on transcriptome sequencing of the skin of fruits on the bud mutation branch from the Oregon Spur Ⅱ apple, a flower pigment synthesis-related regulatory gene, MdPRE6-like was identified. The coding sequence (CDS) of the MdPRE6-like gene (MD14G1197600) was obtained from the apple genome website, and primers were designed using Primer 5.0 to amplify the cDNA from Oregon Spur Ⅱ the skin tissue of fruits on the bud mutation branch. Bioinformatics analysis software was used for biological information analysis, and tissue-specific expression was analyzed using the fluorescence quantitative PCR. The CDS region was cloned and ligated into the linearized expression vector pCAMBIA1301-GFP. Escherichia coli DH5α was heat-shock transformed, and Agrobacterium tumefaciens GV3101 was transformed to construct the overexpression vector. Transient expression was performed in Golden Delicious apple fruit, and the color changes of the skin under intensive light conditions (12 000 lx) were observed to preliminarily identify the genes role in anthocyanin synthesis. Further functional validation was conducted through Agrobacterium-mediated transformation of apple callus and by the floral dip method in Arabidopsis. 【Results】 The MdPRE6-like is located on chromosome 14, with an open reading frame of 279 bp, encoding 92 amino acids. The molecular formula is C444H745N137O149S2, with a relative molecular weight of 10 450.75 Da and a theoretical isoelectric point (pI) of 6.41. The total hydrophobicity is -0.654, which is a hydrophilic protein with a lipid solubility index of 97.50 and an instability index of 85.86. It belongs to an unstable protein, and its secondary structure shows that the protein α spiral structure accounts for 66.30%, irregular curls account for 32.61%, and extended chains account for 1.09%, so there are three α-The atypical bHLH proteins composed of a spiral structure, which is consistent with the proteins tertiary structure. The subcellular localization prediction results of MdPRE6-like protein indicated that it may be localized in the nucleus. Multiple sequence alignment of its conserved domains with similar species revealed that the MdPRE6-like protein was an atypical bHLH protein containing an HLH domain. Organizational specific expression analysis showed that the expression level of MdPRE6-like gene in flowers and fruit peel was significantly higher than that in roots and leaves, indicating that this gene had a certain impact on the growth and development of apple fruit. Instantaneous expression of the Golden Delicious apple showed that MdPRE6-like significantly promoted the accumulation of anthocyanins at the injection site of the Golden Delicious apple peel, and increased the expression level of structural genes related to the anthocyanin synthesis pathway. The UFGT gene, also known as the 3-O-flavonoid glucosyltransferase gene, was significantly different from the control (p≤0.001); The overexpression of MdPRE6-like gene in apple callus and Arabidopsis thaliana revealed a significant increase in anthocyanin content in transgenic apple callus compared with the control. The expression level of MdPRE6-like gene was 5.22 times higher than that of the control, and the relative expression level of structural genes in the anthocyanin synthesis pathway increased. The differences in CHI, DFR and F3H compared to the control were extremely significant (p<0.001), being 5.22, 18.40 and 8.96 times higher, respectively. The accumulation effect of total anthocyanin content in the leaf veins of transgenic Arabidopsis was significant, and the expression level of MdPRE6-like gene in OE1 and OE3 strains was 9.22 and 7.14 times higher than the control, with extremely significant differences compared to the control. 【Conclusion】 MdPRE6-like gene can positively regulate the synthesis and accumulation of anthocyanins and promote the expression levels of structural genes in the anthocyanin synthesis pathway. Therefore, the results can provide theoretical reference for the MdPRE6-like gene to participate in improving the quality of apple fruit in the future.
Key words: Apple; MdPRE6-like gene; Anthocyanin synthesis; Genetic transformation; Expression level
苹果(Malus domestica Borkh.)是温带地区最广泛生产的经济水果作物之一,也是全球营养水平最高和消费最广泛的水果之一[1]。在苹果生产中,可以利用基因技术培育新品种,改良苹果外观品质(如色泽)以提高经济效益,推动苹果产业的发展。然而,目前苹果产业面临气候变化、遗传基础狭窄、营养质量下降等诸多挑战[2],降低了苹果的市场竞争力。因此,提高竞争与适应能力、获取优质资源、确保产业可持续发展尤为重要。元帅系苹果作为现今世界上最易发生芽变的苹果品种之一,迄今已有200余种,且芽变品系已发展到了第五代[3]。俄矮2号(Oregon Spur Ⅱ)是元帅第四代芽变品种俄矮红(Oregon Spur Del.)的芽变品种,8月下旬可着满色,提早上市[4]。
碱性/螺旋环-螺旋(bHLH)是调控植物对激素和逆境反应的转录因子大家族[5],其保守结构域能与其他转录因子共激活或共抑制蛋白形成复合物,调控花青素合成通路中结构基因转录活性,进而影响花青素生物合成。在水稻[6]中,S1(bHLH)作为主基因通过激活C1(MYB)的表达,然后C1激活WA1(WD40)的表达,以MYB-bHLH-WD40复合体的形式,协同调节花青素生物合成基因;在拟南芥[7]中,R蛋白同源bHLH转录因子TT8蛋白是类黄酮后期生物合成基因DFR在拟南芥中正常表达所必需的。非典型成员多效唑抗性蛋白基因(PREs),作为bHLH家族成员,含HLH结构域,通常参与同源或异源二聚体的形成以调控目标基因的表达,进而调节植物形态、细胞大小、色素代谢和非生物胁迫[8-9]。PREs基因的功能在多个物种中已被报道。在拟南芥中,初步研究揭示了AtPREs参与赤霉素(GA)、油菜素类固醇(BR)和光信号通路,通过与bHLH蛋白的相互作用来调节植物的生长[10]。Zheng等[11]研究表明PRE6表达直接受ARF5和ARF8调节,而PRE6是一种转录抑制因子,对拟南芥中的生长素应答产生负调控;拟南芥BNQ3(PRE4)基因在调节光反应中起作用,BNQ3突变改变萼片和心皮颜色,降低叶绿素含量,使花茎色泽变紫,且能通过下调BNQ依赖性光形态发生和发育信号通路来调节花瓣生长发育[12];在番茄中,SlPRE2与光形态的建成、赤霉素的响应及果实细胞发育有关,SlPRE6-like蛋白与光形态建成相关因子SIPAR1互作,进而调节细胞生长[13]。
笔者所在课题组成员在2019年于天水市麦积区的苹果主栽区发现了1株俄矮2号苹果芽变枝条,其突出特点是幼果期就能着色且着色良好、稳定,成熟时果面出现晕红,色泽艳丽,这可能暗示了该突变体具备提前合成和积累花青素的能力。为探究该品种芽变是否为基因突变引起的调控异常,笔者以俄矮2号芽变苹果为材料,利用前期转录组学分析获得的苹果花青素苷合成调控关键基因MdPRE6-like,对其进行生物信息学分析,克隆CDS序列并构建MdPRE6-like过表达载体。同时对金冠苹果果实表皮瞬时表达分析进行该基因的初步功能验证,并通过遗传转化王林苹果愈伤组织和拟南芥,检测转基因植株中的花青素含量及花青素合成相关功能基因的表达水平,为深入研究花青素合成调控机制及应用基因工程改良苹果品质提供理论依据。
1 材料和方法
1.1 试验材料
俄矮2号(Oregon Spur Ⅱ)苹果种植于天水市麦积区苹果主栽区,金冠(Golden Delicious)苹果由平凉市静宁果树果品研究所提供,拟南芥(Arabidopsis thaliana)、王林(Orin)苹果愈伤组织为甘肃农业大学园艺学院实验室保存。
1.2 试验方法
1.2.1 MdPRE6-like基因生物信息学分析 利用EXPASY-Proparam tool(https://web.expasy.org/protparam/)预测MdPRE6-like蛋白的分子质量和理论等电点。利用Portscale(https://web.expasy.org/protscale/)进行蛋白亲疏水性分析,利用Signaip(https://services.healthtech.dtu.dk/services/SignalP-5.0/)进行信号肽的预测,利用GSDS 2.0(http://gsds.gao-lab.org/)进行基因结构图谱构建,利用TMHMM(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)进行蛋白跨膜预测,利用WOLF PSORT(https://wolfpsort.hgc.jp/)进行亚细胞定位预测,利用SOPMA(https://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行蛋白二级结构预测,利用SWISS-MODEL(https://swissmodel.expasy.org/)进行蛋白三级结构预测。
1.2.2 Mdpre6-like基因CDS克隆 在苹果基因组网站(https://iris.angers.inra.fr/gddh13/)下载MdPRE6-like基因(MD14G1197600)的CDS序列,采用primer5.0设计引物(表1),以俄矮2号芽变枝条果皮组织的cDNA为模板进行扩增,将扩增产物在琼脂糖凝胶电泳(1%)中分离后使用SteadyPure(艾科瑞生物)试剂盒回收纯化。
1.2.3 MdPRE6-like过表达载体构建 将纯化回收后的产物连接到线性化载体pCAMBIA1301-GFP(实验室保存、Bam HI酶切)上。热激转化大肠杆菌DH5α,涂板过夜,挑取平板菌落至1.5 mL离心管(Lb液体培养基+卡那霉素),将大肠杆菌菌液PCR,挑选条带合适且明亮的菌液送生工生物工程(上海)股份有限公司进行测序分析,最后通过DNAMAN软件对测序数据进行比对分析测序。测序合适的大肠菌液利用质粒小提试剂盒(北京天根)提取质粒。
1.2.4 金冠苹果瞬时表达 通过热激法将构建好的pCAMBIA1301-GFP过表达载体转化到农杆菌感受态GV3101(北京博迈德基因技术有限公司)中用于金冠苹果果皮的瞬时表达。利用10 mmol·L-1的MES(水吗啉乙磺酸)、200 μmol·L-1的AS(乙酰丁香酮)、10 mmol·L-1的MgCl2(氯化镁)配制缓冲液,重悬菌体后使用2 mm注射器注射苹果表皮,每个注射孔200 ?L,置完全黑暗条件1 d,然后转移至12 000 lx强光条件,持续照射3~5 d,观察并拍照记录着色部位后,取样速冻,并于-80 ℃冰箱保存。
1.2.5 王林苹果愈伤组织和拟南芥的遗传转化 利用农杆菌转化法侵染王林苹果愈伤组织[14],将含MdPRE6-like的过表达农杆菌菌液活化离心后,用MS液体培养基重悬菌体至OD600=0.5,同时将愈伤悬浮2~3 h,将复苏后菌液侵染10~12 min,纱布过滤、滤纸吸干平铺愈伤至MS+3%蔗糖+6 g·L-1琼脂的固体培养基上,暗培养1.5 d,洗菌,转至筛选培养基(筛选条件:头孢0.15 g·L-1,潮霉素1 mg·L-1)上24 ℃暗培养7 d,然后转至光照培养箱(16 h /8 h的光照/黑暗)中,于筛选培养基上继代3~5次后观察愈伤表型,愈伤表面着色后进行Hyg(潮霉素)鉴定,采用CTAB法提取愈伤组织DNA,对潮霉素进行PCR鉴定并将阳性愈伤组织进行扩繁。
拟南芥遗传转化采用花序浸蘸法,热激转化合适的农杆菌液利用Lb液体培养基(含25 mg·L-1卡那霉素、25 mg·L-1利福平)于摇床(28 ℃、165 r·min-1)培养,离心后利用现配侵染液(1/2 MS+5%蔗糖+0.05% Siwet)重悬至OD600=0.8,复苏2~3 h,花序侵染2 min,侵染后黑暗条件1 d,然后转至自然光下室温培养。将收获的T0代种子4 ℃春化后种于含Hyg的MS培养基上(MS+3%蔗糖+6 g·L-1琼脂+12.5 mg·L-1 Hyg)抗性筛选,进行阳性植株初步鉴定,待拟南芥移栽至土壤基质14 d后,采用CTAB法提取植株幼叶DNA,对潮霉素进行PCR鉴定,将对应阳性植株标注,种子单独收取,得到T1代拟南芥,重复以上步骤获得T2代,最终获得纯合的T3代拟南芥。
1.2.6 总花色苷含量的测定 采用苏州梦犀生物医药科技试剂盒,设置3次重复,每个重复0.2 g鲜样,利用Spark多功能酶标仪(瑞士Tecan公司)分别测定不同pH下对照管和测定管于530、700 nm处吸光值,利用计算公式测定花青苷含量。
1.2.7 qRT-PCR 采集俄矮2号芽变枝条在盛花期的根、茎、叶、花、成熟期的果实果皮用于MdPRE6-like基因的组织特异性表达分析;瞬时表达着色部位的苹果果皮、转基因愈伤组织及转基因拟南芥用于测定MdPRE6-like基因及花青素合成通路中结构基因(CHI、CHS、DFR、F3H、ANS、UFGT)的表达水平。使用RNA提取试剂盒(OMEGA试剂盒)提取以上组织中总RNA,然后利用超微量分光光度计检验RNA提取浓度,利用Evo M-MLV反转录试剂盒Ⅱ将RNA反转录为cDNA,-20 ℃冰箱保存备用;用荧光定量PCR仪(罗氏诊断产品有限公司)进行PCR反应,反应体系及反应程序参考SYBR Green Pro Taq HS预混型qPCR试剂盒。利用primer5.0软件进行引物设计(表1),分别以苹果Q-MdMDH和拟南芥Atactin为内参基因,采用2-??Ct法计算基因的相对表达量。
1.3 数据处理
利用Excel 2010数据处理,利用IBM SPSS Statistics 24对MdPRE6-like基因在苹果不同组织中的表达模式进行差异显著性分析,其余利用Origin 2022、插件Paired Coparison Plot多重配对比较进行差异显著性分析及作图。
2 结果与分析
2.1 MdPRE6-like基因的克隆及生物信息学分析
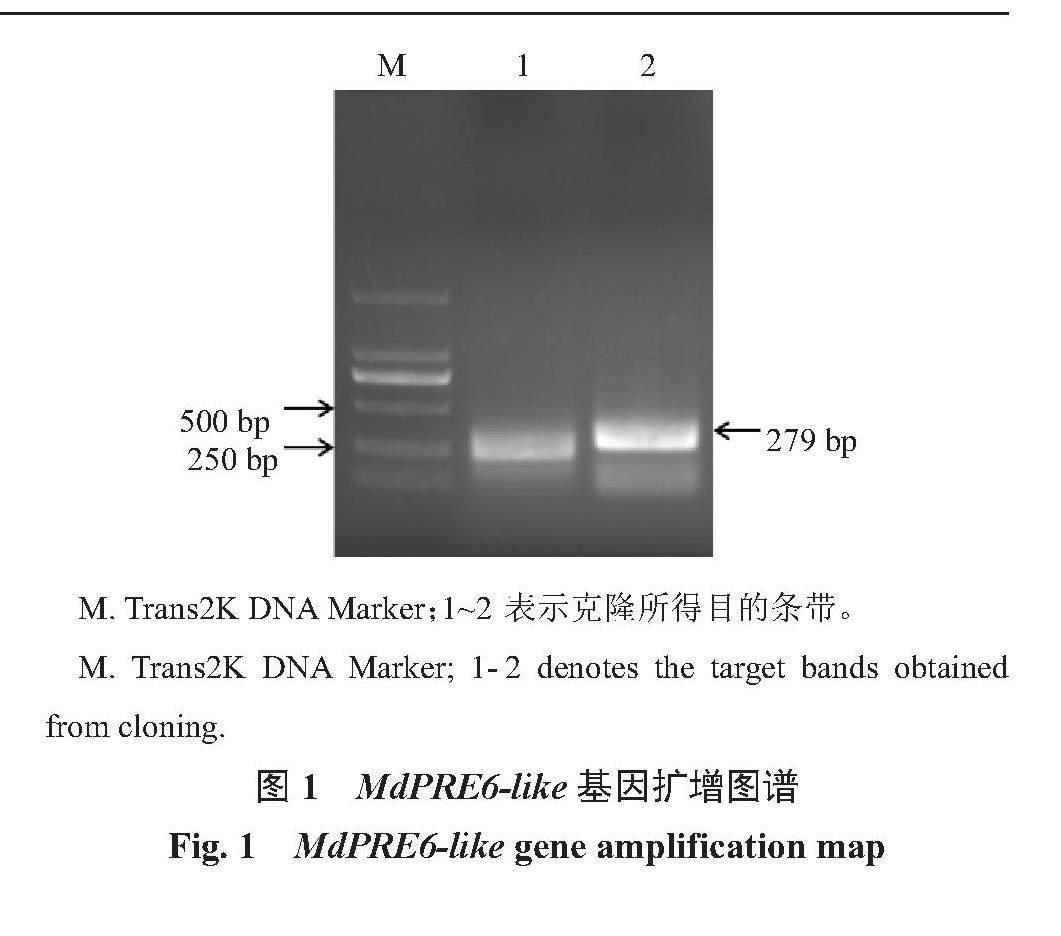
以俄矮2号芽变枝条的果实cDNA为模板,成功克隆到MdPRE6-like基因。电泳结果(图1)表明,在250~500 bp之间出现了一条明亮条带,与目的基因预测结果279 bp相符合。
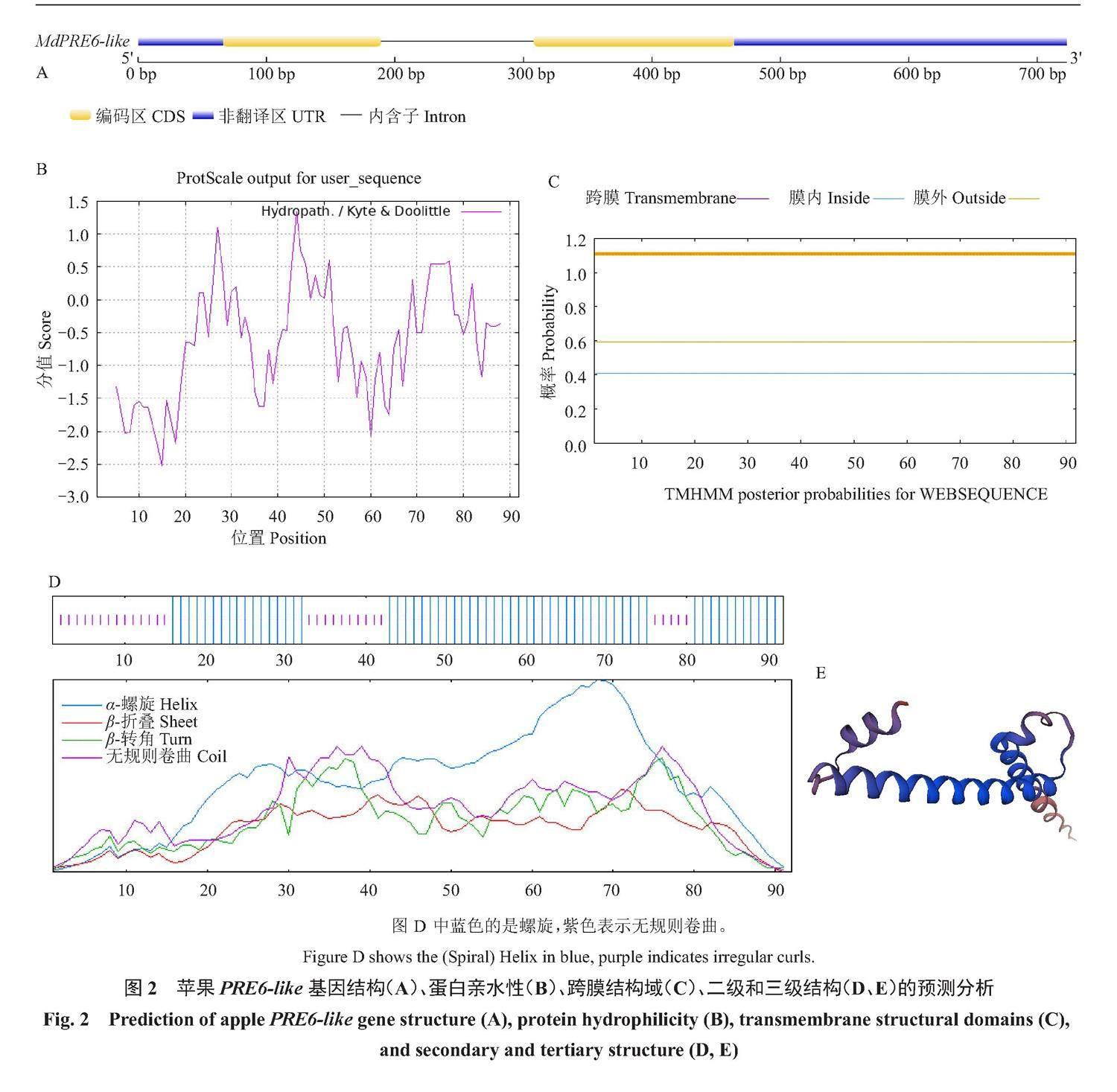
通过PCR技术克隆该基因后,对克隆到的目的基因利用软件进行生物信息学分析。基因结构分析表明,MdPRE6-like全长723 bp,两段CDS序列被非编码区隔开,且在CDS序列两端还存在较长的非翻译区(图2-A)。对MdPRE6-like蛋白理化性质分析表明,MdPRE6-like位于14号染色体上,开放阅读框279 bp,编码92个氨基酸,分子式为C444H745N137O149S2,相对分子质量为10 450.75 Da,理论等电点为6.41,总疏水性为-0.654,表明为亲水性蛋白(图2-B),脂溶指数为97.50,且蛋白不稳定指数85.86,属于不稳定蛋白;跨膜预测结果表明,该蛋白无跨膜区(图2-C),因此是在细胞核中调控基因转录。
蛋白二级结构表明(图2-D),该蛋白α螺旋结构占比66.30%,无规则卷曲占比32.61%,延伸链占1.09%,因此是由3个α螺旋结构构成的非典型bHLH蛋白,这与蛋白三级结构相符合(图2-E)。MdPRE6-like蛋白亚细胞定位预测结果表明,其可能定位于细胞核。
将MdPRE6-like编码的氨基酸序列与相近物种的保守结构域进行多序列比对(图3),结果表明,保守结构域没有碱性区域,只含有HLH结构域。
2.2 MdPRE6-like基因组织特异性表达分析
将俄矮2号突变材料所提取RNA反转录为cDNA,以苹果Q-PRE6-like-F、Q-PRE6-like-R 为引物(表1),用qRT-PCR检测MdPRE6-like基因在苹果不同组织中的表达情况,结果表明,MdPRE6-like在苹果花和果皮中的表达量最高,其次是茎和叶,根系表达量最低(图4)。表明该基因对苹果果实生长发育有一定的影响。
2.3 MdPRE6-like基因过表达载体构建
对PCR产物进行纯化和回收,并连接在表达载体pCAMBIA1301上,转染到大肠杆菌感受态DH5α中,测序结果与目的序列结果一致,过表达载体构建成功(图5-A)。将测序结果正确的大肠杆菌质粒转化农杆菌感受态GV3101,农杆菌转化结果合适(图5-B)。
2.4 MdPRE6-like基因的生物学功能分析
2.4.1 金冠苹果果皮瞬时注射 通过瞬时注射金冠苹果果皮,结果表明,过表达MdPRE6-like(OE)显著提高了果皮注射部位的着色和总花青苷的含量(图6-A~C),且过表达部位总花青苷含量是对照(WT)的10倍,OE-MdPRE6-like基因的相对表达量与WT差异显著(图6-D)。利用qRT-PCR进一步分析果皮中花青素合成通路中相关酶基因的转录水平,发现OE-UFGT基因的相对表达量与WT差异显著,OE-DFR、OE-F3H表达量是WT的2~3倍,其他基因也上调表达,但差异不显著(图6-E)。因此,笔者可以推断,果皮中MdPRE6-like基因表达量的上升影响到花青素的积累及花青素合成通路酶基因转录水平的提高。
2.4.2 MdPRE6-like基因在苹果愈伤组织中的过表达 MdPRE6-like基因在苹果愈伤组织中的过表达结果如图7-A所示,愈伤组织中点状红色色素明显积累,说明OE-MdPRE6-like能够促进总花青苷含量的积累。为了验证这一表征,笔者对愈伤组织中红色组织扩繁后进行总花色苷含量的测定,结果证实过表达愈伤组织中的MdPRE6-like基因表达量显著升高,是WT的5.22倍,且总花色苷含量极显著高于WT(图7-B~C)。为了进一步说明苹果MdPRE6-like能够调控花青素合成,对过表达OE-MdPRE6-like系进行花青素合成通路中相关酶基因测定,所有合成基因都出现了上调表达,其中,DFR、F3H基因相对表达量极显著上调(图7-D)。
2.4.3 MdPRE6-like基因在拟南芥中的过表达 为了验证MdPRE6-like基因在拟南芥花青素合成中的功能,将收获的T0代种子经过抗性筛选及阳性植株鉴定(图8-A),发现抗潮霉素的植株长势好,对潮霉素无抗性的几乎不生长,保持发芽时幼小状态。取阳性苗幼叶提取DNA进行鉴定,发现有部分条带较亮,部分无条带,T2代拟南芥(图8-B)鉴定结果表明,抗性苗和非抗性苗比例达到3∶1,选取对应条带较亮的拟南芥幼苗扩繁,得到纯合T3代拟南芥植株。图8-C显示了过表达株系和野生植株的表型对照,观察可见,过表达株系的叶片叶脉部位明显较野生型深,且表现出紫红色。进一步的数据分析发现,3株过表达植株的花青素含量显著高于野生型(图8-D),其中,MdPRE6-like基因表达量分别达到9.2、4.7、7.1,与WT差异显著(图8-E)。对MdPRE6-like转基因拟南芥花青素合成相关酶基因的转录水平进行测定发现,除CHI、UFGT基因上调但与WT无显著性差异外,F3H显著上调表达,CHS、DFR与ANS极显著上调表达(图8-F)。
3 讨 论
基因在植物组织中的差异性表达是植物适应多样化环境和实现不同功能的重要机制之一。例如,某些基因可能在根部中高度表达,而在叶片中表达量较低,这种差异性表达可以导致根部和叶片在形态和功能上的差异[15]。此外,植物基因的差异性表达还可以通过组织特异性启动子和转录因子结合位点的存在来实现,这些启动子和结合位点可以在特定组织或细胞类型中被激活,从而调控特定基因的表达[16]。通过组织特异性表达分析,笔者发现PRE6-like基因在苹果不同组织中表现出不同的表达模式,在苹果花和果实中的表达水平高,而花青素是一种常见的存在于植物花朵和果实中的色素,预测该基因在果实色泽形成过程中,通过光来实现果皮花青素的积累。
PREs基因(Paclobutrazol Resistance genes),又名多效唑抗性基因,植物对多效唑具有抵抗能力,可调节植物形态、细胞大小、色素代谢并响应不同植物激素的非生物胁迫。目前对于PREs基因的研究大都集中于光合与激素信号传导方面,韩金秀等[17]研究表明,在烟草中过表达bHLH1基因能够影响光合色素含量,进而影响到植物的光合能力;王丽霞等[18]发现光激活的蓝光受体隐色体或红光受体与COP1-SPA相互作用,介导蓝光或红光/远红光的转导,从而抑制COP1-SPA对下游光形态发生转录因子HY5的降解,促进植物光形态发生的HY5的积累。在Yu等[19]研究中,MdLNC610通过作为促进MdACO1表达和乙烯生物合成的正向调节剂参与高光诱导花青素产生的调节。本研究结果表明,金冠苹果处于高强白光状态下,果皮注射MdPRE6-like基因的部位呈现明显色素沉着,且MdPRE6-like基因表达量上升,表明强光诱导MdPRE6-like基因表达量的上升,植物通过花青素的积累以对抗光胁迫引起的氧化压力,且在强光照射下,这些转基因愈伤组织中的外源基因更活跃地表达,激活植物体内的一系列代谢途径,使得愈伤组织中花青素的积累增加。齐方婷等[20]研究表明,转录因子直接或间接调节结构基因表达,控制植物花斑形成,而结构基因通过时间空间特异性表达以及基因间竞争机制,促进色素在花瓣间差异积累形成花斑。拟南芥作为一种常用模式植物,对研究植物的次生代谢和基因调控具有重要意义。本试验转化拟南芥的结果表明,MdPRE6-like基因的过表达促进拟南芥叶脉部位花青素的积累,而在叶片部位积累不明显,猜测花青素合成途径中的某些关键酶类基因受到了特定组织中其他基因的调控,使得花青素只在叶脉中积累[21];也可能与叶脉组织中的代谢调控网络相关,叶脉组织内的物质运输机制促进了花青素在该位置的积累,而其他组织则可能存在限制花青素运输或稳定性的因素[22-23];导致其他组织中存在更多的花青素降解酶或者竞争性代谢途径,使得花青素在这些组织中无法有效积累[24]。
花青素合成通路上的结构基因在植物体内编码关键的酶类,这些酶在花青素的生物合成过程中发挥着重要的功能[25],在花青素合成途径中扮演着不同但相互关联的角色,通过催化特定的化学反应,使得前体物质逐步合成为最终的花青素类化合物[26]。而调控这些基因的表达水平可以影响植物体内花青素的合成水平和种类。花青素合成的早期,两个限速酶CHS、CHI催化4-香豆素辅酶A碳骨架化,分子内环化,F3H依赖双加氧酶催化脱氧黄烷酮C-3位置形成二氢黄酮醇;DFR和ANS、UFGT作为花青素合成后期限速酶和关键酶,促成C-4位羟基形成、将无色花青素转为有色花青素同时糖基化为稳定花青素。在Singh等[27]、Sunil等[28]的研究中,通过控制F3H的表达来调节DFR不受抑制地发挥作用。本研究结果表明,在果皮瞬时注射结果中,UFGT基因转录水平较高,证明在果皮受到强光刺激后,在后期基因UFGT作用下,糖基化催化UDP葡萄糖向花青素前体转移。其中F3H、DFR基因转录水平相当,猜测可能原因是在合成过程的时间阶段上,F3H与DFR存在反馈调节机制,以确定合成通路上的平衡稳定性[29]。对拟南芥和愈伤组织结构通路酶基因转录水平比较发现,DFR转录始终维持在较高水平,且F3H转录水平和MdPRE6-like基因表达水平差异不大,MdPRE6-like可能对F3H基因的表达起到直接的调节作用。Hou等[30]研究发现,与IBH1相关的新参与者HLH4,其过表达造成矮化和深绿色表型,并造成参与花青素生物合成途径的许多关键调节酶基因下调表达。HLH4干扰CIB5的活性,从而抑制CIB5调控的细胞伸长相关基因的转录,HLH4对CIB5的干扰被PRE1抵消,其中这些bHLH蛋白形成了一个新的三拮抗系统。本研究中是否有其他基因参与花青素合成或者是否该基因在果实不同阶段表达模式有所变化还有待进一步探究。
4 结 论
笔者在俄矮2号苹果中克隆得到多效唑抗性蛋白基因(PRE6-like),通过同源转化苹果愈伤及异源转化拟南芥证明MdPRE6-like基因能够激活花青素生物合成及花青素合成通路结构基因的表达。研究结果为MdPRE6-like基因参与苹果种质的创新奠定了基础。
参考文献 References:
[1] 孙子涵. 可见光和UV-B诱导下苹果MdMYB25基因调控花青素合成的分子机制[D]. 泰安:山东农业大学,2023.
SUN Zihan. Molecular mechanism of apple MdMYB25 gene regulating anthocyanin synthesis induced by visible light and UV-B[D]. Taian:Shandong Agricultural University,2023.
[2] 陈学森,王楠,张宗营,毛志泉,尹成苗. 关于果树种质资源与遗传育种若干问题的理解与思考[J]. 中国农业科学,2022,55(17):3395-3410.
CHEN Xuesen,WANG Nan,ZHANG Zongying,MAO Zhiquan,YIN Chengmiao. Understanding and thinking about some problems of fruit tree germplasm resources and genetic breeding[J]. Scientia Agricultura Sinica,2022,55(17):3395-3410.
[3] 杨有龙. 美国元帅系苹果品种(系)介绍[J]. 北方果树,1987(增刊1):84-88.
YANG Youlong. Introduction of apple varieties (lines) of Red Delicious line in the United States[J]. Northern Fruits,1987(Suppl. 1):84-88.
[4] SHARMA D P,SHARMA H R,SHARMA N. Evaluation of apple cultivars under sub-temperate mid hill conditions of Himachal Pradesh[J]. Indian Journal of Horticulture,2017,74(2):162.
[5] 李欣,李影,曲子越,孙璐,王思瑶,詹亚光,尹静. bHLH转录因子在茉莉酸信号诱导植物次生产物合成中的作用及分子机制[J]. 植物生理学报,2017,53(1):1-8.
LI Xin,LI Ying,QU Ziyue,SUN Lu,WANG Siyao,ZHAN Yaguang,YIN Jing. The molecular mechanism and the function of bHLH regulating jasmonic acidmediated secondary metabolites synthesis[J]. Plant Physiology Journal,2017,53(1):1-8.
[6] SUN X M,ZHANG Z Y,LI J J,ZHANG H L,PENG Y L,LI Z C. Uncovering hierarchical regulation among MYB-bHLH-WD40 proteins and manipulating anthocyanin pigmentation in rice[J]. International Journal of Molecular Sciences,2022,23(15):8203.
[7] NESI N,DEBEAUJON I,JOND C,PELLETIER G,CABOCHE M,LEPINIEC L. The TT8 gene encodes a basic Helix-loop-Helix domain protein required for expression of DFR and BAN genes in Arabidopsis siliques[J]. The Plant Cell,2000,12(10):1863-1878.
[8] SONG S S,LIU B,SONG J Q,PANG S H,SONG T X,GAO S,ZHANG Y,HUANG H,QI T C. A molecular framework for signaling crosstalk between jasmonate and ethylene in anthocyanin biosynthesis,trichome development,and defenses against insect herbivores in Arabidopsis[J]. Journal of Integrative Plant Biology,2022,64(9):1770-1788.
[9] ZHU Z G,LUO M L,LI J L,CUI B L,LIU Z X,FU D P,ZHOU H W,ZHOU A P. Comparative transcriptome analysis reveals the function of SlPRE2 in multiple phytohormones biosynthesis,signal transduction and stomatal development in tomato[J]. Plant Cell Reports,2023,42(5):921-937.
[10] BAI M Y,FAN M,OH E,WANG Z Y. A triple Helix-loop-Helix/basic Helix-loop-Helix cascade controls cell elongation downstream of multiple hormonal and environmental signaling pathways in Arabidopsis[J]. The Plant Cell,2013,24(12):4917-4929.
[11] ZHENG K J,WANG Y T,ZHANG N,JIA Q M,WANG X T,HOU C J,CHEN J G,WANG S C. Involvement of PACLOBUTRAZOL RESISTANCE6/KIDARI,an atypical bHLH transcription factor,in auxin responses in Arabidopsis[J]. Frontiers in Plant Science,2017,8:1813.
[12] MARA C D,HUANG T B,IRISH V F. The Arabidopsis floral homeotic proteins APETALA3 and PISTILLATA negatively regulate the BANQUO genes implicated in light signaling[J]. The Plant Cell,2010,22(3):690-702.
[13] 龚俊. 番茄非典型bHLH转录因子SlPRE6-like在植株生长发育中的功能研究[D]. 重庆:重庆大学,2021.
GONG Jun. Functional study of tomato atypical bHLH transcription factor SlPRE6-like in plant growth and development[D]. Chongqing:Chongqing University,2021.
[14] 张淑辉. MdWRKY9-MdSWEET9b响应ABA信号调控苹果果实糖积累的机理研究[D]. 泰安:山东农业大学,2023.
ZHANG Shuhui. Mechanisms of MdWRKY9-MdSWEET9b regulating sugar accumulation in apple fruits in response to ABA signal[D]. Taian:Shandong Agricultural University,2023.
[15] 李贺,毛健鑫,董向向,张志宏,纪明山. 果树microRNA研究进展[J]. 果树学报,2015,32(3):502-510.
LI He, MAO Jianxin, DONG Xiangxiang, ZHANG Zhihong, JI Mingshan. Recent research advances in microRNA of fruit crops[J]. Journal of Fruit Science, 2015, 32(3):502-510.
[16] 陈建琦,赵明珠,王义,张美萍. 植物中组织特异性启动子的研究进展[J]. 北方园艺,2023(19):128-134.
CHEN Jianqi,ZHAO Mingzhu,WANG Yi,ZHANG Meiping. Research progress on tissue specific promoters in plant[J]. Northern Horticulture,2023(19):128-134.
[17] 韩金秀,陈斌,刘晏廷,孟儒,金利妍,何淼. 神农香菊CibHLH1的鉴定及对光合特性的影响[J]. 草业学报,2024,33(1):89-101.
HAN Jinxiu,CHEN Bin,LIU Yanting,MENG Ru,JIN Liyan,HE Miao. Identification of CibHLH1 and its effect on photosynthetic characteristics in Chrysanthemum indicum var. aromaticum[J]. Acta Prataculturae Sinica,2024,33(1):89-101.
[18] 王丽霞. 植物紫外光受体UVR8介导UV-B信号转导的分子机制研究[D]. 武汉:华中农业大学,2023.
WANG Lixia. Molecular mechanism of UV-B signal transduction mediated by the plant UV-B photoreceptor UVR8[D]. Wuhan:Huazhong Agricultural University,2023.
[19] YU J X,QIU K N,SUN W J,YANG T,WU T,SONG T T,ZHANG J,YAO Y C,TIAN J. A long noncoding RNA functions in high-light-induced anthocyanin accumulation in apple by activating ethylene synthesis[J]. Plant Physiology,2022,189(1):66-83.
[20] 齐方婷,黄河. 观赏植物花斑形成调控机制的研究进展[J]. 生物技术通报,2023,39(10):17-28.
QI Fangting,HUANG He. Research advance in the regulation mechanism of flower spots formation in ornamental plant[J]. Biotechnology Bulletin,2023,39(10):17-28.
[21] 黄贝,王鹏,温明霞,吴韶辉,高伟勤,徐建国,夏仁学. 柑橘果实色素-类胡萝卜素的研究进展[J]. 果树学报,2019,36(6):793-802.
HUANG Bei,WANG Peng,WEN Mingxia,WU Shaohui,GAO Weiqin,XU Jianguo,XIA Renxue. Advance study of pigment-carotenoids in Citrus fruits[J]. Journal of Fruit Science,2019,36(6):793-802.
[22] 杨静文. 中国水仙花色代谢途径及其结构基因和代谢产物的研究[D]. 福州:福建农林大学,2016.
YANG Jingwen. The molecular metabolic pathways of flower color of Narcissus tazetta var. chinensis[D]. Fuzhou:Fujian Agriculture and Forestry University,2016.
[23] 祝钦泷. 彩叶草(Solenostemon scutellarioides)叶色形成相关的花色素苷生物合成途径的分子调控研究[D]. 重庆:西南大学,2007.
ZHU Qinlong. Studies on the molecular regulation of the anthocyanin biosynthesis related to leaf color of Solenostemon scutellarioides[D]. Chongqing:Southwest University,2007.
[24] 黎洁,李霆格,王童欣,王健. 植物花青素和甜菜色素互斥机理研究进展[J]. 植物遗传资源学报,2023,24(6):1515-1526.
LI Jie,LI Tingge,WANG Tongxin,WANG Jian. Review of the mutually exclusive mechanism between the anthocyanins and betalains pigments in plants[J]. Journal of Plant Genetic Resources,2023,24(6):1515-1526.
[25] 宿子文,蔡志翔,孙朦,沈志军,马瑞娟,俞明亮,严娟. 植物中绿原酸生物合成研究进展[J]. 江苏农业学报,2023,39(6):1414-1426.
SU Ziwen,CAI Zhixiang,SUN Meng,SHEN Zhijun,MA Ruijuan,YU Mingliang,YAN Juan. Research progress on biosynthesis of chlorogenic acid in plants[J]. Jiangsu Journal of Agricultural Sciences,2023,39(6):1414-1426.
[26] 朱晨. 非编码RNA与RNA甲基化介导的乌龙茶萎凋过程中类黄酮与萜类代谢调控机制研究[D]. 福州:福建农林大学,2022.
ZHU Chen. Metabolic regulatory mechanism of flavonoid and terpenoid mediated by non-coding RNA and RNA methylation in oolong tea during withering process[D]. Fuzhou:Fujian Agriculture and Forestry University,2022.
[27] SINGH P K,RAWAL H C,PANDA A K,ROY J,MONDAL T K,SHARMA T R. Pan-genomic,transcriptomic,and miRNA analyses to decipher genetic diversity and anthocyanin pathway genes among the traditional rice landraces[J]. Genomics,2022,114(5):110436.
[28] SUNIL L,SHETTY N P. Biosynthesis and regulation of anthocyanin pathway genes[J]. Applied Microbiology and Biotechnology,2022,106(5):1783-1798.
[29] 徐新翔. 氮钾配施调节苹果碳氮代谢和果实花青苷合成的生理机制研究[D]. 泰安:山东农业大学,2023.
XU Xinxiang. Physiological mechanism of combined nitrogen and potassium regulating carbon and nitrogen metabolism and anthocyanin biosynthesis in apple fruits[D]. Taian:Shandong Agricultural University,2023.
[30] HOU Q C,ZHAO W,LU L,WANG L L,ZHANG T Y,HU B B,YAN T W,QI Y C,ZHANG F,CHAO N,BARTELS D,WAN X Y. Overexpression of HLH4 inhibits cell elongation and anthocyanin biosynthesis in Arabidopsis thaliana[J]. Cells,2022,11(7):1087.
