肿瘤坏死因子受体相关因子5对缺氧诱导心肌细胞损伤的影响及作用机制研究
2024-06-14蔡振璇张城炼许卫攀
蔡振璇 张城炼 许卫攀

摘要目的:分析肿瘤坏死因子受体相关因子5(TRAF5)对缺氧诱导心肌细胞损伤的影响及相关分子机制。方法:体外培养H9c2细胞,以800μmol/L浓度的二氯化钴(CoCl2)处理细胞建立缺氧诱导心肌细胞损伤模型,采用脂质体转染法将TRAF5过表达质粒(pcDNATRAF5)和空载质粒(pcDNANC)转染至缺氧诱导的H9c2细胞。采用实时荧光定量聚合酶链式反应(qRTPCR)法检测细胞TRAF5基因表达水平,细胞计数试剂盒(CCK8)检测细胞存活率,流式细胞术检测细胞凋亡率,试剂盒法检测乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSHPx)活性及丙二醛(MDA)含量,蛋白免疫印迹(WesternBlot)法检测细胞中TRAF5、细胞外信号调节激酶(ERK)、磷酸化ERK(pERK)、p38丝裂原活化蛋白激酶(p38MAPK)、磷酸化p38MAPK(pp38MAPK)、氨基末端激酶(JNK)、磷酸化JNK(pJNK)蛋白表达水平。结果:与Control组比较,Hypoxic组H9c2细胞中TRAF5mRNA和蛋白表达水平均降低,细胞存活率降低,细胞凋亡率升高,细胞中LDH水平、MDA含量升高,SOD、GSHPx水平降低,细胞中pERK/ERK、pp38MAPK/p38MAPK、pJNK/JNK比值均升高,差异均有统计学意义(P<0.05)。与Hypoxic组比较,Hypoxic+pcDNATRAF5组H9c2细胞中TRAF5mRNA和蛋白表达水平均升高,细胞存活率升高,细胞凋亡率降低,细胞中LDH水平、MDA含量降低,SOD、GSHPx水平升高,细胞中pERK/ERK、pp38MAPK/p38MAPK、pJNK/JNK比值均降低,差异均有统计学意义(P<0.05)。结论:TRAF5通过介导心肌酶活性和氧化应激水平减轻缺氧诱导的心肌细胞损伤,其作用机制可能与调控MAPK信号通路有关。
关键词肿瘤坏死因子受体相关因子5,TRAF5;心肌细胞损伤;氧化应激;实验研究
doi:10.12102/j.issn.16721349.2024.06.010
急性心肌梗死(acutemyocardialinfarction,AMI)是一种因心肌缺血和缺氧而导致的具有高死亡率和严重并发症的临床急重症,是世界范围内的一个重大公共卫生问题。当前,临床治疗AMI在经皮冠状动脉介入治疗和抗血小板药物方面取得了一些进展,但AMI病人心力衰竭的发生率仍然很高[12]。多项研究指出,持续缺氧是AMI后心肌细胞受损的主要原因,缺氧会导致心肌细胞发生炎症、细胞凋亡、坏死和心肌重塑等一系列生理病理变化,从而介导心肌功能严重受损和心力衰竭发生[35]。抑制AMI后心肌细胞损伤是提高治疗效果、改善病人预后的关键环节。因此,探索缺氧诱导心肌细胞损伤的分子机制可能会为AMI提供一种新的治疗策略。肿瘤坏死因子受体相关因子5(tumornecrosisfactorreceptorassociatedfactor5,TRAF5)是肿瘤坏死因子受体相关因子(TRAF)家族的成员之一,TRAF5具有E3泛素连接酶的活性,可通过其受体激活TNF诱导的核因子κB(NFκB)通路参与细胞生物学过程[6]。TRAF5基因缺陷促进脂肪组织炎症及加重饮食诱导的小鼠肥胖[7]。在心肌缺血再灌注(myocardialischemiareperfusioninjury,I/R)损伤过程中,TRAF5敲除加重I/R小鼠心脏损伤、炎症反应和细胞凋亡,而TRAF5过表达抑制I/R刺激的心肌细胞炎症和凋亡[8]。此外,TRAF5缺乏通过激活丝裂原活化的细胞外信号调节激酶(MEK)/细胞外调节蛋白激酶(ERK)信号通路而促进心肌肥厚和纤维化[9]。然而,TRAF5在AMI中发挥作用的研究报道较少。本研究旨在探讨TRAF5在缺氧诱导的心肌细胞损伤中的作用及相关作用机制。
1材料与方法
1.1实验材料
心肌细胞H9c2购自武汉普诺赛生命科技有限公司;纯度≥97%的二氯化钴(CoCl2)购自上海源叶生物科技有限公司;TRAF5过表达质粒(pcDNATRAF5)和空载质粒(pcDNANC)均购自基因科技(上海)股份有限公司;乳酸脱氢酶(lactatedehydrogenase,LDH)、肌酸激酶(creatinekinase,CK)、超氧化物歧化酶(superoxidedismutase,SOD)、谷胱甘肽过氧化物酶(glutathioneperoxidase,GSHPx)、丙二醛(malondialdehyde,MDA)检测试剂盒均购自江苏科惟生物技术有限公司;细胞计数试剂盒(cellcountingkit8,CCK8)、人膜联蛋白V异硫氰酸荧光素/碘化丙啶(AnnexinVfluorescinisothiocyanate/propidiumiodide,AnnexinVFITC/PI)凋亡检测试剂盒均购自爱必信(上海)生物科技有限公司;反转录试剂盒、荧光定量聚合酶链式反应(qRTPCR)试剂盒均购自北京诺博莱德科技有限公司;放射免疫沉淀分析(radioimmunoprecipitationassay,RIPA)裂解液、二喹啉甲酸(bicinchoninicacid,BCA)蛋白定量试剂盒、增强化学发光试剂(enhancedchemiluminescence,ECL)均购自武汉博尔夫生物科技有限公司;兔抗TRAF5、MEK、p38丝裂原活化蛋白激酶(p58MAPK)、磷酸化p38MAPK(pp38MAPK)、氨基末端激酶(JNK)、磷酸化JNK(pJNK)、β肌动蛋白(βactin)一抗以及辣根过氧化物酶标记的山羊抗兔二抗均购自美国Abcam公司。
MCO15AC型恒温培养箱购自日本SANYO公司;FACSVerse流式细胞仪购自美国BD公司;ST360多功能酶标仪购自上海科华生物工程股份有限公司;ChemiDocTouch化学发光成像系统购自美国BioRad公司;Accurate96qRTPCR仪购自北京信钰仪器有限公司。
1.2实验方法
1.2.1细胞培养
将心肌细胞H9c2置于含10%胎牛血清和1%青霉素链霉素的DMEM培养基中,在37℃下、5%CO2细胞培养箱中培养。当细胞贴壁生长达到80%左右时,收集心肌细胞进行实验。
1.2.2缺氧细胞模型建立、细胞转染及分组
实验分为对照组(Control组)、缺氧组(Hypoxic组)、缺氧+空载质粒对照组(Hypoxic+pcDNANC组)、缺氧+TRAF5过表达组(Hypoxic+pcDNATRAF5组)。其中Control组H9c2细胞正常培养12h;Hypoxic组H9c2细胞用800μmol/L浓度的CoCl2处理12h;Hypoxic+pcDNANC组H9c2细胞转染pcDNANC质粒48h后用800μmol/L浓度的CoCl2处理12h;Hypoxic+pcDNATRAF5组H9c2细胞转染pcDNATRAF5质粒48h后用800μmol/L浓度的CoCl2处理12h。使用LipofectamineTM2000试剂盒进行细胞转染,转染过程严格按照试剂盒说明书进行。
1.2.3qRTPCR法检测细胞TRAF5mRNA表达
使用Trizol试剂从H9c2细胞中提取总RNA,以紫外分光光度计测量RNA纯度和浓度。使用反转录试剂盒将RNA反转录成cDNA,以cDNA为模板进行qRTPCR扩增。引物序列:TRAF5正向引物为5′CACTCCGTGCTTCACAAC3′,反向引物为5′AAGGTGGTCCTGGAATCG3′;甘油醛3磷酸脱氢酶(glyceraldehyde3phosphatedehydrogenase,GAPDH)正向引物为5′ATCACTGCCACCCAGAAG3′,反向引物为5′TCCACGACGGACACATTG3′。反应条件(40次循环):95℃60s,95℃40s,60℃40s,72℃30s。使用GAPDH作为内部对照基因,以2-△△Ct法计算目的基因相对表达水平。
1.2.4CCK8法检测细胞存活率
收集处理后的细胞,将细胞稀释至3×105个/mL并按每孔100μL接种到96孔培养板中,培养24h后,每孔加入10μL用无血清DMEM培养基稀释的CCK8溶液,混匀后,在37℃、5%CO2的培养箱中继续培养2h,用酶标仪测量450nm处各孔的吸光度(absorbance,A),计算细胞存活率,细胞存活率=A处理组/A对照组×100%。实验重复3次。
1.2.5流式细胞术检测细胞凋亡情况
收集处理后的细胞,用磷酸盐缓冲液(PBS)冲洗细胞两次,以500μL结合缓冲液重悬细胞调整细胞浓度为1×106/mL,取100μL细胞悬液加入5μL的AnnexinVFITC溶液和10μL的PI溶液,室温下避光孵育15min,采用流式细胞仪进行检测,计算细胞凋亡率。实验重复3次。
1.2.6试剂盒法测定细胞中LDH、SOD、GSHPx活性及MDA含量
收集处理后的H9c2细胞,根据相应试剂盒说明书进行实验,检测细胞中LDH、SOD、GSHPx活性及MDA含量。
1.2.7蛋白免疫印迹法(WesternBlot)检测细胞中相关蛋白表达
使用含有蛋白酶抑制剂的RIPA裂解缓冲液提取细胞中总蛋白,BCA法检测蛋白浓度。将蛋白质通过10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)分离并转移到聚偏二氟乙烯(PVDF)膜,用含5%脱脂牛奶的TBST封闭1h后,在4℃下用TRAF5(1∶1000)、ERK(1∶800)、pERK(1∶800)、p38MAPK(1∶800)、pp38MAPK(1∶800)、JNK(1∶800)、pJNK(1∶800)、βactin(1∶1000)一抗孵育过夜,TBST洗涤3次,每次5min,将膜与辣根过氧化物酶标记的山羊抗兔二抗(1∶2000)在室温下孵育2h,TBST洗涤3次,每次5min,随后用ECL发光液显影,以βactin为内参,采用ImageJ软件分析。
1.3统计学处理
采用SPSS25.0软件进行统计学分析。符合正态分布的定量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSDt检验。以P<0.05为差异有统计学意义。
2结果
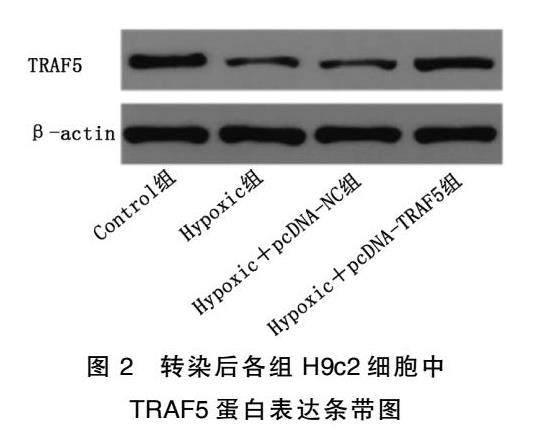
2.1转染后各组H9c2细胞中TRAF5表达水平比较
与Control组比较,Hypoxic组H9c2细胞中TRAF5mRNA和蛋白表达水平均降低,差异均有统计学意义(P<0.05);与Hypoxic组比较,Hypoxic+pcDNANC组H9c2细胞中TRAF5mRNA和蛋白表达水平变化差异无统计学意义(P>0.05),Hypoxic+pcDNATRAF5组H9c2细胞中TRAF5mRNA和蛋白表达水平均升高,差异有统计学意义(P<0.05)。详见图1~图3。
2.2TRAF5过表达对缺氧诱导的H9c2细胞存活率和凋亡率的影响
与Control组比较,Hypoxic组H9c2细胞存活率降低,细胞凋亡率升高,差异均有统计学意义(P<0.05);与Hypoxic组比较,Hypoxic+pcDNANC组H9c2细胞存活率和细胞凋亡率变化差异均无统计学意义(P>0.05),Hypoxic+pcDNATRAF5组H9c2细胞存活率升高,细胞凋亡率降低,差异均有统计学意义(P<0.05)。详见图4~图6。
2.3TRAF5过表达对缺氧诱导的H9c2细胞中LDH水平的影响
与Control组比较,Hypoxic组H9c2细胞中LDH水平升高,差异有统计学意义(P<0.05);与Hypoxic组比较,Hypoxic+pcDNANC组H9c2细胞中LDH水平变化差异无统计学意义(P>0.05),Hypoxic+pcDNATRAF5组H9c2细胞中LDH水平降低,差异有统计学意义(P<0.05)。详见图7。
2.4TRAF5过表达对缺氧诱导的H9c2细胞中氧化应激水平的影响
与Control组比较,Hypoxic组H9c2细胞中SOD、GSHPx水平均降低,MDA含量升高,差异均有统计学意义(P<0.05);与Hypoxic组比较,Hypoxic+pcDNANC组H9c2细胞中SOD、GSHPx、MDA水平变化差异均无统计学意义(P>0.05),Hypoxic+pcDNATRAF5组H9c2细胞中SOD、GSHPx水平均升高,MDA含量降低,差异均有统计学意义(P<0.05)。详见表1。
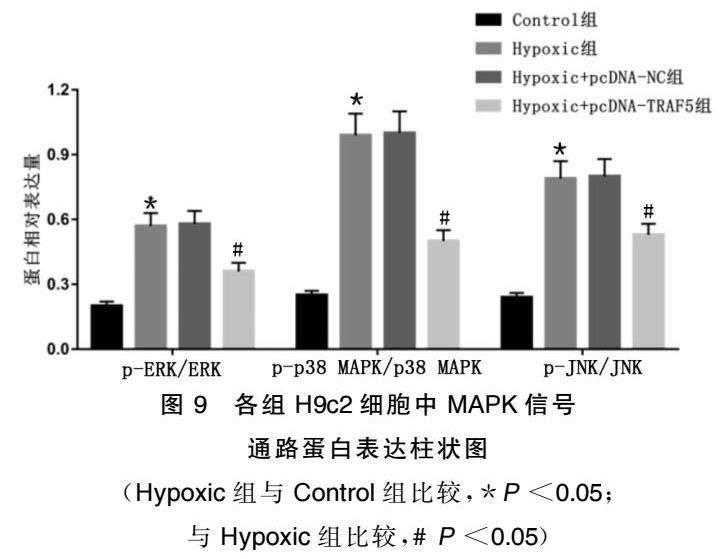
2.5TRAF5过表达对缺氧诱导的H9c2细胞中MAPK信号通路的影响
与Control组比较,Hypoxic组H9c2细胞中pERK/ERK、pp38MAPK/p38MAPK、pJNK/JNK比值均升高,差异均有统计学意义(P<0.05);与Hypoxic组比较,Hypoxic+pcDNANC组H9c2细胞中pERK/ERK、pp38MAPK/p38MAPK、pJNK/JNK比值变化差异均无统计学意义(P>0.05),Hypoxic+pcDNATRAF5组H9c2细胞中pERK/ERK、pp38MAPK/p38MAPK、pJNK/JNK比值均降低,差异均有统计学意义(P<0.05)。详见图8、图9。
3讨论
TRAF家族是一个关键的适应因子家族,存在于哺乳动物和多细胞生物中,迄今为止,已经确定了TRAF家族的7名成员(TRAF1~7),其中TRAF5因其结构的特殊性,可作为连接细胞表面受体和细胞内信号通路的细胞质衔接蛋白,调控多种信号通路,参与免疫调节、炎症反应、细胞增殖和凋亡、自噬和细胞因子合成等许多生物学过程[1011]。有研究报道,TRAF5能够与肿瘤坏死因子(TNF)受体的细胞质部分结合,介导下游核因子κB(NFκB)、干扰素调节因子3(IRF3)和MAPK信号通路[12]。TRAF5还负性调节B淋巴细胞中的Toll样受体信号[13]。Teng等[14]研究表明,过表达miRNA4103p通过靶向TRAF5保护缺氧诱导的心肌细胞损伤。Cai等[15]研究表明,上调miR29b3p通过靶向TRAF5保护缺氧诱导的心肌细胞凋亡。这些研究结果均提示TRAF5参与缺氧诱导的心肌细胞损伤,但TRAF5参与缺氧诱导的心肌细胞损伤的相关分子机制尚未完全清楚。本研究结果显示,缺氧诱导的H9c2细胞中TRAF5表达下降,同时,H9c2细胞存活率下降,凋亡率增加。TRAF5过表达则能够提高细胞存活率、降低细胞凋亡率。该结果表明TRAF5对缺氧诱导的心肌细胞具有保护作用。
LDH是人体能量代谢过程中的一种重要酶,几乎存在于肝脏、肾脏、心肌、骨骼肌、胰腺和肺等所有组织中。当组织坏死发生时,血液中的LDH水平会升高。LDH常被用作心肌坏死的辅助诊断标志物[16]。心肌损伤时LDH水平升高,LDH水平降低则提示心肌损伤得到改善[17]。氧化应激是心肌缺血缺氧损伤时的病理生理学标志,持续的低氧可诱导心肌中活性氧(ROS)的产生。而高水平的ROS会导致心肌细胞凋亡,并激活多个不良级联反应,进一步导致心肌细胞功能障碍[18]。因此,抗氧化指标SOD、GSHPx、MDA水平也用于评估氧化应激导致的心肌细胞损伤[19]。Tang等[20]研究表明,缺氧诱导的心肌细胞中MDA含量增加,SOD、GSHPx活性相应降低,而升高抗氧化酶活性,降低脂质过氧化产物含量,提高心肌细胞抗氧化能力,能够明显减少心肌细胞凋亡,改善缺氧诱导的心肌细胞损伤。本研究中,缺氧诱导的H9c2细胞中SOD、GSHPx活性下降,LDH活性和MDA含量升高。该结果与上述研究结果一致,缺氧诱导的心肌细胞存在氧化应激反应。而缺氧诱导的H9c2细胞中TRAF5过表达时,细胞中SOD、GSHPx水平均升高,LDH活性和MDA含量降低,提示TRAF5过表达可能通过调控细胞内心肌酶活性和氧化应激反应保护缺氧诱导的心肌细胞损伤。
MAPK通路是细胞内识别并响应细胞外刺激的特定信号转导过程,主要包括p38MAPK、ERK和JNK通路。ERK通路与细胞增殖、转化和分化相关,而JNK和p38MAPK通路则参与细胞凋亡、癌基因转化以及炎症反应等[2122]。MAPK通路在心血管疾病中被激活,参与细胞存活和受损心肌细胞凋亡的恢复[23]。心肌发生缺血缺氧损伤时,氧化应激可导致MAPK级联的激活。在缺氧/复氧诱导的心肌细胞损伤中JNK和p38MAPK信号通路被激活,抑制JNK和p38MAPK通路可保护心肌细胞免受缺氧/复氧诱导的损伤[24]。也有研究报道,阻断MAPK信号通路能够有效保护H9c2细胞免受钴氯酸盐诱导的缺氧损伤[25]。既往研究证实,TRAF5可通过介导MAPK通路参与黑色素瘤发展和经典猪瘟病毒复制[2627]。TRAF5还通过靶向JNK信号通路调控肝脏脂肪变性[28]。这些研究结果均表明TRAF5可通过调控MAPK通路介导疾病发生发展。本研究结果显示,缺氧诱导的H9c2细胞中p38MAPK、ERK及JNK磷酸化水平均升高,表明MAPK通路激活参与缺氧诱导的H9c2细胞损伤。TRAF5过表达明显降低了缺氧诱导H9c2细胞中p38MAPK、ERK及JNK磷酸化水平。提示TRAF5可能通过抑制MAPK通路激活减轻缺氧诱导的H9c2细胞损伤。
综上所述,TRAF5参与缺氧诱导的心肌细胞损伤,TRAF5过表达可通过调控心肌酶活性和氧化应激反应保护缺氧诱导的心肌损伤,其作用机制可能与调控MAPK通路活性有关。TRAF5有望成为AMI治疗的新靶点。
参考文献:
[1]KIMURAW,NAKADAY,SADEKHA.Hypoxiainducedmyocardialregeneration[J].JournalofAppliedPhysiology,2017,123(6):16761681.
[2]FANJL,ZHUTT,XUEZY,etal.lncRNAXISTprotectsthehypoxiainducedcardiomyocyteinjurythroughregulatingthemiR125bhexokianse2axis[J].InVitroCellular&DevelopmentalBiologyAnimal,2020,56(4):349357.
[3]WULP,CHENYF,CHENYY,etal.EffectofHIF1α/miR10b5p/PTENonhypoxiainducedcardiomyocyteapoptosis[J].JournaloftheAmericanHeartAssociation,2019,8(18):e011948.
[4]JINAP,CHENGHJ,XIALN,etal.Inhibitionofsphingomyelinsynthase2relieveshypoxiainducedcardiomyocyteinjurybyreinforcingNrf2/AREactivationviamodulationofGSK3β[J].Human&ExperimentalToxicology,2021,40(5):791800.
[5]RENJ,LIJJ,HUJW,etal.OverexpressionofCKIP1alleviateshypoxiainducedcardiomyocyteinjurybyupregulatingNrf2antioxidantsignalingviaKeap1inhibition[J].Biochimie,2019,163:163170.
[6]NAGASHIMAH,ISHIIN,SOT.Regulationofinterleukin6receptorsignalingbyTNFreceptorassociatedfactor2and5duringdifferentiationofinflammatoryCD4+Tcells[J].FrontiersinImmunology,2018,9:1986.
[7]GISSLERMC,ANTOMICHELN,PENNIGJ,etal.GeneticdeficiencyofTRAF5promotesadiposetissueinflammationandaggravatesdietinducedobesityinmice[J].Arteriosclerosis,Thrombosis,andVascularBiology,2021,41(10):25632574.
[8]XUWP,ZHANGL,MASX,etal.TRAF5protectsagainstmyocardialischemiareperfusioninjuryviaAKTsignaling[J].EuropeanJournalofPharmacology,2020,878:173092.
[9]BIANZY,DAIJ,HIROYASUN,etal.Disruptionoftumornecrosisfactorreceptorassociatedfactor5exacerbatespressureoverloadcardiachypertrophyandfibrosis[J].JournalofCellularBiochemistry,2014,115(2):349358.
[10]ARKEET,BISHOPGA.TRAFfamilymoleculesinTcells:multiplereceptorsandfunctions[J].JournalofLeukocyteBiology,2020,107(6):907915.
[11]PARKHH.StructureofTRAFfamily:currentunderstandingofreceptorrecognition[J].FrontiersinImmunology,2018,9:1999.
[12]SUNMS,WUST,ZHANGX,etal.GrouperTRAF5exertsnegativeregulationonantiviralimmuneresponseagainstiridovirus[J].Fish&ShellfishImmunology,2021,115:713.
[13]BUCHTACM,BISHOPGA.TRAF5negativelyregulatesTLRsignalinginBlymphocytes[J].JournalofImmunology,2014,192(1):145150.
[14]TENGYL,RENF,XUH,etal.OverexpressionofmiRNA4103pprotectshypoxiainducedcardiomyocyteinjuryviatargetingTRAF5[J].EuropeanReviewforMedicalandPharmacologicalSciences,2019,23(20):90509057.
[15]CAIYH,LIYP.UpregulationofmiR29b3pprotectscardiomyocytesfromhypoxiainducedapoptosisbytargetingTRAF5[J].Cellular&MolecularBiologyLetters,2019,24:27.
[16]徐识.血清LDH、αHBDH在有机磷农药中毒伴心肌损伤患者中的检测分析及表达意义[J].现代诊断与治疗,2021,32(22):36403641.
[17]GABRIELOVE,KRENV,JABUREKM,etal.Silymarincomponent2,3dehydrosilybinattenuatescardiomyocytedamagefollowinghypoxia/reoxygenationbylimitingoxidativestress[J].PhysiologicalResearch,2015,64(1):7991.
[18]CADENASS.ROSandredoxsignalinginmyocardialischemiareperfusioninjuryandcardioprotection[J].FreeRadicalBiology&Medicine,2018,117:7689.
[19]ZHANGY,ZHAOQH,LIXH,etal.Dexmedetomidinereversedhypoxia/reoxygenationinjuryinducedoxidativestressandendoplasmicreticulumstressdependentapoptosisofcardiomyocytesviaSIRT1/CHOPsignalingpathway[J].MolecularandCellularBiochemistry,2021,476(7):28032812.
[20]TANGQ,LIMY,SUYF,etal.AbsenceofmiR2233pameliorateshypoxiainducedinjurythroughrepressingcardiomyocyteapoptosisandoxidativestressbytargetingKLF15[J].EuropeanJournalofPharmacology,2018,841:6774.
[21]FUQ,MOTR,HUXY,etal.miR19amitigateshypoxia/reoxygenationinducedinjurybydepressingCCL20andinactivatingMAPKpathwayinhumanembryoniccardiomyocytes[J].BiotechnologyLetters,2021,43(2):393405.
[22]WANGG,CUIJ,GUOYF,etal.CyclosporinAprotectsH9c2cellsagainstchemicalhypoxiainducedinjuryviainhibitionofMAPKsignalingpathway[J].InternationalHeartJournal,2016,57(4):483489.
[23]CHENSJ,YANGBS,XUYF,etal.ProtectionofLuteolin7Oglucosideagainstapoptosisinducedbyhypoxia/reoxygenationthroughtheMAPKpathwaysinH9c2cells[J].MolecularMedicineReports,2018,17(5):71567162.
[24]LIUCT,LIUHW,SUNQ,etal.MicroRNA1283alleviatescardiomyocytedamagecausedbyhypoxia/reoxygenationviatargetingGADD45AandinactivatingtheJNKandp38MAPKsignalingpathways[J].KardiologiaPolska,2021,79(2):147155.
[25]LIMC,LIK,RENY.Nesfatin1protectsH9c2cardiomyocytesagainstcobaltchlorideinducedhypoxicinjurybymodulatingtheMAPKandNotch1signalingpathways[J].JournalofBiologicalResearchThessaloniki,2021,28(1):21.
[26]LIM,LONGCQ,YANGGL,etal.MiR26binhibitsmelanomacellproliferationandenhancesapoptosisbysuppressingTRAF5mediatedMAPKactivation[J].BiochemicalandBiophysicalResearchCommunications,2016,471(3):361367.
[27]LVHF,DONGW,GUOKK,etal.Tumornecrosisfactorreceptorassociatedfactor5interactswiththeNS3proteinandpromotesclassicalswinefevervirusreplication[J].Viruses,2018,10(6):305.
[28]GAOL,WANGPX,ZHANGYX,etal.Tumornecrosisfactorreceptorassociatedfactor5(Traf5)actsasanessentialnegativeregulatorofhepaticsteatosis[J].JournalofHepatology,2016,65(1):125136.
(收稿日期:20220901)
(本文编辑郭怀印)
基金项目湖北省卫生健康委青年人才项目(No.WJ2019Q011)
作者单位黄石市中心医院/湖北理工学院附属医院(湖北黄石435000)
通讯作者张城炼,Email:466122457@qq.com
引用信息蔡振璇,张城炼,许卫攀.肿瘤坏死因子受体相关因子5对缺氧诱导心肌细胞损伤的影响及作用机制研究[J].中西医结合心脑血管病杂志,2024,22(6):10211026.
