4种无患子科植物的SMXL家族全基因组鉴定、进化及DlSMXLs在龙眼体胚发生过程中的表达分析
2024-06-12陈莹张春渝许小琼林玉玲赖钟雄
陈莹 张春渝 许小琼 林玉玲 赖钟雄


收稿日期:2024-01-05
基金項目:国家自然科学基金项目(31572088);福建省高原学科建设经费(102/71201801101);福建农林大学科技创新专项基金
项目(KFA19037A)
作者简介:*为通讯作者,赖钟雄(1966-),男,研究员,博士,博士生导师,主要从事园艺植物的生物技术与遗传资源研究,E-mail:
Laizx01@163.com。陈莹(2003-),女,从事果树生物技术研究,E-mail:863445312@qq.com
4种无患子科植物的SMXL家族全基因组鉴定、进化
及DlSMXLs在龙眼体胚发生过程中的表达分析
陈 莹,张春渝,许小琼,林玉玲,赖钟雄*
(福建农林大学园艺植物生物工程研究所,福建福州 350002)
摘要:【目的】为研究无患子科SMXL家族的生物学特性提供理论参考,深入探究该基因家族在无患子科植物非生物胁迫响应中的调控机制。【方法】基于模式植物拟南芥SMXL家族的氨基酸序列,利用TBtools对龙眼、红毛丹、无患子和荔枝的SMXL家族成员进行全基因组鉴定,Expasy、MEGA11等软件用于4种无患子科植物的进化和功能分析,同时利用龙眼转录组数据进行体胚发生早期阶段的表达分析。【结果】4种无患子科植物共鉴定出48个SMXL家族成员,其中龙眼11个、红毛丹11个、无患子9个以及荔枝17个。依据拟南芥SMXL家族成员的分类,将4种无患子科SMXL家族成员分为5个亚族且亚细胞定位于叶绿体、细胞核、细胞质或线粒体。蛋白互作分析表明,无患子科SMXL家族成员可能与多种蛋白存在互作关系,主要分为两类:一种是与受到非生物胁迫时大量表达的热休克蛋白(HSPs)或CLPs互作;另一种是与独角金内酯受体蛋白D14、karrikins受体蛋白KAI2和调控SL信号传导途径的蛋白MAX2进行互作。启动子顺式作用元件分析表明,4种无患子科植物SMXL家族成员存在较多的光响应元件、抗氧化反应元件(ARE)和脱落酸响应元件(ABRE)等,推测该基因家族广泛参与非生物胁迫响应。此外,DlSMXL家族成员在龙眼体胚发生早期存在5种不同的表达模式,其中DlSMXL4基因家族成员在胚性愈伤组织(EC)、不完全胚性紧实结构(ICpEC)和球形胚(GE)阶段相较其他成员呈现较高表达。基于5-氮胞苷、PEG、SL、光、温度和各种激素处理龙眼EC时期转录组数据分析可知,龙眼DlSMXL5在干旱、GR24、黑暗和高温处理下表达量均明显增加,推测该成员能够通过响应植物激素和应激胁迫维持胚性愈伤组织形态。其次DlSMXL8在5-氮胞苷处理时表达上调,推测其可能参与DNA甲基化在龙眼体胚发生过程中发挥作用。【结论】4种无患子科植物SUPPRESSOR OF MAX2-LIKE(SMXL)家族除了在植物生长发育过程种发挥重要的作用,同时还广泛参与植物非生物胁迫调控过程。本研究结果为无患子科植物中SMXL的分类和生物学功能提供了理论依据,并为SMXL在龙眼早期体细胞胚胎发生中的功能验证提供了更好的认识。
关键词:无患子科;SMXL基因家族;全基因组鉴定;进化分析;龙眼早期表达分析
中图分类号:S667 文献标识码:A 文章编号:2095-5774(2024)01-0017-13
Genome-wide Identification and Evolutionary Analysis of the SMXL Gene Family
in Four Sapindaceae Species and Expression Analysis of DlSMXLs during Somatic
Embryogenesis in Longan
Chen Ying,Zhang Chunyu,Xu Xiaoqiong,Lin Yuling,Lai Zhongxiong*
(Institute of Horticultural Bioengineering,Fujian Agriculture and Forestry University,Fuzhou,Fujian 350002,China)
Abstract:【Objective】To provide a theoretical reference for the study of the biological characterization of the SMXL family of Sapindaceae,and to delve into the regulatory mechanism of this gene family in the abiotic stress response of Sapindaceae plants. 【Method】Based on the amino acid sequences of the SMXL family of the model plant Arabidopsis thaliana,TBtools was used for genome-wide identification of SMXL family members from longan,rambutan, sapindus,and litchi. MEGA11 was used to construct the phylogenetic tree,and online software such as Expasy,WoLF PSORT,MEME,STRING,PlantCARE,etc. were used to predict the protein physicochemical properties,subcellular structural localization,conserved motifs,protein interactions,cis-acting elements,etc. respectively. Longan transcriptome data were also utilized for expression analysis in the early stages of somatic embryogenesis. 【Result】Forty-eight SMXL family members were identified in four Sapindaceae species,including 11 in longan,11 in rambutan,9 in sapindus,and 17 in litchi. According to the classification of the SMXL family of Arabidopsis thaliana,the SMXL family members in four Sapindaceae species could be divided into 5 subfamilies,and the subcells were located in chloroplasts,nuclei,cytoplasm or mitochondria. Protein interaction analyses showed that SMXL family members in Sapindaceae could interact with a variety of proteins,which were mainly classified into two categories:one with the heat shock proteins (HSP) or CLP,which were abundantly expressed when subjected to abiotic stress; the other interacted with the strigolactone receptor protein D14,the karrikin receptor protein KAI2,and the MAX2 protein,which regulated the SL signaling pathway. The results of the cis-element analysis showed that among the SMXL family members of the four Sapindaceae species,there were more light-responsive elements,anaerobiosis-inducible elements (ARE),and abscisic acid-responsive elements (ABRE),etc. Therefore,it was hypothesized that the SMXL members were largely involved in the response to abiotic stress in Sapindaceae. Furthermore,there were five different expression profiles of the DlSMXL family during the early SE in longan,with the DlSMXL4 showing higher expression at embryogenic callus (EC),incomplete compact pro-embryogenic (ICpEC),and globular embryos (GE) stages compared with the other members. Based on analysis of transcriptomic data at longan EC treated with 5-azacytidine,PEG,SL,light,temperature,and various hormones,it could be seen that DlSMXL5 expression was significantly increased by drought,GR24,darkness,and high-temperature treatments. It is hypothesized that this member is capable of maintaining embryonic healing tissue morphology in response to phytohormones and stressful stresses. Secondly,DlSMXL8 was up-regulated after 5-azacytidine treatment,which might be involved in DNA methylation playing a role during somatic embryogenesis in longan. 【Conclusion】As well as playing a critical role in plant growth and development,the SMXL family of four Sapindaceae species is also widely implicated in the regulation of abiotic stress. Our results provide a theoretical basis for the classification and biological function of SMXLs in the Sapotaceae and give a better understanding of the functional validation of SMXLs in early somatic embryogenesis longan.
Key words:Sapindaceae;SMXL;Genome-wide identification;Evolutionary analysis;Early somatic embryogenesis in longan
无患子科植物全世界共有144属,1680余种,广泛分布于热带和亚热带,少数种类可分布到温带,为一典型的泛热带分布科[1],主要包括龙眼、红毛丹、无患子和荔枝等,均属于乔木,树体高大,童期长,遗传上高度杂合,常规育种难度大[2]。但其在材用、工业用、药用、食用、生态环境保护和绿化观赏等方面发挥重要的作用[3],以其作为研究对象有较高的经济和生态价值。
独脚金内酯(Strigolactones,SLs)是一类萜类小分子化合物,广泛存在于植物界中[4],来源于类胡萝卜素,涉及广泛的生理功能,包括调节植物结构(抑制芽生长和芽分枝)、光形态发生、种子萌发、结瘤和对非生物因素的生理反应[5]。此外,独脚金内酯作为根际信号能促进寄主植物与丛枝菌根真菌的共生,有助于植物吸收水分和营养,但也会刺激寄生杂草种子的萌发,造成农作物的严重减产[6]。负责独脚金内酯信号传导的蛋白大体分为 3 类:α/β 折叠型水解酶 DWARF14(D14)/ DECREASED APICAL DOMINANCE2(DAD2)/ RAMOSUS3(RMS3),富亮氨酸重复序列 F- box 蛋白 DWARF3(D3)/MORE AXILLARY GROWTH2(MAX2) 以及 Clp 蛋白酶家族 DWARF53(D53)/SUPPRESSOR OF MORE AXILLARY GROWTH2 LIKE I(SMXLs)[7-10]。已有研究表明,在拟南芥和水稻中,SMXL6、SMXL7和SMXL8及其同源物、与蛋白D14和蛋白MAX2在独脚金内酯感知过程中形成一个复合物,并在独脚金内酯信号传导中发挥核心作用[6,11-16]。玉米DWARF 53与SL受体DWARF 14A/B(ZmD14A/B)相互作用影响植株过多分蘖和减少雄穗分枝,是玉米SL信号途径的抑制因子[17]。D53/SMXLs基因除了作为独角金内酯信号传导的抑制因子,还可以通过此通路来控制其他激素,李家洋团队发现,抑制SL信号通路可能导致水稻茎基部生长素含量升高[18]。
SMXL基因對植物的生长和发育起重要的调控作用,目前已从拟南芥[19]、大豆[20]、苹果[21]、油菜籽[22]和龙眼[23]等植物中鉴定出SMXL家族成员,但在荔枝、无患子和红毛丹等无患子科植物中尚未见到详细报道。本研究对4种无患子科植物SMXL基因的结构、其编码蛋白的亚细胞定位及其互作蛋白等进行研究,为揭示无患子科植物SMXL家族成员的潜在功能提供理论依据。
1 试验材料及方法
1.1试验材料
利用第三代龙眼基因组数据(NCBI登录号:PRJNA792504)和转录组数据及从SapBase(http://www.sapindaceae.com/about.html)获取红毛丹、无患子和荔枝的基因组数据和转录组数据进行分析。从TAIR网站获取拟南芥SMXL家族成员并下载其氨基酸序列,从NCBI网站上获取甘蔗SMXL家族成员及其氨基酸序列,甜橙的基因组数据下载于CPBD网站。
1.2试验方法
1.2.1 4种无患子科植物SMXL家族成员的鉴定、蛋白基本理化性质分析和亚细胞结构定位
通过TAIR获取拟南芥的SMXL基因家族的氨基酸序列,利用TBtools[24]以E-value参数为10-5为限制与龙眼、红毛丹、无患子和荔枝的基因组数据进行单向blastp的同源比对。使用NCBI获取保守结构域文件,再删除重复序列,最终确定龙眼、红毛丹、无患子和荔枝SMXL家族成员。
利用Expasy进行蛋白质理化性质预测;通过WoLF PSORT网站预测亚细胞结构定位;在线软件SignalP 6.0用于进行蛋白信号肽的预测。
1.2.2 4种无患子科植物SMXL家族成员系统进化树的构建和进化分析
利用MEGA11软件对龙眼、红毛丹、无患子、荔枝、拟南芥、甜橙和甘蔗SMXL家族成员的氨基酸序列进行进化分析,使用ClustalW进行蛋白序列比对,参数设置:邻接法(NJ)、自展值(Bootstrap)为1000、Passion Model并删除数值小于70的枝干,构建进化树,最后利用在线软件iTOL (version 6.9)进行美化。
1.2.3 4种无患子科植物SMXL基因家族成员的染色体定位
基于龙眼、红毛丹、无患子和荔枝的基因组数据,利用TBtools进行染色体位置定位分析。
1.2.4 4种无患子科植物SMXL家族成员基因结构、保守基序、蛋白保守结构域和蛋白互作分析
利用MEME进行保守基序预测与分析,保守基序数设定为9,其他默认参数;利用NCBI进行蛋白保守结构域的预测,默认参数值;最后,基于龙眼、红毛丹、无患子和荔枝的基因组数据,利用TBtools对各个物种的基因结构、保守基序和蛋白保守结构域进行可视化。利用STRING (https://string-db.org/)在线软件,以模式植物拟南芥为选择标准,进行蛋白互作分析,选择一致性百分比最高的蛋白,置信水平设置为0.4。
1.2.5 4种无患子科植物SMXL家族启动子顺式元件分析和转录因子结合位点预测
基于龙眼、红毛丹、无患子和荔枝的基因组数据,利用TBtools 提取DlSMXL、NlSMXL、SsSMXL 和LcSMXL家族成员上游2 000 bp基因序列,并获取目的基因的启动子文件,再利用PlantCARE预测启动子区域的顺式作用元件,TBtools用于结果的可视化。
1.2.6 龙眼SMXL家族在体胚发生早期阶段的表达分析
利用龙眼转录组数据库数据获取龙眼SMXL基因家族成员在体胚发生早期不同阶段中特异表达的FPKM值,利用TBtools绘制热图,分析各成员在体胚发生早期不同阶段的表达模式。
利用龙眼5-氮胞苷[25]、PEG(PEG 5%和PEG 7.5%)[26]、SL[23]、温度(15℃、25℃和35℃)[27]、光照[28]和各种激素处理(2,4-D、2,4-D+KT、KT和MS)转录组数据,提取DlSMXL家族成员在EC阶段不同处理状态下的FPKM值,借助TBtools绘制热图,分析各成员在不同处理下的表达模式。
2 结果与分析
2.1 4种无患子科植物SMXL家族成员的鉴定
通过鉴定,从龙眼基因组中初步获取14个DlSMXL家族成员,利用NCBI和TBtools分析DlSMXL的保守结构域,删除了2个不含基本保守结构域的DlSMXL成员:Dlo016182和Dlo016183,继续将剩下成员的氨基酸序列比对,发现龙眼Dlo011406和Dlo010410为冗余序列,删除Dlo011406成员,最终确定DlSMXL家族有11个成员。结合各成员在龙眼基因组中的相对位置,按照顺序依次命名为DlSMXL1-DlSMXL11。按照同样的方法获取红毛丹11个SMXL家族成员并将其命名为NlSMXL1-NlSMXL11;无患子SMXL家族9个成员命名为SsSMXL1-SsSMXL9;荔枝SMXL家族17个成员命名为LcSMXL1-LcSMXL17。
2.2 系统进化树的构建和进化分析
为进一步了解4种无患子科植物SMXL家族成员的生理功能和进化关系,利用MEGA11对龙眼、红毛丹、无患子、荔枝、拟南芥、甜橙和甘蔗共75条SMXL蛋白序列,进行系统进化分析表明(图1),依据拟南芥SMXL家族成员的分类,可将本研究SMXL家族的75个成员分为5个亚族。亚族Ⅰ有6个成员,亚族Ⅱ有15个成员,亚族Ⅲ共11个成员,亚族Ⅳ共7个成员及亚族Ⅴ共36个成员。亚族Ⅰ中成员数最少且不包括无患子成员。亚族Ⅴ中成员数量最多,包含甘蔗成员,但不具有拟南芥成员,推测亚族Ⅴ中的成员在进化过程中出现了功能的特异性分化。本文亚族分类均由此得出。
2.3 4种无患子科植物SMXL蛋白质理化性质分析和亚细胞结构定位预测
4种无患子科植物的蛋白氨基酸数介于306 aa~1149 aa,分子量介于34.34 kDa~125.72 kDa,同亚族成员之间大小差异较小;等电点介于4.95~8.51,大量成员呈酸性,仅亚族Ⅰ、Ⅲ和Ⅴ中存在成员表现为碱性;不稳定系数介于34.95~60.56,除了亚族Ⅴ,其余亚族成员均为不稳定蛋白;脂溶指数介于74.84~103.14,均为亲水蛋白,且均无信号肽。根据亚细胞结构定位分析可知,亚族Ⅰ和亚族Ⅱ成员主要在细胞核上行使功能,亚族Ⅲ和亚族Ⅳ成员主要在叶绿体上发挥作用,亚族Ⅴ成员主要定位在叶绿体或细胞质上。
2.4 4种无患子科植物SMXL家族成员的染色体定位分析
为进一步了解各个家族成员之间的关系,通过TBtools对家族成员进行染色体的定位分析,根据结果可知:龙眼DlSMXL家族的11个成员分布在6条染色体上:chr1(DlSMXL1、DlSMXL8、DlSMXL9)、chr5(DlSMXL10、DlSMXL11)、chr12(DlSMXL6)、chr13(DlSMXL3、DlSMXL4)、chr14(DlSMXL2、DlSMXL7)和chr15(DlSMXL5)。红毛丹NlSMXL家族的11个成员分布也在6条染色体上,分别是chr8(NlSMXL3、NlSMXL5、NlSMXL10)、chr11(NlSMXL6、NlSMXL9)、chr2(NlSMXL1、NlSMXL11)、chr7(NlSMXL4、NlSMXL7)、chr15(NlSMXL8)和chr9(NlSMXL2)。无患子SsSMXL家族的9个成员分布在5条染色体上,分别是chr02(SsSMXL1、SsSMXL5)、chr05(SsSMXL4)、chr06(SsSMXL3、SsSMXL9)、chr13(SsSMXL2、SslSMXL8)和chr14(SsSMXL6、SsSMXL7)。荔枝LcSMXL家族的17个成员分布在7条染色体上,染色体由长到短分别是Chr1,其包括LcSMXL1、LcSMXL7、LcSMXL8、LcSMXL11四個成员;Chr3包括LcSMXL14、LcSMXL17两个成员;Chr7包括LcSMXL2、LcSMXL9、LcSMXL16三个成员;Chr10包括LcSMXL5一个成员;Chr12包括LcSMXL4、LcSMXL12、LcSMXL13、LcSMXL15四个成员;Chr13包括LcSMXL6一个成员和Chr15包括LcSMXL3、LcSMXL10两个成员。
2.5 4种无患子科植物SMXL家族成员蛋白保守结构域、基因结构和保守基序种类预测分析
为更深入了解DlSMXL、NlSMXL、SsSMXL和LcSMXL基因结构多样性,将龙眼、红毛丹、无患子和荔枝的SMXL家族5个亚族成员的保守基序、蛋白保守结构域和基因结构进行可视化分析。结果(图2)表明:4种无患子科植物SMXL家族成员的外显子数量为1~13,LcSMXL15和LcSMXL16的基因长度较短,DlSMXL4、SsSMXL3和LcSMXL12的基因长度较长。Motif 3是所有成员均具备的保守基序,保守性较强。保守结构域共有6种,分别是RecA-like_ClpB_Hsp104-like、ClpA superfamily、P-loop_NTPase superfamily、chaperone_ClpB superfamily、clpC和clpC superfamily。同一亚族成员的基因结构、保守基序的种类和保守结构域极为相似,故推测处于同一亚族的成员在结构和功能上具有相似性。
2.6 4种无患子科植物SMXL家族成员蛋白互作分析
为了解无患子科SMXL家族成员表达的蛋白与其他蛋白的互作关系,进一步挖掘核心的调控基因,探究基因的潜在功能,采用STRING在线软件,得到蛋白互作预测结果表明:亚族Ⅰ成员与SMAX1为同源蛋白,并与蛋白SMXL7、D14、MAX2、DAD2、SKIP25、KAI2、RL2、CYP711A1、CCD7和CCD8互作;亚族Ⅱ成员与SMXL6为同源蛋白,与蛋白KAI2、D14、MAX2、CCD7、SMXL7、DAD2、OST1A、STT3A、RPN2、OST48和STT3B发生互作;亚族Ⅲ成员与SMXL3為同源蛋白,与蛋白MAX2、KAI2、D14、CPLS1、F5H14.16、CCD7、CCD8、SMAXI、CLPT2和CLPT1互作;亚族Ⅳ成员与SMXL5为同源蛋白,与蛋白TDR、KAI2、D14、MAX2、CCD8、SMAX1、SMXL4、CLE41、CLE44、Q9LW52_ARATH和F17I23.200进行互作;亚族Ⅴ成员与CLPB3为同源蛋白,与蛋白CLPD、CLPR1、CLPB1、CLPP4、CLPP5、clpP1、HSP70-4、TIC40、CLPB4、CLPC1、CLPP3、TIC110、TOC159和TOC75-3互作。
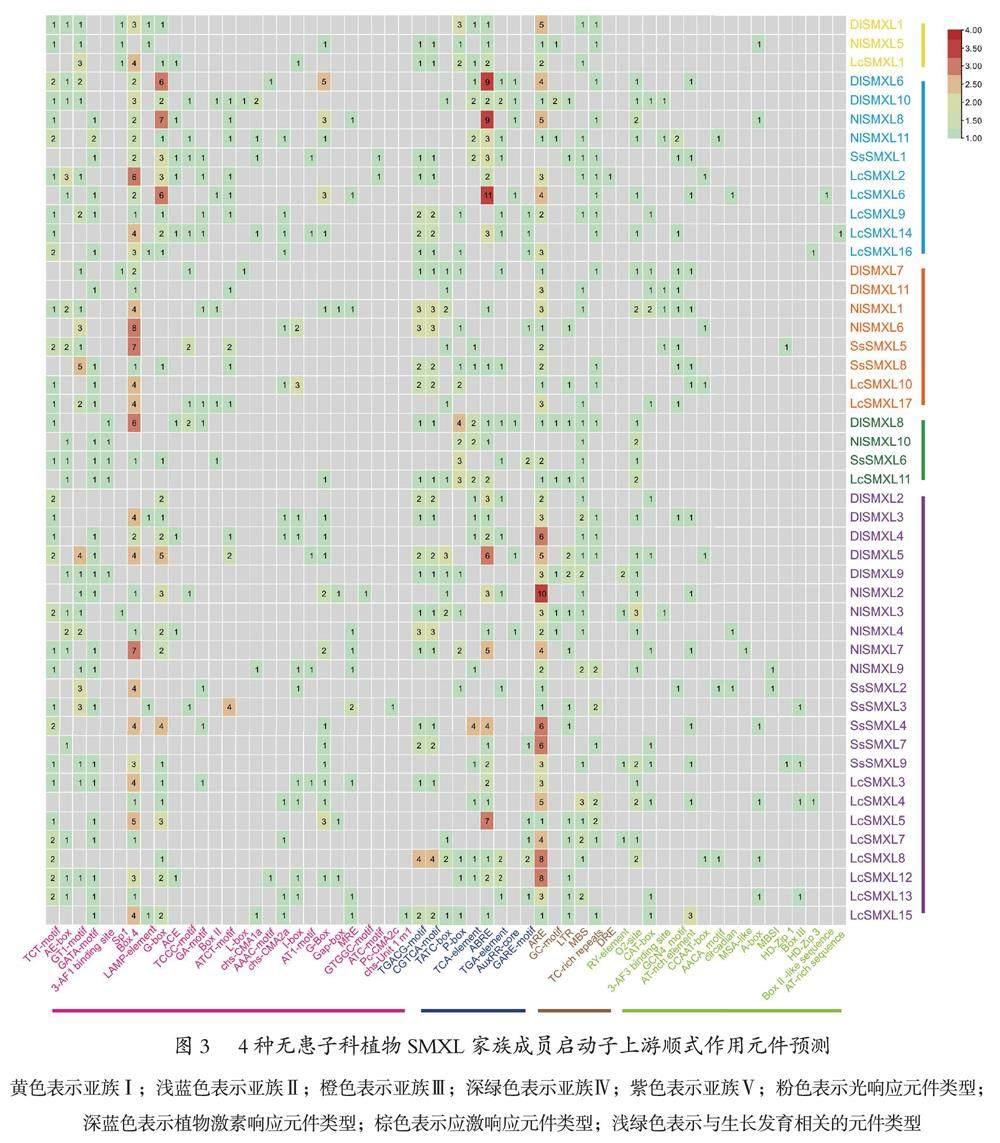
2.7 4种无患子科植物启动子顺式作用元件分析
为了解龙眼、红毛丹、无患子和荔枝SMXL家族成员潜在的生物学功能,利用PlantCARE对龙眼、红毛丹、无患子和荔枝该家族成员的启动子顺式作用元件进行预测(图3)。SMXL家族5个亚族成员的启动子上均具有大量控制转录起始的TATA-box元件和控制转录效率的CAAAT-box元件,说明该基因家族成员均具有必须的转录元件。此外,还具有光响应元件、植物激素响应元件(脱落酸、MeJA、赤霉素、生长素、水杨酸响应元件等)、应激响应元件(厌氧诱导、干旱诱导、低温诱导、防御和应激响应元件等)和与生长发育相关的元件(参与玉米醇溶蛋白代谢调节、分生组织表达、胚乳表达、种子特异性调控等响应元件),其中Box 4光响应元件、与脱落酸响应相关的ABRE植物激素响应元件和抗氧化反应元件ARE数量最多,同时亚族Ⅱ成员还具有较多的G-box光响应元件,亚族Ⅲ成员具有较多的MeJA响应元件,亚族Ⅳ参与赤霉素响应的P-box元件最多。进一步分析可知,DlSMXL2、NlSMXL8、SsSMXL2和LcSMXL3具有较多的启动子顺式作用元件,预测其可能行使较多的功能。
2.8 龙眼DlSMXL家族在体胚发生早期阶段的表达分析
为了解无患子科植物在体胚发生早期的表达模式,基于已知上传的龙眼转录组数据,绘制热图进行结果分析,在龙眼体胚发生早期阶段(EC、ICpEC和GE),DlSMXL家族成员出现了5种不同的表达模式(图4-A):在GE阶段上调,EC、ICpEC阶段下调(DlSMXL3、DlSMXL7、DlSMXL8、DlSMXL11);在ICpEC、GE阶段上调,EC阶段下调(DlSMXL1、DlSMXL10);在ICpEC阶段上调,EC、GE阶段下调(DlSMXL4);在EC阶段上调,ICpEC、GE阶段下调(DlSMXL5);在EC、ICpEC阶段上调,GE阶段下调(DlSMXL2、DlSMXL6、DlSMXL9)。此外,DlSMXL4在EC、ICpEC和GE 阶段相较其他成员呈现较高表达,可能意味着该成员在体胚早期的形成中发挥着重要的作用。同时,DlSMXL5在EC阶段有较高的表达,而在ICpEC和GE阶段表达量相对较低。而其他成员均呈现出较低表达或者不表达。
通过龙眼5-氮胞苷处理表达分析可知(图4-B),DlSMXL家族成员出现了两种不同的表达模式:经过5-氮胞苷处理后的家族成员基因表达下调(DlSMXL1、DlSMXL2、DlSMXL4、DlSMXL5、DlSMXL6、DlSMXL10、DlSMXL11),另外一种是经过5-氮胞苷处理后的家族成员基因表达上调(DlSMXL3、DlSMXL7、DlSMXL8、DlSMXL9)。5-氮胞苷处理可以使龙眼球形胚提前发生[29]。根据分析结果可知,DlSMXL家族成员能够响应5-氮胞苷的处理,但是不同成员的响应模式不一样,其中DlSMXL8经过处理后表达水平上调显著,由此推测,DlSMXL8在5-氮胞苷影响龙眼球形胚的形成过程中发挥作用。
基于龙眼PEG处理(PEG 5%和PEG 7.5%)表达分析,根据热图结果可知(图4-C),DlSMXL家族成员表现出5种不同的表达模式:在PEG 5%和PEG 7.5%处理下表达上调、未处理组表达下调(DlSMXL11);在PEG 7.5%处理下表达上调,PEG 5%处理和未处理组的表达下调(DlSMXL2、DlSMXL5);在未处理组表达上调,PEG 7.5%和PEG 5%处理下表达下调(DlSMXL3、DlSMXL4、DlSMXL6、DlSMXL7、DlSMXL9);在PEG 5%处理下表达上调,PEG 7.5%处理和未处理组表达下调(DlSMXL10);在PEG 5%处理和未处理组表达上调,PEG 7.5%处理下表达下调(DlSMXL1、DlSMXL8)。其中DlSMXL2和DlSMXL5在PEG处理时表达量明显增加,说明这2个成员可能参与干旱胁迫过程。
根据龙眼SL处理的表达分析可知(图4-D),共表现出5种表达模式:经过外源GR24处理表达量增加,未经处理和加入丙酮处理后表达量下降(DlSMXL2、DlSMXL3、DlSMXL4、DlSMXL9、DlSMXL11);未经过处理的表达量增加,经外源GR24和丙酮处理表达量下降(DlSMXL6、DlSMXL8);经过外源GR24和丙酮处理表达量升高,未经处理表达量降低(DlSMXL5);未经处理、加入外源GR24和丙酮均不表达(DlSMXL7);在丙酮处理下表达量升高,未经处理和加入外源GR24表达量下降(DlSMXL1、DlSMXL10)。通过分析可知,龙眼SMXL家族大部分成员都能够在GR24处理后表达量上升,推测该基因家族在调控龙眼的生长发育以及对干旱、低磷、低氮等逆境的适应能力中发挥重要的作用,其中DlSMXL5经GR24处理后表达量显著增加,说明该成员在SLs通路中发挥重要的调控作用。
基于龙眼光处理的表达分析可知(图4-E),共表现出5种表达模式:经过黑暗和白光处理表达量增加,经蓝光处理表达量降低(DlSMXL4);经过白光处理表达量增加,黑暗和蓝光处理表达量降低(DlSMXL6);经过蓝光处理表达量增加,黑暗和白光处理表达量下降(DlSMXL3、DlSMXL9、DlSMXL10);经过黑暗和蓝光处理的表达量增加,白光处理的表达量降低(DlSMXL1);经过黑暗处理表达量增加,蓝光和白光处理表达量降低(DlSMXL2、DlSMXL5)。其中DlSMXL5在黑暗处理下表达量显著上调,而蓝光和白光处理下表达量显著下降,推測该成员在光响应过程中发挥重要的调控作用。
通过龙眼温度处理表达分析,绘制热图可知(图4-F),共表现出6种表达模式:经过15℃和25℃处理的表达量增加,35℃处理的表达量降低(DlSMXL9);经25℃处理的表达量增加,15℃和35℃处理的表达量降低(DlSMXL7、DlSMXL11);经过15℃处理的表达量增加,25℃和35℃处理的表达量降低(DlSMXL1、DlSMXL4);经过15℃和35℃处理的表达量增加,25℃处理的表达量降低(DlSMXL3);经过35℃处理的表达量增加,15℃和25℃处理的表达量降低(DlSMXL2、DlSMXL5、DlSMXL6、DlSMXL10);经过25℃和35℃处理的表达量增加,15℃处理的表达量降低(DlSMXL8)。DlSMXL4在低温处理时,表达量显著增加,推测其在应对低温胁迫时发挥重要作用。DlSMXL5在高温处理时表达量显著增加,表明在高温环境中该成员发挥至关重要的作用。
基于龙眼各种激素(2,4-D、2,4-D + KT、KT和MS)处理表达分析,绘制热图可知(图4-G),共表现出5种表达模式:经过MS处理过的表达上调,2,4-D、2,4-D + KT以及KT处理过的表达下调(DlSMXL6);经KT处理过的表达上调,MS、2,4-D以及2,4-D + KT处理过的表达下调(DlSMXL4和DlSMXL9);经2,4-D处理过的表达上调,MS、2,4-D + KT以及KT处理过的表达下调(DlSMXL1);经2,4-D以及2,4-D + KT处理过的表达上调,KT以及MS处理过的表达下调(DlSMXL3和DlSMXL10);经2,4-D + KT处理过的表达上调,2,4-D、KT以及MS处理过的表达下调(DlSMXL2、DlSMXL5和DlSMXL8)。DlSMXL大多成员在2,4-D和2,4-D + KT处理时表达量上升显著,推测这些成员在响应生长素和细胞分裂素等激素中发挥重要的作用。
3 小结与讨论
3.1 无患子科植物SMXL家族进化特性及功能多样性
SMXL基因对独角金内酯信号通路起重要的调控作用,本研究基于无患子科基因组数据分别鉴定出11个龙眼、11个红毛丹、9个无患子和17个荔枝SMXL家族成员,与大豆的SMXL家族成员数量比较,龙眼、红毛丹、无患子和荔枝单个物种家族成员数量较少[20]。依据拟南芥SMXL家族成员分成的4个亚族构建系统进化树[19],4种无患子科植物SMXL家族成员在进化树中被分为5个亚族。本研究结果与拟南芥SMXL家族分组相比多一个亚族Ⅴ,并且亚族Ⅴ中成员数量最多,且包括单子植物甘蔗SMXL家族1个成员但不包含有拟南芥成员,再根据该亚族成员的基序种类较其他亚族成员多,推测该亚族进化时间较早,发生了特异进化,且出现功能分化并在无患子科植物中行使特殊功能。对4种无患子科植物SMXL家族成员的基因结构及蛋白保守结构域分析发现,位于相同亚族的SMXL家族成员具有相似的外显子-内含子结构及蛋白保守结构域,推测处于同一亚族的SMXL家族成员可能存在相似的生物学功能。
SMXL基因功能的多样性已在拟南芥和豆科植物上被验证。通过亚细胞结构定位,推测无患子科植物的SMXL家族成员主要在叶绿体(22个)cc上行使功能。已有研究表明,TOC和TIC是由多个蛋白亚基组成的膜蛋白复合体,可介导众多不同叶绿体蛋白的跨膜转运,其对于叶绿体的生成、光合作用复合体的组装以及各种代谢途径的运转起着关键作用[30]。通过蛋白互作可知,亚族Ⅴ的成员与蛋白TIC110、TOC159和TOC75-3产生互作。推测无患子科植物SMXL基因能够参与TOC和TIC蛋白复合体的调控过程,改变叶绿体的数量、形态或功能,进而影响植物的光合速率。
3.2 无患子科植物SMXL基因可能广泛响应非生物胁迫过程
目前已知SMXL家族抑制基因是karrikin和strigolactone信号通路的下游元件,在非生物胁迫下的植物生长发育调控中起重要作用[31]。本实验基于龙眼转录组数据得知DlSMXL成员在非生物胁迫下表现出不同程度的表达,且4种无患子科植物启动子上游有大量与干旱及低温等胁迫相关的元件,故推测SMXL家族可能广泛参与无患子科植物非生物胁迫的调控。DlSMXL大部分成员在体胚发生早期经PEG处理后,表达下调。已有研究表明,四季豆PvSMXL2在PEG诱导的干旱胁迫下表达下调,因其瞬时沉默增强了植物干旱胁迫的耐受性[32];拟南芥smxl6/smxl7/smxl8突变体的耐旱性与野生型相比显著增强,主要表现在在脱水过程中叶片气孔指数、角质层渗透性和水分流失降低,花青素生物合成增加,而且对ABA诱导的气孔关闭和ABA响应非常敏感,同时也证明了ABA和SLs信号通路在调节植物对干旱的反应中存在交互作用[33]。从无患子科4种植物的顺式作用元件中预测出较多的响应ABA的元件(ABRE),推测SMXL基因在无患子科植物的ABA信号传导中发挥重要并通过对SLs信号途径的介导增强对干旱等胁迫环境的适应性。DlSMXL家族较多成员经35℃高温处理时,表达量明显上调,相反DlSMXL4在15℃低温处理时表达上调显著,推测SMXL基因在植物高温或低温胁迫下发挥重要的作用。
3.3 SMXL基因在龍眼体胚发生过程中可能发挥重要作用
已有研究表明,SMXL基因通过调节SLs、类胡萝卜素和IAA的合成水平来抑制植物早期胚胎发育[23]。龙眼体胚发生早期和不同处理下龙眼EC的转录组数据显示,DlSMXL在龙眼体胚发生早期呈现出不同的表达模式,推测SMXL基因在龙眼的体胚发生早期也扮演着重要的角色。另外,DlSMXL8经过5-氮胞苷处理后,表达量显著上调,而适宜浓度的5-氮胞苷能抑制2,4-D的甲基化作用,降低龙眼胚性愈伤组织的DNA甲基化水平,促使龙眼球形胚提前发生[29],故推测DlSMXL8可能参与加快龙眼体细胞胚胎发生进程中的DNA甲基化调控网络。植物的生长是光形态建成的过程,光质对植物组织培养的一些形态发生过程起重要的调节作用[34]。据报道,龙眼EC在黑暗、白光和绿光条件下,生长状态最佳;在蓝光条件下,生长状态较好,但出现颜色轻微褐化[35]。DlSMXL大多数成员在黑暗和蓝光处理下表达上调,推测在黑暗或者蓝光照射的条件下,SMXL基因发挥功能促进龙眼体胚的光形态建成。
参考文献:
[1]夏念和,罗献瑞. 中国无患子科的地理分布[J]. 热带亚热带植物学报,1995(1):13-28.
[2]赖钟雄,陈振光,潘良镇,等. 无患子科果树生物技术研究现状与展望[J]. 中国南方果树,1997(6):37-39.
[3]沐建华. 文山州无患子科植物资源及其开发利用价值[J]. 文山学院学报,2017,30 (6):23-27.
[4]陈虞超,巩檑,张丽,等. 新型植物激素独脚金内酯的研究进展[J]. 中国农学通报,2015,31(24):157-162.
[5]Faizan M,Faraz A,SAMI F,et al. Role of strigolactones:signalling and crosstalk with other phytohormones[J]. Open Life Sciences,2020,15:217-228.
[6]Wang L,Wang B,Yu H,et al. Transcriptional regulation of strigolactone signalling in Arabidopsis[J]. Nature,2020,583(7815):277-281.
[7]Arite T,Umehara M,Ishikawa S,et al. d14,a strigolactone-insensitive mutant of rice,shows an accelerated outgrowth of tillers[J]. Plant and Cell Physiology,2009,50(8):1416-1424.
[8]Hamiaux C,Drummond R S,Janssen B J,et al. DAD2 is an α/β hydrolase likely to be involved in the perception of the plant branching hormone,strigolactone[J]. Current Biology,2012,22(21):2032–2036.
[9]Yao R,Wang L,Li Y,et al. Rice DWARF14 acts as an unconventional hormone receptor for strigolactone[J]. Journal of Experimental Botany,2018,69(9):2355-2365.
[10]王雪菱,王如月,李际红,等. 独脚金内酯抑制因子D53/SMXLs基因的研究进展[J]. 农学学报,2023,13(10):37-43.
[11]Jiang L,Liu X,Xiong G,et al. DWARF 53 acts as a repressor of strigolactone signalling in rice[J]. Nature,2013,504(7480):401-405.
[12]Wang L,Wang B,Jiang L,et al. Strigolactone signaling in Arabidopsis regulates shoot development by targeting D53-Like SMXL repressor proteins for ubiquitination and degradation[J]. The Plant Cell,2015,27(11):3128-3142.
[13]Zhou F,Lin Q,Zhu L,et al. D14-SCF(D3)-dependent degradation of D53 regulates strigolactone signalling[J]. Nature,2013,504(7480):406-410.
[14]Soundappan I,Bennett T,Morffy N,et al. SMAX1-LIKE/D53 family members enable distinct MAX2-dependent responses to strigolactones and karrikins in Arabidopsis[J]. The Plant Cell,2015,27(11):3143-3159.
[15]Yao R,Ming Z,Yan L,et al. DWARF14 is a non-canonical hormone receptor for strigolactone[J]. Nature,2016,536(7617):469-473.
[16]Shabek N,Ticchiarelli F,Mao H,et al. Structural plasticity of D3-D14 ubiquitin ligase in strigolactone signalling[J]. Nature,2018,563(7733):652-656.
[17]Villaécija-Aguilar J A,Hamon-Josse M,Carbonnel S,et al. SMAX1/SMXL2 regulate root and root hair development downstream of KAI2-mediated signalling in Arabidopsis[J]. PLOS Genetics,2019,15(8):e1008327.
[18]Wang L,Xu Q,Yu H,et al. Strigolactone and Karrikin Signaling Pathways Elicit Ubiquitination and Proteolysis of SMXL2 to Regulate Hypocotyl Elongation in Arabidopsis[J]. Plant Cell,2020,32(7):2251-2270.
[19]Feng Z,Liang X,Tian H,et al. SUPPRESSOR of MAX2 1 (SMAX1) and SMAX1-LIKE2 (SMXL2) Negatively Regulate Drought Resistance in Arabidopsis thaliana[J]. Plant Cell Physiol,2023,63(12):1900-1913.
[20]Wallner E S,López-Salmerón V,Belevich I,et al. Strigolactone- and karrikin-independent SMXL proteins are central regulators of phloem formation[J]. Current Biology,2017,27(8):1241-1247.
[21]刘小杰.苹果全基因组PIN和SMXL成員鉴定、系统进化及在腋芽萌发中的表达分析[D]. 陕西:西北农林科技大学,2018.
[22]Yang H L,Liu X K,Li J L,et al. Genome-wide identification,phylogenetic and expression analysis of SMAX1-Like genes in rapeseed(Brassica napus L.)[J]. Oil Crop Science,2018,3(2):71-85.
[23]Zhang X Y,Lai C W,Liu M Y,et al. Whole genome analysis of SLs pathway genes and functional characterization of DlSMXL6 in longan early somatic embryo development[J]. International Journal of Molecular Sciences,2022,23(22):14047.
[24]Chen C,Chen H,Zhang Y,et al. TBtools:An Integrative Toolkit Developed for Interactive Analyses of Big Biological Data[J]. Mol Plant,2020,13(8):1194-1202.
[25]Chen R Z,Chen X H,Huo W,et al. Transcriptome analysis of azacitidine (5-AzaC)-treatment affecting the development of early somatic embryogenesis in longan[J]. The Journal of Horticultural Science and Biotechnology,2021,96(3):311-323.
[26]Munir N. Genome-wide Expression Profiling of D.longan,and Identification and Expression Analysis of NAC TF during Somatic Embryogenesis under Drought Stress Conditions[D]. 福建:福建农林大学,2023.
[27]陈晓东. 龙眼体胚发生早期对温度响应的转录组和sRNA分析及SR作用的分子机制研究[D]. 福建:福建农林大学,2021.
[28]Li H,Lyu Y,Chen X,et al. Exploration of the Effect of Blue Light on Functional Metabolite Accumulation in Longan Embryonic Calli via RNA Sequencing[J]. Int J Mol Sci,2019,20(2):441.
[29]陈荣珠,赖钟雄. 5-氮胞苷与2,4-D处理对龙眼早期体胚发生及DlAGOs表达的影响[J]. 热带农业科学,2021,41(8):31-39.
[30]王琪,李云洲,须文,等. 叶绿体TOC-TIC蛋白复合体转运机制研究进展[J]. 园艺学报,2021,48(4):689-704.
[31]Fu X J,Wang J,Shangguan T W,et al. SMXLs regulate seed germination under salinity and drought stress in soybean[J]. Plant Growth Regulation,2022,96(3):397-408.
[32]Fang P,Li M,Guo Q,et al. Genome-wide analysis of the SMXL gene family in common bean and identification of karrikin-responsive PvSMXL2 as a negative regulator of PEG-induced drought stress[J]. Gene,2023,887:147741.
[33]Yang T,Lian Y K,Kang J H,et al. The suppressor of MAX2 1 (SMAX1)-Like SMXL6,SMXL7 and SMXL8 Act as Negative Regulators in Response to Drought Stress in Arabidopsis[J]. Plant and Cell Physiology,2020,61(8):1477-1492.
[34]林小萍,赖钟雄,黄浅. 光质对植物离体培养的影响[J]. 亚热带农业研究,2008 (1):73-80.
[35]李小芳. 光质和ABA对龙眼愈伤组织生长与类胡萝卜素含量的影响及DlPIFs的作用机制[D]. 福建:福建农林大学,2023.
(责任编辑:赖瑞联)