辣椒种质资源PMMoV抗性基因检测与抗性鉴定
2024-06-09陈建分曹振木秦于玲申龙斌刘维侠朱丹吴怡婷刘子记王旭
陈建分 曹振木 秦于玲 申龙斌 刘维侠 朱丹 吴怡婷 刘子记 王旭


关键词:辣椒;种质资源;PMMoV;分子标记;抗病性鉴定
中图分类号:S436.418 文献标志码:A
辣椒(Capsicum annuum L.)为茄科辣椒属一年生或多年生二倍体作物,是全球重要的蔬菜作物之一。辣椒果实富含类胡萝卜素、蛋白质、维生素C 等多种营养物质,既可直接食用又可用作调味品,辣椒提取物在医药和化工领域也具有广泛应用。据联合国粮食及农业组织(FAO)统计,2019 年全球鲜食辣椒和加工辣椒总种植面积约为3.7190×106hm2,总产量约为4.2283×107t;我国2019 年辣椒种植面积约为8.4700×105hm2,总产量达1.9333×107t,居全球首位[1]。
长期以来,病毒病一直是威胁辣椒生产的重要因素。目前,我国报道的病毒种类有30 余种,近年来辣椒轻斑驳病毒(Pepper mild mottle viru,PMMoV)已逐渐成为海南[2]、广西[3]、广东[4]、四川[5]、安徽[6]、黑龙江[7]、山东[8-9]、西藏[10]等多个辣椒产区普遍发生的病害。PMMoV 属于烟草花叶病毒属(Tobamovirus),主要通过种传、汁液传播[11-12]。辣椒感染PMMoV 后叶片症状表现轻微皱缩、褪绿斑驳和花叶症状,果实被侵染后表现为扁平、变小、褪绿斑驳、凹凸斑点、畸形与坏死等现象。
L1、L2、L3、L4 系列等位基因是辣(甜)椒抗烟草花叶病毒属病毒的主要抗性基因[13-15],这些基因被引入辣椒栽培种中保护植株免受烟草花叶病毒的侵染。目前我国辣椒生产上的PMMoV致病型多以P1,2株系为主[16-17],P1,2致病型病毒株系能够系统侵染带有L1、L2 抗性基因的辣(甜)椒,而带有L3抗性基因的辣(甜)椒对该病毒株系表现为抗性,L3基因能够应对我国辣椒生产上的主要问题。张宝玺等[18]通过常规育种技术和分子标记相结合,创制出含有抗PMMoV(P0,1,2)L3基因新品种中椒105 号、中椒106 号、中椒107号、中椒108 号。TOMITA 等[15]通过图位克隆获得L3基因,并利用同位克隆的方法获得了L 的6个等位基因:L1、L1a、L1c、L2、Lb和L4。鉴定抗性种质是选育抗病品种不可缺少的步骤,目前,高抗PMMoV 的辣椒种质鲜有报道。由于辣椒的栽培种遗传多样性比较丰富、L 基因组结构较为复杂,目前尚未利用基因序列開发功能标记。因此,本研究利用已报道的L3连锁标记,遗传距离为0.00015 cM,以110 份辣椒种质资源为研究对象,结合抗病基因检测和苗期抗性鉴定,精准筛选抗辣椒轻斑驳病毒的种质资源,以期为选育抗PMMoV 辣椒品种提供科学依据。
1 材料与方法
1.1 材料
参试辣椒种质资源共110 份,材料名称和来源地详见表1。PMMoV 鉴定毒原P1,2 株系由本课题组从田间发病植株上分离提纯保存。
1.2 方法
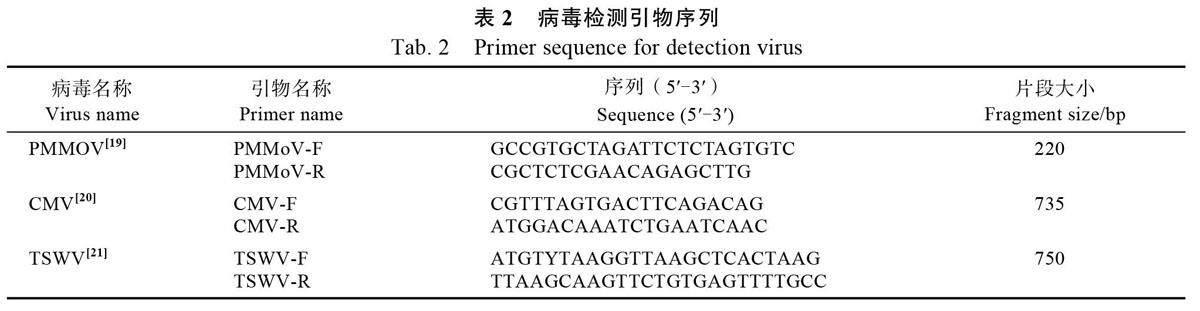
1.2.1 毒原扩繁及检测 将PMMoV 毒源人工接种在本氏烟草(Nicotiana benthamiana)上进行扩繁,待发病后选取感病叶片,利用RT-PCR 方法进行分子检测,引物由生工生物工程(上海)股份有限公司合成,引物序列见表2。
1.2.2 L3抗性基因检测 与L3连锁的分子标记参照TOMITA 等[22]的方法。根据Bioteke DNA 试剂盒( 北京百泰克生物技术有限公司) 提取gDNA,采用1%琼脂糖凝胶电泳和紫外分光光度计测定DNA 的质量和浓度,并将浓度稀释至100 ng/μL,保存于–20 ℃冰箱备用。PCR 反应体系为20 μL:PCR-mix(2×Es Taq Master Mix)10 μL,模板DNA 1.0 μL,正向引物和反向引物(10 μmol/L)各1 μL,ddH2O 补齐至20 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性45 s,60 ℃退火45 s,72 ℃延伸1.5 min,35 个循环;最后72 ℃延伸10 min,4 ℃保存。
1.2.3 PMMoV 苗期人工接种抗性鉴定 将筛选出含有抗性基因分子标记的辣椒种质进行苗期人工接种鉴定, 以14SM517m 材料为感病对照(CK–),中椒107 为抗病对照(CK+)。2022年8 月3 日,将所有辣椒种子经10%磷酸三钠溶液浸种35 min,用蒸馏水清洗除去辣味,在55 ℃下温汤浸种4 h,置于28 ℃恒温培养箱中培养。出芽后播种于50 孔塑料穴盘内育苗,每份参试材料3 次重复,每重复15 株。幼苗长至两叶一心期时,移栽至15.2 cm× 15.6 cm 塑料盆中,育苗基质为高温灭菌基质(蛭石∶营养土=1∶2)。
待辣椒幼苗长至4~5 叶期时,取感染PMMoV的烟草新叶,加入10 倍于鲜叶质量的0.01 mol/L 磷酸缓冲液(PBS, pH 7.0)中,在冰上研磨匀浆,离心去渣取上清液,接种液现配现用。在叶面抹薄层600 目金刚砂,用手指蘸取少量接种液轻轻摩擦叶面。接种30 min 后用清水冲去叶面多余汁液,为避免病毒接不上的情况,3 d 后再接种1次。将幼苗置于28 ℃光照培养箱中培养,接种后5 d 调查局部症状,20 d 调查系统症状,计算病情指数,并进行抗性分级。
1.2.4 病情调查与统计 PMMoV 抗性调查的病情指数计算及抗性级别的划分均参考《辣椒种质资源描述规范和数据标准》[23]。
按上述标准划分单株病情级别。0:无任何症状;1:心叶明脉,或接种叶少量急性小枯斑;3:少数叶片呈花叶,或接种叶脱落,茎部产生坏死斑;5:多数叶片花叶,少数叶片畸形,皱缩,或茎部产生坏死条斑;7:多数叶片畸形,皱缩,植株矮化,或茎、枝和叶脉系统坏死;9:植株严重矮化,停止生长;或植株严重系统坏死,甚至死亡。病情指数计算公式为:
病情指数(DI)=Σ(病级数值×该病级株数)/(病级最高值×调查总株数)×100。
品系群体抗病性划分标准:免疫(I),DI=0;高抗(HR),0 1.3 数据处理 试验数据通过Excel 软件进行分析、计算平均值和标准差,使用SPSS 25 软件进行单因素方差分析,采用LSD 或Duncans 法进行多重比较分析。 2 结果与分析 2.1 毒原扩繁检测结果 RT-PCR 鉴定结果表明,PMMoV 特异性引物能扩增出220 bp 左右的条带,与目的条带一致,而CMV 和TSWV 检测引物均未扩增出条带(图1),初步证明此毒原为PMMoV 单一感染毒原,可用于接种鉴定。 2.2 辣椒种质L3抗性基因检测 L3抗性分子标记鉴定结果表明,17YB32、17SCa28m、CF19-34m、19FB6-1、15SM39-2、CCJ93-1、14SM555×14SM1、14SM567-2、14SM526-1、14SM565-1、14SM514m、14SM502-1、14SM519-1、14SM504m、14SM503m、14SM519-3、14SM518-2、14SM519-2 等46 份种质含有与抗性基因L3连锁的分子标记(图2),其余64 份種质均未扩增出目标条带,说明这些种质不含L3抗性基因。 2.3 辣椒种质PMMoV 抗性鉴定 辣椒种质PMMoV 抗性鉴定结果表明(图3、表3),46 份供试种质存在显著性差异,未发现对PMMoV 免疫的种质,各种质的病情指数在8.86~60.00 之间。病情指数能够反映辣椒种质抗PMMoV 能力的强弱,数值越高,表明抗性越低,反之,表明抗性越高。其中,高抗种质为CF19-34m和19FB6-1,病情指数分别为8.86 和8.79,抗病性显著强于感病种质,叶片几乎无感染症状;抗病种质CCJ93-1 次之,叶片仅有轻微的花叶症状;中抗材料17YB32、17SCa28m、15SM39-2、14SM555×14SM1、14SM567-2、14SM526-1、14SM565-1、14SM502-1、14SM519-1、14SM504m、14SM503m、14SM519-3、14SM518-2、14SM519-2、CCJ52-1 等34 份,植株少数叶片出现花叶、皱缩;感病种质14SM514m、CCJ22-1 、CCJ113-2 、CCJ135-1 、CCJ157-1、CCJ537-1m、L545、CCJ87-2、CCJ133-1,这9 份材料中CCJ113-2 和CCJ135-1 的病情指数最大,病情指数为60.00。感病种质的抗性能力弱,植株叶片多数皱缩和心叶畸形,植株矮化。总体来看,高抗、抗病和中抗材料占总鉴定材料的80.43%。 3 讨论 本研究结合L3抗性基因检测和苗期人工接种抗性鉴定方法,在110 份辣椒种质中筛选出抗PMMoV P1,2种质37 份,这些抗病种质可为辣椒的抗病育种提供优良的种质资源。近年来,辣椒轻斑驳病毒在国内快速蔓延,研究者正加快筛选对其具较大抗性的辣椒种质。秦蕾等[24]对51 份辣椒种质资源进行了TMV 抗性鉴定,获得抗病材料15 份,其中高抗材料2 份,占总鉴定材料的3.92%;姚明华等[25]对引进的42 份非洲辣椒材料进行了TMV 抗性鉴定,获得抗性材料9 份;王飞等[26]在74 份泰国辣椒种质中筛选出7 份TMV抗性材料。已有研究筛选到的抗性材料相对较少,本研究鉴定结果表明,不同的辣椒种质表现的抗性有所不同,其中多数抗病材料表现为中抗,仅获得2 份高抗材料和1 份抗病材料。这可能是由于抗病性受到多种因素的影响,包括外在的环境因子、内在基因表达及辣椒与病毒的相互作用等。其次,可能高效L 基因主要存在于辣椒野生种当中。 目前,辣椒抗PMMoV 的 L 基因已被克隆。本研究利用已报道的与L3连锁的分子标记对110份辣椒种质进行分子鉴定,结果显示有46 份种质含有抗性分子标记,包括一年生辣椒栽培种(C.annuum L)和中国辣椒栽培种(C. chinense Jacquin)。在接种PMMoV P1,2菌株后,其中有9 份含有抗性分子标记的种质表现为感病,这种现象可能与品种的遗传背景有关。本研究采用的是与L3连锁的标记而不是功能标记,因此存在假阳性的可能,为了准确鉴定辣椒种质对PMMoV 的抗性,需要结合抗性鉴定结果进行综合判断。 病毒病一直是威胁辣椒生产的主要病害,对辣椒生产造成严重的经济损失[27]。由于PMMoV具有种传的特性,使用化学杀菌剂和传统的农业防治措施无法控制病毒病的为害。与传统育种方式相比,利用分子标记技术可以快速对已知抗性基因进行检测,缩短了育种年限,有利于寻找新抗源,拓宽辣椒品种抗性遗传多样性,对PMMoV抗病品种的选育尤为重要。 本课题组前期研究已经明确了海南儋州辣椒种质资源圃感染的PMMoV 为P1,2致病型,应用L3抗性基因可以有效克服PMMoV P1,2 致病型的为害。然而,病毒毒株会克服抗性基因而变异,L3基因对PMMoV P1,2,3,4致病型不具有抗性[28]。因此,未来的工作需要挖掘鉴定其他PMMoV 抗性基因用于辣椒抗性种质资源的创制,为辣椒抗PMMoV 育种提供更高效的抗源材料。
