小地老虎AiHSP 19.3基因鉴定及其对高温和杀虫剂胁迫的响应
2024-06-08邵云飞张今王莹莹江连强刘苏仇腾腾范子明李茂业
邵云飞 张今 王莹莹 江连强 刘苏 仇腾腾 范子明 李茂业


摘要
小地老虎Agrotis ipsilon是一種重要的农业害虫。小分子热激蛋白(sHSP)是细胞抵御外界胁迫的关键蛋白,本文旨在探索sHSP基因在小地老虎不同发育阶段以及在高温和杀虫剂胁迫下的响应模式。使用同源检索方法从小地老虎转录组中鉴定到了一个sHSP
基因的cDNA序列,命名为AiHSP19.3。通过RTPCR技术克隆该序列,利用实时荧光定量PCR技术分析AiHSP19.3基因在小地老虎不同发育阶段和不同组织中的转录模式,并分析了该基因在高温和杀虫剂胁迫下的转录水平。结果表明,小地老虎AiHSP19.3基因的开放阅读框为516 bp,编码含171个氨基酸,分子量为19.3 kD的蛋白,具有sHSP典型的α晶状体结构域(ACD)。在供试小地老虎的不同发育阶段和3龄幼虫组织中均能检测到AiHSP19.3的转录,其中在6龄幼虫和3龄幼虫脂肪体内转录水平最高。小地老虎幼虫经高温和3种杀虫剂(高效氯氟氰菊酯、氯虫苯甲酰胺及辛硫磷)处理后AiHSP19.3的转录水平显著提高,表明该基因可能在响应高温及杀虫剂胁迫中起到重要作用。
关键词
小地老虎; 小分子热激蛋白; 高温; 杀虫剂; 转录模式
中图分类号:
S 433.82
文献标识码: A
DOI: 10.16688/j.zwbh.2023261
Identification of the AiHSP19.3 gene and its response to high temperature and insecticide stress in Agrotis ipsilon
SHAO Yunfei1#, ZHANG Jin1#, WANG Yingying1, JIANG Lianqiang2*, LIU Su1,QIU Tengteng1, FAN Ziming3, LI Maoye1*
(1. Key Laboratory of Biology and Sustainable Management of Plant Diseases and Pests, Anhui Higher Education Institutes;
College of Plant Protection, Anhui Agricultural University, Hefei 230036, China; 2. Liangshan Branch of Sichuan Tobacco
Corporation, Xichang 615000, China; 3. Sinochem Modern Agriculture (Ningxia) Co., Ltd., Yinchuan 750021, China)
Abstract
The black cutworm, Agrotis ipsilon, is an important agricultural pest insect. Small heat shock proteins (sHSPs) are crucial for cellular defense against external stresses. This study aims to explore the response patterns of sHSP gene in different developmental stages of A.ipsilon and under high temperature and insecticide stresses. A cDNA sequence of sHSP, AiHSP19.3, was identified from the A.ipsilon transcriptome using homology search and subsequently cloned by RTPCR. The transcriptional pattern of the AiHSP19.3 gene in different developmental stages and tissues of A.ipsilon was analyzed using realtime quantitative PCR, along with transcript levels under high temperature and insecticide stresses. The results showed that the open reading frame of AiHSP19.3 was 516 bp, encoding a protein consisting of 171 amino acids with a molecular weight of 19.3 kD. AiHSP19.3 contained an αcrystallin domain (ACD), a hallmark feature of sHSP. Transcription of AiHSP19.3 was detected in all tested developmental stages and 3rdinstar larval tissues, with the highest level observed in the 6thinstar larvae and fat body of 3rdinstar larvae. Transcription levels of AiHSP19.3 significantly increased in larvae after treatment with high temperature and three insecticides (lambdacyhalothrin, chlorantraniliprole, and phoxim), indicating that this gene may play an important role in responding to high temperature and insecticide stresses.
Key words
Agrotis ipsilon; small heat shock protein; high temperature; insecticides; transcriptional pattern
热激蛋白(heat shock protein,HSP)也称为热休克蛋白,是一类普遍存在于生物体内的分子伴侣[1]。根据分子量大小、氨基酸序列和功能,HSP可分为HSP90、HSP70、HSP60和小分子热激蛋白(small heat shock protein, sHSP)等不同家族[2]。sHSP于1974年从黑腹果蝇Drosophila melanogaster中发现,分子量介于12~42 kD,结构较为保守,都含有N末端区域、C末端区域和C端延伸区3部分,且C末端区域通常具有一个α晶状体结构域(αcrystallin domain, ACD)[3]。
在生物体内,sHSP是细胞抵御外界胁迫的关键蛋白,可以有效阻止细胞质中的其他蛋白质发生变性[4]。在昆虫中,sHSP响应极端温度、病原微生物和杀虫剂等外界胁迫,增强昆虫对环境的适应能力。例如,柞蚕Antheraea pernyi sHSP21在其抵御外界高温胁迫时具有保护机体稳定的作用[5];小菜蛾Plutella xylostella 多个sHSP在响应高温及农药胁迫中发挥关键作用[6]。此外,昆虫sHSP还能调节生长发育、生殖和滞育等[7]。
小地老虎Agrotis ipsilon属鳞翅目Lepidoptera夜蛾科Noctuidae,是一种重要的迁飞性农业害虫,对玉米、小麦、棉花和蔬菜等多种粮食和经济作物造成严重危害[8]。小地老虎幼虫白天藏于表土层,夜间取食幼苗,经常导致田间作物缺苗断垄[9]。极端温度是影响昆虫个体生理和种群动态的重要因子[10],高温同样会对小地老虎的发生与为害产生影响[11]。另一方面,当前对小地老虎的防治主要依赖化学农药,其中高效氯氟氰菊酯、氯虫苯甲酰胺和辛硫磷是3种常用的防治药剂[1214]。在高温和杀虫剂胁迫下,小地老虎可能会通过调控sHSP基因的转录水平来增强虫体抵御外界胁迫的能力。但截至目前,关于小地老虎sHSP基因及其响应外界胁迫的研究非常有限。
本研究针对小地老虎1个小分子热激蛋白基因,对其编码的蛋白质序列进行生物信息学分析,并研究高温和3种杀虫剂(高效氯氟氰菊酯、氯虫苯甲酰胺和辛硫磷)处理后该基因转录水平的变化,以期为探明其在小地老虎响应高温及杀虫剂胁迫中的功能奠定基础。
1 材料与方法
1.1 供试虫源
本研究所用小地老虎为本实验室饲养种群。1龄和2龄幼虫饲喂大白菜,幼虫进入3龄后转移至玻璃指形管中(每管1头),饲喂人工饲料直至化蛹。羽化的成虫用10%(V/V)蜂蜜水饲养。幼虫和成虫的饲养条件均为温度(25±1.0)℃,相对湿度(65±2)%,光周期L∥D=16 h∥8 h。选取1~6龄幼虫、蛹和雌雄成虫进行后续试验,其中1龄幼虫50头,其余龄期幼虫、蛹和雌雄成虫均取15头。另取3龄幼虫30头,在冰上解剖获得表皮、中肠、马氏管和脂肪体等组织。样本收集和组织解剖均设置3次生物学重复,用液氮速冻后保存于-80℃冰箱。
1.2 高温处理
取生长状况较为一致的小地老虎3龄幼虫,置于洁净的玻璃试管(11 cm×2.5 cm)中,每管1头,置于25(对照)、32、35、38℃和41℃的恒温水浴锅(上海一恒科技有限公司)中处理1 h后立即放入液氮中冷冻,随后转入-80℃冰箱保存。每处理设3次生物学重复,每个重复包括20头试虫。
1.3 杀虫剂处理
高效氯氟氰菊酯和氯虫苯甲酰胺购自上海阿拉丁公司;辛硫磷购自北京百灵威公司。3种药剂纯度均≥97%。配制3种杀虫剂的LC50浓度药液,用浸虫法处理小地老虎3龄幼虫,分别在处理后3、6、12、24 h和48 h收集存活试虫,用液氮速冻后保存于-80℃冰箱。以等量丙酮水溶液处理作为对照。每处理进行3次生物学重复,每个重复包含30头试虫。
1.4 AiHSP19.3克隆与序列分析
使用RNAiso Plus试剂(宝生物,大连)提取各小地老虎样本的总RNA,分别使用琼脂糖凝胶电泳和NanoDrop 2000超微量分光光度计(Thermo Fisher Scientific,美國)检测RNA完整性和浓度。使用Hifair Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus,翌圣,上海)合成cDNA。
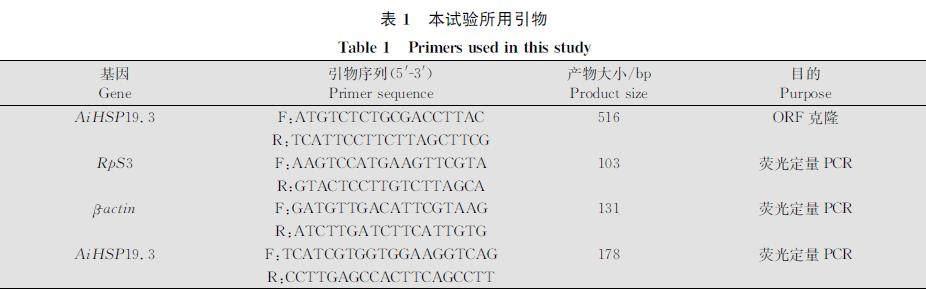
利用BioEdit软件中的BLAST程序,以同为鳞翅目的云杉色卷蛾Choristoneura fumiferana sHSP序列为模板[15],检索已公布的小地老虎转录组[16],得到1条编码小地老虎sHSP的cDNA序列,命名为AiHSP19.3。据此设计基因特异性引物(表1),以小地老虎cDNA为模板扩增AiHSP19.3。PCR扩增体系(50 μL):2×Taq MasterMix(Dye)(康为,江苏)25 μL,10 μmol/L上、下游引物各2 μL,cDNA模板1 μL,超纯水20 μL。反应程序为:94℃ 2 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,35个循环;72℃ 2 min。扩增产物经1%琼脂糖凝胶电泳检测、纯化回收后连入pColdⅡ表达载体,送通用生物(安徽)股份有限公司测序。使用ORFfinder(www.ncbi.nlm.nih.gov/orffinder/)预测AiHSP19.3的开放阅读框;使用ExPASy工具(web.expasy.org/compute_pi/)计算AiHSP19.3理论分子量和等电点;分别使用SignalP 5.0(www.cbs.dtu.dk/services/SignalP/)和TMHMM 2.0(www.cbs.dtu.dk/services/TMHMM/)预测信号肽和跨膜区;多序列联配使用Clustal Omega程序进行(www.ebi.ac.uk/tools/msa/clustalo/);使用MEGA 11软件的邻近法(neighborjoining method)构建系统进化树,各进化分支的置信度采用bootstrap法进行1 000次重复检验[17]。
1.5 AiHSP19.3基因转录模式分析
利用实时荧光定量PCR分析AiHSP19.3的转录模式。所用引物见表1。以小地老虎核糖体蛋白(RpS3)和肌動蛋白(βactin)基因作为双内参基因。荧光定量PCR反应体系(20 μL):Hieff qPCR SYBR Green Master Mix(翌圣,上海)10 μL,10 μmol/L上、下游引物各0.4 μL,cDNA 1 μL,超纯水8.2 μL。扩增反应在CFX96型定量PCR仪(BioRad,美国)上进行,反应程序为:95℃ 5 min;95℃ 10 s,60℃ 30 s,40个循环。试验设3次生物学重复,使用Pfaffl方法[18]计算相对转录水平。
1.6 数据统计与分析
使用DPS 7.05软件进行统计分析,其中不同发育历期,不同组织,不同温度和杀虫剂不同处理时间之间AiHSP19.3转录水平的差异显著性采用单因素方差分析(Oneway ANOVA)和Duncan氏新复极差法进行检验,显著性水平设为α=0.05。
2 结果与分析
2.1 AiHSP19.3基因序列及系统进化位置
从小地老虎转录组中鉴定到一个编码小分子热激蛋白的cDNA序列,命名为AiHSP19.3,该序列包含516 bp的开放阅读框,编码1个由171个氨基酸残基组成的蛋白质。在线软件预测表明,该蛋白理论分子量为19.3 kD,等电点为5.67。结构域分析表明AiHSP19.3具有可变的N末端区域(氨基酸残基1-62),保守的α晶状体结构域(氨基酸残基63-141)和C末端区域(氨基酸残基142-171),是一种典型的sHSP。AiHSP19.3氨基酸序列中未预测出信号肽序列和跨膜区,表明该蛋白位于胞质内。BLAST比对结果显示,AiHSP19.3与草地贪夜蛾Spodoptera frugiperda SfHSP19.3(登录号:XP_035456993.1;一致性90.06%)、黏虫Mythimna separata MsHSP19.3(登录号:ATN45241.1;一致性90.00%)和斜纹夜蛾Spodoptera litura SlHSP19.3(登录号:XP_022837060.1;一致性89.47%)具有较高的氨基酸一致性。多序列联配结果(图1)表明,AiHSP19.3具有保守的α晶状体结构域,且与其他昆虫的sHSP序列具有较高的相似性。基于不同物种sHSP的氨基酸序列构建的系统进化树显示,AiHSP19.3与鳞翅目昆虫sHSP聚为同一进化分支,且与草地贪夜蛾SfHSP19.3(登录号:XP_035456993.1)亲缘关系最近(图2)。
2.2 AiHSP19.3时空转录模式
AiHSP19.3在所有龄期小地老虎样本中均能检测到转录(图3a),在1龄和2龄幼虫期转录水平最低,其后随着龄期增加,转录水平逐渐升高,在6龄幼虫期转录水平达到最大,且显著高于其他发育阶段(图3a)。在蛹期和成虫期,AiHSP19.3转录水平显著下降(图3a)。AiHSP19.3在小地老虎3龄幼虫不同组织中也有不同程度的转录(F3,8=309.40,P=0.000 1),在脂肪体中的转录水平最高,且显著高于其在体壁、马氏管和中肠中的转录水平(图3b)。
2.3 AiHSP19.3在高温胁迫下的转录模式
高温处理1 h对AiHSP19.3转录水平有显著影响(F4,10=39.14,P=0.000 1)。其中,32℃处理诱导AiHSP19.3转录水平升高至对照组的1.97倍;35℃处理下AiHSP19.3转录水平上调最高,达到对照组的2.52倍。但当温度继续升高至38℃和41℃时,AiHSP19.3的转录水平开始下降,但仍显著高于对照组(图4)。
2.4 AiHSP19.3在杀虫剂胁迫下的转录模式
3种杀虫剂(高效氯氟氰菊酯、氯虫苯甲酰胺和辛硫磷)LC50剂量处理均能诱导AiHSP19.3转录水平显著上调(高效氯氟氰菊酯:F5,12=166.49,P=0.000 1;氯虫苯甲酰胺:F5,12=77.31,P=0.000 1;辛硫磷:F5,12=120.29,P=0.000 1),AiHSP19.3转录水平分别在高效氯氟氰菊酯处理后12 h,氯虫苯甲酰胺处理后3 h和辛硫磷处理后6 h达到最高(图5)。同时观察到,3种药剂处理后,AiHSP19.3转录水平均呈现先上升后下降的趋势,但始终高于对照组。
3 结论与讨论
已有研究报道,昆虫绝大多数sHSP含有1个α晶状体结构域,该结构域在分子识别和分子伴侣功能方面具有重要作用,并且可作为sHSP的典型特征[1920]。本研究通过分析小地老虎AiHSP19.3序列,发现该基因编码的蛋白质具有α晶状体结构域,表明AiHSP19.3属于典型的sHSP。AiHSP19.3序列的获得为深入分析该基因响应外界胁迫的分子机制奠定了基础。
前人研究表明,大部分昆虫sHSP基因在其不同发育阶段和不同组织中的转录水平均不相同。如棉铃虫Helicoverpa armigera sHSP22.0在4龄和5龄幼虫期转录水平最高,而在蛹期和成虫期转录水平极低[21];烟草甲Lasioderma serricorne HSP21.7在血淋巴中的转录水平显著高于其在表皮、中肠与脂肪体中的转录水平[22]。本研究在小地老虎不同发育阶段均检测到AiHSP19.3转录,但该基因在6龄幼虫期的转录水平显著高于其他龄期。sHSP基因在高龄幼虫期大量转录的现象也普遍存在于其他昆虫中,例如棉铃虫sHSP22.0和桃蚜Myzus persicaes HSP22.0均在高龄幼虫个体中转录水平最高,以此增强其对外界胁迫的耐受性[21,23]。由此推测AiHSP19.3可能参与小地老虎高龄幼虫抵御外界胁迫。通过组织特异性分析发现,AiHSP19.3在小地老虎3龄幼虫脂肪体中的转录水平显著高于其他组织。脂肪体不仅是昆虫重要的代谢和贮能器官,还参与昆虫生长、发育和生殖等过程[24]。推测AiHSP19.3在脂肪体中高转录可能与小地老虎sHSP合成、代谢调节及变态发育有关。
sHSP对高温胁迫的响应是昆虫适应外界温度变化的重要保护机制[25]。本研究发现AiHSP19.3转录水平在高温处理后均显著上调。高温胁迫引起昆虫sHSP轉录水平上调的现象在其他昆虫中多有报道,例如腰带长体茧蜂Macrocentrus cingulum在受到高温胁迫后其HSP23.8基因转录水平会显著增加[26];高温胁迫下小菜蛾12个sHSP基因转录水平均显著上调[6]。AiHSP19.3在高温胁迫下转录水平显著上调,表明它可能参与了小地老虎响应高温胁迫的过程,在保护虫体的正常生理活动中发挥重要作用。
除了极端高温之外,杀虫剂也是昆虫重要的外界胁迫因子。昆虫sHSP在响应杀虫剂胁迫中的作用已有报道,白蛾周氏啮小蜂Chouioia cunea经苏云金芽胞杆菌、阿维菌素、高效氯氰菊酯和灭幼脲4种农药处理后其sHSP12.2基因转录水平均显著增加[27];此外,当草地贪夜蛾、中华按蚊Anopheles sinensis和舞毒蛾Lymantria dispar等昆虫受到氯虫苯甲酰胺、拟除虫菊酯和甲萘威等药剂胁迫后,sHSPs基因转录水平均显著上调[2830]。本研究发现小地老虎幼虫经LC50剂量高效氯氟氰菊酯、氯虫苯甲酰胺和辛硫磷处理后AiHSP19.3基因转录水平均显著上调,推测其细胞内可能会大量合成AiHSP19.3蛋白,进而增强小地老虎对杀虫剂的防御能力。有研究表明,桃蚜和中华蜜蜂Apis cerana cerana在杀虫剂处理后体内活性氧含量升高,产生氧化胁迫,sHSP随之大量表达,以增强试虫对活性氧的耐受性[23,31]。此外,本研究还发现3种杀虫剂处理后,小地老虎AiHSP19.3基因转录水平达到最高的时间不同,这可能是由于试虫在不同杀虫剂胁迫下存在不同的反应机制,从而导致了响应时间上的差异。
综上所述,本研究阐明了小地老虎AiHSP19.3的序列特征、系统进化关系和转录模式,发现高温及3种杀虫剂均能诱导AiHSP19.3基因转录水平显著上调,表明AiHSP19.3可能参与了小地老虎高温和杀虫剂胁迫的过程。
参考文献
[1] 张旺和, 徐进, 李伟, 等. 热激蛋白在昆虫生殖中的功能及作用机制[J]. 生物安全学报, 2023, 32(2): 109117.
[2] DENLINGER D L. Regulation of diapause [J]. Annual Review of Entomology, 2002, 47(1): 93122.
[3] KRIEHUBER T, RATTEI T, WEINMAIER T, et al. Independent evolution of the core domain and its flanking sequences in small heat shock proteins [J]. The FASEB Journal, 2010, 24(10): 36333642.
[4] BASHA E, ONEILL H, VIERLING E. Small heat shock proteins and αcrystallins: dynamic proteins with flexible functions [J]. Trends in Biochemical Sciences, 2012, 37(3): 106117.
[5] LIU Qiuning, LIU Yu, XIN Zhaozhe. A small heat shock protein 21 (sHSP21) mediates immune responses in Chinese oak silkworm Antheraea pernyi [J]. International Journal of Biological Macromolecules, 2018, 111: 10271031.
[6] CHEN Xien, ZHANG Yalin. Identification of multiple small heatshock protein genes in Plutella xylostella (L.) and their expression profiles in response to abiotic stresses [J]. Cell Stress & Chaperones, 2015, 20: 2335.
[7] 陸明星, 徐静, 杜予州. 昆虫小分子量热激蛋白的研究进展[J]. 应用昆虫学报, 2015, 52(6): 13261332.
[8] 吴豫. 榕江县小地老虎发生特点及防治措施[J]. 植物医生, 2016, 29(5): 6263.
[9] 吴海斌, 范昆, 张坤鹏, 等. 13种杀虫剂对小地老虎卵和幼虫的生物活性[J]. 环境昆虫学报, 2013, 35(3): 409414.
[10]MA Chunsen, MA Gang, PINCEBOURDE S. Survive a warming climate: insect responses to extreme high temperatures [J]. Annual Review of Entomology, 2021, 66: 163184.
[11]向玉勇, 刘同先, 张世泽. 温湿度、光周期和寄主植物对小地老虎求偶及交配行为的影响[J]. 植物保护学报, 2018, 45(2): 235242.
[12]于伟丽, 杜军辉, 胡延萍, 等. 六种杀虫剂对小地老虎的毒力及对土壤生物安全性评价[J]. 植物保护学报, 2012, 39(3): 277282.
[13]何发林, 姜兴印, 姚晨涛, 等. 氯虫苯甲酰胺与6种药剂复配对小地老虎的联合毒力[J]. 植物保护, 2018, 44(6): 236241.
[14]ZHANG Zhengqun, XU Chunmei, DING Jinfeng, et al. Cyantraniliprole seed treatment efficiency against Agrotis ipsilon (Lepidoptera: Noctuidae) and residue concentrations in corn plants and soil [J]. Pest Management Science, 2019, 75(5): 14641472.
[15]QUAN Guoxing, DUAN Jun, LADD T, et al. Identification and expression analysis of multiple small heat shock protein genes in spruce budworm, Choristoneura fumiferana (L.) [J]. Cell Stress & Chaperones, 2018, 23(1): 141154.
[16]GU Shaohua, WU Kongming, GUO Yuyuan, et al. Identification of genes expressed in the sex pheromone gland of the black cutworm Agrotis ipsilon with putative roles in sex pheromone biosynthesis and transport [J/OL]. BMC Genomics, 2013, 14: 636. DOI: 10.1186/14712164/14/636.
[17]TAMURA K, STECHER G, KUMAR S. MEGA11: molecular evolutionary genetics analysis version 11 [J]. Molecular Biology and Evolution, 2021, 38(7): 30223027.
[18]PFAFFL M W. A new mathematical model for relative quantification in realtime RTPCR [J/OL]. Nucleic Acids Research, 2001, 29(9): e45. DOI: 10.1093/nar/29.9.e45.
[19]MONTFORT R V, SLINGSBY C, VIERLING E. Structure and function of the small heat shock protein/αcrystallin family of molecular chaperones [J]. Advances in Protein Chemistry, 2001, 59: 105156.
[20]SUN Y, MACRAE T H. Small heat shock proteins: molecular structure and chaperone function [J]. Cellular and Molecular Life Sciences, 2005, 62(21): 24602476.
[21]楊朔, 刘少凯, 赵少轩, 等. 棉铃虫小分子热激蛋白sHSP22.0基因的克隆及表达谱分析[J]. 植物保护, 2021, 47(3): 6169.
[22]黄岩. 烟草甲热激蛋白基因的鉴定、表达模式和功能研究[D]; 合肥: 安徽农业大学, 2022.
[23]董宝. 桃蚜2个热激蛋白基因对高温和杀虫剂胁迫的响应及其功能研究[D]; 合肥: 安徽农业大学, 2022.
[24]ARRESE E L, SOULAGES J L. Insect fat body: energy, metabolism, and regulation [J]. Annual Review of Entomology, 2010, 55: 207225.
[25]李慧, 何玄玉, 陶蓉, 等. 松墨天牛小热激蛋白基因的克隆、表达谱及对温度胁迫的响应[J]. 昆虫学报, 2018, 61(7): 749760.
[26]XU Pengjun, XIAO Jinhua, LIU Li, et al. Molecular cloning and characterization of four heat shock protein genes from Macrocentrus cingulum (Hymenoptera: Braconidae) [J]. Molecular Biology Reports, 2010, 37: 22652272.
[27]范伟健, 相伟芳, 王静, 等. 农药与紫外胁迫对白蛾周氏啮小蜂小分子热激蛋白sHSP12.2基因表达的影响[J]. 林业科学, 2019, 55(2): 128136.
[28]SAMANTA S, BARMAN M, CHAKRABORTY S, et al. Involvement of small heat shock proteins (sHsps) in developmental stages of fall armyworm, Spodoptera frugiperda and its expression pattern under abiotic stress condition [J/OL]. Heliyon, 2021, 7(4): e06906. DOI: 10.1016/j.heliyon.2021.e06906.
[29]SI Fengling, QIAO Liang, HE Qiyi, et al. HSP superfamily of genes in the malaria vector Anopheles sinensis: diversity, phylogenetics and association with pyrethroid resistance [J]. Malaria Journal, 2019, 18: 115.
[30]刘鹏, 孙丽丽, 张琪慧, 等. 舞毒蛾小分子热激蛋白基因分析及对甲萘威胁迫的响应[J]. 北京林业大学学报, 2017, 39(1): 7884.
[31]ZHANG Yuanying, LIU Yaling, GUO Xulei, et al. sHsp22.6, an intronless small heat shock protein gene, is involved in stress defence and development in Apis cerana cerana [J]. Insect Biochemistry and Molecular Biology, 2014, 53: 112.
(责任编辑:杨明丽)
