HSYA对人晶状体上皮细胞系SRA01/04生物学特性的影响
2024-06-05李诗怡王康黄菊张澳张培培谢迎宾
李诗怡 王康 黄菊 张澳 张培培 谢迎宾
滨州医学院附属医院眼科,滨州 256603
目前,手术仍是白内障患者复明的唯一方式,术后残留的人晶状体上皮细胞(HLECs)出现增殖、迁移及上皮-间质转化(EMT),使后囊膜出现混浊与纤维化,称为后发性白内障(PCO)。尽管手术方式及人工晶状体材质与设计的改进均在一定程度上降低了PCO的发病率,但仍改变不了其为白内障术后最常见的并发症。Nd∶YAG激光后囊膜切开术作为PCO唯一有效治疗手段,仍无法避免黄斑水肿、视网膜脱离、眼压升高及人工晶状体损伤等并发症的出现[1]。因此,有效抑制HLECs增殖、迁移及EMT成为防治PCO的关键。近年来,羟基红花黄色素A(HSYA)被发现可抑制脂多糖诱导的非小细胞肺癌细胞增殖、侵袭、迁移及EMT[2],也有研究发现HSYA可延缓心、肺、肾等脏器纤维化[3-5]。现在HSYA在眼科,尤其是在晶状体相关疾病中的研究较少[6-7]。本研究通过体外实验观察HSYA对人晶状体上皮细胞系SRA01/04(HLEC-SRA01/04)增殖、迁移及EMT的影响,旨在探讨HSYA在PCO防治中的价值。
材料与方法
1.细胞系及主要试剂仪器
HLEC-SRA01/04,广州赛库生物技术有限公司;HSYA,上海麦克林生化科技股份有限公司;重组人表皮生长因子(rhEGF),美国PEPROTECH公司;胎牛血清(FBS),南美洲Lonsera公司;增强型25%胰蛋白酶-EDTA消化液、四甲基偶氮唑蓝(MTT)、Transwell细胞培养小室,广州白鲨生物科技有限公司;兔单克隆抗增殖细胞核抗原(PCNA)抗体,Abcam;兔单克隆抗波形蛋白(Vimentin)抗体,武汉ABclonal公司;山羊抗兔过氧化物酶二抗,中衫金桥;实时荧光定量PCR(qPCR)单链合成试剂盒,北京全式金生物技术股份有限公司;倒置相差显微镜,日本Olympus公司;自动酶标分析仪(AT-858),美国热电Thermo公司;PCR扩增仪、qRT-PCR仪,德国Eppendorf公司。研究时间为2022年6月至2023年9月。
2.方法
2.1.HLEC-SRA01/04的培养 将HLEC-SRA01/04原代细胞复苏后接种于4 ml的完全培养基中(含有20% FBS、1%青霉素链霉双抗的DMEM高糖培养基),置于含体积分数为5% CO2、37 ℃的恒温孵育箱中培养,2 d换液1次,根据细胞生长状况,在细胞对数生长期内,细胞融合度为80%~90%时,按1∶3比例传代培养。取4次传代后的细胞进行后续实验。
2.2.MTT法确定rhEGF诱导增殖的浓度 取对数生长期的细胞用胰酶消化,培养基(含2% FBS)重悬,血球计数板计数,T25培养瓶中细胞浓度为90×104个/ml,按每孔100 μl细胞悬液、4×103个细胞接种于96孔板中,待12 h细胞贴壁后,弃去上清液,分别加入100 μl含0、1、5、10、50 μg/L rhEGF的低血清培养基,每个浓度样本均设置5个复孔,分别处理24 h后,弃去孔中培养基,每孔加入40 μl浓度为5 mg/L的MTT溶液及160 μl含2% FBS的DMEM高糖培养基,在培养箱中孵育4 h后吸除孔内液体,加入150 μl二甲基亚砜(DMSO),待结晶完全溶解后,酶标仪在490 nm处检测吸光度值(OD值),依据公式计算增值率(%)=(不同浓度细胞因子组平均OD值-空白对照组平均OD值)×100%/空白对照组的平均OD值。
2.4.细胞划痕实验确定rhEGF诱导迁移及EMT的浓度 将对数生长期细胞接种于6孔板中,待细胞贴壁且融合度达80%~90%时,替换低血清培养基,饥饿过夜,使用100 μl枪头做细胞划痕,磷酸盐缓冲液轻柔冲洗细胞碎片2遍,按实验分组向每孔内分别加入含0、1、10、50 μg/L rhEGF的低血清培养基,固定同一划痕位置,分别在培养箱中孵育24 h,用光学显微镜拍照,Image J软件测定并分析细胞的迁移距离,依据下列公式计算各组的细胞迁移率(%)=(初始划痕距离-迁移后划痕距离)/初始划痕距离×100%。
2.5.实验分组 根据MTT法确定HSYA药物在HLEC-SRA01/04细胞中24 h的IC50值为(76.520±0.954)μmol/L,48 h的IC50值为(66.094±2.508)μmol/L,故后续实验HSYA的药物浓度分组为0、20、40、70、100 μmol/L;根据MTT及细胞划痕实验结果,后续实验中均使用5 μg/L rhEGF用于诱导增殖,50 μg/L诱导迁移及EMT。以下为后续实验分组:空白对照组为仅低血清培养基培养的HLEC-SRA01/04;含0 μmol/L HSYA+rhEGF处理组;含20 μmol/L HSYA+ rhEGF处理组;含40 μmol/L HSYA+rhEGF处理组;含70 μmol/L HSYA+rhEGF处理组;含100 μmol/L HSYA+rhEGF处理组。
2.6.细胞划痕实验检测不同浓度HSYA作用不同时间对rhEGF诱导的HLEC-SRA01/04迁移能力的影响 按2.4中实验方式将细胞接种于6孔板并做细胞划痕,按上述实验分组处理细胞,固定同一划痕位置,分别在培养箱中孵育0、24、48 h时,于显微镜下拍照记录。
2.7.Transwell小室实验检测不同浓度HSYA作用24 h对rhEGF诱导的HLEC-SRA01/04迁移能力的影响 将SRA01/04细胞分组处理24 h后,分别消化并使用含双抗无FBS培养基重悬,按每孔1×104个细胞接种于已水化好的上层小室中,在每个下层小室内置含30% FBS的完全培养基,于培养箱中孵育24 h,吸除小室内液并擦除上层小室内细胞,固定染色后,清洗染料,于倒置显微镜下观察拍照,Image J软件计数,细胞迁移率=视野中穿过滤过膜的细胞数,每组随机选取3个不同视野取平均数。
2.8.蛋白印迹法(Western Blot)检测PCNA及EMT标记物Vimentin的表达情况 按上述实验分组,分别使用含5 μg/L及50 μg/L rhEGF的不同浓度HSYA溶液处理6孔板内贴壁细胞,培养24 h后,弃去上清液,磷酸盐缓冲液冲洗2遍后分组提取细胞内蛋白,二喹啉甲酸法测定总蛋白浓度,每个样本总蛋白上样量为30 μg,电泳、转膜后,将转好的膜置于快速封闭液中室温封闭15 min,分别使用一抗稀释液(5 μg/L组-抗PCNA抗体抗;50 μg/L组-Vimentin抗体)4 ℃孵育过夜,TBST缓冲液洗膜后,二抗稀释液室温孵育1 h,再次洗膜,滴加超敏发光液曝光、显影。每个样本重复3次实验。Image J软件分析处理目标条带的光密度值。
2.9.逆转录荧光定量聚合链式反法(RT-qPCR)检测PCNA及EMT标记物Vimentin的mRNA表达水平 按上述实验分组处理细胞,给药后24 h,使用Trizol法分组提取总RNA,反转录后,按qPCR反应体系,进行扩增。PCNA、Vimentin和β-肌动蛋白(β-actin)mRNA引物序列均由苏州金唯智生物技术有限公司合成,引物序列(每个样本设3个复孔):PCNA-F:5’-GCTCCATCCTCAAGAAGGTGT-3’,PCNA-R:5’-GGAGCTAATATCCCAGCAGGC-3’;Vimentin-F:5’-AGGCGAGGAGAGCAGGATTT-3’;Vimentin-R:5’-AGTGGGTATCAACCAGAGGGA-3’;β-actin-F:5’-CATGTACGTTGCTATCCAGGC-3’;β-actin-R:5’-CTCCTTAATGTCACGCACGAT-3’。
3.统计学分析
采用SPSS 26.0软件进行数据分析,GraphPad Prism 8.0软件绘图,采用单因素方差分析法,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,组内采用配对t检验,以P<0.05为差异有统计学意义。
结果
1.MTT比色法测定HSYA对rhEGF诱导HLECs增殖的影响(表1)
表1 不同浓度rhEGF对HLECs增殖的影响(±s)
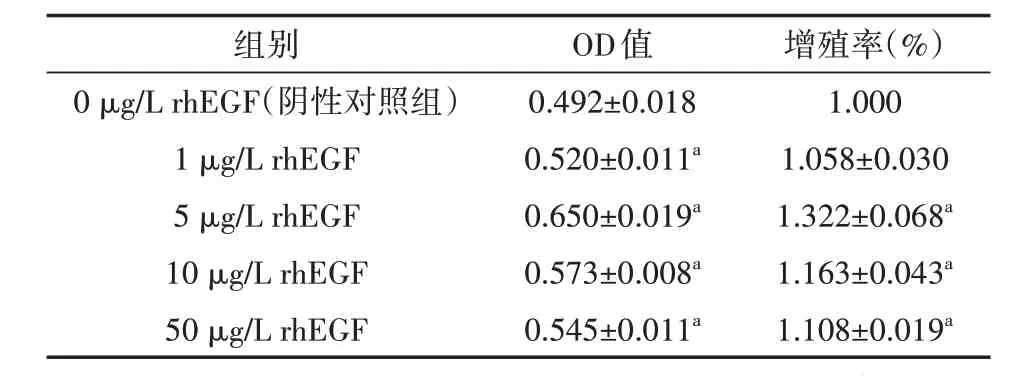
表1 不同浓度rhEGF对HLECs增殖的影响(±s)
注:rhEGF为重组人表皮生长因子,HLECs为人晶状体上皮细胞,OD为吸光度;与阴性对照组比较,aP<0.05
组别OD值增殖率(%)0 μg/L rhEGF(阴性对照组)1 μg/L rhEGF 5 μg/L rhEGF 10 μg/L rhEGF 50 μg/L rhEGF 0.492±0.018 0.520±0.011a 0.650±0.019a 0.573±0.008a 0.545±0.011a 1.000 1.058±0.030 1.322±0.068a 1.163±0.043a 1.108±0.019a
HLECs经不同浓度rhEGF培养后,1 μg/L rhEGF浓度组、5 μg/L rhEGF浓度组、10 μg/L rhEGF浓度组、50 μg/L rhEGF浓度组OD值及增殖率均高于阴性对照组,差异均有统计学意义(均P<0.05)。
当读者在头脑中对这首诗进行精细复述时,lover这个词在译者的先验里应该与美好的爱情有关,这就会抑制读者关于“dream”噩梦、梦魇的相关联想,只会激活其梦或者梦想的概念。“drive”可能激活开车、驾驶、驱赶、发动等动作,但与后面的“orioles”会为译者提供物体的背景情景来帮助判断所要提取的意义,在此处要选取“驱赶”之意。以此类推,根据上下文提供背景的模拟运演,本诗构建出的情景模型是一位少女正在梦中与自己的心上人约会,不料被枝头啼叫的黄鹂鸟惊醒,尽管鸟儿歌声动听,但打断了少女与情人的约会。通过这一心理过程读者理解的诗的主体是少女思念情人。
2.不同浓度及时间下HSYA对rhEGF诱导HLECs增殖的影响(表2)
表2 不同浓度及时间下HSYA对rhEGF诱导HLECs增殖的影响(±s)
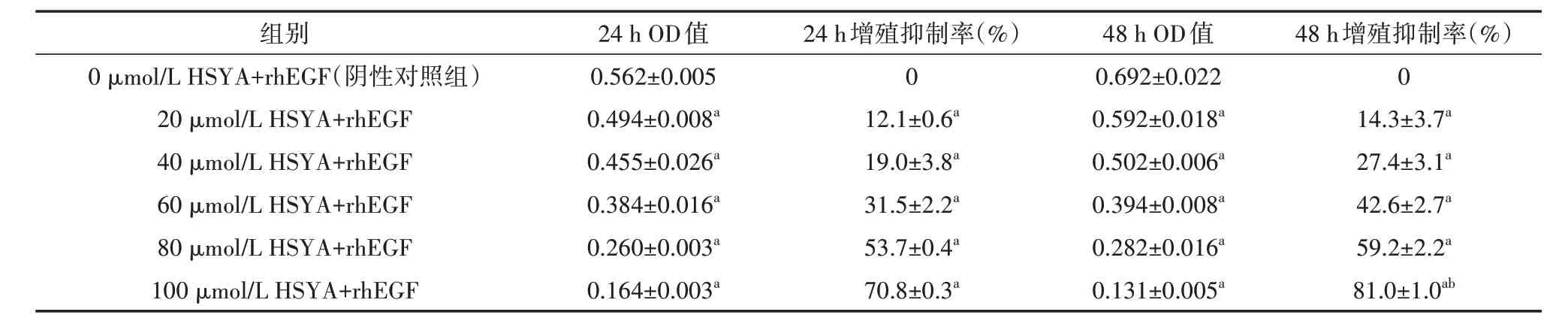
表2 不同浓度及时间下HSYA对rhEGF诱导HLECs增殖的影响(±s)
注:rhEGF均为5 μg/L;HSYA为羟基红花黄色素A,rhEGF为重组人表皮生长因子,HLECs为人晶状体上皮细胞,OD为吸光度;与阴性对照组比较,aP<0.05;与24 h增殖抑制率比较,bP<0.05
48 h增殖抑制率(%)0 14.3±3.7a 27.4±3.1a 42.6±2.7a 59.2±2.2a 81.0±1.0ab组别0 μmol/L HSYA+rhEGF(阴性对照组)20 μmol/L HSYA+rhEGF 40 μmol/L HSYA+rhEGF 60 μmol/L HSYA+rhEGF 80 μmol/L HSYA+rhEGF 100 μmol/L HSYA+rhEGF 24 h OD值0.562±0.005 0.494±0.008a 0.455±0.026a 0.384±0.016a 0.260±0.003a 0.164±0.003a 24 h增殖抑制率(%)0 12.1±0.6a 19.0±3.8a 31.5±2.2a 53.7±0.4a 70.8±0.3a 48 h OD值0.692±0.022 0.592±0.018a 0.502±0.006a 0.394±0.008a 0.282±0.016a 0.131±0.005a
不同浓度HSYA与5 μg/L rhEGF共同作用于HLECs不同时长后,随着HSYA浓度升高,孔内OD值逐渐减小,HSYA对HLECs增殖抑制率逐渐升高,表现出明显的浓度依赖性;同一浓度作用下,HSYA对HLECs的48 h增殖抑制率均高于24 h,但仅有100 μmol/L浓度组差异有统计学意义(P<0.05),其余各浓度组24 h与48 h的抑制率差异均无统计学意义(均P>0.05);作用24 h后,HSYA对HLECs的IC50值为(76.520±0.954)μmol/L,48 h的IC50值为(66.094±2.508)μmol/L。
3.细胞划痕实验及Transwell小室实验测定不同浓度HSYA对rhEGF诱导的HLECs迁移的影响
不同浓度rhEGF作用24 h后,0、1、10、50 μg/L组的迁移率分别为(45.6±9.7)%、(46.1±3.1)%、(58.3±6.8)%、(83.1±2.7)%,随着rhEGF浓度增加,细胞迁移率逐渐增加,除0 μg/L与1 μg/L组间外,其余各组间差异均有统计学意义(均P<0.05)。见图1、图2。
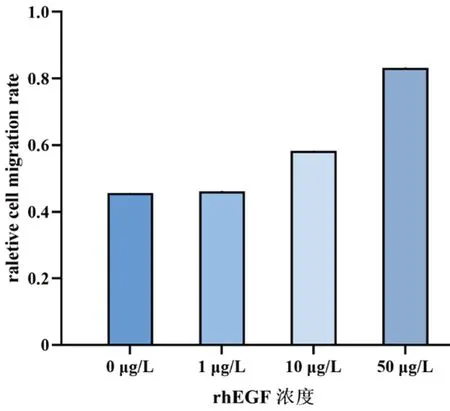
图1 细胞划痕实验测定不同浓度rhEGF对HLECs迁移率的影响

图2 不同浓度组rhEGF作用于HLECs后的划痕实验结果
4.细胞划痕实验及Transwell小室实验测定不同浓度HSYA对rhEGF诱导HLECs迁移的影响
不同浓度HSYA作用于50 μg/L rhEGF诱导的HLECs 24、48 h后,各组细胞划痕实验结果见图3。空白组及0、20、40、70、100 μmol/L组的24 h细胞迁移率分别为(46.9±1.8)%、(90.0±1.5)%、(88.4±2.1)%、(43.3±6.6)%、(31.5±16.2)%、(5.82±5.2)%,48 h细胞迁移率分别为(81.1±2.3)%、100%、(95.5±0.1)%、(72.6±3.5)%、(58.5±6.1)%、(37.4±7.1)%,随HSYA浓度增加,HLECs迁移率逐渐下降,具有浓度依赖性,各组数据经单因素ANOVA检验发现,0 μmol/L与20 μmol/L组间在24 h和48 h作用时长下,差异均无统计学意义(均P>0.05),证明当HSYA浓度≥40 μmol/L时,HSYA可明显抑制50 μg/L rhEGF诱导HLECs的迁移(图4、图5)。
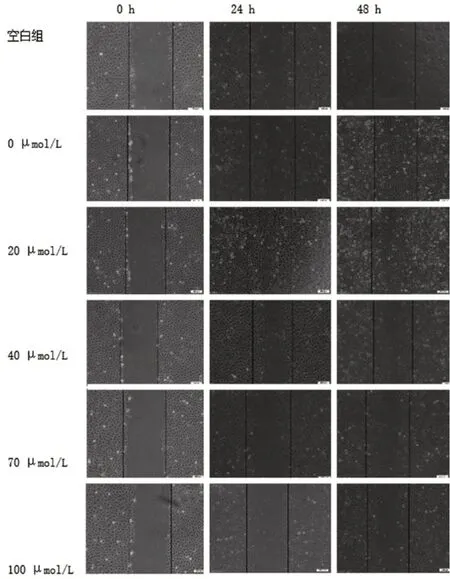
图3 不同HSYA浓度组作用于50 μg/L rhEGF诱导HLECs 24 h及48 h后的划痕实验
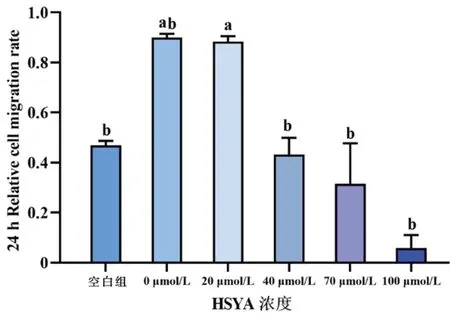
图4 细胞划痕实验测定不同浓度HSYA作用于50 μg/L rhEGF诱导HLECs的24 h迁移率

图5 细胞划痕实验测定不同浓度HSYA作用于50 μg/L rhEGF诱导HLECs的48 h迁移率
5.Transwell小室实验测定不同浓度HSYA对rhEGF诱导HLECs迁移的影响
Transwell小室实验结果显示:空白组及0、20、40、70、100 μmol/L组的细胞数分别为(171.667±20.407)个、(290.222±24.135)个、(198.667±16.826)个、(161.222±5.981)个、(134.111±6.850)个、(67.444±7.351)个,其中40 μmol/L与70 μmol/L浓度组的穿膜细胞数比较,差异无统计学意义(P>0.05)。见图6、图7。
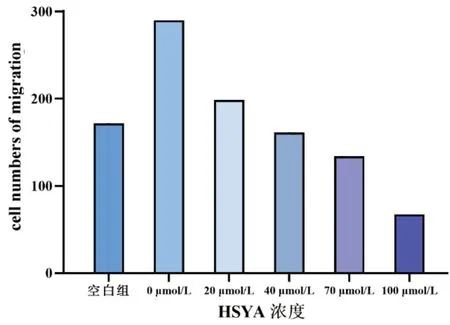
图6 Transwell小室实验测定不同浓度HSYA作用于50 μg/L rhEGF诱导HLECs 24 h后,各组的穿膜细胞数
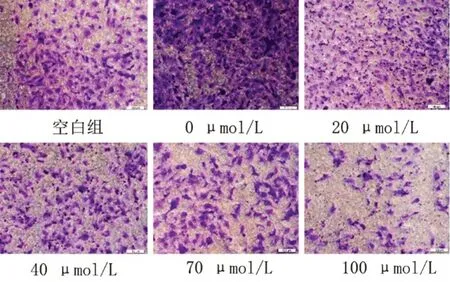
图7 不同HSYA浓度组作用于50 μg/L rhEGF诱导HLECs 24 h后的Transwell小室实验
6.Western blot法分析各组内PCNA及Vimentin含量
空白组与0 μmol/L HSYA组PCNA及Vimentin相对表达量比较,差异均有统计学意义(均P<0.05);各组蛋白PCNA及Vimentin表达量随HSYA浓度升高而降低,其中0 μmol/L与40、70、100 μmol/L组内PCNA及Vimentin含量比较(均P<0.05),当HSYA浓度≥40 μmol/L时,可明显抑制rhEGF诱导HLECs内PCNA与Vimentin的表达(图8~10)。
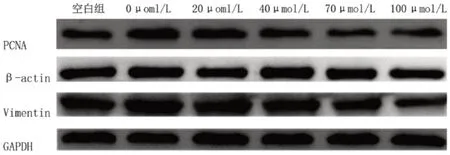
图8 Western Blot法测定各组PCNA及Vimentin蛋白的表达水平
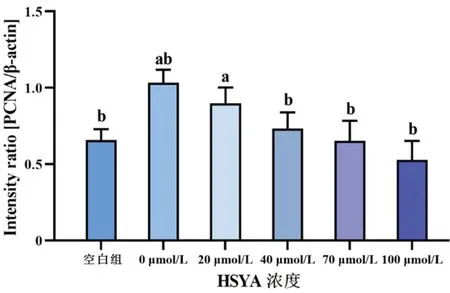
图9 不同浓度HSYA作用于rhEGF诱导HLECs 24 h后,各组细胞PCNA蛋白的相对表达量
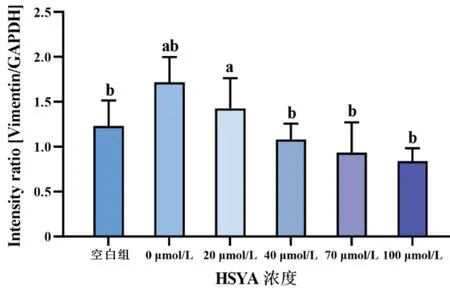
图10 不同浓度HSYA作用于rhEGF诱导HLECs 24 h后,各组细胞的Vimentin相对表达量
7.RT-qPCR法分析各组内PCNA及Vimentin的mRNA表达量
PCNA及Vimentin的mRNA含量均随HSYA的浓度升高而降低,其中当HSYA浓度≥40 μmol/L时,PCNA与Vimentin的mRNA表达量与0 μmol/L组相比,差异均有统计学意义(均P<0.05)。见图11、图12。
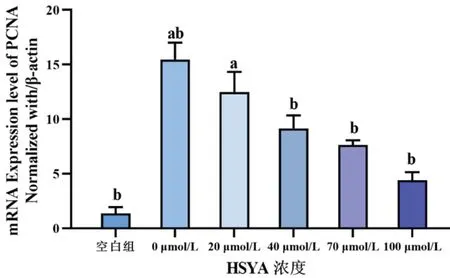
图11 不同浓度HSYA作用于rhEGF诱导HLECs 24 h后,各组细胞PCNA 的mRNA相对表达量

图12 不同浓度HSYA作用于rhEGF诱导HLECs 24 h后,各组细胞的Vimentin mRNA相对表达量
讨论
白内障术后残留的HLECs异常增殖、迁移及分化是导致后囊膜出现白色纤维化混浊的主要原因,临床上PCO的病理改变主要分为再生型和纤维化型,前者为残余晶状体细胞在手术机械刺激后出现的异常增殖与分化,后者可见纺锤形细胞的出现、基质沉积和后囊膜皱缩[8],患者自身基础疾病(如糖尿病)、年龄、术式、人工晶状体材质都与PCO的发病率有关系[9]。在对发病机制的进一步研究发现,白内障术后眼内炎症因子的表达明显增加,可刺激表皮生长因子(EGF)、转化生长因子、纤维生长因子等细胞因子进入激活状态,它们在PCO的发生、发展中起着关键作用[10-11]。
EGF最早发现于小鼠颌下腺,在人体内由十二指肠及颌下腺分泌,存在于人所有的体液中,且人晶状体中可检测到相应受体的表达[12-13]。Majima[14]在确保低血清中无rhEGF的前提下,提出EGF可有效促进晶状体上皮细胞(LECs)的增殖潜力,其中,1 μg/L的EGF作用较好,而10 μg/L的EGF还可以促进LECs的纤维化。Kampmeier等[13]提出5 μg/L EGF可诱导HLEC-SRA01/04增殖。胡艳红等[15]添加不同浓度rhEGF培养牛晶状体上皮细胞,发现当rhEGF浓度为50 μg/L时,促生长作用明显。进一步研究发现,使用EGF可抑制人晶状体上皮细胞系HLE-B3 Ad12/SV40增殖、迁移及细胞内基质收缩[16]。Jang等[17]提出EGF可通过细胞外调节蛋白激酶和磷脂酰肌醇3激酶/蛋白激酶B信号通路介导基质金属蛋白酶的表达,促进HLECs发生迁移。本研究选取rhEGF构建体外PCO模型发现,rhEGF可有效促进HLEC-SRA01/04增殖,而HLEC-SRA01/04的迁移表现出对rhEGF明显的浓度依赖性。
红花也称草红花或刺红花,具有活血化瘀、通经止痛功效,而HSYA是红花黄色素的主要活性成分[18-19],具有抗炎、调控细胞凋亡、抑制新生血管生成、抗凝等多种药理作用[6],不仅可抑制肺癌[2]、结直肠癌[20]及食道癌[21]等肿瘤细胞增殖与分化,还可抑制3T3-L1前脂肪细胞[22]、脐静脉内皮细胞[23]、成纤维细胞[24-25]、血小板衍生生长因子[26]或脂多糖[27]诱导的血管平滑肌细胞增殖和迁移,逆转心、肝、肺等脏器纤维化[3-5,28]。近年来,也有眼科学者发现,红花黄色素可改善糖尿病大鼠视网膜的血流灌注,拮抗小鼠视网膜光损伤[29-30]。HSYA可降低高糖环境下血管内皮细胞的VEGF表达,并抑制其增殖[31];红花黄色素可上调抗氧化蛋白表达水平,使晶状体免受氧化损伤[7]。
本研究在采用体外rhEGF诱导HLEC-SRA01/04模拟PCO的发生发展过程,观察HSYA对其增殖、迁移及EMT的影响。MTT、细胞划痕及Transwell小室实验结果显示,HSYA可以抑制rhEGF诱导的HLEC-SRA01/04增殖与迁移,具有较好浓度依赖性。HSYA可抑制间质细胞标记物Vimentin mRNA与蛋白的表达,具有较好浓度依赖性,使HLECs的迁移能力下调。近年来与PCO发病机制相关的细胞因子及基因[32-34]研究不断深入,对于HSYA对HLECs生物学特性影响的具体作用靶点,仍需进一步实验探究。
综上所述,HSYA可抑制rhEGF诱导的HLECs增殖、迁移及EMT,并下调PCNA与Vimentin基因及蛋白表达,提示HSYA有希望成为PCO防治中的新型药物。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明李诗怡:酝酿和设计试验,实施研究,采集、分析/解释数据,起草文章,统计分析;王康:酝酿和设计试验,统计分析;黄菊:酝酿和设计试验,分析/解释数据;张澳、张培培:酝酿和设计试验,采集数据;谢迎宾:酝酿和设计试验,对文章的知识性内容作批评性审阅,获取研究经费,指导,支持性贡献
