三倍体太平洋牡蛎不同组织中挥发性风味成分分析
2024-06-04郑泽文周子权陈志陈建楠薛婷林岗
郑泽文 周子权 陈志 陈建楠 薛婷 林岗

摘 要:為探究太平洋牡蛎不同组织中挥发性风味成分的差异,揭示牡蛎总体风味的来源及形成机制。采用 SPME-GC-MS 技术结合多元统计分析的方法,对太平洋牡蛎闭壳肌、肝胰腺、鳃和性腺的挥发性风味成分进行了检测。结果表明:闭壳肌中检测到 18 种物质,肝胰腺中检测到11 种物质,鳃中检测到 8 种物质,性腺中检测到 6 种物质。闭壳肌、鳃和性腺中主要成分为醛类物质,肝胰腺中主要成分为醇类物质,4 个组织中共检测出 28 种挥发性风味成分,其中大多数化合物为醛类、酮类、醇类等;采用聚类热图分析、关键风味成分筛选以及主成分分析比较 4 个不同组织的挥发性风味成分,结果显示太平洋牡蛎中各组织风味差异明显,影响太平洋牡蛎风味的主要物质为醛类和酮类,太平洋牡蛎不同组织中的各种风味物质相互协调,造就了太平洋牡蛎独特的海洋鲜香风味。研究结果对指导太平洋牡蛎风味研究和产品加工利用有重要意义。
关键词:太平洋牡蛎;固相微萃取-气相色谱-质谱;挥发性风味成分
中图分类号:TS254.4文献标志码:A文章编号:0253?2301(2024)02?0001?09
DOI: 10.13651/j.cnki.fjnykj.2024.02.001
Analysis of Volatile Flavor Components in Different Tissues of Triploid Pacific Oyster (Crassostrea gigas)
ZHENG Ze-wen1, ZHOU Zi-quan1, CHEN Zhi2, CHEN Jian-nan1, XUE Ting1 *, LIN Gang1 *
(1. Technology Research and Development Center of Marine Active Substances and Products of Fuzhou Institute of Oceanology, Fujian Key Laboratory for the Sustainable Utilization of Special Marine Biological Resources, Fujian Normal University, Fuzhou, Fujian 350117, China; 2. Freshwater Fisheries Research Institute of Fujian,
Fuzhou, Fujian 350025, China )
Abstract: In order to investigate the differences of volatile flavor components in different tissues of Crassostrea gigas, and reveal the source and formation mechanism of the overall flavor of oysters, the volatile flavor components in the adductor muscle, hepatopancreas, gills and gonads of Crassostrea gigas were detected by using SPME-GC-MS technique combined with the method of multivariate statistical analysis. The results showed that 18 substances were detected in the adductor muscle, 11 substances were detected in the hepatopancreas, 8 substances were detected in the gills and 6 substances were detected in the gonads. The main components in the adductor muscle, gills and gonads were aldehydes, and the main components in hepatopancreas were alcohols. A total of 28 volatile flavor components were detected in the four tissues, most of which were aldehydes, ketones and alcohols, etc. The clustering heat map analysis, screening of key flavor components and principal component analysis were used to compare the volatile flavor components of the four different tissues, and the results showed that there were obvious differences in the flavors of the various tissues of Crassostrea gigas, and the main substances that affected the flavors of Crassostrea gigas were aldehydes and ketones. The various flavor substances in the different tissues of Crassostrea gigas coordinated with each other to create the unique marine fresh flavor of Crassostrea gigas. The results of this study were of great significance in guiding the research on the flavor of Crassostrea gigas and the processing and utilization of Crassostrea gigas products.
Key words: Crassostrea gigas;Solid-phase microextraction-gas chromatography-mass spectrometry;Volatile flavor components
牡蛎俗称“蚝” “蚵” “海蛎子”,是我国重要的海洋经济贝类,其产量约占养殖贝类总产量的1/3,其中太平洋牡蛎是最为重要的品种之一[1]。太平洋牡蛎广泛分布于我国南北沿海,其富含高质量的蛋白质、糖原和维生素,特别是牛磺酸等营养成分因而备受消费者喜爱,素有“海洋牛奶”的美称[2]。牡蛎的营养成分、维生素以及微量元素等含量是评价牡蛎品质的重要指标。然而,随着消费者对于水产品有了更高的追求,牡蛎所具有的独特海洋鲜香风味也已成为消费者购买和食用的重要因素。目前针对牡蛎挥发性风味成分的研究主要集中在不同品种、产地、养殖区域、收获季节等对于活体牡蛎挥发性风味成分的影响方面[3?5],但对牡蛎不同组织中挥发性风味成分进行分析的报道却较少见到。牡蛎不同组织中的挥发性风味成分必然有所差异,如有些组织中存在较重的不愉悦风味(如腥臭味)而不被消费者接受,从而影响了牡蛎的精加工和开发利用的价值。为揭示不同组织对牡蛎总体风味的贡献,进一步解析太平洋牡蛎的风味特性,本研究采用SPME-GC-MS联用技术对太平洋牡蛎闭壳肌、肝胰腺、鳃以及性腺组织中的挥发性风味成分进行检测,并进行聚类分析、关键挥发性风味成分分析以及主成分分析,探明太平洋牡蛎不同组织中挥发性风味成分的差异,揭示其风味的来源及形成机制,为太平洋牡蛎风味研究和加工利用提供参考依据。
1 材料与方法
1.1 试验材料
三倍体太平洋牡蛎Crassostrea gigas 2023年11月采集于福建省福清市福清湾海域(25.381°N,119.575°E),规格为(116.27±4.08)g·个?1,壳长(117.34±4.06)mm,壳宽(54.06±3.12)mm,壳高(34.27±3.04)mm(图1)。由冷链运输车低温运输至实验室后,以灭菌人工海水洗净,沥干,置于?80℃保存备用。
1.2 仪器与设备
DS-200高速组织捣碎机(江阴市保利科研器械有限公司);集热式磁力搅拌器(金坛市易晨仪器制造有限公司);电子天平(上海精密科学仪器有限公司);20 mL顶空样品瓶、57330-U固相微萃取装置、50/30 μm-57348-U型-DVB/CAR/PDMS固相微萃取针(美国色谱科公司);7890B-5977B GC-MS联用仪、HP-5MS色谱柱(60 m×0.25 mm,0.25 μm)(美国安捷伦公司)。
1.3 试验方法
1.3.1 样品制备
鲜活三倍体太平洋牡蛎去壳用灭菌海水洗净后分别取下闭壳肌、肝胰腺、鳃以及性腺(15个样品为1 组)。以1︰3的固定料液比将分离后的各个组织分别打成匀浆,将匀浆装入样品瓶中立即使用或存放于?80℃冰箱。
1.3.2 挥发性风味成分的萃取
取3 mL样品装于固相微萃取顶空瓶中,使用磁力搅拌水浴锅在60℃条件下磁力搅拌萃取30 min,萃取完成后迅速将萃取头插入进样口,在250℃条件下热解吸4 min。第1次使用的萃取头应置于250℃条件下老化1 h。
1.3.3 GC-MS 条件
GC条件:载气为高纯氦气,流速1 mL·min?1;选择不分流进样模式,HP-5MS色谱柱(60 m×0.25 mm,0.25 ?m);前进样口温度250℃,柱温采用升温程序:初始温度40℃,保持3 min;随后以6℃·min?1速率升温至200℃;再以10℃·min?1升至250℃,保持10 min。MS條件:采用电子电离模式;离子阱温度150℃;传输线温度250℃;质量扫描范围m/z 33~300;EI电子能量70 eV。
1.3.4 挥发性风味物质的定性及定量分析
根据GC-MS得出的总离子流图中各峰质谱信息,使用NIST17标准谱库自动检索各组分质谱数据,辅助人工图谱解析,鉴定挥发性风味成分的化学结构,通过峰面积归一化法计算太平洋牡蛎各组织中风味成分的相对含量。
1.3.5 关键挥发性风味成分的分析
在太平洋牡蛎各组织挥发性风味物质相对含量的基础上,结合各挥发性风味物质在水中的感觉阈值[6],采用ROAV法评价各化合物对太平洋牡蛎组织主体风味的贡献。各挥发性风味物质的ROAV按下式计算:
式中:Cri、Ti分别对应各个挥发性成分的相对含量和相应的感觉阈值;Crstan、Tstan分别表示在样品总体风味中贡献最大的物质的相对含量和相应的感觉阈值。所有的挥发性风味物质都应满足0≤ROAV≤100,且ROAV越大,该物质对风味贡献越大[7]。当0.1<ROVA<1时,表明该物质对风味具有修饰作用,当ROVA>1时,则表明该物质可能影响风味的关键物质[8]。
1.4数据处理
采用Excel 2022进行数据统计分析,使用Origin 2022软件绘制图形。
2 结果与分析
2.1 三倍体太平洋牡蛎不同组织的挥发性风味成分组成分析
由图2可知,从峰的数目上来看闭壳肌组织最多,肝胰腺组织次之,性腺组织最少。通过NIST17数据库匹配,仅保留匹配度≥80的化合物,在太平洋牡蛎不同组织中共检测到28种挥发性风味成分,其中醛类、酮类、醇类等物质占绝大部分。由表1、图3、图4可知,28种挥发性风味成分在4个组织中的分布情况不同。在闭壳肌中检测到18种物质,肝胰腺中检测到11种物质,鳃中检测到8种物质,性腺中检测到6种物质。其中醛类物质共检出11种,闭壳肌中所含醛类化合物种类最多,为7种,在鳃中醛类化合物相对含量最高,为92.84%;酮类物质共检出5种,肝胰腺中所含酮类化合物种类最多,为5种,在闭壳肌中酮类化合物相对含量最高,为12.04%;醇类物质共检出3种,闭壳肌中所含醇类化合物种类最多,为2种,在肝胰腺中醇类化合物相对含量最高,为79.22%;酯类、酸类、其他类(烷烃类、酚类等)化合物共鉴定出9种,含量相对较低。以上结果表明,醛、酮、醇类物质为太平洋牡蛎中含量最为丰富的挥发性风味物质,这与以往太平洋牡蛎风味研究得出的结果相似[9?11]。
2.2
三倍体太平洋牡蛎不同组织挥发性风味成分聚类热图分析
为了更加清晰地展示出太平洋牡蛎不同组织之间挥发性风味成分的差异,将不同组织中检测到的挥发性风味成分进行聚类分析,结果表明太平洋牡蛎中闭壳肌、肝胰腺、鳃和性腺之间的风味成分存在明显差异。由图5可知,太平洋牡蛎不同组织中的28种挥发性风味成分可以聚类为4类,其中化合物相对含量A类>B类>C类>D类,太平洋牡蛎中挥发性风味成分含量差异最为显著的是A、B类化合物,包括壬醛、甲基壬基甲酮、癸醛、香叶基丙酮等醛、酮类物质。由于太平洋牡蛎各个组织中检测出的挥发性风味成分种类较多,为进一步明确在各组织中起关键作用的挥发性风味成分,还需利用ROAV法对太平洋牡蛎各组织中的挥发性风味成分进行更深入的分析。
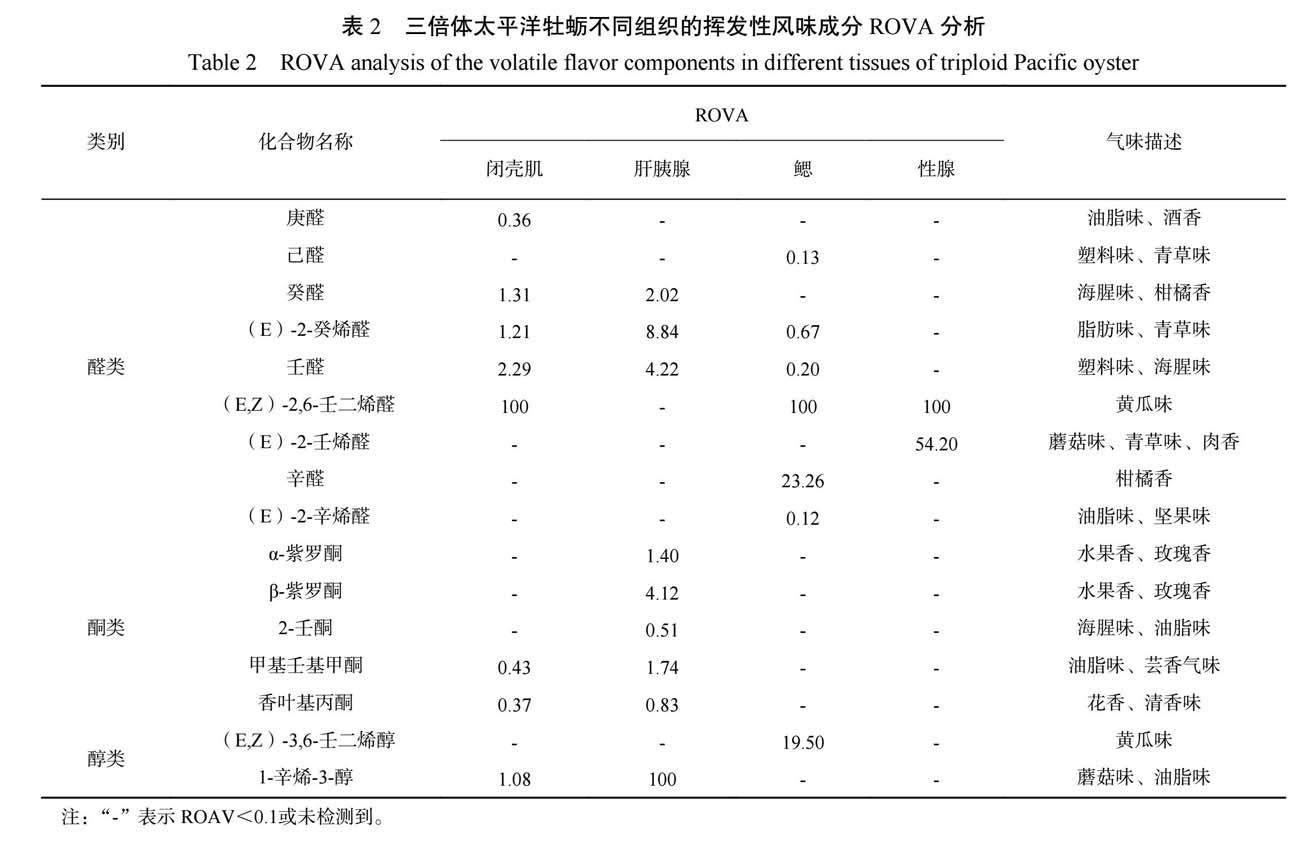
2.3 三倍体太平洋牡蛎不同组织的关键挥发性风味成分分析
为了更深入剖析太平洋牡蛎各组织中的关键风味成分,根据太平洋牡蛎中风味成分的组成及其感觉阈值,应用ROVA法对太平洋牡蛎不同组织中的风味成分进行评价分析。由表2可知,太平洋牡蛎闭壳肌中对风味起关键作用的挥发性风味成分(ROVA>1)有5 种,分别为癸醛、(E)-2-癸烯醛、壬醛、(E,Z)-2,6-壬二烯醛以及1-辛烯-3-醇;肝胰腺中有6种,分别为癸醛、(E)-2-癸烯醛、壬醛、α-紫罗酮、β-紫罗酮和甲基壬基甲酮;鳃中有3种,分别为(E,Z)-2,6-壬二烯醛、辛醛以及(E,Z)-3,6-壬二烯醇,且这3种ROVA都比较高;性腺中有2种,分别为(E,Z)-2,6-壬二烯醛和(E)-2-壬烯醛,结果表明醛类物质是对太平洋牡蛎不同组织风味影响较大的化合物。(E,Z)-2,6-壬二烯醛对太平洋牡蛎闭壳肌、鳃和性腺风味影响最大,为牡蛎总体风味贡献黄瓜味;1-辛烯-3-醇对三倍体太平洋牡蛎的肝胰腺风味影响最大,而在二倍体香港牡蛎中(E,Z)-2,6-壬二烯醛对其风味影响最大[12],1-辛烯-3-醇具有蘑菇味、肉香,这可能也是使得三倍体太平洋牡蛎更加鲜美的原因之一。在太平洋牡蛎各组织中0.1<ROVA<1的物质共有5 种,分别为庚醛、己醛、(E)-2-辛烯醛、2-壬酮、香叶基丙酮,表明这些物质在牡蛎总体风味起修饰作用。闭壳肌和肝胰腺中的癸醛、壬醛具腥味且ROVA>1,可能是造成牡蠣带有不愉悦气味(海腥味)的重要原因之一;肝胰腺中独有的风味化合物α-紫罗酮、β-紫罗酮为牡蛎总体风味贡献花果香;鳃中的辛醛、(E,Z)-3,6-壬二烯醇对牡蛎携带柑橘香气、黄瓜味具有重要贡献,而性腺中的(E)-2-壬烯醛则为牡蛎总体风味贡献青草味、肉香。
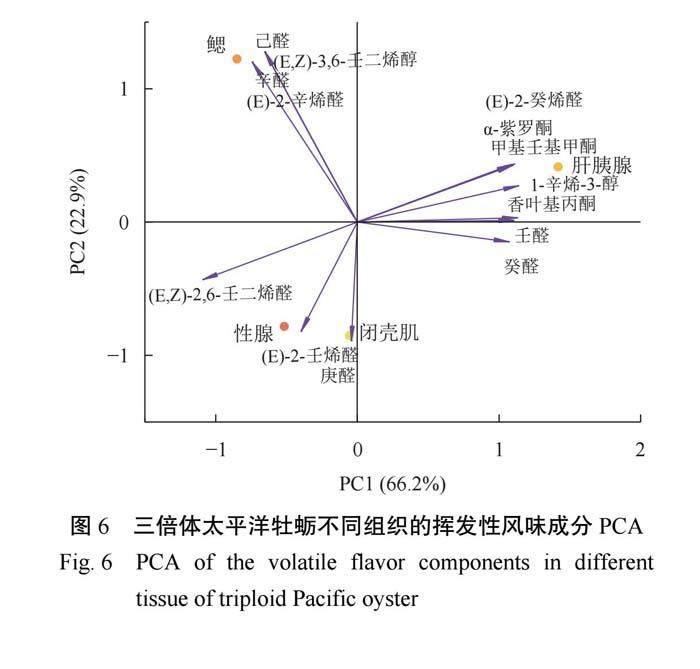
2.4 三倍体太平洋牡蛎不同组织的挥发性风味成分 PCA
在ROVA分析结果的基础上,为进一步直观区分太平洋牡蛎不同组织之间风味的差异,选择具有特征风味的挥发性成分进行PCA。由图6可知,PC1(66.2%)和PC2(22.9%)的累计贡献率为89.1%,表明此PCA分离模型能有效地反映挥发性风味物质的信息。根据太平洋牡蛎组织间的分布特征,可以了解到不同组织与风味物质之间的关系。各组织之间的分布较分散,说明不同组织风味差异较大。(E)-2-癸烯醛、紫罗酮、1-辛烯-3-醇等物质与PC1呈高度正相关,(E,Z)-2,6-壬二烯醛呈高度负相关,载荷系数较大。PC2则主要与己醛、(E,Z)-3,6-壬二烯醇、辛醛等呈高度正相关,与庚醛呈高度负相关。其中,大部分的挥发性风味成分与肝胰腺有关。肝胰腺的风味成分主要与醛类、酮类和醇类物质有关,且这些物质多具有令人愉悦香气,对牡蛎总体风味有着重要贡献作用。闭壳肌组织的风味成分主要与醛类物质有关,庚醛等直链醛通常具有令人不愉悦香气,对牡蛎风味中的腥味有一定贡献。鳃和性腺主要与烯醛类物质有关,是牡蛎愉悦香气的重要组成部分。
3 讨论与结论
肉品的风味物质是由多种成分和复杂的化学反应共同产生的,包括蛋白质的降解、脂肪的氧化、美拉德反应等,这些过程共同作用使其呈现出丰富多样的口感和香气。其中脂肪的氧化降解是产生醇、醛和酮等碳氢化合物的最主要原因[13]。本研究发现醛类物质在太平洋牡蛎的闭壳肌、鳃以及性腺中占据主导地位,分别占总挥发性成分相对含量的54.93%、92.84%和79.69%。醛类物质主要由脂肪氧化产生,其感觉阈值相对较低,是肉品风味的主要构成部分[14?15]。在闭壳肌中直链醛相对含量较高,其中由油酸和亚油酸氧化产生的壬醛,为牡蛎贡献塑料味、鱼腥味[16]。辛醛、癸醛、己醛和庚醛等直链醛大多会呈现出令人不愉悦的油脂氧化气味,这些直链醛往往是造成海鲜带有泥土味、腥臭味等不愉悦风味的重要原因[17?18]。在性腺中烯醛类化合物相对含量较高,烯醛和二烯醛来自亚油酸酯以及亚麻酸酯的氢过氧化物的降解[19],通常带有愉悦香气。如(E)-2-壬烯醛、(E,Z)-2,6-壬二烯醛、(E)-2-癸烯醛等烯醛类化合物使牡蛎呈现出黄瓜清香以及脂肪香气。这些醛类物质可以同许多风味物质叠加[20],对构成太平洋牡蛎的鲜香气味具有重要贡献。
酮类物质一般是由多不饱和脂肪氧化和降解、氨基酸分解或微生物氧化产生[21];因其感觉阈值较高,在肉品风味的形成中主要起修饰作用[22]。酮类化合物在牡蛎等贝类中呈现出花香、果香等气味,本研究中共检测出5种酮类化合物,在肝胰腺中酮类物质种类最为丰富。其中甲基壬基甲酮在闭壳肌、肝胰腺和鳃中均存在,其赋予太平洋牡蛎油脂味和芸香气味。肝胰腺中的2-壬酮是强气味物质,有研究表明其是牡蛎中贡献鲜味的主要化合物[23]。在肝胰腺中还发现α-紫罗酮、β-紫罗酮、香叶基丙酮这3种具有花果香的风味物质,这使得牡蛎呈现出热带水果所具有的香韵[24]。
醇类物质大多是由脂肪氧合酶和氢过氧化物酶氧化降解亚油酸产生[25],其羟基属于强发香基团,通常携带植物的芳香味、酸败和土气味[26]。但醇类化合物感觉阈值较高,对肉品风味贡献不大,然而其中也存在一些不饱和醇,它们的风味阈值较低,可以赋予肉品一定的风味[27]。如在闭壳肌和肝胰腺中检测出的1-辛烯-3-醇为牡蛎赋予了蘑菇味、清香气;闭壳肌中检出的2-乙基己醇赋予牡蛎玫瑰香气;鳃中检出的(E,Z)-3,6-壬二烯醇戊醇赋予牡蛎黄瓜气味。
在太平洋牡蛎不同组织中,除了醛、酮、醇类化合物以外,还含有酯类、酸类、烷烃类等挥发性风味成分,这些物质检出较少。其中酯类物质一般是由脂肪氧化产生的醇类物质与脂肪酸发生酯化反应形成[28],但其感觉阈值较高,对牡蛎风味的贡献较小。酸类物质则可能是不饱和脂肪醛、酮、醇类等物质发生氧化降解生成的,其对牡蛎中的难闻气味有一定贡献。烷烃类化合物主要来自脂肪酸烷氧自由基断裂[29],在本研究中检测出十三烷、十四烷和十六烷等风味物质,但由于这几种化合物感觉阈值较高,对牡蛎的风味直接贡献相对较小。
综上,本研究采用SPME-GC-MS技术对三倍体太平洋牡蛎闭壳肌、肝胰腺、鳃、性腺4个组织的挥发性风味成分组成与含量进行分析,共检测出28 种挥发性风味成分,主要包括醛类、酮类、醇类、酯类、酸类及其他类等化合物,这些化合物多由脂肪氧化降解而来。其中醛类、酮类和醇类挥发性物质种类较多,含量较高,而酯类、酸类和其他类挥发性化合物种类较少,含量相对较低。通过聚类热图分析、ROVA分析以及主成分分析表明,太平洋牡蛎中各组织风味差异较明显,主要风味物质为(E,Z)-2,6-壬二烯醛、1-辛烯-3-醇、辛醛、癸烯醛、己醛等,太平洋牡蛎不同组织中的各种风味物质相互协调,造就了太平洋牡蛎独特的海洋鲜香风味。本研究从不同组织风味差异的角度为太平洋牡蛎的风味研究提供数据支撑,有利于更清晰地认识太平洋牡蛎的食用价值,也为太平洋牡蛎进一步加工和开发利用提供参考依据。
参考文献:
[ 1 ]农业农村部. 2020 中国渔业统计年鉴 [M]. 北京:中国农业出版社,2021.
[ 2 ] YUASA M,KAWABETA K,EGUCHI A,et al. Characterizationof taste and micronutrient content of rock oysters ( Crassostreanippona) and Pacific oysters (Crassostrea gigas) in Japan[J].International Journal of Gastronomy and Food Science,13(2018) :52?57.
[ 3 ] 黄艳球,杨发明,秦小明,等. 不同养殖区香港牡蛎的化学组成及特征气味成分分析[J]. 食品科学,2019,40(14):236?242.
[4] HOUCKE JV,MEDINA I,LINSSEN J,et al. Biochemical and volatile organic compound profile of European flat oyster (Ostrea edulis) and Pacific cupped oyster (Crassostrea gigas) cultivated in the Eastern Scheldt and Lake Grevelingen,the Netherlands[J]. Food Control,2016,68:200?207.
[5] 林海生,秦小明,章超桦,等. 中国沿海主要牡蛎养殖品种的营养品质和风味特征比较分析[J]. 南方水产科学,2019,15(2):110?120.
[ 6 ] GEMERT LJV. 化合物香味阈值汇编[M]. 刘强,冒德寿,汤蛾,译. 北京:科学出版社,2015.
[7]田迪英,焦慧,陶崴,等. 5种海鱼挥发性风味成分分析[J]. 食品與发酵工业,2015,41(10):155?159.
[8]刘登勇,周光宏,徐幸莲. 确定食品关键风味化合物的一种新方法:“ROAV”法[J]. 食品科学,2008(7):370?374.
[ 8 ] 刘登勇,周光宏,徐幸莲. 确定食品关键风味化合物的一种新方法: “ROAV”法[J]. 食品科学,2008(7) :370?374.
[ 9 ] LIU L,ZHAO Y,LU S,et al. Metabolomics investigation on the volatile and non-volatile composition in enzymatic hydrolysates of Pacific oyster (Crassostrea gigas) [J]. Food Chemistry,2023,17.
[10] CHEN L,TENG X,LIU Y,et al. The dynamic change of flavor characteristics in Pacific oyster ( Crassostrea gigas) during depuration uncovered by mass spectrometry-based metabolomics combined with gas chromatography-ion mobility spectrometry (GC-IMS) [J]. Food Chemistry,2024,434.
[11] 孟楠,郝丽莉,王昕岑,等. 不同温度胁迫条件下太平洋牡蛎挥发性化合物的变化[J]. 现代食品科技,2024(2) :265?272.
[12] 刘琳琳. 香港牡蛎酶解前后挥发性成分变化及其脱腥方法研究[D]. 广州:广东海洋大学,2019.
[13]DASHDORJ D,AMMA T,HWANG I. Influence of specific taste-active components on meat flavor as affected by intrinsic and extrinsic factors:an overview[J]. European Food Research and Technology,2015,241:157?171.
[14]FARMER LJ,PATTERSON RLS. Compounds contributing to meat flavour[J]. Food Chemistry,1991,40(2):201?205.
[15]崔明仙,李妍,付睛睛,等. 三种扇贝挥发性风味物质指纹图谱分析[J]. 海洋与湖沼,2022,53(3):743?758.
[16]XU L,YU X,LI M,et al. Monitoring oxidative stability and changes in key volatile compounds in edible oils during ambient storage through HS-SPME/GC–MS[J]. International Journal of Food Properties,2017,20(sup3):S2926?S2938.
[17] HU M,WANG S,LIU Q,et al. Flavor profile of dried shrimp at different processing stages[J]. Lwt,2021,146.
[18]冉云,张思嘉,陈蓉,等. 海水暂养过程中缢蛏挥发性成分变化[J]. 食品科学,2019,40(10):206?213.
[19] 陈德慰. 熟制大闸蟹风味及冷冻加工技术的研究[D]. 无锡:江南大学,2007.
[20] SHAHIDI F. Flavor of meat,meat products and seafoods[M]. London:Blackie Academic & Professional,1998.
[21] LIU J,SHEN S,XIAO N,et al. Effect of glycation on physicochemical properties and volatile flavor characteristics of silver carp mince[J]. Food Chemistry,2022,386:132741.
[22]PIVETEAU F,LE GUEN S,GANDEMER G,et al. Aroma of Fresh Oysters Crassostrea gigas:Composition and AromaNotes[J]. Agricultural and Food Chemistry,2000,48(10):4851?4857.
[23]刘琳琳,秦小明,刘亚,等. 香港牡蛎挥发性成分及其加热处理变化[J]. 广东海洋大学学报,2018,38(5):41?49.
[24]徐莉,张逸君,梁和明,等. 海南岛养殖近江牡蛎挥发性风味物质分析[J]. 食品工业,2017,38(4):178?181.
[25]黄崇棱,尹雪莲,陆婷婷,等. 即食贻贝加工过程中风味活性物质的分析[J]. 中国食品学报,2023,23(10):294?304.
[26]黄忠白,丁媛,黄健,等. 栉孔扇贝柱和扇贝裙边中挥发性物质的比较分析[J]. 食品科学,2016,37(4):98?102.
[27]林恒宗,梁志源,秦小明,等. 基于GC-MS鉴别活体太平洋牡蛎不同流通阶段气味特征变化[J]. 食品科学,2023,44(2):279?287.
[28] DAGORN F, COUZINET-MOSSION A, KENDEL M, et al. Exploitable Lipids and Fatty Acids in the Invasive Oyster Crassostrea gigas on the French Atlantic Coast[J]. Marine Drugs,2016,14(6).
[29]FRATINI G,LOIS S,PAZOS M,et al. Volatile profile of Atlantic shellfish species by HS-SPME GC/MS[J]. Food Research Inter national,2012,48(2):856?865.
(责任编辑:柯文辉)
