雷帕霉素-深共晶溶剂滴眼液对小鼠同种异体角膜移植排斥反应的抑制作用及其机制
2024-05-29杨洋黄慈欣曾繁星孙亚如韦超王红卫高华
杨洋 黄慈欣 曾繁星 孙亚如 韦超 王红卫 高华

[摘要] 目的 探讨雷帕霉素(RAPA)-深共晶溶剂(DES)滴眼液对小鼠同种异体角膜移植免疫排斥反应的抑制作用及其机制。
方法采用CCK-8实验检测10种DES对人角膜上皮细胞系(HCECs)细胞活性的影响,选择细胞活性显著高于对照组的DES检测其表征,筛选最适宜DES,并通过BALB/c小鼠和新西兰大白兔对最适宜DES进行生物相容性评价。将小鼠随机分为正常组、磷酸盐溶液(PBS)组、DES组和RAPA-DES组。正常组正常饲养小鼠,PBS组、DES组和RAPA-DES组小鼠右眼行角膜移植术,术后小鼠右眼分别滴加PBS、DES和RAPA-DES溶液,隔天通过裂隙灯观察角膜移植物的存活状况,评估角膜移植物的生存百分比并绘制角膜移植物生存曲线。于移植术后第7、16天,取小鼠眼球,苏木素-伊红(HE)染色,于显微镜下观察角膜水肿和炎症浸润情况。于移植术后第16天,经实时荧光定量PCR(RT-qPCR)法检测各组小鼠角膜组织中TNF-α、IL-1β、IL-6、IL-10、IL-12α和IL-17α mRNA的表达水平。并通过蛋白质免疫印迹试验(WB)检测各组小鼠角膜组织中IL-6和IL-17α蛋白表达水平。
结果CCK-8實验显示,与对照组比较,DES-1和DES-2组细胞的细胞活性显著升高(P<0.05),DES-1组细胞的细胞活性较DES-2组高(P<0.05),且DES-1的黏度低于DES-2,pH值更接近于7.4,因此DES-1为最适宜DES,应用于后续实验。生物相容性评价结果显示,DES-1对小鼠和新西兰大白兔眼球和角膜均无任何刺激。相比PBS组,RAPA-DES组的角膜植片在术后第7、16天更透明,无明显水肿和新生血管现象。RAPA-DES组与PBS组、RAPA-DES组与DES组相比,角膜移植物的生存百分比显著升高(P<0.05)。PBS组、DES组和RAPA-DES组小鼠角膜移植物的中位生存时间分别为16、16和22 d。HE染色结果显示,PBS组和DES组小鼠角膜移植物明显水肿,有大量炎症细胞浸润。RAPA-DES组的角膜移植物中无明显水肿,只有少量炎症细胞积累。RT-qPCR结果显示,RAPA-DES组小鼠角膜组织中TNF-α mRNA表达水平与PBS组无明显差异(P>0.05),RAPA-DES组IL-1β、IL-6、IL-10 mRNA表达水平明显低于PBS组和DES组(P<0.05),RAPA-DES组小鼠角膜组织中IL-12α和IL-17α mRNA表达水平低于PBS组(P<0.05)。WB结果显示,RAPA-DES组的IL-6和IL-17α蛋白的表达水平明显低于PBS组(P<0.05)。
结论RAPA-DES滴眼液能显著延长角膜移植物生存时间,其可以通过降低角膜组织中促炎因子水平,抑制术后角膜移植物炎症反应,从而起到抑制免疫排斥反应的作用。
[关键词] 角膜移植;移植,同种;免疫抑制疗法;西罗莫司;深共晶溶剂;药物载体
[中图分类号] R779.6;R779.64
[文献标志码] A
Inhibitory effect of rapamycin-deep eutectic solvent eye drops on corneal allograft rejection in mice and its mechanism
YANG Yang, HUANG Cixin, ZENG Fanxing, SUN Yaru, WEI Chao, WANG Hongwei, GAO Hua
(Faculty of Medicine, Qingdao University, Qingdao 266071, China)
;[ABSTRACT] Objective To investigate the inhibitory effect of rapamycin (RAPA)-deep eutectic solvent (DES) eye drops on corneal allograft rejection in mice and its mechanism.
Methods CCK-8 assay was used to measure the influence of 10 types of DES on the viability of human corneal epithelial cells (HCECs), and the DES with a significantly higher cell viability than the control group was selected for characterization to obtain the most suitable DES. BALB/c mice and New Zealand white rabbits were used to evaluate the biocompatibility of the most suitable DES. The mice were randomly divided into normal group, phosphate solution (PBS) group, DES group, and RAPA-DES group. The mice in normal group were fed normally, and those in the PBS group, the DES group, and the RAPA-DES group were administrated PBS, DES, and RAPA-DES solution, respectively, to the right eye after corneal transplantation. On the next day, a slit lamp was used to observe the survival of corneal grafts, and the survival percentage of corneal grafts was analyzed to plot the survival curve of corneal grafts. On days 7 and 16 after transplantation, the eyeballs of the mice were collected, and HE staining was used to observe corneal edema and inflammatory cell infiltration under a microscope. On day 16 after transplantation, RT-qPCR was used to measure the mRNA expression levels of tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β), interleukin-6 (IL-6), interleukin-10 (IL-10), interleukin-12α (IL-12α), and interleukin-17α (IL-17α) in corneal tissue, and Western blot was used to measure the protein expression levels of IL-6 and IL-17α in corneal tissue.
Results CCK-8 assay showed that compared with the control group, the DES-1 group and the DES-2 group had a significant increase in cell viability (P<0.05), and the DES-1 group had a significantly higher cell viability than the DES-2 group (P<0.05); in addition, DES-1 had a lower viscosity than DES-2 and a pH va-
lue closer to 7.4, and therefore, DES-1 was the most suitable DES and was used for subsequent experiments. The results of biocompatibility evaluation showed that DES-1 did not cause any irritation to the eyes and cornea of mice and New Zealand white rabbits. Compared with the PBS group, the RAPA-DES group had more transparent corneal grafts on days 7 and 16 after surgery, without significant edema or neovascularization. The RAPA-DES group had a significant increase in the survival percentage of corneal grafts compared with the PBS group and the DES group (P<0.05). The median survival time of corneal grafts in the PBS, DES, and RAPA-DES groups was 16 d, 16 d, and 22 d, respectively. HE staining showed significant edema and massive inflammatory cell infiltration in the corneal grafts of mice in the PBS group and the DES group, while there was no significant edema with a small number of inflammatory cells in the RAPA-DES group. RT-qPCR showed that there was no significant difference in the mRNA expression level of TNF-α in corneal tissue between the RAPA-DES group and the PBS group (P>0.05); compared with the PBS group and the DES group, the RAPA-DES group had significantly lower mRNA expression levels of IL-1β, IL-6, and IL-10 (P<0.05), and compared with the PBS group, the RAPA-DES group had significantly lower mRNA expression levels of IL-12α and IL-17α in corneal tissue (P<0.05). Western blot showed that the RAPA-DES group had significantly lower protein expression levels of IL-6 and IL-17α than the PBS group (P<0.05).
Conclusion RAPA-DES eye drops can significantly prolong the survi-
val time of corneal grafts and inhibit immune rejection reaction by reducing the levels of proinflammatory factors in corneal tissue and inhibiting the inflammatory response of corneal grafts after surgery.
[KEY WORDS] Corneal transplantation; Transplantation, homologous; Immunosuppression therapy; Sirolimus; Deep eutectic dolvents; Drug carriers
角膜移植手術是失明患者主要的治疗方法,是否发生免疫排斥反应是手术成功与否的关键,目前临床常用的免疫抑制剂有环孢素、他克莫司和雷帕霉素(RAPA)。RAPA是一种特异性雷帕霉素靶蛋白复合体1(mTORC1)抑制剂[1]。但其水溶性极低,局部应用时,在角膜和前房常难以达到有效药物浓度,影响其功效[2]。
近十年來,脂质体、水凝胶、纳米材料和离子液体(ILs)等被广泛用于药物载体[3-6],提高了药物的溶解度和持续释放能力。ILs具有对非极性物质的高溶解性,化学和热稳定性强,以及低蒸汽压力的特性[7]。作为一种新型ILs,深共晶溶剂(DES)弥补了某些药物水溶性差和生物利用率低的缺点,在化学、材料、食品和药物等行业均引起了高度关注,但其生物安全性还有待进一步明确。本研究根据摩尔比和相应温度采用混合加热的方法合成了一种基于DES的雷帕霉素(RAPA)滴眼液,并对该滴眼液的表征、生物相容性以及对小鼠角膜移植排斥反应作用进行评估,旨在提高RAPA临床应用的效果。
1 材料和方法
1.1 材料和试剂
氯化胆碱、果糖、蔗糖、葡萄糖、尿素、乙二酸、丙二酸、苹果酸、乙二醇、丙二醇和1,4-丁二醇均购自上海麦克林生化科技有限公司,所有试剂纯度均超过98%。CCK-8细胞增殖检测试剂盒购自上海耶森生物技术有限公司,人角膜上皮细胞系(HCECs)由Choun-Ki JOO教授(韩国加图立大学,首尔,韩国)赠与。雄性C57小鼠(共24只)和BALB/c小鼠(共76只),均8周龄,体质量(22±2)g,由北京维通利华实验动物繁育有限公司提供。雄性新西兰大白兔(共6只),12周龄,体质量(2.5±0.1)kg,购自济南西岭角生物科技有限公司。
1.2 DES的合成
根据摩尔比和相应温度采用混合加热的方法参照相关文献合成10种DES,分别为氯化胆碱/果糖(DES-1)、氯化胆碱/蔗糖(DES-2)、氯化胆碱/葡萄糖(DES-3)[8]、氯化胆碱/尿素(DES-4)[9]、氯化胆碱/乙二酸(DES-5)[10]、氯化胆碱/丙二酸(DES-6)[8]、氯化胆碱/苹果酸(DES-7)[11]、氯化胆碱/乙二醇(DES-8)[12]、氯化胆碱/丙二醇(DES-9)[13]和氯化胆碱/丁二醇(DES-10)DES[14]。将10种DES分别溶解于混合培养液(10%胎牛血清、1%青霉素-链霉素溶液和90% DMEM-f12培养液)中,配置成DES浓度为5%的DES混合培养液备用。
1.3CCK-8实验检测各DES对HCECs细胞细胞活性的影响
将HCECs细胞接种于96孔板,加入DMEM-f12混合培养液,于37 ℃、含体积分数0.05的CO2的培养箱中培养24 h,然后弃去原培养液,分别加入DES-1~DES-10混合培养液,设置为DES-1~DES-10组,同时设立对照组(加入DMEM-f12混合培养液),均再培养24 h,然后每孔加入10 μL的CCK-8试剂,并在培养箱中继续培养3 h。使用酶标仪测量450 nm波长处的吸光度值,并计算细胞活性。选择细胞活性高于对照组的DES组用于后续实验。
1.4 DES的表征
将上面筛选出来的DES放置于干燥炉中干燥48 h。用流变仪测定各DES在25 ℃时的黏度,并且测量各DES的pH值。使用Nicolet380热光谱仪进行傅里叶变换红外光谱(FTIR)分析,测量各DES的FTIR峰值。所有测量均重复3次。使用细胞活性高、黏度低以及pH接近7.4的DES(后简称DES)用于后续的实验。采用流变仪测定该DES在20、40、60 ℃时的黏度。
1.5 生物相容性评价
将BALB/c小鼠随机分为实验组和对照组,每组6只。实验组小鼠每天以5.0 μL剂量的DES(浓度100%)混合后,滴双眼,对照组小鼠双眼滴用等量的PBS溶液,均每天4次,第8天停药,观察至第14天,期间正常喂饲小鼠。在实验的第0、7和14天,利用裂隙灯观察两组小鼠眼球,每次观察结束后立即用2%荧光素钠滴眼,10 s后将小鼠置于裂隙灯钴蓝光下,观察其角膜上皮。取雄性新西兰大白兔6只,右眼(实验组)每30 min滴入20 μL的DES(浓度100%),共5次,左眼(对照组)同时滴入等量的PBS。在第1次滴眼前以及第5次滴眼后第1、24、48小时,利用裂隙灯观察兔角膜上皮和眼球,采用Draize评分系统[15]对眼球症状进行评估。
1.6 小鼠同种异体角膜移植模型的建立和评估
RAPA-DES滴眼液的配制:将1.0 mg的RAPA粉末和1.0 mL的DES(浓度100%)混合后,以10 000 r/min离心5 min,充分混合,未发现有未溶解物,即RAPA完全溶解于DES中后,使用盐酸溶液调整其pH值至7.4。将BALB/c小鼠随机分为正常组、磷酸盐溶液(PBS)组、DES组和RAPA-DES组,每组16只。正常组不进行角膜移植手术,正常喂饲30 d。以24只C57小鼠的双眼为供体,移植到PBS组、DES组和RAPA-DES组48只小鼠的右眼中[16],术后第2天,三组小鼠的右眼分别滴加PBS、DES和RAPA-DES滴眼液,每次5 μL,每天4次,第8天停药,正常喂饲至第30天。
四组小鼠各取5只,隔天通过裂隙灯观察一次角膜移植物的存活状况,并根据文献报道的评分系统[17]评估角膜移植物的生存百分比并绘制角膜移植物生存曲线。
1.7 苏木素-伊红(HE)染色观察小鼠角膜移植术后角膜水肿和炎症浸润情况
四组小鼠分别于术后第7、16天,每组每次随机选取3只,断颈处死后,摘除右眼眼球,以4%的多聚甲醛固定24 h后,脱水制作成石蜡切片。将切片置于60 ℃烤箱中烘烤20 min行HE染色,于显微镜下观察角膜水肿和炎症浸润情况。
1.8实时荧光定量PCR(RT-qPCR)检测小鼠角膜移植术后角膜组织中TNF-α、IL-1β、IL-6、IL-10、IL-12α和IL-17α mRNA表达水平
四组小鼠分别于术后第16天,每组随机选取3只,断颈处死后,摘除右眼眼球并剥离角膜,提取角膜组织中的总RNA。以GAPDH作为内参,使用ABI7000 SDS系统通过RT-qPCR技术,测量角膜组织中TNF-α、IL-1β、IL-6、IL-10、IL-12α和IL-17α mRNA的表达水平。引物名称及其序列见表1。实验重复3次,结果取均值。
1.9蛋白质免疫印迹试验(WB)检测小鼠角膜移植术后角膜组织中IL-6和IL-17α蛋白的表达水平
四组小鼠分别于术后第16天,每组取剩余的2只,断颈处死后,摘除右眼眼球并剥离角膜,加入至RIPA裂解液和PMSF蛋白抑制剂(100∶1)中,将角膜组织研磨,超声处理后,在4 ℃下以12 000 r/min离心30 min。使用BCA法绘制标准曲线并计算蛋白浓度。将蛋白样品于95 ℃加热10 min后置于-80 ℃冰箱过夜。第2天取出蛋白样品后,95 ℃加热5 min,4 ℃下以12 000 r/min离心10 min。配置好SDS-PAGE胶后,电泳、转膜。室温摇床封闭2 h。一抗4 ℃冰箱孵育过夜。以GAPDH作为内参。复温30 min,TBST洗膜3次。二抗室温摇床孵育2 h,TBST洗膜3次后,加入发光液于超高灵敏电子压片成像仪上显影。使用Image J软件分析条带灰度值。
1.10 统计学处理
使用Prism 9(GraphPad)对数据进行统计分析。符合正态分布的数据以 ±s表示,使用独立样本t检验比较两组数据间的差异;使用单因素方差分析(ANOVA)评估多组数据的总体分布,进一步两两比较采用Tukey检验。使用Kaplan-Meier法绘制角膜移植物的生存曲线并计算中位生存期,使用Log-rank (Mantel-Cox) 检验分析各组生存曲线的差异。
2 结 果
2.1 DES的生物相容性和表征
CCK-8实验结果显示,对照组细胞的细胞活性为(100.0±1.0)%,DES-1~DES-10组细胞的细胞活性分别为(137.0±9.2)%、(112.0±5.2)%、(90.7±4.7)%、(2.0±2.0)%、(10.0±2.0)%、(3.0±0.0)%、(8.0±2.0)%、(34.0±1.0)%、(9.7±2.1)%和(11.7±0.6)%。与对照组比较,DES-1组和DES-2组细胞的细胞活性显著升高(t=6.95、3.93,P<0.05),且DES-1组显著高于DES-2組(t=4.11,P<0.05);DES-3~DES-10组细胞的细胞活性明显降低(t=3.35~168.00,P<0.05)。因此选择细胞活性高于对照组的DES-1组和DES-2组进行后续实验。
DES-1和DES-2在25 ℃时的黏度分别为0.80和1.37 Pa·s,pH则分别为8.04±0.09和8.05±0.03。FITR分析结果显示,氯化胆碱的FTIR峰值为3 256 cm-1,DES-1、DES-2的FTIR峰值分别为3 330 cm-1和3 327 cm-1。综合上面的实验结果,以DES-1为最适宜DES,用于后续实验。DES-1在20、40、60 ℃时黏度分别为1.0、0.25和0.1 Pa·s。
裂隙灯观察结果显示,在实验的第0、7、14天时,对照组和实验组小鼠眼球均没有角膜新生血管、角膜混浊或角膜上皮水肿的现象;荧光素钠染色结果显示,在实验的第0、7、14天时,对照组和实验组小鼠角膜均未出现溃疡、划痕或糜烂现象。在滴眼前以及滴眼结束后第1、24、48小时,对照组和实验组兔眼均未出现结膜充血、角膜混浊或虹膜炎性渗出现象;荧光素钠染色结果显示,两组兔眼角膜上皮均无脱落、水肿及溃疡现象,Draize评分均为0分。
2.2 RAPA-DES对各组小鼠角膜移植排斥反应的影响
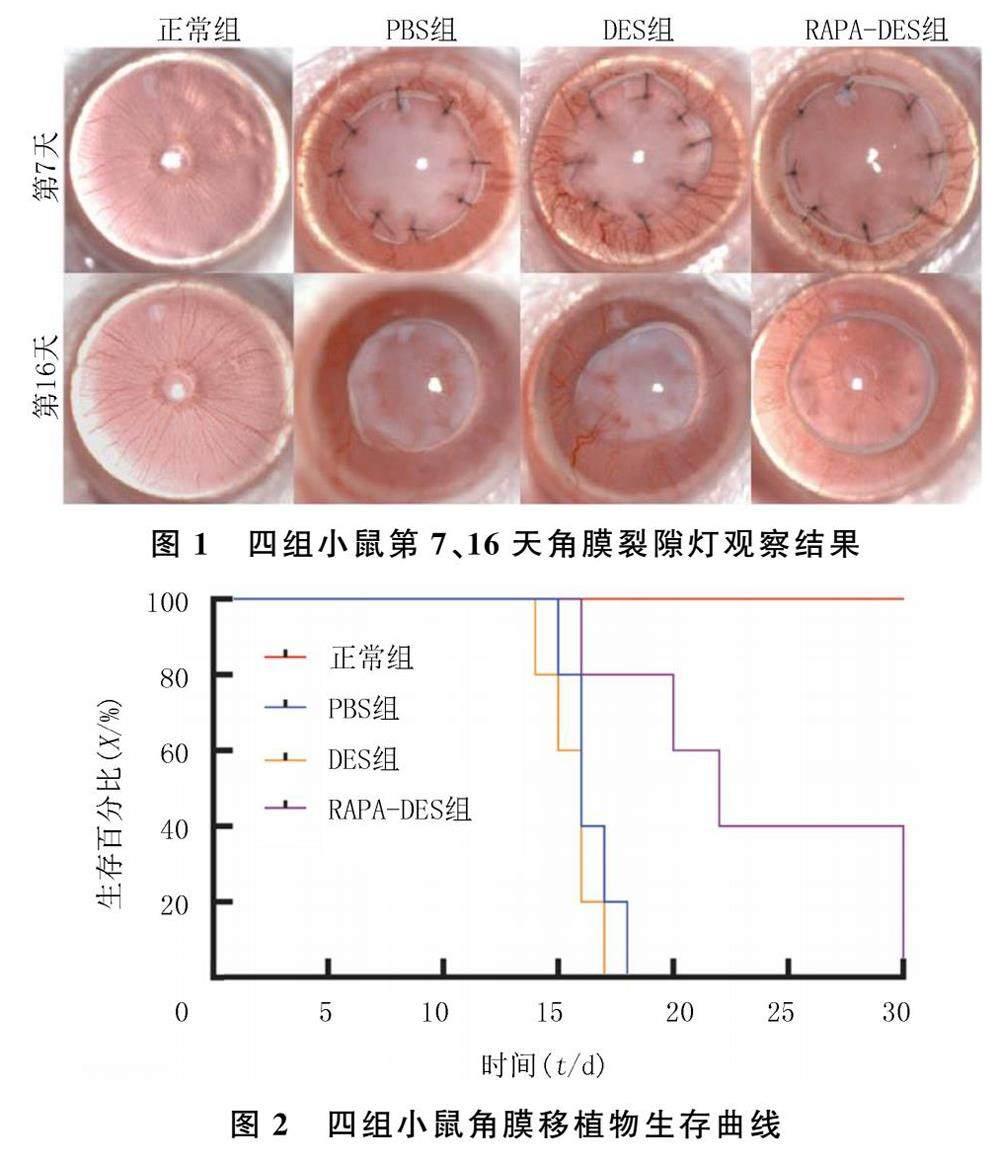
PBS组和DES组小鼠在角膜移植术后第7天均出现角膜反应性水肿和轻度混浊,术后第16天,移植物水肿加重,严重者前房、瞳孔边缘无法窥见,新生血管逐渐向移植物中心生长。相比PBS组,RAPA-DES组的角膜植片在术后第7、16天更透明,无明显水肿和新生血管现象。见图1。
角膜移植物的生存曲线显示,PBS组、DES组和RAPA-DES组第17天角膜移植物生存百分比分别为40%、20%和100%,RAPA-DES组与PBS组、RAPA-DES组与DES组比较差异有显著性(χ2=5.84、6.43,P<0.05),对照组和DES组比较差异无显著性(P>0.05);PBS组、DES组和RAPA-DES组小鼠角膜移植物的中位生存时间分别为16、16 和22 d。见图2。
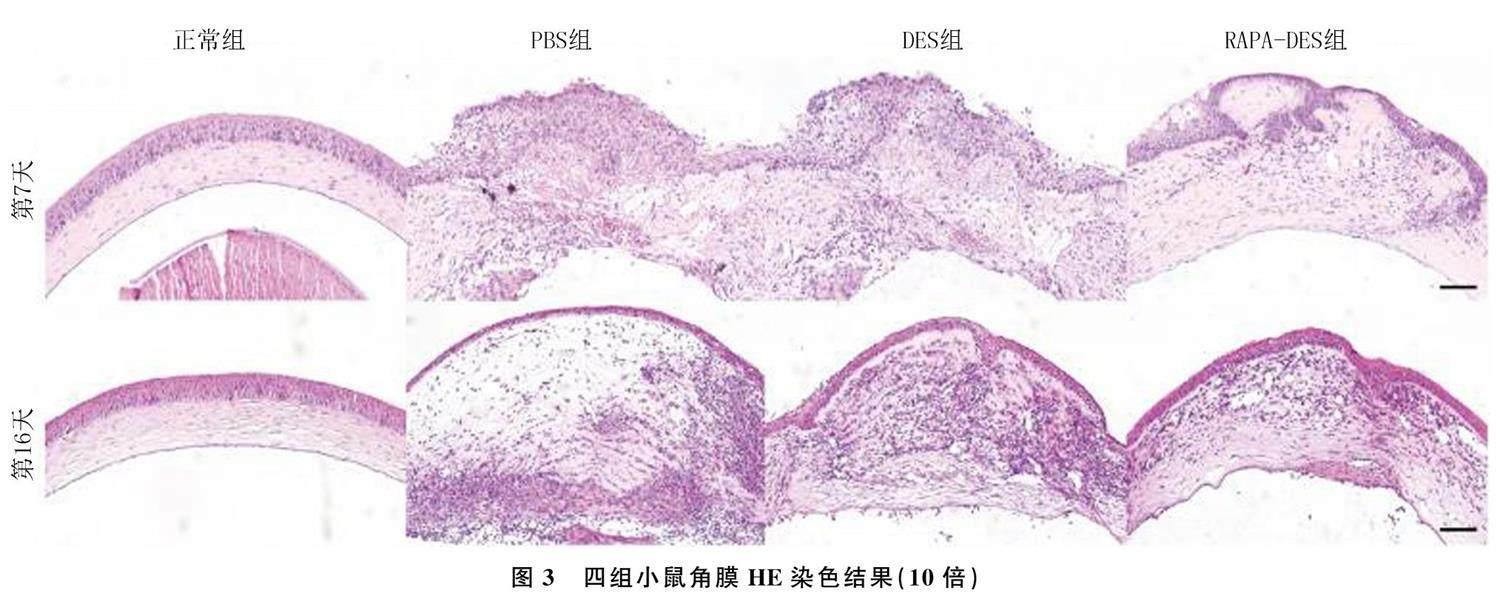
HE染色结果显示,正常组小鼠的角膜5层结构均清楚可见,没有明显水肿和炎症反应;PBS组和DES组小鼠角膜移植物有明显水肿,有大量炎症细胞浸润,并且角膜间质层的血管结构明显,血管腔内充满大量红细胞;RAPA-DES组的角膜移植物无明显水肿,只有少量炎症细胞积累。见图3。
RT-qPCR检测结果显示,4组小鼠角膜组织中TNF-α、IL-1β、IL-6、IL-10、IL-12α和IL-17α mRNA表达水平比较差异具有显著意义(F=19.43~961.90,P<0.05);正常组与PBS组、DES组、RAPA-DES组上述6项指标比较差异均具有显著意义(P<0.05);PBS组和DES组比较,IL-1β、IL-6、IL-10和IL-17α mRNA表达水平差异有显著意义(P<0.05);PBS组与RAPA-DES组比较,IL-1β、IL-6、IL-10、IL-12α和IL-17α mRNA表达水平差异有显著性(P<0.05);DES组与RAPA-DES组比较,TNF-α、IL-1β、IL-6、IL-10 mRNA表达水平差异有显著性(P<0.05)。WB检测结果显示,4组小鼠角膜组织中IL-6和IL-17α蛋白的表达水平比较差异有显著性(F=8.76、6.50,P<0.05)。正常组与PBS组、PBS组与RAPA-DES组IL-6和IL-17α表达水平比较差异有显著性(P<0.05),正常组与DES组、正常组与RAPA-DES组、PBS组与DES组、DES与RAPA-DES组IL-6和IL-17α表达水平比较差异无显著性(P>0.05)。见表2,图4。
3 讨 论
DES中氢键受体(HBA)和氢键供体(HBD)间的氢键能维持混合物结构的稳定性,从而克服了药物水溶性差和生物利用率低的缺点。DES制备中常用的HBA有氯化胆碱和氨基酸,氯化胆碱因易于降解,在药物递送方面应用广泛,因此本研究中HBA选择了氯化胆碱。同时本研究又选择了DES制备中常用的四类HBD(碳水化合物、酰胺、有机酸和多元醇),共制备了10种DES,研究其生物相容性和负载RAPA后对角膜移植免疫排斥反应影响。
本研究CCK-8实验的结果表明,基于葡萄糖(DES-3)、酰胺(DES-4)、有机酸(DES-5~DES-7)和多元醇(DES-8~DES-10)的DES处理HCECs细胞24 h以后,HCECs细胞的细胞活性较对照组显著降低,具有一定的毒性,而基于碳水化合物DES-1和DES-2组细胞的细胞活性显著升高,上述结果与BERGUA等[18]的研究结果一致。进一步分析原因可能为,果糖等碳水化合物是可被细胞利用的能源,因此,DES-1不仅没有毒性,同时还可以提升细胞的活力,促进细胞增殖。
DES黏度与氢键作用力、范德华力和静电力的相互作用紧密相关,是影响DES在眼科应用中舒适度的重要因素之一[19]。本研究中DES-1和DES-2在25 ℃时的黏度分别为0.80和1.37 Pa·s,同时,DES-1组细胞的细胞活性显著高于DES-2组,DES-1的黏度低,pH更接近于7.4,因此以DES-1为最适宜DES,用于后续实验。本研究还评估了不同温度对于DES-1黏度的影响,结果显示,随着温度从20 ℃升至40 ℃,DES的黏度迅速从1.0 Pa·s下降至0.26 Pa·s,并在60 ℃时达到0.10 Pa·s。DES-1的黏度随温度升高而降低的趋势,可能是由于加热过程中范德华力和氢键作用力减弱,以产生足够的动能来克服分子间的相互作用力。这些结果均与Arrhenius公式关于温度和黏度关系的描述相吻合[20]。同时,DES-1的pH呈轻度碱性,这也是人眼睛能够接受的适宜pH值[21]。
本研究通过FTIR分析,结果显示,氯化胆碱在3 256 cm-1处有一个宽阔的O-H拉伸振动峰,在DES-1、DES-2的光谱中,该峰位向更低波数移动。这可能是由于在DES制备过程中,碳水化合物(果糖和蔗糖)中的羟基与氯化胆碱中的氯离子之间形成了强氢键所导致。综上,相较于DES-2,DES-1可显著促进HCECs细胞的细胞活性,且黏度低、pH适宜。对DES-1又通过小鼠和新西兰兔进行了生物相容性评价,结果表明,DES-1对小鼠和新西兰兔的眼球和角膜均无任何刺激,是一种具有良好生物相容性的眼用药物载体。
本研究结果显示,PBS组和DES组小鼠在角膜移植术后第7天出现角膜水肿和混浊现象,术后第16天,角膜移植物水肿更加明显,新生血管长入角膜中央,提示排斥反应达到了高峰期。相比PBS组和DES组,RAPA-DES组小鼠角膜移植物第16天时非常透明,无明显水肿,能窥见虹膜和瞳孔。角膜移植物生存曲线结果显示,PBS组、DES组和RAPA-DES组小鼠角膜移植物的中位生存时间分别为16、16 和22 d,表明RAPA-DES组能明显延长角膜移植物的存活时间。HE染色显示,与PBS组相比,RAPA-DES组小鼠角膜移植物炎症细胞数量少,水肿及血管结构不明显,表明RAPA-DES滴眼液能够显著降低角膜移植物的炎症反应。
本研究又进一步测定了各组小鼠角膜组织中炎症因子相关基因的表达水平,结果显示,在术后第16天,RAPA-DES组与PBS组的TNF-α mRNA表达水平没有明显差异,这可能与TNF-α主要在炎症早期发挥作用有关[22]。相比PBS组,促炎因子IL-1β、IL-6、IL-12α和IL-17α mRNA表达水平在RAPA-DES组均有所降低。WB结果表明,RAPA-DES组的炎症因子IL-6和IL-17α蛋白的表达水平低于PBS组,提示RAPA-DES滴眼液能够通过降低这些促炎因子的水平,抑制角膜移植物的炎症反应,从而抑制移植角膜免疫排斥反应。
综上所述,本研究成功制备出一种生物相容性良好的RAPA-DES滴眼液,该滴眼液能显著延长角膜移植物生存時间,其可以通过降低角膜组织中促炎因子基因的水平,抑制术后角膜移植物的炎症反应,从而起到抑制免疫排斥反应发生的作用。本研究为RAPA-DES滴眼液的眼科临床应用提供了实验数据。但本研究只是针对小鼠进行了初步实验,关于RAPA-DES滴眼液的远期疗效及潜在作用机制尚需进一步深入探讨。
伦理批准和动物权利声明: 本研究涉及的所有动物实验均已通过山东第一医科大学医学伦理委员会的审核批准(W202302220055)。所有实验过程均遵照《眼科和视觉研究中动物使用声明》的条例进行。
作者声明: 杨洋、黄慈欣、王红卫和高华参与了研究设计;杨洋、曾繁星、孙亚如、韦超和王红卫参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]SCHREIBER K H, ARRIOLA APELO S I, YU D Y, et al. A novel rapamycin analog is highly selective for mTORC1 in vivo[J]. Nat Commun, 2019,10(1):3194.
[2] MAO J Z, WANG H, XIE Y, et al. Transdermal delivery of rapamycin with poor water-solubility by dissolving polymeric microneedles for anti-angiogenesis[J]. J Mater Chem B, 2020,8(5):928-934.
[3] ABU LILA A S, DOI Y, NAKAMURA K, et al. Sequential administration with oxaliplatin-containing PEG-coated cationic liposomes promotes a significant delivery of subsequent dose into murine solid tumor[J]. J Control Release, 2010,142(2):167-173.
[4] WU D Q, ZHU J, HAN H, et al. Synthesis and characterization of arginine-NIPAAm hybrid hydrogel as wound dressing: In vitro and in vivo study[J]. Acta Biomater, 2018,65:305-316.
[5] KHAN H, MIRZAEI H R, AMIRI A, et al. Glyco-nanoparticles: New drug delivery systems in cancer therapy[J]. Semin Cancer Biol, 2021,69:24-42.
[6] ALI M K, MOSHIKUR R M, WAKABAYASHI R, et al. Biocompatible ionic liquid-mediated micelles for enhanced transdermal delivery of paclitaxel[J]. ACS Appl Mater Interfaces, 2021,13(17):19745-19755.
[7] CUPPINI M, GARCIA I M, DE SOUZA V S, et al. Ionic li-
quid-loaded microcapsules doped into dental resin infiltrants[J]. Bioact Mater, 2021,6(9):2667-2675.
[8] HAYYAN M, MBOUS Y P, LOOI C Y, et al. Natural deep eutectic solvents: Cytotoxic profile[J]. Springerplus, 2016,5(1):913.
[9] MORRISON H G, SUN C C, NEERVANNAN S. Characte-
rization of thermal behavior of deep eutectic solvents and their potential as drug solubilization vehicles[J]. Int J Pharm, 2009,378(1-2):136-139.
[10] GUO Y, LI Y, LI Z, et al. Deep eutectic solvent-homogenate based microwave-assisted hydrodistillation of essential oil from Litsea cubeba (Lour.) Pers. fruits and its chemical composition and biological activity[J]. J Chromatogr A, 2021,1646:462089.
[11] HU Y, LIANG P Y, WANG Z X, et al. Exploring the mechanism of solubilization and release of isoliquiritigenin in deep eutectic solvents[J]. Int J Pharm, 2023,644:123298.
[12] HAGHBAKHSH R, DUARTE A R C, RAEISSI S. Viscosity investigations on the binary systems of (1 ChCl: 2 ethylene glycol) DES and methanol or ethanol[J]. Molecules, 2021,26(18):5513.
[13] LE N T, HOANG N T, VAN V T T, et al. Extraction of curcumin from turmeric residue (Curcuma longa L.) using deep eutectic solvents and surfactant solvents[J]. Anal Met-
hods, 2022,14(8):850-858.
[14] ZHANG S Z, DUAN Y, TENG C C, et al. Fast and selective degradation of biomass for xylose, glucose and lignin under mild conditions[J]. Molecules, 2023,28(8):3306.
[15] WILHELMUS K R. The Draize eye test[J]. Surv Ophthalmol, 2001,45(6):493-515.
[16] WEI C, MA L, XIANG D M, et al. Enhanced autophagy alleviated corneal allograft rejection via inhibiting NLRP3 inflammasome activity[J]. Am J Transplant, 2022,22(5):1362-1371.
[17] PAN Q, XU Q G, BOYLAN N J, et al. Corticosteroid-loaded biodegradable nanoparticles for prevention of corneal allograft rejection in rats[J]. J Control Release, 2015,201:32-40.
[18] BERGUA F, DELSO I, MUOZ-EMBID J, et al. Structure and properties of two glucose-based deep eutectic systems[J]. Food Chem, 2021,336:127717.
[19] GUAJARDO N, DOMNGUEZ DE MARA P, CANALES R. Integrating biocatalysis with viscous deep eutectic solvents in lab-on-A-chip microreactors[J]. ChemSusChem, 2022,15(9):e202102674.
[20] BAHADORI L, CHAKRABARTI M H, MANAN N S, et al. The effect of temperature on kinetics and diffusion coefficients of metallocene derivatives in polyol-based deep eutectic solvents[J]. PLoS One, 2015,10(12):e0144235.
[21] DOLDOLOVA K, BENER M, LALIKO
LU M, et al. Optimization and modeling of microwave-assisted extraction of curcumin and antioxidant compounds from turmeric by using natural deep eutectic solvents[J]. Food Chem, 2021,353:129337.
[22] KONG D H, KIM Y K, KIM M R, et al. Emerging roles of vascular cell adhesion molecule-1 (VCAM-1) in immunological disorders and cancer[J]. Int J Mol Sci, 2018,19(4):1057.
(本文編辑 耿波 厉建强)
