西瓜噬酸菌DeoR家族转录因子glpR的功能研究
2024-05-29王成梁乔培刘德华孟永红关巍杨玉文赵廷昌
王成梁 乔培 刘德华 孟永红 关巍 杨玉文 赵廷昌
摘 要:DeoR(Deoxyribonucleoside operon repressor)家族轉录因子是在原核生物中广泛存在的转录调控因子。DeoR通过调节毒力因子的表达来影响病原细菌的致病性,并且在不同的病原细菌中有不同的调控网络。为了阐明DeoR在西瓜噬酸菌中的功能和信号通路,Aac5菌株被用来构建DeoR转录因子glpR的缺失突变株及互补菌株,通过进行表型及转录水平的测定,对西瓜噬酸菌中DeoR转录因子glpR的功能进行初步探究。结果表明,缺失glpR基因后,Aac5菌株利用果糖的能力、对西瓜苗的致病能力、西瓜子叶体内生长能力以及形成生物膜的能力均显著下降,体外生长速度减慢,而抗高盐胁迫能力以及抗铜离子胁迫能力显著增强。同时,基因glpR的缺失会导致三型分泌系统基因hrpG、hrpE及hrcJ表达量显著下调,果糖利用相关基因fruA、fruB与fruK表达量显著下调,生物膜相关基因flgG表达量显著下调,与WT-fruBpGUS相比,ΔglpR-fruBpGUS的fruB的启动子活性显著减弱。以上结果表明,glpR基因在西瓜噬酸菌果糖利用、抵抗逆境胁迫以及致病过程中起重要作用。
关键词:西瓜噬酸菌;致病力;DeoR转录因子
中图分类号:S651+Q945.8 文献标志码:A 文章编号:1673-2871(2024)05-041-12
Function of DeoR family transcription factor glpR in Acidovorax citrulli
WANG Chengliang1, 2, QIAO Pei2, LIU Dehua1, 2, MENG Yonghong3, GUAN Wei2, YANG Yuwen2, 4, ZHAO Tingchang2, 4
(1. College of Plant Protection, Jilin Agricultural University, Changchun 130118, Jilin, China; 2. Institute of Plant Protection, Chinese Academy of Agricultural Sciences/State Key Laboratory for Biology of Plant Diseases and Insect Pests, Beijing 100193, China; 3. Ledong Douzhiguo Melon and Watermelon Planting Professional Farmers Cooperative, Ledong 572541, Hainan, China; 4. National Nanfan Research Institute(Sanya), Chinese Academy of Agricultural Sciences, Sanya 572024, Hainan, China)
Abstract: The DeoR(Deoxyribonucleoside operon repressor) family of transcription factors are transcriptional regulators that are widely present in prokaryotes. DeoR affects the pathogenicity of pathogenic bacteria by regulating the expression of virulence factors, and there are different regulatory networks in different pathogenic bacteria. In order to elucidate its function and signaling pathway in Acidovorax citrulli, Aac5 strain was used to construct the deletion mutant and complementary strain of DeoR transcription factor glpR. The function of DeoR transcription factor glpR in Acidovorax citrulli was preliminarily explored by measuring the phenotype and transcription level. The results showed that after deletion of glpR gene, the ability of Aac5 strain to utilize fructose, the pathogenicity of watermelon seedlings, the growth ability of watermelon cotyledons and the ability to form biofilm were significantly decreased, and the growth rate in vitro was slowed down. The ability to resist high salt stress and copper ion stress was significantly increased. At the same time, the deletion of the gene glpR resulted in a significant down-regulation of the type III secretion system genes hrpG, hrpE and hrcJ, a significant down-regulation of the fructose utilization-related genes fruA, fruB and fruK, and a significant down-regulation of the biofilm-related gene flgG. Compared with WT-fruBpGUS, the promoter activity of fruB in ΔglpR-fruBpGUS was significantly reduced. The results indicated that glpR gene plays an important role in fructose utilization, resistance to stress and pathogenicity of Acidovorax citrulli.
Key words: Acidovorax citrulli; Virulence; DeoR transcription factor
细菌性果斑病(bacterial fruit blotch,BFB)是典型的检疫性细菌性病害,会对西瓜、甜瓜等葫芦科作物造成严重危害,西瓜噬酸菌(Acidovorax citrulli)为其病原菌。根据寄主的差异可以将西瓜噬酸菌划分为两组,I组菌株、II组菌株分别主要分离自甜瓜、西瓜[1-2]。1965年该病首次在美国佐治亚州被发现[3],目前已在世界范围内发生流行。在西瓜噬酸菌中研究比较多的发挥重要作用的致病因子主要有Ⅲ型分泌系统[4-6]、IV型菌毛[7]、Ⅵ型分泌系统[8]、鞭毛[9]、群体感应[10]以及生物膜等[11],但是该病害在致病机制方面的研究仍然较少,针对性的防控手段也比较有限[12-13],因此通过解析该病害的致病机制可为开发新的防控果斑病技术提供参考。
果糖是细菌碳水化合物代谢途径早期进化中的重要糖类,果糖代谢在生命活动中具有重要意义,并且果糖磷酸转移酶系统(PTSFru)在细菌物种中比任何其他碳水化合物磷酸转移酶系统都更广泛[14]。果糖磷酸转移酶系统由fruA和fruB组成,细菌先通过果糖磷酸转移酶系统将果糖运输并磷酸化为果糖-1-磷酸,然后通过fruK编码的1-磷酸果糖激酶把果糖-1-磷酸磷酸化为果糖-1,6-二磷酸。因此,fruA、fruB和fruK是果糖代谢过程中的关键基因[15]。
DeoR(Deoxyribonucleoside operon repressor)家族转录调控因子广泛存在于细菌中,该家族首个被鉴定的成员是大肠杆菌(Escherichia coli)DeoR蛋白,是一种调控deo操纵子(deoxyribonucleoside operon)转录表达的转录抑制子[16-18]。DeoR蛋白單体在结构上主要由N末端DNA结合结构域和存在于C末端的配体结合结构域组成,并且有一个保守的螺旋-转角-螺旋(helix-turn-helix,HTH)结构基序存在于N端DNA结合结构域中[19-20],C末端结构域的用途是完成蛋白寡聚化和配体结合[21]。而在功能上,大肠杆菌DeoR蛋白既可作为局部的特异性调控因子[22-23],也可作为全局的多效性调控因子[24-25],还可以通过结合启动子DNA的特定序列来转录抑制或者激活靶基因的转录表达[26]。
目前已发现多个DeoR转录因子在细菌致病过程、果糖代谢和抗胁迫过程中发挥着重要作用。笔者在本研究中,通过对西瓜噬酸菌 AAC00-1 基因组生物信息学分析,只发现了1个DeoR家族转录因子glpR,但是DeoR家族转录因子在西瓜噬酸菌致病过程中的功能尚不清楚,因此,笔者通过敲除西瓜噬酸菌glpR基因来探究其对西瓜噬酸菌致病相关多种表型以及转录水平的影响,从而明确glpR基因在西瓜噬酸菌中的功能,为西瓜噬酸菌中DeoR家族转录因子相关调控网络的后续探索提供参考,也为细菌性果斑病有效防治技术的开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试植物、菌株与质粒 试验于2022年6月至2023年8月在中国农业科学院植物保护研究所进行。试验所用西瓜(Citrullus lanatus)品种为中蔬瑞鑫[中蔬种业科技(北京)有限公司]。本试验所用菌株及质粒详见表1。
大肠杆菌在溶菌肉汤(Lysogeny broth,LB)培养基中37 ℃、220 r·min-1振荡培养;西瓜噬酸菌Aac5、ΔglpR和ΔglpRcomp使用金氏B(Kings B,KB)培养基28 ℃、220 r·min-1培养。卡那霉素(Kanamycin,Km)、氨苄青霉素(Ampicillin,Amp)、氯霉素(Chloraphenical, Cm)的终质量浓度分别为50、100、25 μg·mL-1。
1.1.2 试剂、培养基 试剂:限制性内切酶和KOD高保真酶购自日本TaKaRa公司,质粒小提试剂盒购自美国Axygen生物有限公司,SuperReal PreMix Plus(SYRB Green)购自北京天根生化科技有限公司,细菌总RNA提取试剂盒购自翌圣生物科技(上海)股份有限公司等。由北京六合华大基因科技有限公司完成测序以及相关引物合成。
培养基-(1)KB培养基(pH 7.0):参考蔡馥宇等[27]的配方;(2)LB培养基(pH 7.0):参考蔡馥宇等[27]的配方;(3)0.3%半固体培养基[28](pH 7.0):细菌专用蛋白胨0.24 g、运动性专用琼脂粉2.4 g以及酵母粉0.24 g,分别使用去离子水将上述3种培养基定容至800 mL,灭菌温度和时间分别为121 ℃、20 min,灭菌后放室温备用。(4)三型分泌系统(Type III Secretory System,T3SS)诱导培养基XVM2:果糖1.801 g、MgSO4 0.601 g、KH2PO4 0.021 7 g、酪蛋白水解物0.3 g、蔗糖3.432 g、(NH4)2SO4 1.33 g、CaCl2 1.11 g、FeSO4·7H2O 0.002 8 g、NaCl 1.17 g以及K2HPO4·3H2O 0.073 g,最后调至pH=6.7[29];(5)M9培养基(pH 7.0):KH2PO4 9 g、Na2HPO4·12H2O 45.362 1 g、NaCl 1.5 g以及NH4Cl 3 g[30];(6)MMX基础培养基(pH 7.0):KH2PO4 6 g、柠檬酸三钠1 g、MgSO4·7H2O 0.2 g、K2HPO4 4 g、葡萄糖5 g、(NH4)2SO4 1.33 g[31]。(7)MMX-q培养基则是在MMX基础培养基基础上,将该培养基中的糖源葡萄糖改为果糖。将上述4种培养基均加入去离子水至1000 mL,在110 ℃条件下高压灭菌15 min后备用。
1.2 试验方法
1.2.1 构建glpR基因的缺失突变菌株和互补菌株 通过NCBI(https://www.ncbi.nlm.nih.gov/)检索西瓜噬酸菌AAC00-1的基因组后发现glpR基因位于660 436~661 200之间,并且全长为765 bp。然后通过KEGG(https://www.kegg.jp/)下载glpR基因的完整核苷酸序列;利用Primer 5设计的左右臂引物glpR-1F/glpR-1R、glpR-2F/glpR-2R在KOD高保真酶作用下扩增glpR上下游的DNA片段;再通过Overlapping PCR技术连接扩增成功的上下游DNA片段,酶切(EcoRⅠ/HindⅢ)pK18mobsacB载体质粒后将质粒通过无缝连接酶的作用与上下游DNA片段连接并转入到大肠杆菌感受态DH5α中,从而构建pK18-glpR敲除载体[32],然后依据同源重组双交换的原理筛选正确的ΔglpR突变菌株,pK18-glpR通过三亲杂交导入到Aac5-WT中,筛选具有Km以及Amp抗性的正确单交换克隆;通过在含有Amp和10%蔗糖的M9固体平板上涂布单交换克隆,筛选获取正确的缺失突变菌株[33],利用三亲本杂交法在Aac5-WT以及突变菌株中均导入pBBR1MCS-2质粒,从而消除pBBR1MCS-2对菌株的影响。最后利用西瓜噬酸菌特异性引物WFB1/WFB2、目的基因特异性验证引物ΔglpR-L/ΔglpR-R以及pBBR1MCS-2质粒检测引物Kan-F/Kan-R进行PCR验证。相关的引物序列见表2。
使用引物对ΔglpRcomp-F/ΔglpRcomp-R扩增glpR的全长序列,使用无缝连接酶将其与酶切(HindIII/BamHI)后的载体质粒pBBR1MCS-2连接并转入大肠杆菌感受态DH5α。通过测序确认已构建的pBBR1MCS-glpR載体,利用三亲本杂交的原理把互补载体质粒pBBR1MCS-glpR导入突变株中,同样用引物ΔglpR-F/ΔglpR-R、WFB1/WFB2以及Kan-F/Kan-R进行验证(表2)。
1.2.2 GUS基因表达菌株的构建 使用引物对GUS-F/GUS-R扩增fruB的启动子序列,使用无缝连接酶将其与酶切(XbaI/EcoRI)后的质粒pBBRNolacGUS连接并转入大肠杆菌感受态DH5α。通过测序确认已构建的pBBRNolacGUS-fruBp载体,利用三亲本杂交的方法将载体质粒pBBR1MCS-glpR分别导入Aac5及ΔglpR菌株中,再利用三亲本杂交的方法将载体质粒pBBR1MCS导入Aac5菌株中,使用GUS-F/GUS-R进行PCR验证[34]。
1.2.3 果糖利用能力的测定 在MMX基础培养基上对糖源进行替换,然后分别在添加果糖和不添加果糖条件下进行试验,调菌悬液浓度至OD600=0.6后离心,弃上清液,然后用培养基重悬,在装有990 μL培养基的离心管中加入10 μL菌悬液,设置5个重复。各处理均在28 ℃、220 r·min-1条件下培养4 d,然后分别测定其OD600值[31]。利用XVM2培养基来测定各菌株对果糖的利用能力,分别在添加果糖和不添加果糖条件下进行试验,调各菌株菌悬液浓度至OD600=0.6,然后分别从各菌株菌悬液中取出1 mL至15 mL离心管,离心弃上清液后的菌体用5 mL XVM2培养基重悬,均设置3次重复。各处理均在28 ℃、220 r·min-1条件下培养24 h后分别测定并记录其OD600值[35]。
1.2.4 抗胁迫能力测定 用KB培养基(含4% NaCl)来模拟高盐胁迫条件,将新鲜的菌悬液浓度统一调至OD600=0.3后,用4%NaCl的KB培养基重悬,在28 ℃、220 r·min-1下振荡培养20 h后,分别测定其OD600值[36],每个处理设置5次重复,试验3次重复。利用4 mmol·L-1 CuSO4·5H2O KB培养基来模拟铜离子胁迫条件,方法同抗高盐胁迫测定。
1.2.5 致病力测定 通过喷雾接种测定各菌株致病能力。各菌株的菌悬液离心弃上清液后用无菌水统一调浓度至OD600=0.3(3×108 CFU·mL-1),每种菌株都准备100 mL菌液备用,共分为ΔglpR、ΔglpRcomp、Aac5和清水阴性对照4个处理,每个处理4次重复,每个重复5株苗。待西瓜苗长出3~4片真叶后进行接种,在西瓜真叶的正反面均匀喷雾后置于生长条件为28 ℃ 、16 h光照和20 ℃ 、8 h黑暗的光照气候培养箱中,相对湿度为85%。接种10 d后调查各处理西瓜苗的病情指数[37]。试验3次重复。
1.2.6 体外生长能力测定 将OD600=0.3的各菌株菌悬液用KB液体培养基稀释100倍后,各取200 μL加入100孔聚苯乙烯板,在自动生长曲线仪中28 ℃振荡培养96 h,每2 h测定1次OD600值[9]。每个处理设置4次重复,试验3次重复。
1.2.7 寄主体内生长能力测定 新鲜菌悬液用无菌水重悬后浓度调至106 CFU·mL-1,然后将菌悬液用1 mL去掉针头的注射器注满西瓜子叶,放置于培养箱中,培养条件同1.2.3。各菌株都设置3个重复,共接种30株西瓜苗,设置在西瓜子叶中注射清水的阴性对照。共取样5次,接种后1、24、48、72、96 h随机取3片西瓜子叶拍照,每片子叶使用打孔器(直径1 cm)截取叶盘,放入装有500 μL无菌水的2 mL离心管中,充分研磨后梯度稀释,分别取10 μL点样于加有Km和Amp抗生素的KB固体平板,于28 ℃倒置培养48 h后计算各处理菌落数[38]。试验3次重复。
1.2.8 生物膜的形成能力测定 将各菌株的菌悬液使用新鲜KB液体培养基分别调浓度至OD600=0.3后,采用结晶紫染色的方法进行生物膜形成能力测定[39],记录各处理OD575值,每个处理分别设置4次重复,试验3次重复。
1.2.9 致病相关基因表达量的测定 分别从西瓜噬酸菌Aac5和突变菌株ΔglpR的培养平板上挑取单菌落到T3SS诱导培养基以及KB液体培养基中,并使用恒温摇床28 ℃、220 r·min-1摇培24 h。然后用细菌总RNA提取试剂盒分别提取经两种培养基培养后的野生型菌株Aac5和突变菌株ΔglpR的总RNA,将各处理的RNA浓度调节统一后反转录为cDNA,选取的内参基因为rpoB,然后分别对果糖利用关键基因(fruA、fruK、fruB)、三型分泌系统关键基因(hrpG、hrpE、hrpX、hrcJ)和生物膜相关基因(flgG)进行qRT-PCR测定,本试验引物信息见表2。利用相对定量(2-ΔΔCt)的方法计算对应基因在突变菌株中的表达量[40-42]。试验3次重复。
1.2.10 启动子活性测定 分别取KB培养的OD600=0.6的WT-GUS、WT-fruBp-GUS和ΔglpR-fruBp-GUS菌懸液各5 mL,低温离心后弃上清液,用Sonic Buffer调浓度至OD600=0.5,取液体1 mL超声破碎(35 W,超声开时间5 s,超声关时间5 s,工作总时间5 min)后,于4 ℃、12 000 r·min-1离心15 min,取上清液备用。使用XVM2重复上述操作,获得蛋白上清液备用。使用 BCA protein Assay Kit 检测各处理上清液的蛋白浓度。使用Infinte F200多功能酶标仪(激发光360 nm、发射光480 nm)测定反应前后各处理的荧光数值,并计算GUS 活性。具体试验步骤参见张晓晓[43]的方法。
1.3 数据处理
使用Excel 2019记录并计算试验数据和制图,使用SPSS 26进行方差分析和差异显著性分析。
2 结果与分析
2.1 突变菌株及互补菌株的构建
使用目的基因特异性验证引物ΔglpR-F/ΔglpR-R、西瓜噬酸菌特异性引物WFB1/WFB2以及pBBR1MCS-2质粒检测引物Kan-F/Kan-R分别对Aac5、ΔglpR以及ΔglpRcomp进行PCR验证,以加ddH2O作为阴性对照(图1)。目的基因特异性验证引物ΔglpR-F/ΔglpR-R的验证结果表明,Aac5与互补菌株ΔglpRcomp均成功扩增出664 bp的条带,而突变菌株ΔglpR没有条带,确定获得了正确的突变菌株及互补菌株;利用西瓜噬酸菌特异性引物WFB1/WFB2证实各菌株均为西瓜噬酸菌;利用Kan-F/Kan-R证实Aac5-WT与突变菌株中成功导入了pBBR1MCS-2空载质粒。
2.2 GUS基因表达菌株的构建
使用目的基因特异性验证引物GUS-F/GUS-R、西瓜噬酸菌特异性引物WFB1/WFB2以及pBBRNolacGUS质粒检测引物Kan-F/Kan-R分别对WT-GUS、WT-fruBp-GUS以及ΔglpR-fruBp-GUS进行PCR验证,以加ddH2O作为阴性对照(图2)。目的基因特异性验证引物GUS-F/GUS-R验证结果表明,WT-GUS、WT-fruBp-GUS以及ΔglpR-fruBp-GUS均成功扩增出542 bp的条带,确定获得了正确的GUS基因表达菌株;利用WFB1/WFB2证实各GUS基因表达菌株均为西瓜噬酸菌;利用Kan-F/Kan-R证实WT-GUS、WT-fruBp-GUS以及ΔglpR-fruBp-GUS中成功导入了pBBRNolacGUS质粒。
2.3 glpR的缺失减弱了Aac5对果糖的利用能力
果糖利用能力测定结果表明,在MMX-q培养基中,不添加果糖的3种菌悬液浓度无显著差异;而添加果糖后的Aac5、ΔglpR和ΔglpRcomp的OD600值分别为0.60、0.55和0.59,ΔglpR的OD600值显著低于Aac5菌株,而互补菌株的OD600值与Aac5的OD600值没有显著差异,说明glpR基因的缺失减弱了西瓜噬酸菌Aac5对果糖的利用能力(图3-A)。
在XVM2培养基中,不添加果糖的3种菌悬液浓度无显著差异;而添加果糖后的Aac5、ΔglpR和ΔglpRcomp的OD600值分别为0.58、0.48和0.57。ΔglpR的OD600值显著低于Aac5菌株,而互补菌株的OD600值与Aac5的OD600值没有显著差异,说明glpR基因的缺失使西瓜噬酸菌Aac5对果糖的利用能力减弱(图3-B)。
2.4 glpR的缺失影响西瓜噬酸菌Aac5的抗胁迫能力
利用4% NaCl的KB培养基对各菌株进行抗高盐胁迫能力测定,高盐胁迫条件下培养20 h后,Aac5、ΔglpR和ΔglpRcomp的OD600值分别为0.13、0.21和0.16,Aac5菌株的抗高盐胁迫能力显著低于突变株ΔglpR,而互补菌株ΔglpRcomp部分恢复抗高盐胁迫能力(图 4)。表明基因glpR的缺失增强了西瓜噬酸菌抗高盐胁迫的能力。
在4 mmol·L-1 CuSO4·5H2O的KB培养基中培养20 h后,Aac5、ΔglpR 和ΔglpRcomp的OD600值分别为0.33、0.67和0.30,Aac5菌株和互补菌株ΔglpRcomp的OD600值均显著低于突变株ΔglpR,并且互补菌株ΔglpRcomp的OD600值能够恢复至Aac5水平(图5)。结果表明glpR基因缺失后,西瓜噬酸菌抗铜离子胁迫的能力得到显著提高。
2.5 glpR的缺失减弱了Aac5的致病能力
喷雾接种西瓜幼苗14 d后,西瓜幼苗接种ΔglpR后与接种Aac5、ΔglpRcomp相比发病更轻(图 6-A),接种Aac5幼苗病情指数为40.67,接种互补菌株ΔglpRcomp的西瓜幼苗病情指数为38.79,两者均显著高于接种ΔglpR的病情指数26.36,互补菌株ΔglpRcomp的致病力能够恢复至Aac5水平(图 6-B)。
2.6 glpR的缺失减弱了Aac5的体外生长能力
突变菌株ΔglpR和互补菌株ΔglpRcomp比野生菌株Aac5进入对数生长期慢了约4 h。但在进入平台期后,突变菌株的生长量和Aac5相差不大,互补菌株的生长量略低于突变菌株和Aac5(图7)。
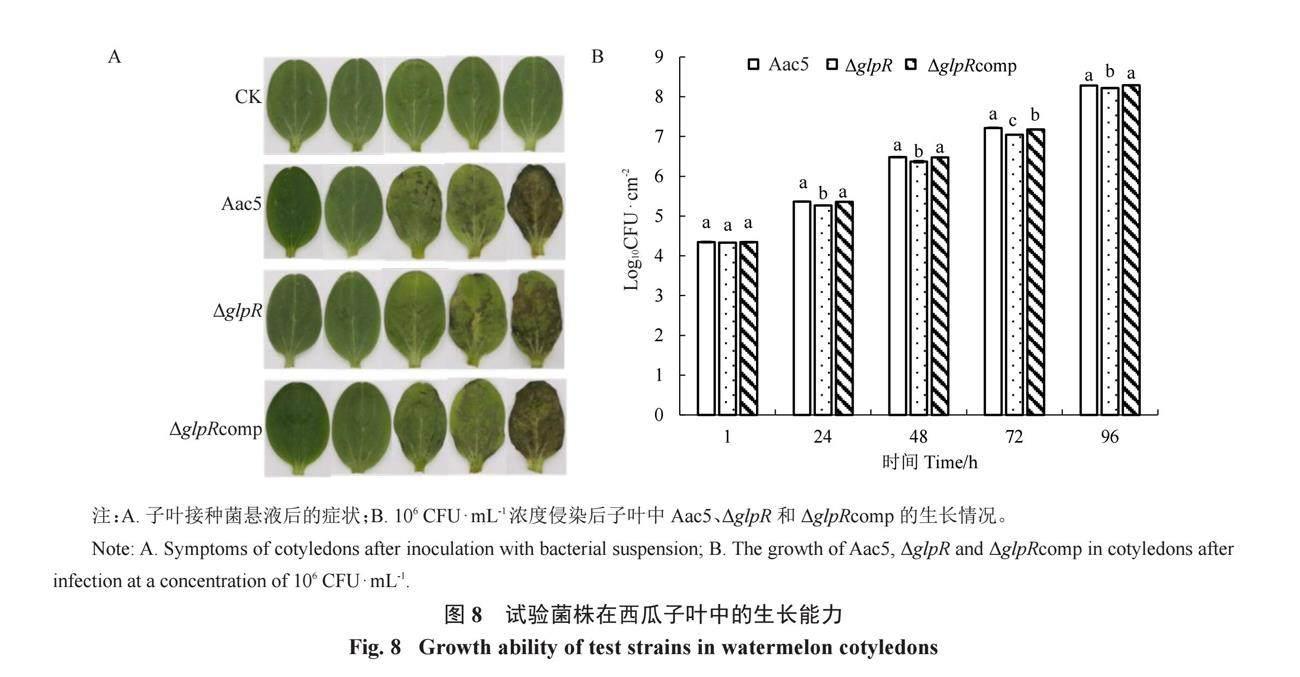
2.7 基因glpR的缺失减弱了Aac5的体内生长能力
通过子叶注射对各菌株体内定殖能力进行测定。结果表明,子叶中的活菌数量均随时间推移而升高,在接种各处理48 h后,ΔglpR接种的子叶发病情况明显弱于Aac5(图 8-A),且在接种各处理24~96 h时,ΔglpR在子叶中的菌群数量始终低于Aac5,而互补菌株ΔglpRcomp在体内生长情况基本恢复至Aac5水平(图 8-B)。
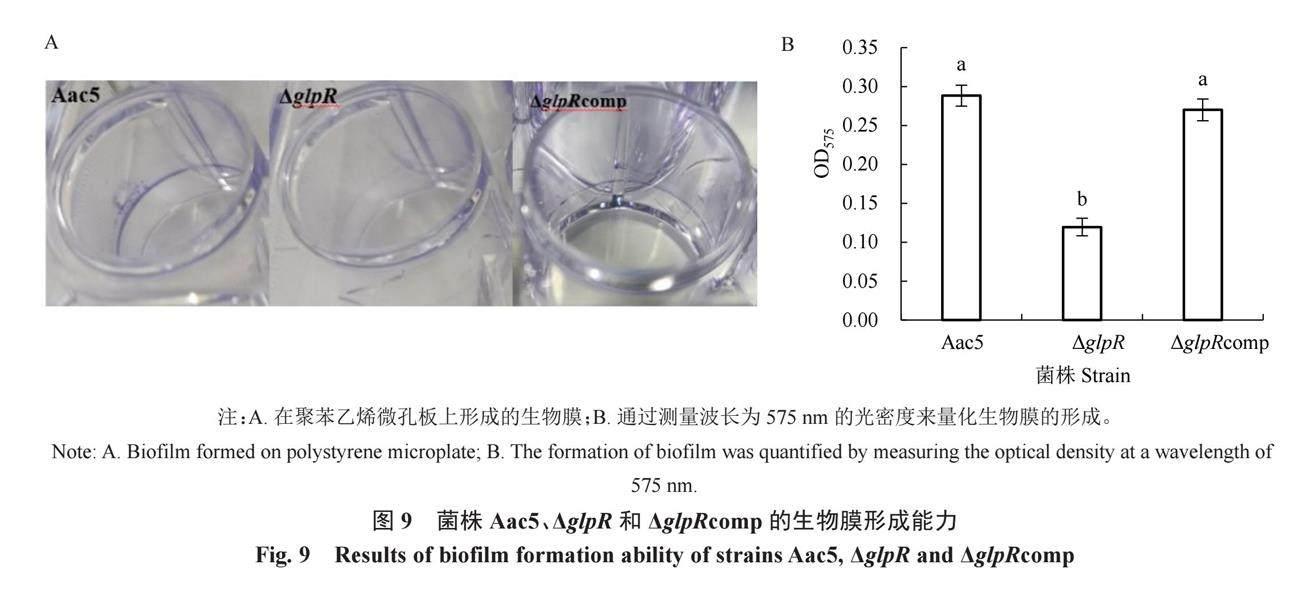
2.8 glpR的缺失减弱了Aac5的生物膜形成能力
Aac5形成的生物膜比ΔglpR更明显,ΔglpRcomp和Aac5形成的生物膜相近(图9-A)。用95%乙醇溶解生物膜后测量得到Aac5、ΔglpR和ΔglpRcomp的OD575值分别为0.29、0.12和0.27。Aac5菌株和互补菌株ΔglpRcomp的OD575值均显著高于ΔglpR,并且互补菌株ΔglpRcomp的OD575值可以恢复到Aac5的水平(图9-B)。
2.9 致病相关的基因表达量测定结果
qRT-PCR测定结果表明,与Aac5相比,用T3SS诱导培养基培养时,ΔglpR中T3SS关键基因hrpG、hrpE与hrcJ表达量显著降低,果糖代谢相关基因fruA、fruB与fruK表达量显著降低;通过KB培养基培养,ΔglpR生物膜相关基因flgG表达量显著降低(图10),推测西瓜噬酸菌中的基因glpR和T3SS相关基因、果糖代谢相关基因以及生物膜相关基因之间均存在着一定的调控关系。
2.10 GUS启动子活性检测
笔者分析了 fruB 基因的启动子在Aac5和ΔglpR菌株中的活性,以此来进一步验证 qPCR检测的相关结果。GUS酶活检测结果表明,与WT菌株相比,在KB和XVM2培养基两种培养条件下,ΔglpR菌株中的基因fruB的启动子活性均显著降低(图 11)。这与qPCR测定结果一致,表明基因glpR在西瓜噬酸菌中能调控果糖利用关键基因fruB的启动子活性。
3 讨论与结论
为了研究基因glpR的功能,笔者构建了西瓜噬酸菌glpR基因缺失突变株及互补菌株,在测定glpR基因缺失突变株对果糖利用能力时发现,同Aac5相比,突变株利用果糖的能力显著下降,并且转录水平测定结果表明,果糖利用相关基因fruA、fruB与fruK表达量显著下调。GUS启动子活性检测结果表明,突变株中的fruB基因的启动子活性显著降低,推测glpR可能与果糖利用关键基因fruB的启动子结合,促进fruB基因的转录,而glpR缺失后对激活fruB基因启动子造成影响,进而影响突变株对果糖的利用能力。綜上所述,glpR基因在西瓜噬酸菌果糖代谢过程中起关键作用,这与以往的研究结果相一致[44]。在抗胁迫测定中发现,glpR基因缺失突变株在高盐胁迫以及铜离子胁迫中的耐受程度都显著高于Aac5。在进一步对致病相关的表型分析后发现,突变菌株ΔglpR的体内定殖能力、体外生长能力以及生物膜的形成能力均显著下降,体内定殖能力、体外生长能力以及生物膜形成能力的减弱可能与缺失glpR基因后西瓜噬酸菌对果糖等营养元素利用能力减弱有关。glpR基因缺失使西瓜噬酸菌的致病能力显著减弱,在丁香假单胞菌中,DeoR家族转录因子setA的缺失会导致病原菌对寄主的致病能力显著下降并且T3SS中相关基因的表达量也显著下降[45],与此相似,glpR缺失后西瓜噬酸菌T3SS关键基因hrpG、hrpE及hrcJ表达量显著下调,推测glpR基因是hrpG、hrpE及hrcJ上游潜在的调控基因。
综上所述,笔者的研究初步探究了glpR基因对西瓜噬酸菌致病性相关表型的影响,glpR基因在西瓜噬酸菌中不仅在果糖利用、抗胁迫方面具有重要作用,而且对西瓜噬酸菌致病力方面具有重要贡献。但目前对西瓜噬酸菌中DeoR家族调控机制的研究还不够深入,对该转录因子的调控网络了解较少,在后续研究中还需要继续寻找其下游可能存在的重要调控靶点,探寻可能存在的调控网络,从而为寻找新的病原细菌防治靶标提供参考。
参考文献
[1] YANG Y W,QIAO P,WANG T L,et al.Further characterization of host preference of Acidovorax citrulli based on growth competition between group I and group II strains[J].Horticulturae,2022,8(12):1173.
[2] 杨玉文,乔培,刘德华,等.基于多重PCR技术的西瓜噬酸菌分组检测方法及其应用[J].植物保护,2022,48(4):211-219.
[3] WEBB R E,GOTH R W.A seedborne bacterium isolated from watermelon[R].Plant Disease Reports,1965,49:818-821.
[4] JI W Q,ZHAO M,FEI N Y,et al.Essential Acidovorax citrulli virulence gene hrpE activates host immune response against pathogen[J].International Journal of Molecular Sciences,2022,23(16):9144.
[5] JIANG J,ZHAO M,ZHANG X X,et al.Acidovorax citrulli effector AopV suppresses plant immunity and interacts with aromatic dehydratase ADT6 in watermelon[J].International Journal of Molecular Sciences,2022,23(19):11719.
[6] YANG L L,ZHAO M,ZHANG X X,et al.Acidovorax citrulli type III effector AopU interferes with plant immune responses and interacts with a watermelon E3 ubiquitin ligase[J].Frontiers in Microbiology,2023,14:1275032.
[7] YANG Y W,FEI N Y,JI W Q,et al.pilA gene contributes to virulence,motility,biofilm formation,and interspecific competition of bacteria in Acidovorax citrulli[J].Microorganisms,2023,11(7):1806.
[8] FEI N Y,JI W Q,YANG L L,et al.Hcp of the type VI secretion system (T6SS) in Acidovorax citrulli group II strain Aac5 has a dual role as a core structural protein and an effector protein in colonization,growth ability,competition,biofilm formation,and ferric iron absorption[J].International Journal of Molecular Sciences,2022,23(17):9632.
[9] GUAN W,WANG T L,HUANG Q,et al.Transcriptomic and functional analyses reveal roles of AclR,a luxR-type global regular,in regulating motility and virulence of Acidovorax citrulli [J].Molecular Plant Microbe Interactions,2021,34(8):952-961.
[10] WANG T L,GUAN W,HUANG Q,et al.Quorum-sensing contributes to virulence,twitching motility,seed attachment and biofilm formation in the wild type strain Aac-5 of Acidovorax citrulli[J].Microb Pathogenesis,2016,100:133-140.
[11] MALAFAIA C B,BARROS M P,MACEDO A,et al.Biofilm formation by phytopathogenic bacteria Acidovorax citrulli subsp.citrulli and Ralstonia solanacearum[J].Journal of Environmental Analysis and Progress,2018,3(4):347-355.
[12] DUTTA B,GITAITIS R,SMITH S,et al.Interactions of seedborne bacterial pathogens with host and non- host plants in relation to seed infestation and seedling transmission[J].Plos One,2014,9(6):e99215.
[13] JIANG C H,WU F,YU Z Y,et al.Study on screening and antagonistic mechanisms of Bacillus amyloliquefaciens 54 against bacterial fruit blotch (BFB) caused by Acidovorax avenae subsp.citrulli[J].Microbiological Research,2015,170:95-104.
[14] SAIER M H,RAMSEIER T M.The catabolite repressor/activator (Cra) protein of enteric bacteria[J].Journal of Bacteriology,1996,178(12):3411-3417.
[15] DE CR?CY-LAGARD V,BOUVET O M,LEJEUNE P,et al.Fructose catabolism in Xanthomonas campestris pv.campestris.sequence of the PTS operon,characterization of the fructose-specific enzymes[J].The Journal of Biological Chemistry,1991,266(27):18154-18161.
[16] VALENTIN-HANSEN P,SVENNINGSEN B A,MUNCH-PETERSEN A,et al.Regulation of the deo operon in Escherichia coli:The double negative control of the deo operon by the cytR and deoR repressors in a DNA directed in vitro system[J].Molecular and General Genetics,1978,159(2):191-202.
[17] SINGER J T,BARBIER C S,SHORT S A.Identification of the Escherichia coli deoR and cytR gene products[J].Journal of Bacteriology,1985,163(3):1095-1100.
[18] MORTENSEN L,DANDANELL G,HAMMER K.Purification and characterization of the DeoR repressor of Escherichia coli[J].The EMBO Journal,1989,8(1):325-331.
[19] ?KERLOV? J,F?BRY M,HUB?LEK M,et al.Structure of the effector-binding domain of deoxyribonucleoside regulator DeoR from Bacillus subtilis[J].FEBS Journal,2014,281(18):4280-4292.
[20] ?EZ??OV? P,KO???EK M,MOY S F,et al.Crystal structures of the effector-binding domain of repressor central glycolytic gene regulator from Bacillus subtilis reveal ligand-induced structural changes upon binding of several glycolytic intermediates[J].Molecular Microbiology,2008,69(4):895-910.
[21] ZENG X M,SAXILD H H,SWITZER R L.Purification and characterization of the DeoR repressor of Bacillus subtilis[J].Journal of Bacteriology,2000,182(7):1916-1922.
[22] BARRI?RE C,VEIGA-DA-CUNHA M,PONS N,et al.Fructose utilization in lactococcus lactis as a model for low-GC gram-positive bacteria::Its regulator,signal,and DNA-binding site[J].Journal of Bacteriology,2005,187(11):3752-3761.
[23] HIROOKA K,KODOI Y,SATOMURA T,et al.Regulation of the rhaEWRBMA operon involved in L-rhamnose catabolism through two transcriptional factors,RhaR and CcpA,in Bacillus subtilis[J].Journal of Bacteriology,2016,198(5):830-845.
[24] QUINTERO-YANES A,LEE C M,MONSON R,et al.The FloR master regulator controls flotation,virulence and antibiotic production in Serratia sp.ATCC 39006[J].Environmental Microbiology,2020,22(7):2921-2938.
[25] ELGRABLY-WEISS M,SCHLOSSER-SILVERMAN E,ROSENSHINE I,et al.DeoT,a DeoR-type transcriptional regulator of multiple target genes[J].FEMS Microbiology Letters,2006,254(1):141-148.
[26] ULANOVA D,KITANI S,FUKUSAKI E,et al.SdrA,a new DeoR family regulator involved in Streptomyces avermitilis morphological development and antibiotic production[J].Applied and Environmental Microbiology,2013,79(24):7916-7921.
[27] 蔡馥宇,費诺亚,乔培,等.西瓜噬酸菌磷酸盐特异性转运系统pstS基因功能分析[J].中国瓜菜,2022,35(10):16-25.
[28] 李晶,杨玉文,赵廷昌.西瓜噬酸菌Aac-5AAA ATPases基因moxR和ruvB功能研究[J].植物病理学报,2016,46(6):748-758.
[29] WENGELNIK K,MARIE C,RUSSEL M,et al.Expression and localization of HrpA1,a protein of Xanthomonas campestris pv.vesicatoria essential for pathogenicity and induction of the hypersensitive reaction [J].Journal of Bacteriology,1996,178(4):1061-1069.
[30] 任争光,侯磊,宋治国,等.甜瓜细菌性果斑病菌致病性突变体筛选与hrcR基因的克隆[J].植物病理学报,2009,39(5):501-506.
[31] 赵玉强,田艳丽,高杜娟,等.pyrG基因对西瓜噬酸菌致病性和组氨酸利用的影响[J].江苏农业学报,2014,30(6):1309-1315.
[32] LORENZ C,HAUSNER J,BUTTNER D.HrcQ provides a docking site for early and late type III secretion substrates from Xanthomonas [J].Plos One,2012,7(11):e51063.
[33] SCHAFER A,TAUCH A,JAGER W,et al.Small mobilizable multi-purpose cloning vectors derived from the Escherichia coli plasmids pK18 and pK19:Selection of defined deletions in the chromosome of Corynebacterium glutamicum [J].Gene,1994,145(1):69-73.
[34] ZHANG X X,ZHAO M,YAN J P,et al.Involvement of hrpX and hrpG in the virulence of Acidovorax citrulli strain Aac5,causal agent of bacterial fruit blotch in cucurbits[J].Frontiers in Microbiology,2018,9:507.
[35] QIAO P,ZHAO M,GUAN W,et al.A putative multi-sensor hybrid histidine kinase,BarAAc,inhibits the expression of the type III secretion system regulator HrpG in Acidovorax citrulli[J].Frontiers in Microbiology,2022,13:1064577.
[36] 陈加臻,农添植,邢方婷,等.嗜水气单胞菌ntrC调控的生理功能及其机制研究[J].微生物学报,2021,61(12):4059-4069.
[37] LIU D H,ZHAO M,QIAO P,et al.ntrC contributes to nitrogen utilization,stress tolerance,and virulence in Acidovorax citrulli[J].Microorganisms,2023,11(3):767.
[38] REN Z G,JIANG W J,NI X Y,et al.Multiplication of Acidovorax citrulli in planta during infection of melon seedlings requires the ability to synthesize leucine[J].Plant Pathology,2014,63(4):784-791.
[39] 张爱萍,张晓晓,吴林娜,等.西瓜噬酸菌趋化性及鞭毛素基因ΔcheAΔfliC双突变体构建及功能[J].农业生物技术学报,2017,25(11):1838-1850.
[40] 金岩,张俊杰,吴燕华,等.西瓜细菌性果斑病的发生与病原菌鉴定[J].吉林农业大学学报,2004,26(3):263-266.
[41] 高杜娟,韓振华,王敏杰,等.瓜类细菌性果斑病菌hpaP基因的功能分析[J].农业生物技术学报,2011,19(4):746-752.
[42] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCT method[J].Methods,2001,25(4):402-408.
[43] 张晓晓.西瓜噬酸菌效应蛋白Ace1功能研究及光照黑暗条件下致病性差异分析[D].北京:中国农业科学院,2018.
[44] GAURIVAUD P,LAIGRET F,GARNIER M,et al.Characterization of FruR as a putative activator of the fructose operon of Spiroplasma citri [J].FEMS Microbiology Letters,2001,198(1):73-78.
[45] TURNER S E,PANG Y Y,O'MALLEY M R,et al.A DeoR-type transcription regulator is required for sugar-induced expression of type Ⅲ secretion-encoding genes in Pseudomonas syringae pv.tomato DC3000[J].Molecular Plant-Microbe Interactions,2020,33(3):509-518.
