M2 型巨噬细胞通过分泌白细胞介素-10 调控胆囊癌细胞增殖、迁移和侵袭的研究
2024-05-28赵向阳江博文
赵向阳,江博文,陶 滔,谈 燚
(蚌埠医科大学第一附属医院肝胆外科,安徽 蚌埠 233004)
胆囊癌(gallbladder cancer, GBC)是一种常见的胆道恶性肿瘤,约占80%~95%,该病具有侵袭性且易发生转移,所以致死率高,5 年生存率低于5%[1-3]。现阶段对GBC 发生机制的认识尚不充分,积极挖掘新的分子靶点并针对性开发相应药物将有助于改善GBC 预后状况。
肿 瘤 微 环 境(tumor microenvironment, TME)是一个参与肿瘤生长和发展每个阶段的复杂生态系统,主要构成有肿瘤细胞、多种免疫细胞和细胞因子以及细胞外基质等。肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)是TME 中含量很高的一种免疫细胞,主要分为M1 型和M2 型,其中M2 型即TAMs 一般所指代的巨噬细胞,能够促进肿瘤生长和转移以及抑制免疫应答[4-6]。白细胞介素-10(IL-10)是Ⅱ类细胞因子家族的成员,其生物活性形式是一种可溶性的36 kDa 同源二聚体[7]。IL-10 可由巨噬细胞、多种T 细胞和肿瘤细胞等细胞分泌,并在肿瘤中可发挥免疫抑制作用,降低免疫细胞对癌细胞造成的损伤[8]。此外,IL-10 还在部分肿瘤中被证实可以促进癌细胞的增殖和转移,包括神经胶质瘤[9]、非小细胞肺癌[10]、肝癌[11]、卵巢癌[8]等。IL-10 的浓度在包括GBC 在内的多种肿瘤中显著升高[12],但目前在GBC 中关于IL-10 生物效应方面的研究偏少。本实验意在探讨M2 型巨噬细胞对胆囊癌细胞增殖、迁移和侵袭的影响,以及IL-10 在该调控中的作用,为将来胆囊癌临床治疗的开展提供新的实验数据。
1 材料与方法
1.1 细胞和主要材料
人单核细胞株THP-1 购自ATCC 公司;人GBC 细胞株NOZ 和GBC-SD 由蚌埠医学院第一附属医院徐明课题组惠赠;佛波酯、人重组IL-4 和IL-13 购 自MCE 公 司;RPMI 1640 培 养 基 选 自Gibco 公司;人IL-10 中和抗体购自Biolegend 公司;ELISA检测试剂盒选自江苏晶美公司;CCK-8 检测试剂盒选自上海碧云天公司;Matrigel 胶选自BD 公司;Trizol 购自Takara 公司;cDNA 逆转录试剂盒和荧光定量PCR 试剂盒购自近岸蛋白质公司;兔源多克隆抗体E-cadherin 和鼠源单克隆抗体Vimentin 选自武汉三鹰公司;兔源多克隆抗体GAPDH、鼠二抗和兔二抗购自爱博泰克公司。
1.2 细胞培养与处理
THP-1、NOZ 和GBC-SD 细 胞 在37 ℃、5%CO2的恒温培养箱中用含10%胎牛血清的RPMI 1640 培养基进行常规培养。诱导实验时,将THP-1细胞种入六孔板(细胞密度为1×106个),先用150 nmol/L 的PMA 诱导24 h,更换新鲜培养基后,再用20 ng/L 的IL-4 和IL-13 诱导48 h 即为M2 型巨噬细胞,诱导前后拍照记录;诱导完成后弃旧培养基,更换新鲜无血清培养基再培养48 h,收集上清作条件培养基(M2-CM)。实验分组:Control 组(用不含血清的培养基作对照处理)、M2-CM 组(用M2-CM 处理)、M2-CM+anti-IL-10 组(用含10 μg/L 的IL-10中和抗体的M2-CM 处理)、M2-CM+IgG 组(用含10 μg/L 的IL-10 同型对照抗体的M2-CM 处理)。
1.3 RT-qPCR 实验
收集诱导前后的THP-1 细胞,Trizol 法提取细胞RNA,检测RNA 浓度,定量并逆转录合成cDNA,根据荧光定量PCR 试剂盒使用说明对样品中的待测基因定量分析。采用2-ΔΔCT计算每个基因的相对表达量。用于实验的引物序列见表1。

表1 引物序列Tab 1 Primer sequence
1.4 ELISA
收集THP-1 和M2 巨噬细胞的上清液,参考ELISA 试剂盒说明书,分别检测两组细胞上清中IL-10 的表达量。
1.5 CCK-8 实验
取处于对数生长期的NOZ 和GBC-SD 细胞悬液加入96 孔板中(每孔100 μL,3 000 个),待细胞贴壁 后,按 各 组 要 求 分 别 孵 育0 h、24 h、48 h 和72 h后,以10∶1 比 例 向 每 孔 加 入CCK-8 溶 液,再 孵 育120 min,上酶标仪检测各组450 nm 处的吸光度值。
1.6 划痕实验
制备NOZ 和GBC-SD 细胞的细胞悬液并铺板于6 孔板中,待细胞长满后,用无菌枪头在孔内均匀划直线,分组处理48 h。在0 h 和48 h 观测划痕宽度并拍照,而后利用Image J 软件计算细胞迁移率。
1.7 Transwell 实验
将Matrigel 液与预冷无血清培养基充分混匀,加入每个上室后,于37 ℃培养箱放置1 h。取预先处理的NOZ 和GBC-SD 细胞(分组处理了72 h),用无血清培养基制备细胞悬液,每个上室加100 μL(每孔7 000 个),下室分别加入600 μL 的完全培养基,再培养48 h 后取出小室,PBS 洗涤后在4%的多聚甲醛和0.1%的结晶紫中分别浸泡15 min,PBS洗涤后倒置放在吸水滤纸上,晾干表面水分,高倍镜下观察侵袭细胞数并拍照。
1.8 Western blot 实验
用RIPA 于冰上裂解各组细胞,提取蛋白并对各组蛋白样品定量;蛋白样品先电泳分离(先70 V,30 min,再120 V,60 min),后 电 转 至PVDF 膜 上(250 mA,120 min);PVDF 膜用牛奶封闭120 min后,放入配好的一抗稀释液中于4 ℃环境下孵育过夜(稀释比例分别为:Vimentin 1∶20 000、E-cadherin 1∶20 000 和GAPDH 1∶5 000)。第二天取出PVDF膜,TBST 洗膜3 遍共约15 min,而后在二抗稀释液中(稀释比均为1∶5 000)于摇床上室温孵育120 min,孵育结束再次洗膜,之后蘸取ECL 反应液进行曝光显影。
1.9 统计学处理
使用Graphpad Prism 8.0 软件对实验结果统计分析并绘制统计图;实验数据用均数±标准差(±s)表示,采用t检验分析诱导实验结果;其余实验数据用单因素方差分析(ANOVA)检验比较,P<0.05表示差异具有统计学意义。
2 结果
2.1 M2 型巨噬细胞的诱导与鉴定
THP-1 在诱导前悬浮生长,细胞形态呈圆形或类圆形,经PMA、IL-4 和IL-13 诱导后,细胞贴壁,形态转为略不规则形并伸出伪足(图1A)。经RTqPCR 检测显示,与未诱导的THP-1 相比,诱导后细胞中M2 型巨噬细胞的标志分子CD206 和Arg 1[13]表达升高(P<0.05,P<0.05),而M1 型巨噬细胞的标 志 分 子CD80 和iNOS[13,14]表 达 无 明 显 变 化 或 略有下降(P>0.05,P<0.05,图1B),这说明M2 型巨噬细胞诱导成功。

图1 M2 巨噬细胞的诱导与鉴定Fig 1 Induction and identification of M2 macrophages
2.2 IL-10 在M2 型巨噬细胞内和M2 型巨噬细胞上清液中高表达
经RT-qPCR 和ELISA 检测发现,与诱导前的THP-1 相 比,IL-10 在M2 型 巨 噬 细 胞 内 的mRNA水平表达升高(P<0.05,图2A),在上清液中的蛋白含量明显增多(P<0.05,图2B)。
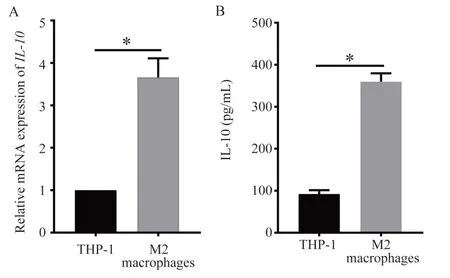
图2 IL-10 在THP-1 和M2 型巨噬细胞内及上清中的表达情况Fig 2 Expression of IL-10 in THP-1 and M2 macrophages and its supernatant
2.3 M2 型巨噬细胞通过分泌IL-10 促进GBC 细胞增殖、迁移和侵袭
利用CCK-8 实验检测了各实验组对细胞增殖的影响,结果显示:NOZ 和GBC-SD 细胞在被处理48 h 和72 h 后,相较于Control 组,M2-CM 组的细胞增殖能力明显增强(P<0.05);与M2-CM 组相比,M2-CM+anti-IL-10 组的细胞增殖能力显著减弱(P<0.05),M2-CM+IgG 组的细胞增殖能力无明显差异(P>0.05),见图3。在细胞划痕实验中发现M2-CM 可使GBC 的细胞迁移率升高,在anti-IL-10 中和了M2-CM 中的IL-10 之后,GBC 的细胞迁移率明显下降(P<0.05),而IL-10 的同型对照抗体对GBC 细胞迁移率无明显影响(P>0.05),见图4。Transwell实验结果显示M2-CM 组的侵袭细胞数明显多于Control 组和M2-CM+anti-IL-10 组(P<0.05),而和M2 -CM+IgG 组 相 比 无 明 显 差 异(P>0.05),见图5。
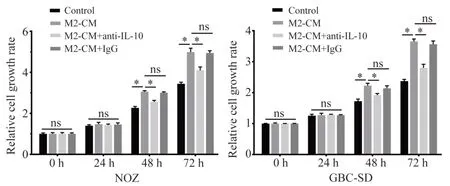
图3 M2 型巨噬细胞和IL-10 对GBC 细胞增殖的影响Fig 3 Effects of M2 macrophages and IL-10 on the proliferation of GBC cells
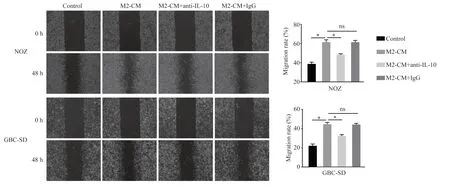
图4 M2 型巨噬细胞和IL-10 对GBC 细胞迁移的影响Fig 4 Effects of M2 macrophages and IL-10 on the migration of GBC cells
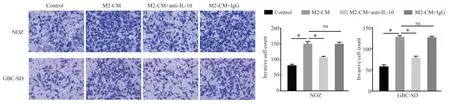
图5 M2 型巨噬细胞和IL-10 对GBC 细胞侵袭的影响Fig 5 Effects of M2 macrophages and IL-10 on the invasion of GBC cells
2.4 M2 型巨噬细胞通过分泌IL-10 促进GBC 细胞上皮间质转化
为探明M2 型巨噬细胞和IL-10 对GBC 细胞上皮间质转化的影响,利用Western blot 实验检测了E-cadherin 和Vimentin 的表达情况,结果显示,与Control 组 相 比,M2-CM 组 上 皮 表 型E-cadherin 的 表达明显下降,而间质表型Vimentin 的表达显著升高(P<0.05);与M2-CM 组相比,M2-CM+anti-IL-10组E-cadherin 和Vimentin 的表达变化明显被抑制(P<0.05),M2-CM+IgG 组E-cadherin 和Vimentin 的表达水平无明显变化(P>0.05),见图6。
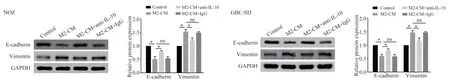
图6 M2 型巨噬细胞和IL-10 对GBC 细胞上皮间质转化相关蛋白表达的影响Fig 6 Effects of M2 macrophages and IL-10 on the expression of proteins related to epithelial-mesenchymal transformation in GBC cells
3 讨论
由于GBC 早期症状缺乏特异性且进展迅速,通常患者初诊时病情已至晚期,丧失了根治性手术机会[3,15],只能被迫接受化疗、放疗和靶向治疗等非手术性姑息疗法。虽然化疗是非手术治疗的首选方案[1],但是由于化疗药无法忽视的耐药性和全身毒性等问题,使得GBC 化疗疗效比较有限[16];而GBC对放疗不敏感[15],GBC 的靶向治疗目前尚未取得突出成效,5 年生存率未有得到明显提高[17]。因此需要更加深入探究GBC 致瘤的内在机制,努力寻找更有效的分子靶点和优化治疗方案,来延长患者生存期和改善患者预后。
近几年,随着对TME 的研究深入,针对TME所开展的抗肿瘤研究也逐渐成为了诸多学者所关注一个议题。M2 型巨噬细胞是TME 的重要组成,能够分泌多种可溶性细胞因子,诸如TGF-β1、CCL5、CCL18 和CCL22 等[18-21],在这些细胞因子介导下,M2 型巨噬细胞可推动肿瘤细胞恶性进展或抑制抗肿瘤免疫应答,进而实现对肿瘤的塑造。阻断这些细胞因子的功能发挥可能是切断肿瘤相关巨噬细胞与癌细胞之间相互联系的一个新思路。在本实验中笔者发现,IL-10 在M2 巨噬细胞的mRNA 水平高表达,以及在其上清液中明显增多,所以推测IL-10 可能是M2 巨噬细胞发挥促癌能力的重要媒介。
越来越多的数据表明,IL-10 可参与多种肿瘤的生长与进展,IL-10 或可作为抗肿瘤治疗的一个靶点。有文献指出,在肿瘤细胞和肿瘤相关巨噬细胞中IL-10 的表达上调可作为癌症分期和转移潜力进展的预测指标[7]。此外IL-10 还可增强肿瘤细胞的干性和转移能力。比如,Zhang 等[22]研究指出,IL-10 可以通过升高KPNA2 表达促进神经胶质瘤细胞的增殖和侵袭;另有文献表明,IL-10 介导了人类白细胞抗原-E 对神经母细胞瘤细胞迁移和侵袭能力的增强调控[23];在胃癌、肺癌和膀胱癌中,M2 型巨噬细胞来源的IL-10 促进了肿瘤细胞的恶性进展[24-26]。IL-10 除了在细胞层面体现了它作为分子靶标的潜力,也在动物水平的研究中证明了它在临床治疗中的可能价值。Gordy 等[27]研究表明,在黑色素瘤模型中,IL-10 中和抗体以依赖于Ⅰ型干扰素活性的方式增强了MIP3α-gp100DNA 疫苗的抗癌效果。为探明IL-10 在GBC 中的作用,本实验用M2 型巨噬细胞上清液和IL-10 中和抗体处理GBC细胞,结果显示M2 型巨噬细胞对GBC 细胞的增殖、迁移和侵袭有促进作用,而阻断IL-10 后,M2 型巨噬细胞的这一促进效应明显减弱。上皮间质转化(epithelial-mesenchymal transition, EMT)是一种癌细胞上皮样状态丧失转而获得间质表型的可塑性过程,此转化过程可使得肿瘤细胞的转移能力获得提升[20]。多项实验研究发现,M2 型巨噬细胞可以诱导肿瘤细胞的EMT,例如,有实验证明M2 型巨噬细胞在肾细胞癌中可通过分泌CXCL13 促进肿瘤细胞迁移、侵袭和EMT[28];在肺鳞状细胞癌中,M2 型 巨 噬 细 胞 通 过 释 放TGF-β 激 活Smad/ZEB 通路促进癌细胞EMT[29];Chen 等[30]研究发现,在CCL2/AKT/β-catenin 通路介导下M2-CM 可激发三阴性乳腺癌细胞的EMT。而在本实验中也得到了相似结果,M2 型巨噬细胞可下调GBC 细胞Ecadherin 的表达以及上调Vimentin 的表达,中和IL-10 后,EMT 相关蛋白表达的这一变化明显被抑制。
综上所述,本研究发现M2 型巨噬细胞通过分泌IL-10 促进GBC 细胞增殖、迁移、侵袭和上皮间质转化,揭示了M2 型巨噬细胞对GBC 细胞功能调控的分子机制,为GBC 的精准治疗提供了新的理论依据。
作者贡献度说明:
赵向阳:实验构思、实验实施、实验数据统计分析和文章撰写;江博文、陶滔:协助部分实验实施和实验数据统计分析;谈燚:实验指导和文章批改。
所有作者声明不存在利益冲突关系。
