灵宝护心丹治疗动脉粥样硬化的转录组学机制研究
2024-05-25芦瑞霞,林文勇,靳琪鹏,王肖龙
芦瑞霞,林文勇,靳琪鹏,王肖龙
摘要目的:研究灵宝护心丹改善动脉粥样硬化的疗效和潜在作用机制。方法:C57BL/6小鼠喂以正常饮食,载脂蛋白E基因敲除(ApoE-/-)小鼠喂养高脂饮食诱导动脉粥样硬化模型,12周后随机分为模型组、灵宝护心丹低剂量组、灵宝护心丹中剂量组、灵宝护心丹高剂量组和他汀组。给予药物8周后,检测血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平;通过油红O染色、Masson染色、苏木素-伊红(HE)染色观察主动脉根部的病理变化。通过转录组学测序分析灵宝护心丹减轻动脉粥样硬化的机制。结果:与模型组相比,灵宝护心丹组的斑块及TC、TG、LDL-C水平明显降低,斑块的胶原面积明显增多,炎性细胞浸润减少。转录组学测序结果显示,灵宝护心丹组和模型组相比筛选出733个差异基因,富集到的通路包括脂肪酸生物合成、胶原蛋白形成、炎症信号通路等。结论:灵宝护心丹对动脉粥样硬化有显著改善作用,机制可能涉及脂质代谢和炎癥反应的关键通路。
关键词动脉粥样硬化;灵宝护心丹;转录组学;血脂;实验研究
doi:10.12102/j.issn.1672-1349.2024.08.008
Transcriptomic Mechanism of Lingbao Huxin Pill for the Treatment of Atherosclerosis
LU Ruixia, LIN Wenyong, JIN Qipeng, WANG Xiaolong
Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
Corresponding AuthorWANG Xiaolong, E-mail: wxlqy0214@163.com
AbstractObjective:To study the therapeutic effect and potential mechanism of Lingbao Huxin Pill in improving atherosclerosis.Methods:C57BL/6 mice were fed with normal diet,and apolipoprotein E gene knockout(ApoE-/-) mice were fed with high-fat diet to induce the atherosclerosis model.After 12 weeks,the mice were randomly divided into model group,Lingbao Huxin Pill low-dose group,Lingbao Huxin Pill medium-dose group,Lingbao Huxin Pill high-dose group and statin group.After 8 weeks of administration,the levels of serum total cholesterol(TC),triglyceride(TG),low density lipoprotein cholesterol(LDL-C) and high density lipoprotein cholesterol(HDL-C) were detected.The pathological changes of aortic root were detected by oil red O staining,Masson staining and hematoxylin-eosin(HE) staining.The mechanism of alleviating atherosclerosis of Lingbao Huxin Pill was analyzed by transcriptomic sequencing.Result:Compared with model group,the levels of plaque,TC,TG and LDL-C in the Lingbao Huxin Pill groups significantly decreased,the collagen area of plaque was significantly cells increased,and inflammatory infiltration was decreased.Transcriptomic sequencing results showed that compared with the model group,733 differential genes were screened out in the Lingbao Huxin Pill groups and the pathways enriched included fatty acid biosynthesis,collagen formation,and inflammation signaling pathways.Conclusion:Lingbao Huxin Pill could significantly improve atherosclerosis,and the mechanism might involve the key pathways of lipid metabolism and inflammatory response.
Keywordsatherosclerosis; Lingbao Huxin Pill; transcriptomics; lipids; experimental study
JAMA Cardiology杂志2019年发表了中国心血管疾病负担统计结果,心血管疾病导致的死亡人数从1990年的251万人增加到2016年的397万人,缺血性心脏疾病是心血管疾病死亡的前三大原因之一,死亡率增长了184.1%[1]。根据2021年发表在Nature杂志的评论[2],动脉粥样硬化现已成为全球性的挑战,其普遍性和越发年轻化的趋势导致动脉粥样硬化性心血管疾病成为全球死亡原因的主要贡献者。尽管目前的治疗策略在控制低密度脂蛋白、血压以及其他传统危险因素方面取得了显著成效,但动脉粥样硬化性心血管疾病的残余风险仍然显著。因此,迫切需要推动其综合管理策略的发展,并致力于开发新的治疗手段以减轻其对公共健康的负担。
灵宝护心丹由人工麝香、蟾酥、人工牛黄、冰片、红参、三七、琥珀、丹参和苏合香共9味中药组成,收录在《中华人民共和国药典》[3],临床研究已证实其在治疗冠心病等方面疗效明显[4]。本课题组前期研究显示,灵宝护心丹的临床疗效较显著,具有改善血脂的功效。动脉粥样硬化是冠心病的病理基础,但是关于灵宝护心丹减轻动脉粥样硬化的具体作用机制,目前的研究证据还不充足。
转录组学在揭示中药治疗疾病的分子机制方面发挥着重要作用。通过精确测定疾病状态下的基因表达水平,能够定位中药治疗过程中调控发生变化的关键基因和生物通路,获得深入的生物学见解[5]。王莹等[6]的转录组学研究表明,毛冬青三萜皂苷缓解脂多糖引发的小鼠肠道损伤可能与调节肠道IgA免疫及TRP通道的炎症反应有关。因此,本研究旨在运用转录组学测序技术,筛选出关键基因和调控途径,深化对灵宝护心丹改善动脉粥样硬化分子机制的理解。
1材料与方法
1.1动物
无特定病原体(SPF)级野生型C57BL/6小鼠5只,基于C57BL/6小鼠背景进行载脂蛋白E基因敲除(ApoE-/-)的小鼠25只,体质量19~23 g,购自北京维通利华实验动物技术有限公司。动物在上海中医药大学动物实验中心SPF屏障系统内饲养,动物使用许可证号:SYXK(沪)2020-0009。适应性喂养1周,湿度40%~60%,环境温度20~25 ℃,自由饮食,每日12 h光照维持,昼夜循环。
1.2药品与试剂
灵宝护心丹(国药准字Z32021181)购自苏州雷允上药业集团有限公司;阿托伐他汀钙片(立普妥,国药准字J20130129)购自美国辉瑞公司;无水乙醇、二甲苯、中性树胶、异丙醇购自国药集团化学试剂有限公司;环保型脱蜡液、通用型组织固定液、苏木素-伊红(HE)染液套装、Masson染液套装、分化液、油红染液均购自Servicebio公司。
1.3仪器
NanoDrop 2000分光光度计(Thermo Scientific,USA);VAHTS Universal V5 RNA-seq Library Prep试剂盒;Pannoramic MIDI组织切片数字扫描仪(3DHISTECH);Chemray 240全自动生化分析仪(深圳雷杜生命科技有限公司);Donatello脱水机(DIAPATH);JB-P5包埋机(武汉俊杰电子有限公司);RM2016病理切片机(上海徠卡仪器有限公司);KD-P组织摊片机(浙江省金华市科迪仪器设备有限公司);GFL-230烤箱(天津市莱玻瑞仪器设备有限公司);CRYOSTAR NX50冰冻切片机(赛默飞世尔科技有限公司);NIKON ECLIPSE E100正置光学显微镜(日本尼康)。
1.4动物分组与给药
ApoE-/-小鼠高脂饲料喂养12周后,随机分为模型组、灵宝护心丹低剂量组[4.68 mg/(kg·d)]、灵宝护心丹中剂量组[9.36 mg/(kg·d)]、灵宝护心丹高剂量组[18.72 mg/(kg·d)]和他汀组[2.4 mg/(kg·d)],每组5只,连续8周,给药同时维持高脂饮食。另外,将C57BL/6小鼠5只作为空白组,普通饲料喂养20周。模型组和空白组给予等体积生理盐水。
1.5血脂检测
第20周末,小鼠眼球取血,室温静置2 h后,3 000 r/min离心10 min,吸取上层血清,采用全自动生化仪检测血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)水平。
1.6主动脉根部病理染色
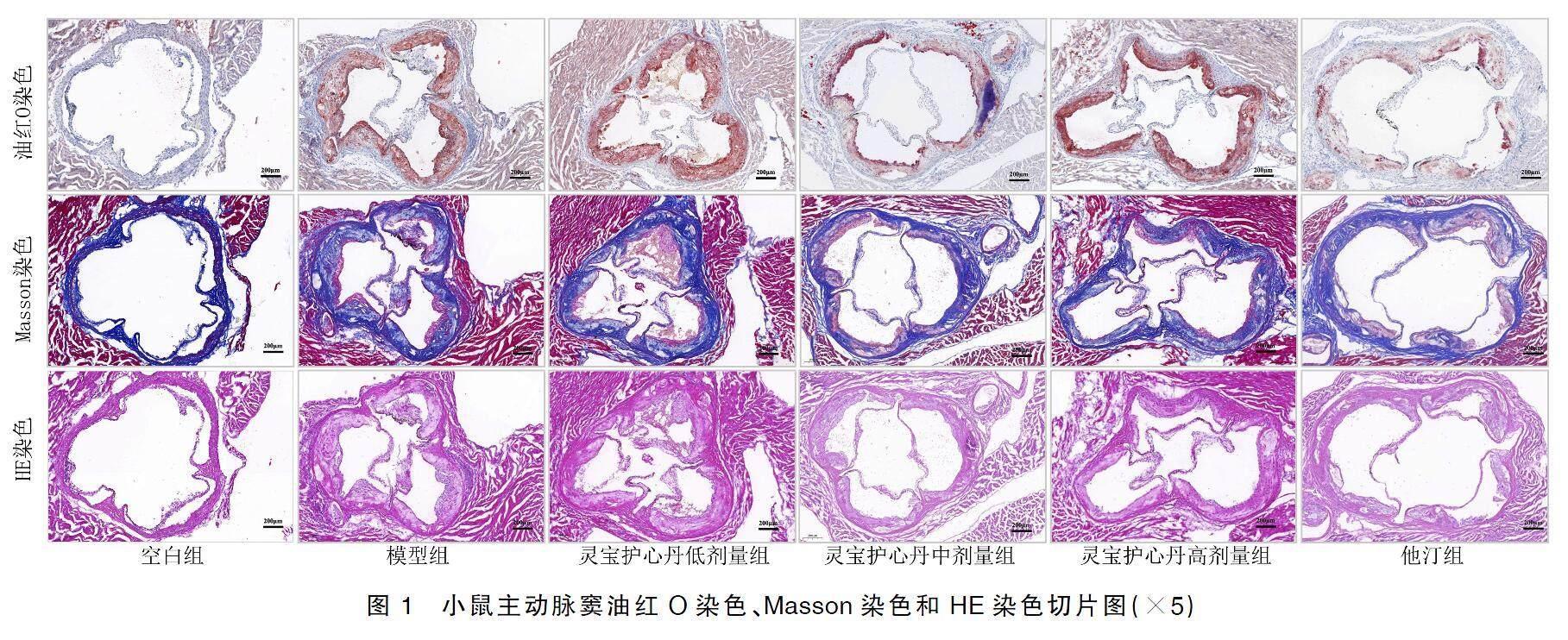
将小鼠四肢固定于操作板上,打开胸腔和腹腔,剪右心房,灌流针插入心尖,灌流磷酸缓冲盐溶液,直至肝脏颜色变浅、肺组织变白后结束。将小鼠心脏置于4%多聚甲醛固定24 h,最佳切割温度化合物(optimal cutting temperature compound,OCT)冰冻包埋,固定于冰冻过切片机,以8~10 μm的厚度进行切片,进行油红O染色、HE染色和Masson染色。用光学显微镜观察切片,并使用成像系统拍照,用Image J软件对斑块面积进行测量。
1.7转录组学文库的构建及测序
为了研究灵宝护心丹对动脉粥样硬化的影响,从空白组、模型组及灵宝护心丹最佳剂量组小鼠各随机选取3只,收集主动脉组织样本,并委托上海欧易生物医学科技有限公司进行核糖核酸(RNA)提取及转录组学序列分析。通过QIAGEN RNeasy Lipid Tissue Mini Kit 从主动脉组织样本中提取总RNA,使用NanoDrop 2000分光光度计鉴定RNA纯度和定量,使用Agilent 2100 Bioanalyzer评估RNA完整性。依据VAHTS Universal V5 RNA-seq Library Prep试剂盒说明书构建转录组文库。采用 llumina Novaseq 6000 测序平台对文库进行测序,并生成150 bp 双端读段(reads)。采用fastp软件[7]对 fastq格式的原始测序序列进行处理,从3′端及5′端去除低质量测序序列后进行后续数据分析。使用 HISAT2软件[8]进行参考基因组比对,并进行基因表达量计算,再通过HTSeq-count[9]获得每个基因的测序序列计数。使用每百万片段数每千碱基外显子的片段数(fragments per kb per million reads,FPKM)法估算基因表达水平。
1.8转录组学分析
利用DESeq2[10]软件对所有样本基因的数目进行标准化处理,计算差异倍数,并采用负二项分布检验的方式进行差异显著性检验,首先对每个基因进行P值计算,再用假发现率错误控制法对P值作多重假设检验矫正得到q值,最终将q<0.05且差异倍数大于2的基因定义为差异表达基因(DEGs)。
基于超几何分布算法对灵宝护心丹组和模型组的DEGs进行基因本体(gene ontology,GO)[11]、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)[12]、Reactome[13]和 WikiPathways[14]富集分析。其中GO富集分析包含生物学过程(biological process,BP)、细胞组分(cellular component)和分子功能(molecular function,MF)。
1.9统计学处理
采用GraphPad Prism(版本9.4.1)进行统计分析和绘图。符合正态分布的定量资料以均数±标准差(x±s)表示,应用单因素方差分析(one-way analysis of variance,ANOVA)进行多组间比较;采用Tukey多重比较测试作为后续分析。以P<0.05为差异有统计学意义。
2结果
2.1灵宝护心丹对高脂饲料喂养的ApoE-/-小鼠动脉粥样斑块的影响
空白组小鼠的主动脉壁结构分界清晰,内皮层完整,细胞排列规整,核染色均匀,没有炎症细胞浸润或其他病理改变,内皮下区域未见明显的脂质积累,胶原纤维分布正常。模型组小鼠的主动脉窦内皮下可见大量炎性细胞浸润和泡沫细胞堆积,细胞排列不规整,斑块区域内胶原纤维增加。与模型组相比,灵宝护心丹中剂量组、灵宝护心丹高剂量组和他汀组的炎症细胞浸润明显减少,血管内皮的结构部分恢复,泡沫细胞减少,斑块区域脂质沉积明显减少,胶原纤维含量在斑块区域增加。表明灵宝护心丹可以减缓动脉粥样硬化进程,减少炎症细胞和泡沫细胞浸润,有助于斑块稳定,改善病理状态。详见图1。
2.2灵宝护心丹对ApoE-/-小鼠血清脂质水平的调节作用
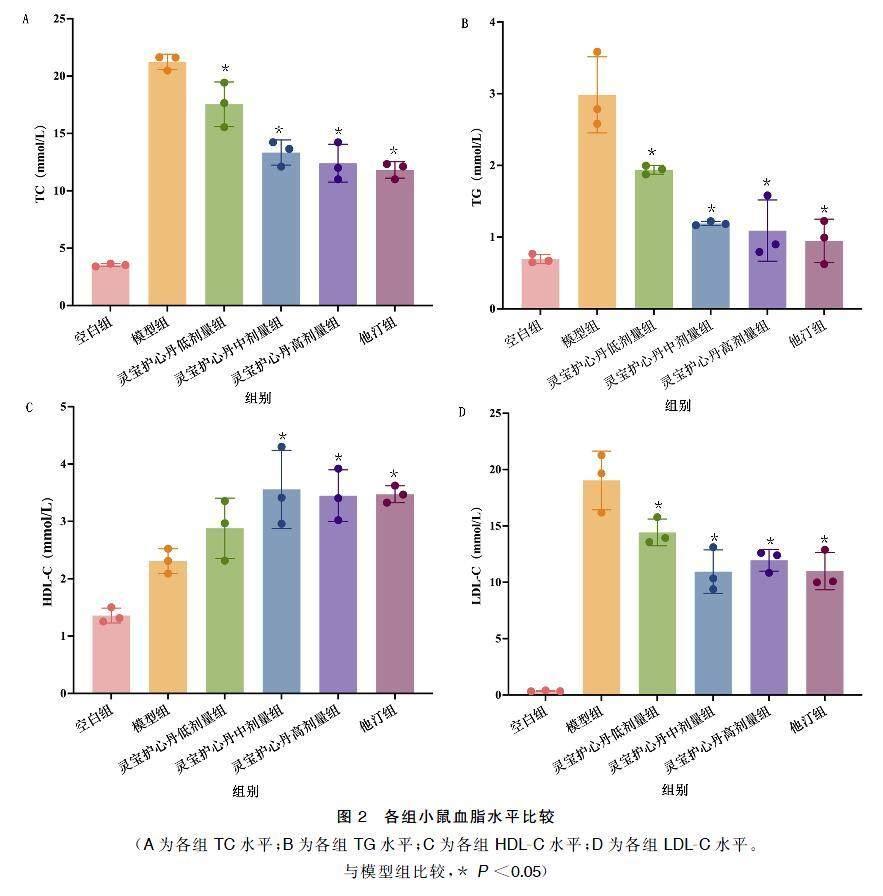
与空白组相比,模型组小鼠血清中TC、TG、LDL-C、HDL-C的水平均显著升高。与模型组相比,灵宝护心丹在不同剂量下TC、TG和LDL-C水平均有效降低,但灵宝护心丹低剂量组改善程度较弱,灵宝护心丹中剂量组和高剂量组的降脂效果与他汀组相似。灵宝护心丹低剂量不能明显提升HDL-C水平,而灵宝护心丹中剂量和高剂量能够提高HDL-C水平。说明灵宝护心丹在调节血脂方面具有显著的疗效。详见图2。
2.3转录组学测序数据的基因表达水平
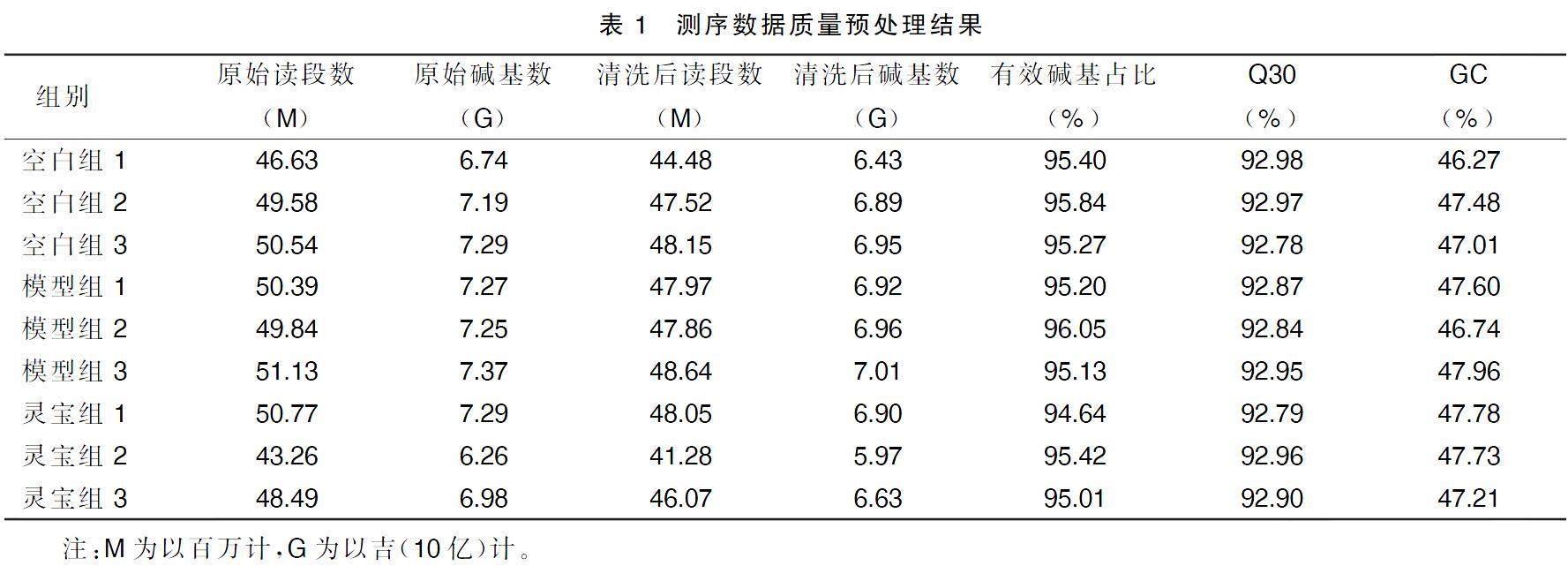
根据灵宝护心丹不同剂量组小鼠血脂水平和主动脉窦斑块面积的研究结果显示,灵宝护心丹中剂量组和高剂量组在改善动脉粥样硬化方面的效果差异无统计学意义。考虑到从经济学角度评估疗效与成本之间的关系,选取灵宝护心丹中剂量组为最佳剂量组进行后续的机制研究是更为合理的选择。在不影响治疗效果的前提下,避免了不必要的药物过量。所以从空白组、模型組和灵宝护心丹中剂量组各随机选取了3个主动脉组织进行转录组学测序分析。质量检测结果显示(见表1),各样本的有效数据量分布在5.97~7.01 G,测序质量分数达到或超过30(Q30)的碱基分布在92.78%~92.98%,平均鸟嘌呤和胞嘧啶(GC)含量为47.53%。通过将reads比对到参考基因组上,得到各样本的基因组比对情况,比对率为97.75%~98.69%。这反映了测序数据与参考基因组的高度一致性,为本研究提供了可靠的基础数据。
2.4DEGs分析
与空白组相比,模型组上调基因964个、下调基因337个,共有1 301个DEGs,说明动脉粥样硬化疾病条件下会发生广泛的基因表达变化。与模型组相比,灵宝护心丹组上调基因426个、下调基因307个,共有733个DEGs(见图3)。其中灵宝护心丹回调了部分小鼠动脉粥样硬化后主动脉组织的DEGs,说明灵宝护心丹在一定程度上改善了模型组中诱发的基因表达异常[15]。详见图4。
2.5GO富集分析
模型组和空白组的DEGs富集的GO通路结果提示,MF过程包括细胞外基质结构成分、胶原蛋白结合、钙离子结合等;CC类别包括细胞外区、细胞外空间、细胞外基质、质膜等;BP包括炎症反应、细胞黏附、先天免疫反应等。灵宝护心丹组和模型组的DEGs进行的GO富集结果提示,MF包括钙离子结合、细胞外基质结构成分、蛋白质结合;CC类别包括细胞外区、细胞外基质、肌浆网、突触、基底膜等;BP过程包括肌节组织、心肌收缩、心率调节等。详见图5。
2.6KEGG富集分析
模型组和空白组的DEGs富集的KEGG通路包括趋化因子信号通路、脂质与动脉粥样硬化、胆固醇代谢、脂肪的消化和吸收、花生四烯酸代谢等;灵宝护心丹和模型组的DEGs富集的KEGG结果包括心肌收缩、柠檬酸循环、脂肪酸生物合成、丙氨酸代谢等通路。详见图6。
2.7Reactome 富集分析
模型组和空白组的DEG富集的Reactome通路包括细胞外基质组织、先天免疫系统、中性粒细胞脱颗粒、胶原蛋白形成、弹性纤维形成、整合素细胞表面相互作用、免疫系统、细胞外基质的降解等生物过程。灵宝护心丹组和模型组的DEGs富集的Reactome通路包括胶原蛋白形成、细胞外基质的降解、脂肪酰辅酶A生物合成、胶原纤维的交联等生物过程。详见图7。
2.8WikiPathways 富集分析
模型组和空白组的DEGs富集的WikiPathways通路包括补体激活、类二十烷酸脂质合成、氧化损伤反应、炎症反应途径等。灵宝护心丹组和模型组的DEGs富集的WikiPathways通路包括脂肪酸生物合成、氧化应激反应、心肌细胞中的钙调节、心脏发育、炎症反应途径等。详见图8。
3讨论
动脉粥样硬化是一种以脂质堆积和慢性炎症为特征的动脉疾病。本研究结果总体揭示了灵宝护心丹对高脂饲料喂养的ApoE-/-小鼠动脉粥样硬化方面的影响。通过对主动脉窦油红O染色、Masson染色、HE染色和血脂水平的检测,发现灵宝护心丹不仅减少了斑块区域的炎症细胞浸润和泡沫细胞堆积,增加斑块内胶原纤维面积,而且能够降低血清TC、TG和LDL-C,同时提高HDL-C。增加的纤维帽厚度有助于防止斑块破裂,从而减少心血管事件的风险[16]。
转录组学结果提示灵宝护心丹可以回调差异基因的水平,如腺苷三磷酸柠檬酸裂解酶(adenosine triphosphate citrate lyase,ACLY)、白细胞介素36γ(interleukin 36 gamma,IL-36γ)、神经调节素1(neuregulin 1,NRG1)、钙黏蛋白(calreticulin,CALR)等。IL-36γ通过磷酸肌醇3-激酶(PI3K)途径特异性上调巨噬细胞清除率受体的表达,加重巨噬细胞泡沫细胞的形成和动脉粥样硬化的进展[17]。NRG1可调节心脏炎症、氧化应激、坏死凋亡等[18]。非凋亡调节的细胞死亡蛋白CALR可能在动脉粥样硬化的沉默进化中发挥关键作用,并可能具有尚未开发的治疗潜力[19-20]。ACLY是他汀类药物靶点3-羟基-3-甲基戊二酰辅酶A还原酶(3 hydroxy-3-methylglutaryl-CoA reductase,HMGCR)上游的关键酶,连接碳水化合物和脂质代谢,通过将柠檬酸转化为乙酰辅酶A,参与脂肪酸和胆固醇的生物合成[21]。
本研究结果显示,灵宝护心丹组与模型组的差异基因在WikiPathways富集到的PI3K-AKT-mTOR信号通路和炎症反应途径,在Reactome富集到的胶原蛋白生物合成和修饰酶、胶原蛋白形成、细胞外基质的降解、胶原蛋白降解通路,在KEGG富集到的低氧诱导因子1(hypoxia-inducible factor 1,HIF-1)信号通路、脂肪酸延伸、转化生长因子-β(transforming growth factor beta,TGF-β)信號通路、趋化因子信号通路、不饱和脂肪酸的生物合成通路,在模型组与空白组差异基因富集的疾病通路中也存在,说明灵宝护心丹可以通过调节这些途径来发挥改善动脉粥样硬化的作用。脂肪酸合成与动脉粥样硬化之间的关系复杂多变,不饱和脂肪酸在动脉粥样硬化相关的巨噬细胞功能调节中发挥核心作用。他们不仅作为前列腺素、白三烯等生物活性分子的前体,而且作为磷脂的组成部分,调节细胞膜的流动性和细胞过程,在动脉粥样硬化中的巨噬细胞功能中也扮演重要角色[22]。TGF-β信号通路是动脉粥样硬化相关血管炎症的主要驱动因素之一,通过促进血管壁炎症和血管通透性加速动脉粥样硬化进展[23]。PI3K-蛋白激酶B(AKT)通路能够促进动脉血栓形成,抑制巨噬细胞排出,促进脂质沉积[24-26]。灵宝护心丹通过这些通路的调节可能对动脉粥样硬化的治疗具有潜在的益处。
4小结
灵宝护心丹对高脂饲料喂养的ApoE-/-小鼠模型的动脉粥样硬化具有显著改善效果,包括减少主动脉斑块的炎症细胞浸润、降低血脂水平,并增加斑块内胶原纤维含量。通过对脂肪酸代谢途径、炎症反应途径和胶原纤维形成等相关通路的调节,灵宝护心丹展现了其潜在的治疗动脉粥样硬化的可能性。这些发现为灵宝护心丹在心血管疾病治疗领域的应用提供了科学依据。
参考文献:
[1]LIU S,LI Y,ZENG X,et al.Burden of cardiovascular diseases in China,1990-2016:findings from the 2016 global burden of disease study[J].JAMA Cardiol,2019,4(4):342-352.
[2]LIBBY P.The changing landscape of atherosclerosis[J].Nature,2021,592:524-533.
[3]国家药典委员会.中华人民共和国药典-(四部)2015年版[M].北京:中国医药科技出版社,2015:1-5.
[4]华根元.新的心血管类中成药——灵宝护心丹[J].湖北医药导报,1987(1):27.
[5]MARGUERAT S,BHLER J.RNA-seq:from technology to biology[J].Cellular and Molecular Life Sciences,2010,67(4):569-579.
[6]王莹,陈冰莹,伍钰蓉,等.基于转录组学研究毛冬青三萜皂苷对脂多糖诱导小鼠肠损伤的保护作用及其机制[J].中草药,2022,53(22):7102-7111.
[7]CHEN S,ZHOU Y,CHEN Y,et al.Fastp:an ultra-fast all-in-one FASTQ preprocessor[J].Bioinformatics,2018,34(17):i884-i890.
[8]KIM D,LANGMEAD B,SALZBERG S L.HISAT:a fast spliced aligner with low memory requirements[J].Nature Methods,2015,12:357-360.
[9]ANDERS S,PYL P T,Huber W.HTSeq--a Python framework to work with high-throughput sequencing data[J].Bioinformatics,2015,31(2):166-169.
[10]LOVE M I,HUBER W,ANDERS S.Moderated estimation of fold change and dispersion for RNA-Seq data with DESeq2[J].bioRxiv,2014,10:1101/002832.
[11]The Gene Ontology Consortium.The Gene Ontology resource:20 years and still going strong[J].Nucleic Acids Res,2019,47(D1):D330-D338.
[12]KANEHISA M,ARAKI M,GOTO S,et al.KEGG for linking genomes to life and the environment[J].Nucleic Acids Res,2008,36:D480-D484.
[13]MILACIC M,BEAVERS D,CONLEY P,et al.The reactome pathway knowledgebase 2024[J].Nucleic Acids Research,2024,52(D1):D672-D678.
[14]AGRAWAL A,BALCL H,HANSPERS K,et al.WikiPathways 2024:next generation pathway database[J].Nucleic Acids Research,2024,52(D1):D679-D689.
[15]BAARDMAN J,VERBERK S G S,VAN DER VELDEN S,et al.Macrophage ATP citrate lyase deficiency stabilizes atherosclerotic plaques[J].Nat Commun,2020,11(1):6296.
[16]ZHANG M,LIU J,GAO R,et al.Interleukin-36γ aggravates macrophage foam cell formation and atherosclerosis progression in ApoE knockout mice[J].Cytokine,2021,146:155630.
[17]WANG Y,WEI J,ZHANG P,et al.Neuregulin-1,a potential therapeutic target for cardiac repair[J].Front Pharmacol,2022,13:945206.
[18]UYY E,SUICA V I,BOTEANU R M,et al.Regulated cell death joins in atherosclerotic plaque silent progression[J].Sci Rep,2022,12(1):2814.
[19]LI Y H,ZHOU M Z,LI H Q,et al.Macrophage P2Y6 receptor deletion attenuates atherosclerosis by limiting foam cell formation through phospholipase Cβ/store-operated calcium entry/calreticulin/scavenger receptor A pathways[J].European Heart Journal,2024,45(4):268-283.
[20]FENG X,ZHANG L,XU S,et al.ATP-citrate lyase(ACLY)in lipid metabolism and atherosclerosis:an updated review[J].Prog Lipid Res,2020,77:101006.
[21]MNGAUT L,JALIL A,THOMAS C,et al.Macrophage fatty acid metabolism and atherosclerosis:the rise of PUFAs[J].Atherosclerosis,2019,291:52-61.
[22]CHEN P Y,QIN L F,LI G X,et al.Endothelial TGF-β signalling drives vascular inflammation and atherosclerosis[J].Nature Metabolism,2019,1:912-926.
[23]CUI S,WU H,HE Q,et al.Fucoxanthin alleviated atherosclerosis by regulating PI3K/AKT and TLR4/NF-κB mediated pyroptosis in endothelial cells[J].Int Immunopharmacol,2023,120:110370.
[24]WANG Y,LIU X Y,WANG Y,et al.NOX2 inhibition stabilizes vulnerable plaques by enhancing macrophage efferocytosis via MertK/PI3K/AKT pathway[J].Redox Biol,2023,64:102763.
[25]LIBERALE L,PUSPITASARI Y M,MINISTRINI S,et al.JCAD promotes arterial thrombosis through PI3K/Akt modulation:a translational study[J].Eur Heart J,2023,44(20):1818-1833.
[26]JIANG L,QIAO Y,WANG Z,et al.Inhibition of microRNA-103 attenuates inflammation and endoplasmic reticulum stress in atherosclerosis through disrupting the PTEN-mediated MAPK signaling[J].J Cell Physiol,2020,235(1):380-393.
(收稿日期:2023-12-01)
(本文編辑王雅洁)
