鹿茸多肽通过SDF-1α/CXCR4轴调控PI3K/AKT信号通路促进下肢动脉硬化性闭塞症大鼠血管新生的作用机制
2024-05-25丁爱国,王雁彬,李廷荃,李子娟,王继尧,曹佳颖
丁爱国,王雁彬,李廷荃,李子娟,王继尧,曹佳颖

摘要目的:探索鹿茸多肽通過基质细胞衍生因子(SDF-1α)/趋化因子受体(CXCR4)轴对磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)通路促进下肢动脉硬化性闭塞症(PAD)大鼠血管新生的作用机制。方法:采用结扎并离断大鼠股动脉及分支造成肢体缺血、给予高脂饲料喂养制作大鼠下肢动脉硬化闭塞症模型。将100只雄性Sprague Dawley(SD)大鼠随机分为10组,分别为空白组、模型组、假手术组,鹿茸多肽低剂量组、鹿茸多中剂量肽组、鹿茸多肽高剂量组、抑制剂LY294002组、鹿茸多肽低剂量+抑制剂LY294002组、鹿茸多肽中剂量+抑制剂LY294002组、鹿茸多肽高剂量+抑制剂LY294002组。将空白组、模型组及假手术组灌胃等容量蒸馏水。鹿茸多肽低、中、高剂量组+抑制剂LY294002组先行腹腔注射再灌胃,于造模完第1天开始给药,每日1次,28 d后处死。采用流式细胞术检测给药后外周血、骨髓中造血干细胞(CD34+细胞)比例;免疫荧光法检测给药后患侧腓肠肌SDF-1α、PI3K的阳性细胞数比例。结果:造血干细胞(CD34+细胞)比例模型组均显著高于空白组(P<0.05);其中鹿茸多肽低剂量组较鹿茸多肽低剂量+抑制剂LY294002组阳性细胞比例升高,鹿茸多肽中剂量组较鹿茸多肽中剂量+抑制剂LY294002组阳性细胞比例升高,鹿茸多肽高剂量组较鹿茸多肽高剂量+抑制剂LY294002组阳性细胞比例升高(P<0.05);给药组SDF-1α、PI3K的阳性细胞数高于模型组及抑制组(P<0.05),鹿茸多肽中剂量组高于鹿茸多肽低剂量组(P<0.05),鹿茸多肽高剂量组高于鹿茸多肽高剂量组+LY294002组(P<0.05)。结论:鹿茸多肽通过SDF-1α/CXCR4轴影响PI3K/AKT信号通路促进了内皮祖细胞的增殖及分化、PAD血管新生。
关键词下肢动脉硬化性闭塞症;鹿茸多肽;内皮祖细胞;血管新生;实验研究
doi:10.12102/j.issn.1672-1349.2024.08.012
The Mechanism of Antler Polypeptide Regulating PI3K/AKT Signaling Pathway through SDF-1α/CXCR4 Axis Promotes Angiogenesis on Rats with Lower Extremity Arteriosclerotic Obliterans
DING Aiguo, WANG Yanbin, LI Tingquan, LI Zijuan, WANG Jiyao, CAO Jiaying
Shuozhou People′s Hospital, Shuozhou 036000, Shanxi,China
Corresponding AuthorWANG Yanbin, E-mail: 416210959@qq.com
AbstractObjective:To explore the effect of antler polypeptides on phosphatidylinoinosidine-3-kinase(PI3K)/protein kinase B(AKT) pathway through stromal cell derived factor(SDF-1α)/receptor(CXCR4) axis,and to promote angiogenesis on rats with lower limb arteriosclerotic obliterans(PAD).Methods:The rats model with lower extremity arteriosclerosis obliterans were established by ligation and severing of femoral artery and branches to construct limb ischemia and feeding with high fat diet.One hundred male SD rats were randomly divided into blank group,model group and sham operation group; antler polypeptide low dose group,medium dose antler polypeptide medium dose group,antler polypeptide high dose group,inhibitor LY294002 group,LY294002+antler polypeptide low dose group,LY294002+antler polypeptide medium dose group,LY294002+antler polypeptide high dose group.The blank group,model group and sham group were gavaged equal volume of distilled water.LY294002+antler polypeptide low dose group,LY294002+antler polypeptide medium dose group,LY294002+antler polypeptide high dose group were first injected intraperitoneally and then gavaged with intragastric administration,once a day after modeling,and rats,were executed after 28 days.Flow cytometry was used to detect the proportion of hematopoietic stem cells(CD34+cells) in peripheral blood and bone marrow after administration.The proportion of SDF-1α and PI3K positive cells in gastrocnemius muscle was detected by immunofluorescence assay.Results:The proportion of hematopoietic stem cells(CD34+cells) in model group was higher than that in blank group(P<0.05).The proportion of positive cells in antler polypeptide low dose group was higher than that in LY294002+antler polypeptide low dose group,the proportion of positive cells in antler polypeptide medium dose group was higher than that in LY294002+antler polypeptide medium dose group,and the proportion of positive cells in antler polypeptide high dose group was higher than that in LY294002+antler polypeptide high dose group(P<0.05).The proportion of positive cell number of SDF-1α and PI3K in administration group was significantly higher than that in model group and inhibition group(P<0.05),the antler polypeptide medium dose group was higher than that in LY294002+antler polypeptide medium dose group group,and the antler polypeptide medium dose group was higher than that in antler polypeptide low dose group group(P<0.05),antler polypeptide high dose group was higher than LY294002+antler polypeptide high dose group(P<0.05).Conclusion:Antler polypeptide affected the PI3K/AKT signaling pathway through SDF-1α/receptor(CXCR4) axis thereby promoting the proliferation and differentiation of endothelial progenitor cells,and facilitating the angiogenesis of PAD.
Keywordsarteriosclerotic obliterans of lower extremity; antler polypeptide; endothelial progenitor cells; angiogenesis; experimental study
下肢动脉硬化性闭塞症(peripheral artery disease in the lower extremity,PAD)是我国老年人的常见病、多发病[1]。研究表明,有症状的PAD是全身血管系统硬化的重要标志,在早期以肢体发凉、怕冷及间歇性跛行为主[2-3],发展到后期常出现肢体末端坏疽而面临截肢,其病理特点往往表现为动脉粥样硬化导致的动脉狭窄、闭塞、局部缺血,所以该病治疗集中在缺血部位的血管再通和血管新生方面[4]。
鹿茸能够补肾、填精、益髓,其核心成分是鹿茸多肽,探究鹿茸多肽调控内皮祖细胞(EPCs)动员、归巢及促进PAD缺血区血管新生的机制意义重大。本课题组前期动物实验已经证实,鹿茸能够改善内皮细胞,通过磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)信号通路调控EPCs的动员及归巢,促进PAD大鼠的血管新生[5-7]。鹿茸主要成分是鹿茸多肽,鹿茸多肽对成纤维细胞及表皮细胞有显著促进增殖作用,可以加速疮面的愈合,促进其血管内皮细胞增殖分化及迁移[8],对EPCs的特征和鹿茸多肽信号传导途径的充分理解更有利于研究PAD的分子生物学机制。本研究旨在分析鹿茸多肽通过基质细胞衍生因子(SDF-1α)/趋化因子受体4(CXCR4)轴对PI3K/AKT通路的影响,探讨促进PAD大鼠血管新生的作用机制。
1材料与方法
1.1实验材料
1.1.1实验动物
100只2月龄雄性Sprague Dawley(SD)大鼠,清洁级,体质量250~300 g,由山西省中医药研究院提供,实验动物合格证号:1103221911003889[9]。
1.1.2饲料制备
高脂饲料:80.3%基础饲料+15%猪油+0.5%淡黄色胆酸钠+0.2%丙硫氧嘧啶+4%胆固醇。
1.1.3药物与试剂
鹿茸多肽采用马鹿茸多肽,鹿茸多肽冻干粉购于陕西斯诺特生物科技技术有限公司,储存于室温,鹿茸多肽冻干粉溶于去离子水,配置为浓度 4.5 mg/mL的溶液,置于 EP 管中,储存在 2~6 ℃冰箱中[9];PI3K抑制剂LY294002采购于美国辉瑞公司,用非质子溶剂二甲基亚砜(DMSO)配置母液(10 mg PI3K抑制剂溶于6.507 5 mL二甲基亚砜中)在-20 ℃冰箱保存,每日所配置的当日所需工作液由10%母液+40%PEG300+5%Tween-80+45%生理盐水组成,即用即配[9];维生素针剂D3购于哈尔滨摩天农科兽药有限公司;造血干细胞CD34抗体及同型对照抗体购于BD公司;SDF-1α、PI3K购于英国 Abcam 公司。
1.1.4仪器
德国EPPENDORF移液器;电子天平购于瑞士METTER公司;中国中衫金桥有限公司微量加样吸头;法国Froilabo烘箱;日本OLYMPUS显微镜;脱水机、包埋机及冻台购于武汉俊杰电子公司;病理切片机购于上海徕卡科技公司;烤箱、微波炉及冰箱购于美的电器制造有限责任公司;流式细胞仪购于美国贝克曼库尔特公司;恒温水浴箱购于江苏太仓医用仪器厂;高速搅拌器为德国Fluko公司。
1.2實验方法
1.2.1分组
按随机数字表法将100只大鼠分为10组:空白组、模型组、假手术组、给药组(包括鹿茸多肽低剂量组、鹿茸多肽中剂量组、鹿茸多肽高剂量组、鹿茸多肽低剂量+抑制剂LY294002组、鹿茸多肽中剂量+抑制剂LY294002组、鹿茸多肽高剂量+抑制剂LY294002组)、抑制剂LY294002组,每组10只。
1.2.2PAD模型制作
将SD雄性大鼠,腹腔麻醉(5%水合氯醛溶液7 mL/kg),取平卧位,固定于手术台中央,左腹股沟区域碘消毒,纵向切口约1.5 cm,暴露血管鞘,分离其股动脉及其分支,齿镊钳夹约30 s,结扎并离断左侧股动脉的分支;用0号线缝合皮肤及皮下组织,在SD大鼠背部皮下注射生理盐水10 mL补液抗休克治疗,观察大鼠各项生命体征,平稳后放回鼠笼;肌肉注射30×104 U青霉素3 d,预防感染;饲料为高脂饲料并且喂养12周[8-9];给予维生素D3(30×104 U/kg),右下肢肌肉注射,每月1次[10]。
1.2.3给药方法
鹿茸多肽低、中、高剂量组分别灌胃给药0.143 g/(kg·d)、0.286 g/(kg·d)、0.572 g/(kg·d)。抑制剂LY294002组腹腔注射LY294002 1 mg/(kg·d);空白组、模型组和假手术组灌胃等容量蒸馏水;鹿茸多肽低中、高剂量+抑制剂LY294002组先进行腹腔注射然后再灌胃;在造模后的第1天给药,连续28 d,每日1次,28 d后处死大鼠[9]。
1.2.4采集标本及处理方法
将大鼠麻醉,用小镊子摘去其中一只眼球,收集外周血到微量离心管(EP)管中;取大鼠结扎及分离后术侧的下肢股骨,用注射器抽吸磷酸缓冲盐溶液(PBS)反复冲洗下肢股骨骨髓腔,过滤、离心及吹打后制成密度均匀的骨髓悬液,收集到EP管中,温度调至-70 ℃冻存[9]。
1.2.5检测指标
1.2.5.1一般状态
观察SD大鼠的一般状态,包括大鼠的精神状态和毛色,大鼠的皮温和活动灵敏度等。
1.2.5.2大鼠血脂水平
分别于手术后第6周、12周时测量与记录空白组和给药组大鼠体质量,用乙醇棉球擦拭固定好的大鼠尾部,将尾静脉血抽取作为标本,用生化分析仪检测空白组和给药组低密度脂蛋白(LDL)、总胆固醇(TC)、三酰甘油(TG)水平[9]。
1.2.5.3采用流式细胞术检测外周血、骨髓中CD34+细胞比例
将每只大鼠各设置5个测定管,2个单染管及同型对照管,另加1个三染测定管,在抗凝管中加入红细胞裂解液5 mL,放入37 ℃恒温水温箱中,避光孵育10 min,1 500 r/min离心5 min,弃上清,在抗凝管中加红细胞裂解液5 mL,再次放入37 ℃恒温水温箱中避光孵育10 min,1 500 r/min离心5 min,弃上清后加PBS 350 μL,将每个样品分装到5个1.5 mL的离心管中,每管给予50 μL,按CD34检测、 CD34对照及三色检测顺序标明各管,将各管中加入所对应的抗体,放入4 ℃恒温水温避光孵育20~25 min,各管加1 mL PBS缓冲液洗涤1次,再以1 500 r/min离心5 min,弃上清液,加入PBS缓冲液定容至500 μL,样本按CD34检测、CD34对照、三色检测移至流式管中备用,最后将样品重悬,按CD34检测、CD34对照、三色检测顺序上机检测,软件分析各管双阳性细胞所占比例[12]。
1.2.5.4免疫荧光技术检测下肢腓肠肌中SDF-1α、PI3K的阳性细胞数
将样本涂片后用多聚甲醛固定10 min;PBS溶液微振荡洗涤5 min×2次,加0.4%裂解缓解液Triton-X100破膜5~10 min,然后用PBS微振荡洗涤3 min×3次;再用1% PBS溶液封闭30 min至1 h;给予0.5% PBS溶液稀释一抗,比例为1∶100;4 ℃过夜;冰箱取出后需37 ℃ 复温45 min;或在室温下2~3 h;或37 ℃ 1 h,用0.5% PBS溶液稀释二抗,比例为1∶400;室温30 min至1 h;孵育后洗涤5 min×3次;荧光染料DAPI原液为1 g/mL,将其稀释为1∶1 000浓度,快速染色10 s,再用蒸馏水冲洗和用防淬灭的封片剂封片,在荧光显微镜高倍视野下观察[9]。
1.3统计学处理
应用SPSS 25.0软件进行统计分析,定量资料符合正态分布且方差齐时用独立样本t检验,以均数±标准差(x±s)表示;不符合正态分布时用秩和检验,方差不齐时用校正t检验。以P<0.05为差异有统计学意义。
2结果
2.1大鼠一般状态
空白组和假手术组大鼠毛色光泽,活动灵敏,下肢温度正常;模型组和给药组大鼠毛色暗淡,活动欠灵敏,下肢温度降低。
2.2空白组与给药组大鼠血脂水平变化
空白组的LDL、TC、TG在实验第6周与第12周比较,差异均无统计学意义(P>0.05)。给药组各时期TC及LDL与空白组比较,差异有统计学意义,LDL第12周较第6周上升(P<0.05)。详见表1。
2.3流式细胞术检测给药后外周血和骨髓中CD34+细胞比例
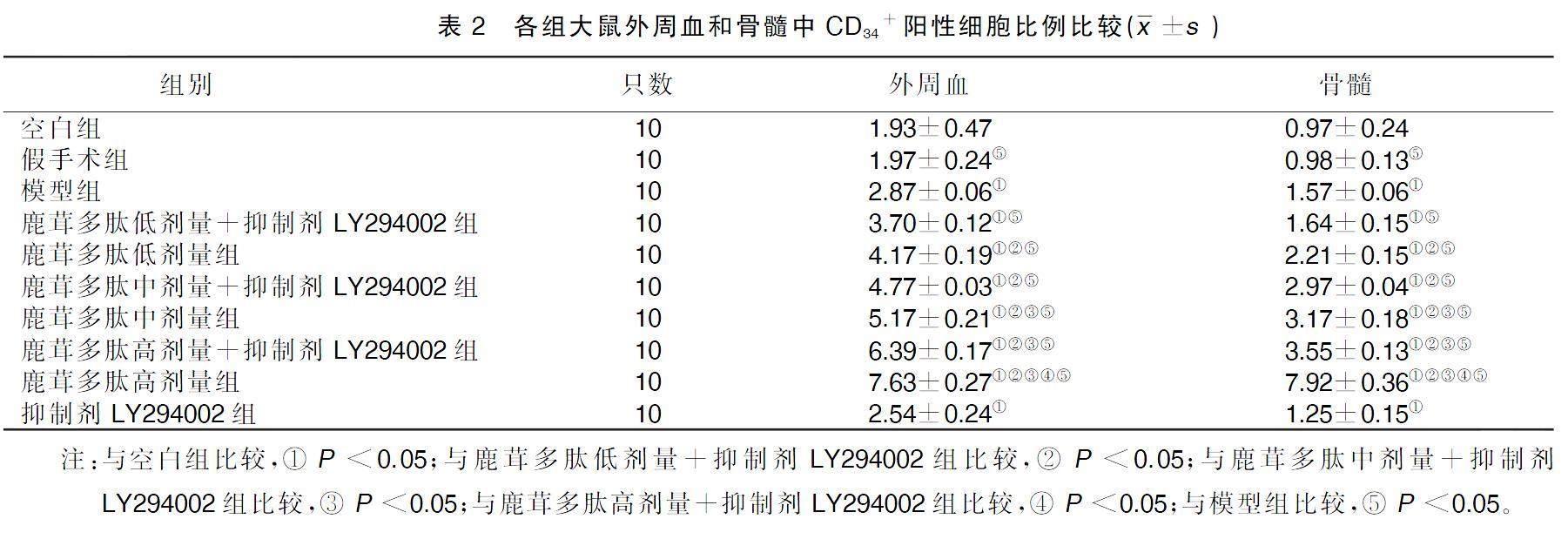
与空白组比较,模型组外周血和骨髓中CD34+阳性细胞比例升高;与鹿茸多肽低剂量+抑制剂LY294002组比较,鹿茸多肽低剂量组、鹿茸多肽中剂量组、鹿茸多肽中剂量+抑制剂LY294002组、鹿茸多肽高剂量组、鹿茸多肽高剂量+LY294002组外周血和骨髓中CD34+阳性细胞比例升高;鹿茸多肽中剂量组较鹿茸多肽中剂量+抑制剂LY294002组外周血和骨髓中CD34+阳性细胞比例升高;鹿茸多肽高剂量组、鹿茸多肽高剂量+抑制剂LY294002组较鹿茸多肽中剂量+LY294002组外周血和骨髓中CD34+阳性细胞比例升高;鹿茸多肽高剂量组较鹿茸多肽高剂量+抑制剂LY294002组外周血和骨髓中CD34+阳性细胞比例升高;与模型组比较,假手术组、给药组外周血和骨髓中CD34+阳性细胞比例升高。详见表2。
2.4免疫荧光法检测给药后腓肠肌中SDF-1α、PI3K阳性细胞数
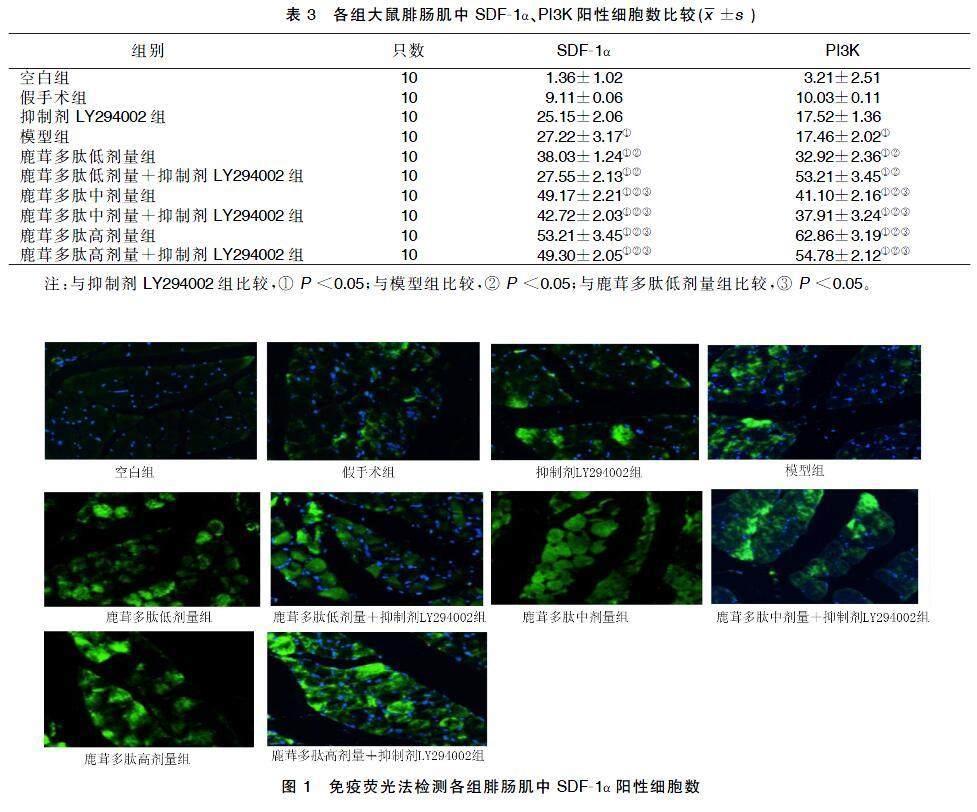
与抑制剂LY294002组比较,模型组及给药组抑制剂LY294002组SDF-1α、PI3K阳性细胞数增加(P<0.05);与模型组比较,给药组、模型组SDF-1α、PI3K阳性细胞数增加(P<0.05);与鹿茸多肽低剂量组比较,鹿茸多肽中剂量组、鹿茸多肽中剂量+抑制剂LY294002组、鹿茸多肽高剂量组、鹿茸多肽高剂量+抑制剂LY294002组较鹿茸多肽低剂量组阳SDF-1α、PI3K阳性细胞数增加(P<0.05)。详见表3及图1、图2。
3讨论
PAD的病理特点往往表现为动脉狭窄、闭塞、局部缺血,所以该病治疗集中在缺血部位的血管再通和血管新生方面[9]。外科手术和介入难以从根本上解决术后再狭窄和术后血管远期通畅率。有文献报道,在膝上股-腘动脉人工血管移植后3年的通畅率为60%~80%,膝下3年通畅率仅20%~30%,并且外科治疗在基层医疗机构推广应用困难[10]。血管新生的研究为临床治疗PAD提供了新的思路,是指通过药物促进缺血组织在原有微血管基础上形成新毛细血管与原有血管网相交汇,通过加速和增加侧支动脉发育来治疗血管狭窄、阻塞引起的缺血[11]。EPCs源于骨髓,具有调控缺血区定向归巢的作用,成熟的内皮细胞与血管新生有密切关系,直接参与血管新生。中药干预在治疗PAD方面有极大潜力。鹿茸能够补肾、填精、益髓,其核心成分是鹿茸多肽,探究鹿茸多肽调控EPCs动员、归巢及促进PAD缺血区血管新生的机制意义重大。
PAD病本在肾,病位在脉,补肾是关键。中医学将PAD归为“脉痹”“阴疽”“脱疽”范畴,其病本在肾,病位在脉。本病的发生多与肾虚血瘀有关。人到老年,随着年龄的增长,肾精渐亏,肾阳渐衰,导致气血亏虚,运行无力,脉络不通,筋脉痹阻,肢体缺乏血液的濡养,故出现发凉、麻木、间歇性跛行等。《景岳全书》:“血即精之属也”,精髓是化生血液的基本物质。清代王士雄《温热经纬》曰:“人体血生于脾,藏于肝,脉源于肾而主于心”,也就是说其资始于肾,即脉形成的物质基础是肾精,所以脉络生成受到“腎”的调控。鹿茸补肾生髓,鹿茸中含有大量的氨基酸、蛋白质、糖类化合物、多肽,其中鹿茸多肽为其主要成分[12]。鹿茸多肽含有许多细胞生长因子和内生的抗氧化酶,如血管内皮生长因子(VEGF)、谷胱甘肽过氧化物酶(GPX)和过氧化氢酶(CAT)等多种在疾病治疗中起主要作用的生物活性成分[13-15]。
SDF-1α/CXCR4軸在EPCs 归巢到缺血组织过程中起着重要作用。基质细胞衍生因子-1α(stromal cell derived factor-1,SDF-1α),属于CXC型趋化因子,参与缺血诱导的EPCs动员及介导EPCs在缺血组织中趋化和归巢[16]。CXCR4作为SDF-1α的唯一受体,是一种具有7个跨膜结构域的G蛋白偶联受体[17],研究证明,缺血组织SDF-1α表达增强,进而导致外周血SDF-1α水平升高,组织缺血同时诱导骨髓SDF-1α表达下调,骨髓对EPCs的滞留作用减弱,外周血对EPCs的趋化作用增强,从而导致骨髓源性EPCs动员到外周血,参与缺血组织新生血管的形成[18]。PI3K/AKT信号转导通路处于SDF-1α/CXCR4轴的下游,调控EPCs的迁移及归巢,抑制受体CXCR4可显著降低SDF-1α诱导的骨髓EPCs归巢到下肢缺血区域的数量[19-20]。鹿茸多肽促进外周血及骨髓EPCs缺血区血管新生。本实验通过SDF-1α/CXCR4轴调控PI3K/AKT信号通路促进EPCs的动员及归巢,促进血管新生。因此,本实验检测CD34+阳性细胞比例、SDF-1α、PI3K的阳性细胞数,结果显示CD34+细胞比例模型组高于空白组(P<0.05);其中鹿茸多肽低剂量组较鹿茸多肽低剂量+抑制剂LY294002组阳性细胞数升高,鹿茸多肽中剂量组较鹿茸多肽中剂量+抑制剂LY294002组阳性细胞数升高,鹿茸多肽高剂量组较鹿茸多肽高剂量+抑制剂LY294002组阳性细胞数升高(P<0.05);给药组SDF-1α、PI3K的阳性细胞数数高于模型组及抑制剂组(P<0.05),鹿茸多肽中剂量组高于鹿茸多肽低剂量组(P<0.05),表明大鼠下肢动脉硬化闭塞缺血激活了SDF-1α/CXCR4轴从而调控PI3K/AKT信号通路,在鹿茸多肽干预下促进了EPCs的增殖及分化,影响下肢动脉硬化闭塞症大鼠,促进PAD大鼠血管新生[9]。
综上所述,鹿茸多肽可以促进PAD大鼠血管新生,通过SDF-1α/CXCR4轴调控PI3K/AKT信号通路促进了EPCs的增殖及分化,鹿茸多肽提高外周血及骨髓CD34+细胞比例,给药后提高腓肠肌中SDF-1α、PI3K阳性细胞数比例。
参考文献:
[1]徐义岩,王海洋.下肢动脉硬化闭塞症的治疗进展[J].医学论述,2020,26(24):4892-4895.
[2]TICKNER A,KLINGHARD C,ARNOLD J F,et al.Total contact cast use in patients with peripheral arterial disease:a case series and systematic review[J].Wounds,2018,30(2):49-56.
[3]GIANNOPOULOS G,ANGELIDIS C,VOGIATZI G,et al.Antioxidant treatment in peripheral artery disease:the rationale is there,but what about clinical results?[J].Curr Opin Pharmacol,2018,39:53-59.
[4]LEE S C,JOH J H,CHANG J H,et al.Hybrid treatment of multilevel revascularization in patients with peripheral arterial disease--a multi-centre study in Korea[J].Vasa,2018,47(3):235-241.
[5]王雁彬,化金凤,张晓园,等.鹿茸对大鼠下肢缺血模型CD34+、FLK-1+阳性细胞比例影响[J].辽宁中医药大学学报,2015,17(1):24-26.
[6]化金凤,索炜,李廷荃.鹿茸对大鼠缺血下肢骨骼肌毛细血管密度的影响[J].中西医结合心脑血管病杂志,2014,12(1):80-81.
[7]化金凤,索伟,李廷荃.鹿茸对大鼠下肢缺血模型VEGF表达的影响[J].辽宁中医药大学学报,2014,16(2):34-36.
[8]李琳,叶彤,陈文凤,等.鹿茸多肽功能的研究进展[J].吉林医药学院学报,2020,41(1):54-56.
[9]李子娟,李廷荃,王雁彬,等.鹿茸通过PI3K/AKT信号通路促进下肢动脉硬化性闭塞症大鼠血管新生的作用机理[J].时珍国医国药,2021,32(9):2061-2066.
[10]MINGOLI A,SAPIENZA P,FELDHAUS R J,et al.Comparison of femorofemoral and aortofemoral bypass for aortoiliac occlusive disease[J].J Cardiovasc Surg(Torino),2001,42(3):381-387.
[11]MANUNEEDHI CHOLAN P,CARTLAND S P,KAVURMA M M.NADPH oxidases,angiogenesis,and peripheral artery disease[J].Antioxidants (Basel),2017,6(3):E56.
[12]GILBEY A,PEREZGONZALEZ J D.Health benefits of deer and elk velvet antler supplements:a systematic review of randomised controlled studies[J].N Z Med J.2012,125(1367):80-86.
[13]CHENG S L,JIAN Y L,CHEN C M,et al.Relationships between antioxidants and quality characteristics from velvet antlers of formosan sambar deer[J].Korean J Food Sci Anim Resour,2017,37(4):542-551.
[14]PITA-THOMAS W,NIETO-SAMPEDRO M,MAZA R M,et al.Factors promoting neurite outgrowth during Deer antler regeneration[J].J Neurosci Res,2010,88(14):3034-3047.
[15]XIAO X,XU S,LI L,et al.The effect of velvet antler proteins on cardiac microvascular endothelial cells challenged with ischemia-hypoxia[J].Front Pharmacol,2017,8:601.
[16]DE FALCO E,PORCELLI D,TORELLA A R,et al.SDF-1 involvement in endothelial phenotype and ischemia-induced recruitment of bone marrow progenitor cells[J].Blood,2004,104(12):3472-3482.
[17]TARASOVA N I,RICE W G,MICHEJDA C J.Inhibition of G-protein-coupled receptor function by disruption of transmembrane domain interactions[J].J Biol Chem,1999,274(49):34911-34915.
[18]WALTER D H,HAENDELER J,REINHOLD J,et al.Impaired CXCR4 signaling contributes to the reduced neovascularization capacity of endothelial progenitor cells from patients with coronary artery disease[J].Circ Res,2005,97(11):1142-1151.
[19]CHAVAKIS E,CARMONA G,URBICH C,et al.Phosphatidylinositol-3-kinase-gamma is integral to homing functions of progenitor cells[J].Circ Res.2008,102(8):942-949.
[20]ZHENG H,FU G,DAI T,et al.Migration of endothelial progenitor cells mediated by stromal cell-derived factor-1αlpha/CXCR4 via PI3K/Akt/eNOS signal transduction pathway[J].J Cardiovasc Pharmacol,2007,50(3):274-280.
(收稿日期:2023-11-27)
(本文編辑王雅洁)
