伴和不伴快速眼动睡眠行为障碍帕金森病患者自发脑活动的静息态功能磁共振成像研究
2024-05-20辛子悦周祺宸祁亚鹏王一涵刘建仁张凯华陈伟杜小霞
辛子悦,周祺宸,祁亚鹏,王一涵,刘建仁,张凯华,陈伟*,杜小霞*
作者单位 1.上海体育大学心理学院,运动与脑研究中心,上海 200438;2.上海交通大学医学院附属第九人民医院神经内科,上海 200011;3.山东师范大学心理学院,济南 250014
0 引言
帕金森病(Parkinson's disease, PD)主要的病理特征为大脑黑质多巴胺能神经元的变性坏死,是一种临床常见的神经退行性疾病,在60 岁以上的人群中患病率约为1.37%[1];具有异质性大、治疗难度高等[2-3]特点,给患者家庭及社会带来极大的负担。快速眼动睡眠行为障碍(rapid eye movement sleep behavior disorder, RBD)指发生在快速眼动期的异态睡眠,主要的病理特征为骨骼肌失迟缓并伴有异常梦境行为演绎[4]。PD 常合并睡眠障碍,其中以RBD较为常见,发病率约为30%~60%,且随着病程发展升高[5-6]。特发性的RBD被认为是α-突触核蛋白病变的前驱阶段,并且罹患帕金森病、帕金森痴呆、路易体痴呆或多系统萎缩等α-突触核蛋白病的风险极高[7-8]。PD 伴RBD(PD-RBD)患者表现出更严重的运动症状和非运动症状以及更严重的自主神经功能障碍,病程发展更快,预后效果更差,被认为是一种更严重的PD 亚型[9]。然而有关PD-RBD 发生发展的病理生理机制尚不清楚,需要进一步探究。
静息态功能MRI(resting-state functional MRI,rs-fMRI)不依赖既定任务,是一种无创无辐射的脑影像技术,能够分析大脑静息状态下脑功能变化,被广泛应用于探索中枢神经系统疾病发病机制的研究。静息态指标度中心度(degree centrality, DC)通过计算单个体素和全脑其他体素之间功能连接的数量,量化该体素在全脑网络中的中心性或功能重要性,可以识别全脑功能网络中的重要节点。低频振幅(amplitudes of low-frequency fluctuation, ALFF)的变化被认为和局部神经元的活动有关,可以有效检测局部脑区自发低频振荡的波动,评估局部神经元自发活动幅度改变。目前基于DC 和ALFF 方法对PD-RBD亚型的自发性神经活动的研究非常有限。LI等[10]发现相比PD 不伴RBD(PD-nonRBD)患者,PD-RBD 患者在初级运动皮层延伸至运动前皮层的ALFF值明显下降。JIANG等[11]发现相比PD-nonRBD,PD-RBD患者额叶皮层的局部一致性(regional homogeneity,ReHo)值更高。与PD-nonRBD 患者相比,PD-RBD患者表现为左小脑、右枕中区和左颞中区的区域均匀性显著增加,而在左额中区的区域均匀性显著降低[12]。LI 等[13]发现PD-RBD 比PD-nonRBD 患者的静息态脑网络表现出更广泛的节点特性变化,以及双侧丘脑和左侧脑岛的中心性作用增强,并伴随右侧额叶上回背外侧的病理性改变。与PD-nonRBD 患者相比,PD-RBD 患者在默认网络、执行网络和突显网络内表现出网络内异常的功能连接[14]。
目前研究提示PD-RBD和PD-nonRBD可能存在不同功能活动特征[10-15],表现为局部脑区的ReHo 和ALLF 值存在显著差异[10-13],以及特定功能网络内的连接不同[14]。至今为止PD-RBD 的静息态脑功能成像研究还十分有限,如DC 分析以及结合多个静息态指标的研究较少,PD-RBD 和PD-nonRBD 患者以及健康对照(healthy controls, HC)组系统的对比研究还较为缺乏,因此PD-RBD 患者的静息态脑功能活动特征有待深入探究;此外静息态指标的变化和临床症状和评分的相关性需要进一步解析。ALLF 反映局部自发功能活动强度,而DC 反映局部体素在全脑网络的地位和作用,ALFF 和DC 可以从不同的侧面点面结合研究静息脑功能活动特征。本研究采用了rs-fMRI 的DC 和ALFF 指标探究PD-RBD 相对PD-nonRBD 患者和HC 静息状态下脑功能活动特征,进一步明确DC 和ALFF 指标的变化和临床症状及评分的相关性。
1 材料与方法
1.1 研究对象
纳入2017 年11 月至2021 年7 月由上海第九人民医院神经内科诊断为PD 的患者共60 例(男32 例,女28 例),被试为随机招募,患者自愿参与研究。PD患者纳入标准:(1)均符合MDS 统一帕金森病评定量表(MDS Unified Parkinson Disease Rating Scale,MDS-UPDRS);(2)均为右利手,母语为汉语;(3)均能配合完成神经心理学评估。排除标准:(1)存在MRI扫描禁忌证;(2) 伴随痴呆、偏头痛、中风等其他神经系统疾病。符合纳排标准的PD 患者根据快速眼动睡眠行为障碍筛查问卷(RBD 问卷)评分被分为两个亚组:伴有RBD 的PD 患者20 例(PD-RBD 组);无RBD 的PD 患者40 例(PD-nonRBD 组)。其中RBD 问卷评分≥6 分被视为PD-RBD 患者[16]。分别采用Hoehn-Yahr(H-Y)分期和统一帕金森病评估量表第三部分(Unified Parkinson Disease Rating Scale-Ⅲ,UPDRS-Ⅲ)评分评估患者的病情分级和运动功能,记录UPDRS 中第13、14、15、29 和30 项为姿势步态异常评分,并应用冻结步态问卷(Freezing of Gait Questionnaire, FOGQ)评估患者的步态冻结症状;通过帕金森病非运动症状量表(Non-Motor Symptoms questionnaire, NMSquest)、自主神经功能障碍量表(the Scales for Outcomes in Parkinson's Disease-Autonomic,SCOPA-AUT)、简易精神状态评估量表(Mini Mental State Examination, MMSE)评估患者的非运动症状、自主神经功能和认知功能[17]。
同期纳入了44 例年龄性别匹配的HC(男20 例,女24 例)。纳入标准:(1)均为右利手,母语为汉语;(2)认知功能正常,无焦虑抑郁。排除标准:(1)痴呆、偏头痛、中风等其他神经系统疾病;(2)患有慢性疾病。本研究遵守《赫尔辛基宣言》,已获得上海体育大学(批准文号:202772023RT097)和上海交通大学医学院附属第九人民医院(批准文号:2016-44-T1)伦理委员会批准,所有被试或其家属均已签署知情同意书。
1.2 研究方法
1.2.1 MRI扫描
所有数据采集在华东师范大学上海市磁共振重点实验室完成,扫描使用德国西门子Prisma 3.0 T 磁共振扫描仪和64通道头颈联合线圈。数据采集工作中要求被试保持静躺不动,并采用海绵垫固定头部,从而尽可能减小被试头部运动对数据质量的影响。所有被试在磁共振扫描之前48小时停止服用药物或酒精,所有被试均接受了rs-fMRI 扫描和高分辨 T1加权结构像扫描。静息态数据采集过程中,要求被试闭眼并保持静止且保持清醒。静息态扫描采用的是T2*加权的平面回波成像序列:TR 2000 ms,TE 30 ms,FA 90°,层数33 层,FOV 220 mm×220 mm,矩阵64×64,层厚3.5 mm, 240 帧。高分辨T1 加权结构像采用3D-T1加权预磁化快速梯度回波序列:TR 2530 ms,TE 2.98 ms,TI 1100 ms,FA 7°,FOV 256 mm×256 mm,矩阵256×256,矢状位共192 层,层厚1 mm,层间距50%。
1.2.2 MR数据处理
预处理基于Matlab R2013b 平台,使用DPABI 软件集成包进行图像数据预处理。格式转换后,考虑到被试的不适应性和序列扫描开始阶段的不稳定性,去除前10个时间点。随后进行时间层校正,并通过刚体变换进行头部运动校正,排除所有头部运动超过2.5 mm 或2.5°的被试。通过DARTEL 配准法将个体T1 加权结构像与静息态功能像配准,实现至蒙特利尔(Montreal Neurological Institute, MNI)空间的标准转换,并重采样至3 mm×3 mm×3 mm。通过一般线性模型回归协变量,包括Friston 24 头部运动参数、白质和脑脊液信号。
对预处理后的数据进一步计算DC 指标值。先去除时间序列的线性趋势,然后进行带通滤波处理,计算全脑任意体素间的皮尔森相关系数,建立全脑功能连接矩阵,设置相关系数阈值为0.25,获得无方向性二值矩阵,计算各体素的DC 值,进行标准化得到zDC。此时,对全脑指标值进行空间平滑,高斯平滑核选用6 mm。对数据进一步计算ALFF 指标值。先进行空间平滑,选用半峰全宽高斯核6 mm×6 mm×6 mm。然后去除时间序列的线性趋势,并设置频率范围为0.01~0.10 Hz,通过傅立叶变换将滤波后的数据转换到频域,并计算低频波动的功率。最后须对得到的ALFF值进行标准化处理以排除个体差异,即将每个体素的指标值与全脑指标值的均值之差及全脑指标值的标准偏差相比,得到比值zALFF。
脑功能数据采用方差分析对三组指标值进行统计分析,然后采用双样本t检验进行两两比较,年龄、性别作为协变量。体素水平P<0.001,簇水平经过错误发现率(false discovery rate, FDR)多重比较校正P<0.05,且体素数>50,则认为差异具有统计学意义。
使用 DPABI 对组间差异脑区的zDC 值、zALFF值进行提值处理,并利用 SPSS 软件将提取到的平均值分别与患者的认知评分(MMSE 评分)、运动功能评分(UPDRS-Ⅲ评分)、自主神经功能障碍量表(SCOPA-AUT 评分)等进行皮尔森相关分析。最后,对相关分析结果进行多重比较校正(FDRP<0.05)。
1.3 统计学分析
对于人口学和临床资料使用 SPSS 22 进行统计分析,三组间年龄采用方差分析,三组间性别采用卡方分析。由于PD-RBD 组和PD-nonRBD 组患者人数≤50,对两组间病程、H-Y 分期水平、UPDRS-Ⅲ评分进行Shapiro-Wilk 正态性检验。满足正态性分布时进行皮尔森相关分析;不满足正态性分布时进行Mann-Whitney 分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 人口学和临床资料
PD-RBD、PD-nonRBD 及HC 三组的人口学和临床资料见表1。三组间性别、年龄和受教育年限上差异无统计学意义。PD-RBD 组和PD-nonRBD 组在H-Y 分期、UPDRS-Ⅲ评分、FOGQ 评分、MMSE 评分上差异无统计学意义;两组PD 患者在病程(P=0.047)、PIGD评分(P=0.051)和SCOPA-泌尿评分(P=0.054)上存在边缘显著性差异;两组PD 患者在NMSquest 评分、SCOPA-AUT 评分和SCOPA-消化评分上差异有统计学意义(P<0.05)。临床资料显示PD-RBD 组和PD-nonRBD 组在临床症状上存在一定的差异,特别是非运动症状和自主神经功能上。

表1 受试者人口学和主要临床资料Tab.1 Demographic and clinical characteristics of subjects
2.2 rs-fMRI结果
2.2.1 DC分析
三组间方差分析结果表明,主效应脑区为右侧中央前回(延伸至左侧中央旁小叶、右侧内侧额回、左侧中央后回和右侧扣带回)、右侧颞上回(延伸至右侧边缘上回)、左侧颞上回、左侧小脑CrusⅡ、右侧额中回、右侧小脑CrusⅡ(延伸至右侧小脑CrusⅠ)、左侧额中回(表2,图1)。
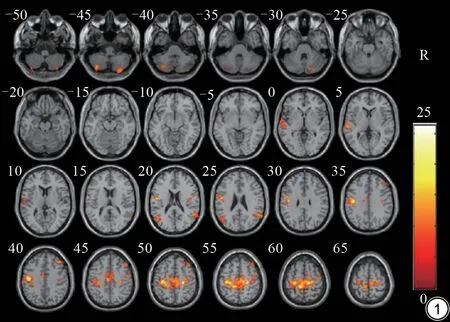
图1 PD-RBD、PD-nonRBD 及HC 三组间DC 值差异具有统计学意义脑区。PD-RBD:伴快速眼动睡眠障碍帕金森病;PD-nonRBD:无睡眠障碍帕金森病;HC:健康对照;DC:度中心度;R:右侧。Fig.1 Brain regions with statistically significant differences of DC values among the three groups.PD-RBD: Parkinson's disease with rapid eye movement sleep behavior disorder; PD-nonRBD: Parkinson's disease without rapid eye movement sleep behavior disorder; HC: healthy control;DC: degree centrality; R: right.

表2 PD-RBD、PD-nonRBD及HC三组间DC值差异具有统计学意义的脑区Tab.2 Brain regions with statistically significant differences of DC values among the three groups
相比于HC 组,PD-RBD 组左侧额上回、左侧小脑CrusⅡ(延伸至左侧小脑CrusⅠ)、右侧颞上回(延伸至右侧边缘上回、右侧颞中回、右侧角回)、左侧颞中回(延伸至左侧颞上回、左侧角回)、右侧额中回(延伸至右侧额上回)、右侧小脑CrusⅡ(延伸至右侧小脑CrusⅠ)、左侧额中回的DC 值显著升高,而左侧中央前回(延伸至左侧中央旁小叶、右侧内侧额回、左侧中央后回、左侧扣带回)、左侧颞上回、左侧颞中回的DC值显著降低(表3,图2A)。

图2 三组间两两比较DC 值差异具有统计学意义的脑区。2A:PD-RBD vs.HC;2B:PD-nonRBD vs.HC;2C:PD-RBD vs.PD-nonRBD。红色表示升高,蓝色表示降低。PD-RBD:伴快速眼动睡眠障碍帕金森病;PD-nonRBD:无睡眠障碍帕金森病;HC:健康对照;DC:度中心度;R:右侧。Fig.2 Pairwise compared brain regions with statistically significant differences of DC values between the three groups.2A: PD-RBD vs.HC; 2B: PD-nonRBD vs.HC; 2C: PD-RBD vs.PD-nonRBD.Red indicates increase, and blue indicates decrease.PD-RBD: Parkinson's disease with rapid eye movement sleep behavior disorder; PD-nonRBD: Parkinson's disease without rapid eye movement sleep behavior disorder; HC: healthy control; DC: degree centrality; R: right.

表3 PD-RBD、PD-nonRBD及HC两组间DC值差异具有统计学意义脑区Tab.3 Brain regions with statistically significant differences of DC values within-group in PD-RBD,PD-nonRBD, and HC
相比于HC 组,PD-nonRBD 组右侧小脑CrusⅡ的DC 值显著升高,而右侧中央前回(延伸至左侧中央旁小叶、左侧中央后回、右侧扣带回)、左侧颞上回的DC值显著降低(表3,图2B)。
相比于PD-nonRBD 组,PD-RBD 组右侧额中回的DC 值显著升高,而左侧楔前叶(延伸至左侧顶上小叶)的DC值显著降低(表3,图2C)。
2.2.2 ALFF分析
三组间方差分析结果表明,主效应脑区为左侧海马旁回、左侧楔叶、左侧舌回、右侧舌回、右侧楔叶(表4,图3)。

图3 PD-RBD、PD-nonRBD 及HC 三组间ALFF 值差异具有统计学意义脑区。PD-RBD:伴快速眼动睡眠障碍帕金森病;PD-nonRBD:无睡眠障碍帕金森病;HC:健康对照;ALFF:低频振幅;R:右侧。Fig.3 Brain regions with statistically significant differences of ALFF values among PD-RBD, PD-nonRBD and HC groups.PD-RBD:Parkinson's disease with rapid eye movement sleep behavior disorder;PD-nonRBD: Parkinson's disease without rapid eye movement sleep behavior disorder; HC: healthy control; ALFF: amplitudes of low-frequency fluctuation; R: right.

表4 PD-RBD、PD-nonRBD及HC三组间ALFF值差异具有统计学意义的脑区Tab.4 Brain regions with statistically significant differences of ALFF values among the three groups
相比于HC 组,PD-RBD 组在右侧楔叶(延伸至左侧舌回)的ALFF 值显著降低。相比于HC 组,PD-nonRBD 组在左侧舌回的ALFF 值显著降低(表5,图4)。PD-RBD 组和PD-nonRBD 组之间ALFF 值比较未发现显著差异。

图4 三组间两两比较ALFF 值差异具有统计学意义的脑区。4A:PD-RBD vs.HC;4B:PD-nonRBD vs.HC。红色表示升高,蓝色表示降低。PD-RBD:伴快速眼动睡眠障碍帕金森病;PD-nonRBD:无睡眠障碍帕金森病;HC:健康对照;ALFF:低频振幅;R:右侧。Fig.4 Pairwise compared brain regions with statistically significant differences of ALFF values between the three groups.4A: PD-RBD vs.HC; 4B: PD-nonRBD vs.HC.Red indicates increase, and blue indicates decrease.PD-RBD: Parkinson's disease with rapid eye movement sleep behavior disorder; PD-nonRBD: Parkinson's disease without rapid eye movement sleep behavior disorder; HC: healthy control; ALFF:amplitudes of low-frequency fluctuation; R: right.

表5 PD-RBD、PD-nonRBD及HC两组间ALFF值差异具有统计学意义脑区Tab.5 Brain regions with statistically significant differences of ALFF values within-group in PD-RBD,PD-nonRBD, and HC
2.3 相关性分析
相关性分析显示在PD-RBD组中,左侧额上回的DC值与姿势异常步态障碍评分呈正相关(r=0.788,P=0.008);左侧额中回的DC 值与MMSE 评分呈负相关(r=-0.553,P=0.044)、与姿势异常步态障碍评分呈正相关(r=0.642,P=0.044);右侧颞上回延伸至右侧边缘上回、右侧颞中回、右侧角回的DC值与SCOPA-AUT评分呈负相关(r=-0.697,P=0.016),见表6。

表6 PD-RBD组差异具有统计学意义的脑区与行为学评分的相关性Tab.6 Correlation between brain regions and behavioral scores in PD-RBD
而在PD-nonRBD 组中,左侧颞上回的DC 值与MMSE 评分呈正相关(r=0.418,P=0.037);但与UPDRS-Ⅲ评分呈负相关(r=-0.396,P=0.037)、与FOGQ评分呈负相关(r=-0.390,P=0.037);与SCOPA-AUT 评分呈负相关(r=-0.372,P=0.037)。右侧额中回DC值与SCOPA-AUT评分呈正相关(r=0.330,P=0.027)、与SCOPA-消化系统评分呈正相关(r=0.461,P=0.008)、与姿势异常步态障碍评分呈正相关(r=0.395,P=0.027),见表7。
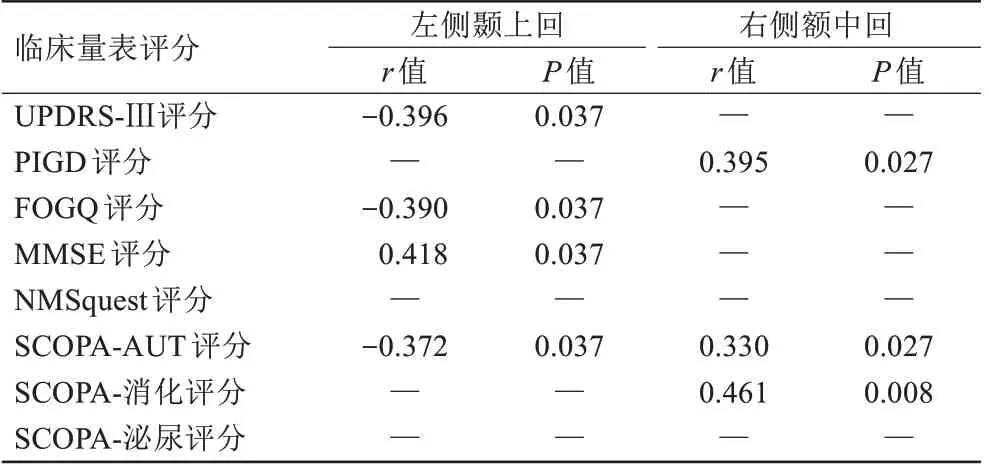
表7 PD-nonRBD组差异具有统计学意义脑区与行为学评分的相关性Tab.7 Correlation between brain regions and behavioral scores in PD-nonRBD
未发现组间ALFF 值有差异的脑区与临床评分之间有统计学意义上的相关性。
3 讨论
本文对比分析PD-RBD、PD-nonRBD 和HC 三组间DC、ALFF 值,探索PD 伴RBD 患者脑功能活动特征及RBD 特异性脑区,试图进一步解释RBD 发生的病理生理学机制。方差分析结果显示三组间DC 值主效应脑区为右侧中央前回、颞上回、小脑、额中回;ALFF 值主效应脑区为左侧海马旁回、楔叶、舌回。本研究结果证实PD-RBD、PD-nonRBD 和HC 三组其静息态脑功能活动确实存在显著的差异,临床评分也存在差异,提示PD-RBD 和PD-nonRBD 是不同亚型,其影像和病理不同[10-15]。
3.1 PD-RBD与PD-nonRBD亚型间脑功能差异
通过双样本分析发现,相比于PD-nonRBD 组,PD-RBD组在右侧额中回的DC值显著升高。JIANG等[11]发现PD-RBD组的右侧额上回、右侧额中回、左侧内侧额上回的ReHo 值比PD-nRBD组更高,这与本研究结果一致。额叶属于运动皮层,参与随意运动的控制,一些研究提示额叶区域功能和结构改变可能与快速眼动睡眠期间发起的异常运动行为相关[18-19]。本研究结果中PD-RBD组在右侧额中回的过度激活可能与快速眼动睡眠期感觉运动皮层兴奋后产生了异常梦境行为相关。此外本研究还发现,PD-RBD组在左侧楔前叶及左侧顶上小叶的DC值显著降低。楔前叶位于枕叶上部,作为默认模式网络的一部分,大量研究证明其涉及视觉空间信息的注意和获取过程,并参与视觉空间信息整合以及执行功能[20-21]。默认模式网络更易受到疾病的影响,楔前叶的功能改变或许提示两种亚型的存在[22]。一项关于特发性RBD的研究中显示,楔前叶的灰质体积减小与视觉辨别能力的下降有关,并伴有明显的认知老化趋势[23]。本研究结果中PD-RBD组在左侧楔前叶的激活降低,与前人结果一致[24],提示PD-RBD组可能出现更严重的非运动症状,尤其是视觉空间执行功能障碍和认知障碍。前人研究发现脑干结构能够区分PD-nonRBD与PD-RBD[15],本研究并未发现脑干DC、ALFF异常,其原因可能是fMRI技术的限制,脑干位处脑部深处,体积较小,周围有空隙和大血管经过,存在fMRI分辨率不足,生理噪声影响以及图像形变等技术问题。
3.2 PD-RBD表现出更广泛的功能异常
通过双样本分析发现,相比于HC组,PD-nonRBD组在右侧小脑CrusⅡ的DC 值显著升高;在右侧中央前回、左侧颞上回的DC 值显著降低;在左侧舌回的ALFF 值显著降低。小脑参与运动控制,并与大脑皮层存在广泛的结构与功能连接。前人研究中多已报道小脑参与PD 的病理生理机制,并与其运动和非运动症状相关[25-27]。不同模式的小脑-皮质回路影响PD的疾病进展[28]。本研究中小脑局部的过度激活可能提示PD-nonRBD 组的小脑发挥了代偿作用。初级运动皮层的异常功能活动或会导致运动障碍[29],PD-nonRBD 组在感觉运动网络的DC 值显著降低可能与其功能受损相关,提示其运动症状的发生。
相比于HC 组,PD-RBD 组在左侧额上回、小脑CrusⅡ、右侧颞上回、左侧颞中回、额中回的DC 值显著升高。而在左侧中央前回、左侧颞上回、左侧颞中回的DC 值显著降低。相比于HC 组,PD-RBD 组在右侧楔叶及左侧舌回的ALFF 值显著降低。本研究结果中PD-RBD 组额叶的自发性活动异常可能与非运动症状,尤其是认知和情绪障碍有关。有研究发现,额叶或为PD 认知受损及焦虑、抑郁的生理标志物[30-31]。枕叶作为视觉中枢,PD-RBD 组枕叶的激活异常可能与PD 患者视觉处理功能异常相关[32],包括视觉记忆、视觉空间和视觉感知的功能受损;或许与快速眼动睡眠期梦境中生动的视觉图像有关[33]。同时一项研究结果显示,PD-RBD组患者的枕叶和颞叶的ReHo 值显著增高,提出枕颞叶同步的异常活动模式可能反映了脑部不稳定的状态,并会加剧RBD 的发作;同时,PD-RBD 组患者小脑与枕颞叶的功能连接增强,进一步提示小脑-视觉-运动网络异常活动可能对PD合并RBD的产生具有重要意义[12]。PD-RBD组额颞区、感觉运动系统、边缘系统和小脑的脑功能改变或许与快速眼动睡眠期间的梦境体验及异常发起的运动行为相关,可能伴随更严重的运动、认知和视觉空间功能障碍[34]。与前人结果一致,在PD-RBD组中出现更广泛的皮质及皮质下结构和功能异常[35]以及更严重的运动和非运动症状[36]。
3.3 局部脑功能变化与临床评分的相关性分析
本研究结果显示PD 相关运动症状,尤其是姿势步态异常症状与左侧颞上回、左侧额上回、额中回的自发性活动有较强的相关性。前人研究提示PD 合并RBD 患者更易出现失平衡、步态冻结等运动症状[37],可能是快速眼动睡眠期肌肉张力紊乱的发生和程度与姿势步态障碍有关[38]。而且特发性RBD 患者在诊断为PD前就会出现步态和姿势障碍[39]。提示快速眼动睡眠期间肌肉张力调节的病理生理过程可能与控制姿势和运动的结构和通路相关。相关分析提示左侧额中回和左侧颞上回与MMSE 评分相关,提示PD 合并RBD 患者更易出现认知能力下降。SCOPA-AUT 用于评估自主神经功能障碍和损害,其中消化系统评分评估患者的消化系统损伤情况,相关分析结果提示自主神经功能受损可能与双侧颞上回和右侧额中回的功能有关。前人研究结果证实,在PD-RBD 患者中更可能伴随严重的自主神经功能障碍[40-41]。PD-RBD患者中更易出现严重的运动和非运动症状,或许是一种预后更差、进展更迅速、功能恶化更明显的亚型标志[42-43]。
3.4 本研究的局限性
本研究存在一定局限性。首先,RBD 的明确诊断需要通过多导睡眠图进行专业评估,本研究通过RBD 问卷评分对PD 患者进行分组,尽管RBD 问卷在识别RBD 时具有高敏感性、可靠性和特异性[44],但并未通过多导睡眠图确诊,在一定程度上缺少诊断的准确性。此外PD 患者间存在较大异质性,本研究为横断面研究,并未记录动态发展变化,需要补全纵向研究,并结合药物治疗状况进行跟踪研究。且由于PD伴随RBD患者往往病程更长,因此亚型间病程不完全匹配,研究中将病程作为协变量减少其影响。此外,本研究如果能够补充RBD 患者(即有RBD 无PD 症状的患者),可能有助于解析PD 患者RBD 的病理机制,这是未来研究可以继续探索的方向。
4 结论
综上所述,本研究通过 rs-fMRI 的 DC 和ALFF研究结果发现PD-nonRBD 组和PD-RBD 组分别与HC 组相比,PD-RBD 组表现出更广泛的皮质及皮质下功能异常,而PD-nonRBD 组与PD-RBD 组相比仅表现出右侧额中回的DC 值显著升高;左侧楔前叶及左侧顶上小叶的DC值显著降低。相关分析进一步提示右侧额中回、左侧楔前叶的自发性脑活动异常与快速眼动睡眠期异常运动及更严重的非运动症状有关,与PD 患者RBD 的发生有重要联系。总之这些异常脑区的DC值可能是RBD的影像学指标之一,对鉴别PD-nonRBD与PD-RBD具有重要的参考价值。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:杜小霞设计本研究的方案并实施,参与数据的分析与解释,对稿件重要内容进行了修改,并提供研究经费支持;陈伟设计本研究的方案,参与数据的获取、分析与解释,对稿件重要内容进行了修改,并获得上海市康复医学会健康管理科研基金课题面上项目和上海交通大学医学院附属第九人民医院学科特色生物样本库项目的资助;辛子悦起草和撰写稿件,获取、分析和解释本研究的数据;周祺宸、祁亚鹏、王一涵、刘建仁、张凯华获取、分析或解释本研究的文献/数据,对稿件重要内容进行了修改,其中张凯华获得了国家自然科学基金项目的资助;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。
