一例鹌鹑大肠杆菌病的诊治
2024-05-20刘风波冯晓东连亮亮
刘风波 冯晓东 连亮亮
摘 要:文章对鹌鹑疑似大肠杆菌病进行实验室确诊,通过药敏试验筛选敏感药物,并结合综合防制措施以预防鹌鹑大肠杆菌病。
关键词:鹌鹑大肠杆菌病;实验室确诊;药敏试验
中图分类号:S854.5+3 文献标志码:A 文章编号:1001-0769(2024)02-0068-03
鹌鹑大肠杆菌病是由埃希大肠杆菌(Escherichi coli)感染鹌鹑引起的一种常见病。该病一年四季均可发生,可感染各年龄段鹌鹑,一般6月龄后的鹌鹑发病率较高,虽不会引起大群暴发性死亡,但对产蛋率及蛋品质影响很大,加之反复发作,往往会带来巨大经济损失[1]。大肠杆菌广泛分布于自然界中,畜禽都易感染。该病主要通过消化道感染鹌鹑,发生的主要原因是饲养密度过大,笼舍消毒不彻底,卫生条件差。饲养管理不善,饲养环境长期潮湿不洁,气温突变,过度炎热及疫苗接种造成的应激反应,都能诱发该病和加重病情;某些疾病,如新城疫、呼吸道病,常并发或继发感染。
1 材料和方法
1.1 病例来源
本地养殖户饲养的2月龄鹌鹑发病,送检时已死亡。问诊得知鹌鹑拉白色稀粪,产蛋率下降,产软壳蛋、破壳蛋增多,户主曾滴鼻点眼接种新城疫疫苗,并在饮水中添加环丙沙星进行控制,不见好转。
临床上,发病鹌鹑消瘦,上下眼睑肿胀,两腿前后伸张,肛门周围绒毛污秽不堪。剖检发现,尸体眼前房积脓;肝肿胀,呈暗红色;肝脏、心脏表面均有一层灰白色纤维素性薄膜覆盖;胆囊肿大,胆汁充盈;小肠胀气,黏膜增厚;肺肠充血出血;输卵管肿胀;卵巢变形。
1.2 主要试剂
麦康凯琼脂,普通营养琼脂,伊红美蓝琼脂,三糖铁琼脂,甲基红试剂,葡萄糖蛋白胨水培养基,营养肉汤,革兰染液。药敏片包括阿莫西林(amoxicillin,AMX)、氨苄西林(ampicillin,SU)、头孢噻肟(ceftizoxime,CTX)、头孢他啶(ceftazidime,CED)、头孢曲松钠(ceftriaxone sodium,CFX)、卡那霉素(kanamycin,K)、庆大霉素(gentamicin,GM)、氟苯尼考(florfenicol,FF)、泰乐菌素(tylosin,TL)、硫酸红霉素(erythromycin sulfate,E)、利福平(rifampicin,RA)、氧氟沙星(ofloxacin,OFL)、诺氟沙星(norfloxacin,NOR)、环丙沙星(ciprofloxacin,CIP)、恩诺沙星(enophthalmin,ENR),均为自制[1],密封低温保存备用。
1.3 细菌的分离培养
无菌条件下,取发病鹌鹑的肝、心脏切片样本,分别划线接种于普通琼脂平板、麦康凯琼脂平板、伊红美蓝琼脂平板及营养肉汤,于37 ℃培养24 h后观察结果。
1.4 涂片染色镜检
挑取普通琼脂平板上可疑菌落涂布于载玻片上,革兰染色,在油镜下观察菌落形态。
1.5 生化试验[2]
1.5.1 糖类分解试验
挑取普通琼脂平板上可疑菌落,随后接种于各种糖培养基上,在37 ℃恒温箱中培养24 h,观察结果。
1.5.2 硫化氢试验
挑取普通琼脂平板上可疑菌落,接种于营养肉汤中,置于37 ℃恒温箱培養6~8 h。用无菌接种针蘸取纯培养物,沿管壁作穿刺三糖铁培养基,37 ℃下培养24 h,随后观察培养基颜色变化。
1.5.3 甲基红试验
取1.5.2培养的肉汤培养物,接种于葡萄糖蛋白胨水培养基中,在37 ℃恒温箱中培养24 h,取出后加甲基红试剂3滴,观察培养基颜色变化。
1.5.4 运动力检查
灭菌接种针蘸取1.5.2培养的肉汤培养物,垂直刺进半固体培养基的琼脂柱中间直至管底,置37 ℃恒温箱中培养18 h,而后取出检查。
1.6 动物试验
选取体重18~20 g小白鼠4只做动物试验。挑取普通琼脂平板上的单个菌落接种于营养肉汤中,置于37 ℃恒温箱中培养6~8 h,取1 mL菌液,用生理盐水10倍稀释,每只小鼠腹腔接种0.2 mL稀释的菌液,饲养观察结果。
1.7 药敏试验
采用纸片琼脂扩散法(Baner-Kirby建立的K-B法)[3]进行药敏试验。
2 试验结果
2.1 细菌培养特性
普通琼脂平板上长出形态凸起、光滑湿润、灰白色、半透明、边缘整齐、有特殊的粪便样臭味的大菌落。麦康凯琼脂平板上长出粉红色大菌落,稍凸起,表面光滑湿润,菌落边缘波状。伊红美蓝琼脂平板上为圆形蓝紫色菌落,中心为紫黑色带金属光泽。肉汤呈均匀浑浊,管底有黏液样沉淀物。
2.2 染色镜检结果
油镜下观察到单个散在的两端钝圆的革兰阴性短杆菌。
2.3 生化培养
2.3.1 分离菌发酵特点
分离菌能发酵葡萄糖、麦芽糖、乳糖、木糖、甘露醇,产酸产气,产生靛基质,不发酵蔗糖。
2.3.2 培养基变化
培养基颜色无变化,未产生硫化氢。
2.3.3 培养液变化
培养液为黄色,甲基红试验为阴性。
2.3.4 运动力观察
检查见由穿刺线向四周扩散生长,周围的培养基变浑浊,该菌具有运动力。
2.4 动物试验
小鼠接种菌液后,在18 h内全部死亡。取死亡小鼠心脏和肝脏切片样本、腹水样本,制成抹片,革兰染色镜检,并将样本划线接种于麦康凯琼脂平板上,置于37 ℃恒温箱内培养24 h后观察结果。镜检结果为两端钝圆的革兰阴性短小杆菌,麦康凯琼脂培养基表面有粉红色、稍凸起、表面光滑湿润、菌落边缘波状的大菌落。与从原发病鹌鹑的样本中分离出的菌株形态一致。综上试验结果可判断,从原发病鹌鹑中分离出的细菌为致病性大肠杆菌[4]。
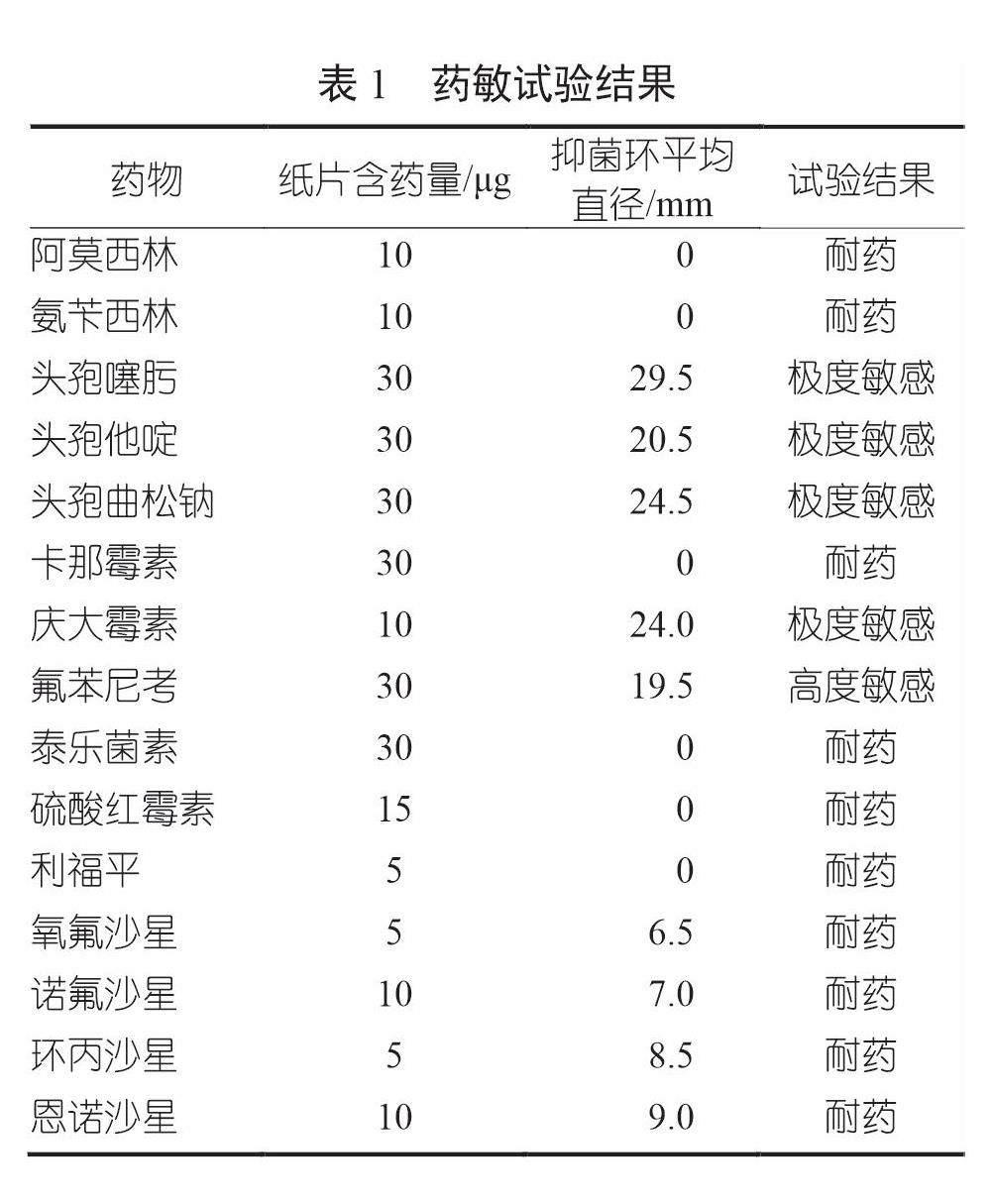
2.5 药敏试验结果
药敏试验结果如表1所示。按以下标准判定[5]:抑菌圈直径大于20 mm为极度敏感;抑菌圈直径大于15 mm且不超过20 mm为高度敏感;抑菌圈直径大于10 mm且不超过15 mm为中度敏感;抑菌圈直径大于0且不超过10 mm为耐药。
3 分析与讨论
3.1 药敏试验结果分析
本研究表明,引起本地养殖户2月龄鹌鹑发病的致病性大肠杆菌对头孢噻肟(CTX)、头孢曲松钠(CFX)、庆大霉素(GM)和头孢他啶(CED)极度敏感,对氟苯尼考(FF)高度敏感,对阿莫西林(AMX)、氨苄西林(SU)、卡那霉素(K)、泰乐菌素(TL)、硫酸红霉素(E)、利福平(RA)、氧氟沙星(OFL)、诺氟沙星(NOR)、环丙沙星(CIP)和恩诺沙星(ENR)耐药。因此,头孢菌素类抗生素、胺基糖苷类抗生素、氯霉素类抗生素可作为治疗药物。
3.2 大肠杆菌病发病原因分析
3.2.1 环境因素
饲养环境卫生条件差、管理不當与大肠杆菌病有着密切的关系。当舍内空气不好,阴暗潮湿,尘埃过重,饲料饮水等被大肠杆菌污染时,易使大肠杆菌通过呼吸道和消化道感染鹌鹑,从而引起发病。部分养殖户未对设施进行消毒,或者对消毒工作不重视,大量重复地滥用药物,致耐药菌株产生。大多数养殖户在鹌鹑群发病时,便“病急乱投医”,也不考虑药物是否有效,或者一旦有效,便长时间大量使用同一种抗菌药,结果导致大肠杆菌耐药性增加,鹌鹑的免疫力急剧下降,最后不但不能治疗疾病,反而造成耐药菌株种类超标[6],造成大肠杆菌的发生与流行。
3.2.2 应激因素
在正常情况下鹌鹑的肠道内存在大量的大肠杆菌,舍内也广泛存在大肠杆菌,当饲养管理、环境卫生条件变差,特别是鹌鹑群受到环境因素的影响,如高温,转群,惊吓,饲养密度过大,突然更换饲料,机体内环境发生改变而使抵抗力下降,导致大肠杆菌病发生。
参考文献
[1] 陆承平.兽医微生物学[M].5版.北京:中国农业出版社,2013.
[2] 姚火春.兽医微生物学实验指导[M].2版.北京:中国农业出版社,2004.
[3] (美)卡尔尼克(Calnek B. W.)主编.高福,刘文军主译.禽病学:第9版[M].北京:中国农业大学出版社,1991.
[4] 甘肃农业大学.兽医微生物学[M].2版.北京:农业出版社,1991.
[5] 朱模忠.兽药手册[M].北京:化学工业出版社,2002.
[6] 崔增学,高树云.耐药性大肠杆菌病的诊治[J].中国禽业导刊,2002,19(9):33.
