滑膜细胞及软骨细胞释放HMGB1 流体力学阈值的研究
2024-05-18童乔莹邵博许颖捷贾梦莹马优祎龚忠诚
童乔莹, 邵博, 许颖捷, 贾梦莹, 马优祎, 龚忠诚
1. 新疆医科大学第一附属医院(附属口腔医院)口腔颌面肿瘤外科,新疆维吾尔自治区 乌鲁木齐(830054); 2. 新疆维吾尔自治区口腔医学研究所,新疆维吾尔自治区 乌鲁木齐(830054)
颞下颌关节骨关节炎(temporomandibular joint osteoarthritis,TMJOA)是颞下颌关节紊乱病(temporomandibular disorders,TMD)分类中的一个重要亚型,其病理特征是进行性的软骨丧失、软骨下骨的硬化、骨赘的形成及滑膜炎症等[1]。TMJOA 的发病机制复杂且受多种因素影响,其中错因素所导致的异常机械应力被认为是关键因素[2]。近年有学者提出TMJOA 是关节损伤后,关节软骨及其周围结构复杂相互作用的结果[3],然而,对于滑膜炎症和软骨退变在TMJOA 中发生的顺序,仍存争议。有研究使用核磁共振证实滑膜炎的发生存在于TMJOA 的所有阶段,尤其在早期阶段,而且与TMJOA 的发展、疼痛以及关节功能障碍有关[4];TMJOA 的滑膜特征为大量免疫细胞浸润,例如CD4+、CD68+细胞,以及分泌以IL-1 与肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)为主的细胞因子,而IL-1 和TNF-α 是参与关节软骨破坏的主要细胞因子[5-6]。高迁移率族蛋白1(high-mobility group box 1,HMGB1)作为一种细胞损伤相关分子模式(damage-associated molecular patterns,DAMPs),在细胞破裂后被释放至细胞外[7],可通过与晚期糖基化终产物受体(receptor of advanced glycation endproducts,RAGE)或toll 样受体4(toll-like receptor 4,TLR4)等表面受体结合,诱导巨噬细胞分泌TNF,并刺激先天性免疫系统并触发炎症反应,HMGB1 作为一种警报蛋白,还可以加重关节内炎症以及促进骨关节炎(osteoarthritis,OA)软骨细胞的分解代谢[8];而早期阻断HMGB1 可减少OA 的软骨炎症以及软骨退变,同时也有效减少了RAGE 和TLR4 的产生[9]。在FFSS 刺激下的软骨细胞表达更高水平的前破骨细胞因子,如基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)及核因子κB 受体激活剂配体(receptor activator of nuclear factor kappa B ligand,RANKL),并通过促进破骨细胞生成诱导髁突软骨下骨吸收,这表明软骨变化先于软骨下骨变化[10]。而在异常流体流动剪切力(fluid flow shear stress,FFSS)刺激下,同在关节囊中的滑膜细胞及软骨细胞损伤先后顺序还未有研究阐明。
本研究利用FFSS 模拟颞下颌关节腔的异常刺激,在细胞学水平观察滑膜细胞及软骨细胞对于异常机械力刺激的反应,寻找滑膜细胞及软骨细胞大量释放HMGB1 的阈值,阐明在异常机械力作用下,滑膜细胞及软骨细胞破坏的先后顺序,可为针对性地阻断滑膜细胞与软骨细胞间相互作用,以防止不可逆的软骨损伤,为TMJOA 后续靶向治疗提供实验依据。
1 材料和方法
本研究已通过新疆医科大学第一附属医院医学动物实验伦理审查委员会的审批(批号:20210301-68)。
1.1 主要仪器及试剂
流体剪切力学装置:蠕动泵(BT600-2J,Longerpump,中国)、储液瓶,平行平板流动腔(Chanber 901,Naturethink,中国)、垫片、连接管(14#,19#,20#乳胶管),变径转接头(Naturethink,中国);H-DMEM 高 糖 溶 液、双 抗、胎 牛 血 清(Gibco 美国);Ⅱ型胶原酶(Worthington,美国);细胞冻存液(DMSO)(Sigma,美国);各梯度乙醇(上海振兴,中国);TBST 缓冲液、4%多聚甲醛(博士德,中国);防脱载玻片(世泰,中国);中性树胶、抗体稀释液、Triton-100、4×蛋白上样缓冲液、10 × TBST 缓冲液(索莱宝,中国);大鼠HMGB1、IL-1βELISA 试剂盒(上海江莱,中国);兔抗鼠多克隆抗体HMGB1 一抗(1∶1 000,索莱宝,中国);兔抗鼠多克隆抗体actin(1∶1 000,Affinity,美国);兔抗鼠多克隆抗体IL-1β(1∶1 000,Abcam,英国);蛋白裂解液(RIPA)、蛋白酶抑制剂、磷酸酶抑制剂、彩色蛋白Marker 26616(Thermo,美国);山羊抗兔辣根过氧化物酶标记二抗(Bs-0295G-HRP,博奥森,中国);ECL 化学发光试剂盒(Thermo,美国);Tris 粉末、Glycine 粉末、SDS 粉末(Biofrox,中国)。
1.2 研究对象
SD 大鼠(约130 g 左右,5 周龄,雌雄不限)购自新疆医科大学动物中心,动物合格证号:SYXK(新)2018-0003。
大鼠后颈椎脱臼处死后,仰卧位固定,无菌条件下于膝关节中线髌骨表面偏内侧垂直切开,逐层分离至滑膜组织,取出滑膜组织,浸泡于含10%双抗的PBS 中,充分暴露膝关节软骨并向上钝性分离肌肉等组织至股骨头,取股骨下端、胫骨平台和股骨头的软骨组织,浸泡于含10%双抗的PBS 中,低温转移入预先消毒完成的超净工作台;PBS 冲洗3 次,每次5 min,将滑膜及软骨组织剪成约1 mm ×1 mm 大小的组织块碎片,滑膜组织中加入等量的0.1%Ⅱ型胶原酶(软骨组织加入0.2%的Ⅱ型胶原酶),封口,放置于摇床内37 ℃、180 r/min 消化4 h(软骨细胞过夜消化,一般超过12 h)后,加入等体积的H-DMEM 终止消化,离心力为178 g离心5 min,保留沉淀层,加入1 mL 完全培养基重悬沉淀,200 目铜网细胞筛过滤,吸取过滤液,接种至细胞培养皿中,置37 ℃、5% CO2条件下培养,倒置显微镜下观察,48 h 后首次换液,待细胞贴壁率达到85%左右后,以1∶3 进行细胞传代,培养至3~4 代进行后续实验。
1.3 流体剪切力的选择及计算
根据既往研究和本课题组前期FFSS 干预实验[11-12],本研究沿用水平剪切力值,根据剪切力与流速换算公式:Ʈω(dyn/cm2)=μϒ=6μQ/a2b(ϒ 为剪切率,ϒ=1 m/s;μ 为介质的表面粘度,μ=0.003;a 为内径管高;b为内径管宽;Q代表流量,单位为mL/s)。本研究最终使用的14#软管,其所对应的速度为150 mL/ min,将设置的0、1、3、4、5、8、10、12 以及16 dyn/cm2的剪切力带入公式转换为蠕动泵的转速分别对应0、22.4、67.2、90、112、180、224、270 以及360 r/min。
1.4 研究分组
取3~4 代滑膜细胞及软骨细胞,通过流体剪切力学装置对软骨及滑膜细胞施加FFSS,根据不同大小的FFSS 值分组,滑膜细胞加载不同流体剪切力为1、3、5 以及10 dyn/cm2,软骨细胞加载不同流体剪切力为4、8、12 以及16 dyn/cm2,均作用1 h。静息培养(0 dyn/cm2)作为对照组。
1.5 滑膜细胞、软骨细胞形态观察
接种后的滑膜细胞分别加载1、3、5、10 dyn/cm2的FFSS,放置于显微镜下分别于0、1、2、3 h 拍摄照片;接种后的软骨细胞分别加载4、8、12、16 dyn/cm2的FFSS,放置于显微镜下分别于0、1、2、3 h 拍摄照片。
1.6 免疫细胞化学染色
滑膜细胞及软骨细胞加载不同大小的FFSS后,即刻进行免疫细胞化学染色。PBS 清洗标本3 次,每次1 min,预冷的4%多聚甲醛固定15 min,空气干燥5 min,PBS 清洗标本3 次,每次2 min,0.5%Triton-X100 孵育20 min,PBS 清洗标本3 次,每次2 min,3% H2O2孵育5 min,PBS 清洗标本3 次,每次2 min,胎牛血清封闭20 min,配置一抗HMGB1(1∶500)、IL-1β(2 μg/mL)4 ℃孵育过夜,第2 日弃去一抗,PBS 清洗标本3 次,每次5 min,二抗工作液37 ℃孵育30 min,PBS 清洗标本3 次,每次5 min,DAB 显色2~3 min,蒸馏水清洗标本2 次,每次1 min,苏木素复染2 min,流动水清洗标本5~8 min,盐酸乙醇分化1~2 s,PBS 清洗,蒸馏水返蓝(1~5 min,显微镜下观察核的颜色),95%乙醇Ⅰ8 s、95%乙醇Ⅱ8 s、无水乙醇8 s 梯度脱水,二甲苯(Ⅰ、Ⅱ)透明各1 min,干燥封片,显微镜下观察拍照。
1.7 ELISA 检测上清液HMGB1 及IL-1β 浓度
滑膜细胞及软骨细胞加载不同大小的FFSS后,于37 ℃、5% CO2条件下培养24 h,收集各处理组细胞的培养基,4 ℃,12 000 r/min,离心15 min,收集上清液,于-80 ℃长期保存。严格按照检测试剂盒说明书步骤,测定各组培养基上清液中上述因子的浓度。
1.8 Western Blot 检测细胞内HMGB1 及IL-1β 蛋白表达情况
滑膜细胞及软骨细胞加载不同大小的FFSS后,立即收集细胞,提取蛋白,制备样品,测定蛋白浓度以计算上样体积。取15 μg 总蛋白上样进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDSPAGE)分离蛋白,电转转移到PVDF 膜上,用5%脱脂牛奶室温下封闭2 h,配置一抗,包括HMGB1(1∶1 000);IL-1β(2 μg/mL);actin(1∶1 000),4 ℃摇床孵育过夜,次日复温,HRP 二抗孵育2 h,ECL 显色液显色,使用Image J 软件对蛋白条带灰度值进行分析。
1.9 统计学分析
使用SPSS 26.0 以及GraphPad Prism 8.0.1 软件软件进行数据整理,炎症因子浓度以均数±标准差(±s)表示,多组之间比较采用单因素方差分析,组与组之间比较采取Tukey 检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 滑膜及软骨细胞分别加载FFSS 后细胞形态的观察
加载1 dyn/cm2或者4 dyn/cm2后,可观察到滑膜细胞及软骨细胞肿胀膨大,部分细胞从细胞核周围开始,出现不规则空腔,逐渐向细胞外崩解,胞膜破裂,细胞间隙中可见碎片;且随着FFSS 的增加(滑膜细胞为3、5、10 dyn/cm2,软骨细胞为8、12、16 dyn/cm2),贴壁细胞数量明显减少,破裂的细胞数量增加,胞浆弥散于细胞间隙中;随着时间的增加(1 h、2 h、3 h),细胞碎片增多,胞浆逐渐弥散(图1)。
2.2 加载不同大小的FFSS 可诱导HMGB1 与IL-1β在细胞内的位移
在FFSS 为0 dyn/cm2时,滑膜细胞及软骨细胞的HMGB1及IL-1β分布在细胞核和细胞质中均可见,且随着FFSS 的增加(滑膜细胞为1、3、5、10 dyn/cm2,软骨细胞为4、8、12、16 dyn/cm2),滑膜细胞及软骨细胞肿胀形变,部分胞浆折叠或胞膜破裂;HMGB1及IL-1β 的表达由细胞核逐渐位移至胞浆中(图2)。
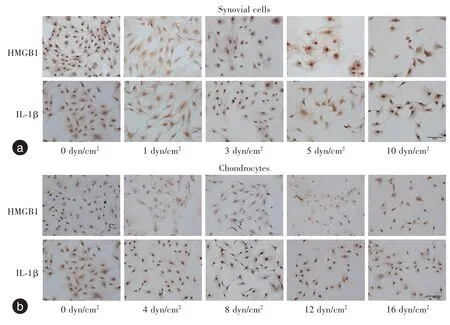
图2 滑膜及软骨细胞加载FFSS 后HMGB1、IL-1β 的免疫细胞化学染色(×200)Figure 2 Immunocytochemical staining of HMGB1 and IL-1β in synovial cells and chondrocytes after FFSS loading (×200)
2.3 加载不同大小的FFSS 可诱导细胞释放HMGB1 与IL-1β
在滑膜细胞中,相比于对照组(0 dyn/cm2),1、3、5、10 dyn/cm2FFSS 组中所释放的HMGB1(P<0.01)、IL-1β(P<0.01)明显升高(图3a、3b);在软骨细胞中,与对照组(0 dyn/cm2)相比,4、12、16 dyn/cm2FFSS 干预组中HMGB1 在上清液中的表达水平增加(P<0.05),与对照组(0 dyn/cm2)相比,在8 dyn/cm2FFSS 干预组中HMGB1 在上清液中的表达水平明显增加(P<0.01);与对照组(0 dyn/cm2)相比,4、8、12、16 dyn/cm2FFSS 干预组中IL-1β 在上清液中表达水平逐渐增加(P<0.01)(图3c、3d)。
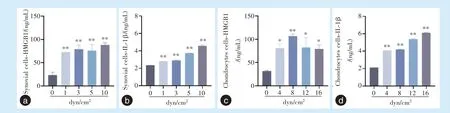
图3 滑膜及软骨细胞加载FFSS 后上清液中HMGB1、IL-1β 的ELISA 检测Figure 3 ELISA analysis of HMGB1 and IL-1β in the supernatant of synovial cells and chondrocytes after FFSS loading
2.4 加载不同大小的FFSS 可以诱导细胞中HMGB1 及IL-1β 蛋白表达
相比于对照组(0 dyn/cm2),在1、3、5、10 dyn/cm2FFSS 干预组中滑膜细胞所表达的HMGB1(P<0.01)、IL-1β(P<0.01)逐渐升高;相比于对照组(0 dyn/cm2),在4、12、16 dyn/cm2FFSS 干预组中软骨细胞所表达的HMGB1 蛋白表达水平明显增加(P<0.01),相比于对照组(0 dyn/cm2),在8 dyn/cm2FFSS 干预组中HMGB1 蛋白表达减少(P<0.01)。相比于对照组(0 dyn/cm2),在4 dyn/cm2组中软骨细胞所表达的IL-1β无明显差异(P>0.05),在8 dyn/cm2组 中IL-1β(P<0.05)升 高,而 在12 dyn/cm2和16 dyn/cm2组中IL-1β(P<0.01)明显升高(图4)。
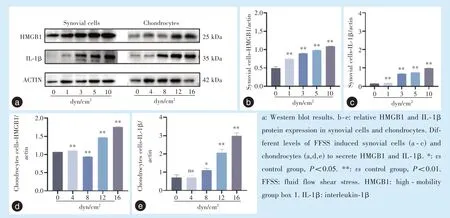
图4 滑膜及软骨细胞加载FFSS 后HMGB1、IL-1β 的Western blot 检测Figure 4 Western blot analysis of HMGB1 and IL-1β in synovial cells and chondrocytes after FFSS loading
3 讨 论
颞下颌关节是一种滑膜关节[13],滑膜组织是覆盖在关节囊内侧的疏松结缔组织,通过分泌滑液来滋养软骨细胞,去除基质降解的代谢产物,润滑关节,关节内的滑膜层具有可变形的牢固的组织结构,借此支撑着关节腔的运动。日常咀嚼、言语等活动对关节软骨产生生理性刺激(压缩、拉伸和剪切力等),使软骨细胞维持正常功能[14],软骨组织具有特异性抗压能力,可在一定程度内调节软骨组织应力的耐受范围,然而,夜磨牙、错畸形等所导致颞下颌关节机械负荷过重,超过生理性的剪切应力的作用下,关节软骨表面的摩擦增加,滑液润滑作用中断,上调基质金属蛋白酶(matrix metalloproteinase,MMP)的分泌,从而降解软骨组织中Ⅱ型胶原和聚集蛋白聚糖,从而导致软骨细胞的分解代谢和合成代谢活性失衡[15],诱导软骨组织和软骨下骨的结构和功能进行性损伤,最终导致OA 的发生[16-17],然而在早期通过去除机械负荷后软骨会进行自我修复,逆转损伤[18]。
OA 始于关节软骨的病理改变,后续激活的炎症反应会涉及所有关节内组织:软骨下骨、滑膜、滑液、关节盘与韧带等[19],但越来越多的研究表明,在此之前滑膜炎可能是疾病进展的驱动因素,在OA 的发病过程中发挥作用[20]。滑膜细胞会产生一系列促炎调节因子,如炎症细胞因子,一氧化氮(NO)和前列腺素E2(prostaglandin E2,PGE2)等,这些由滑膜所产生的炎症细胞因子会通过滑液扩散从而作用于关节软骨;此外,它们还诱导IL-6、IL-8 等表达,上调TLR2 和RAGE 等某些模式识别受体(pattern recognition receptors,PRRs),诱导HMGB1 和低分子量透明质酸等DAMPs 的释放[21]。有研究报道,滑膜炎症在OA 中起启动作用,通过释放促炎介质和软骨破坏因子,诱导软骨损伤,软骨损伤放大滑膜炎症,建立恶性循环[5]。本研究结果显示在受到异常机械力刺激后,滑膜细胞先于软骨细胞释放HMGB1。
HMGB1 作为一种晚期炎症因子,具有显著趋化及促炎效应,其分布广泛,在所有哺乳动物细胞核中均有高表达,在OA 中发挥重要作用[22];OA 患者滑液中HMGB1、IL-1β、IL-18 与PGE2 等促炎细胞因子呈现高表达,且HMGB1 水平与OA 的严重程度相关,故有理由推测HMGB1 参与了炎症诱导的OA 的发生和发展[23-25]。HMGB1 通过激活细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和c-Jun 氨基末端激酶(c-Jun N-ter minal kinase,JNK)有效上调TMJOA 滑膜成纤维细胞血管内皮生长因子(vascular endothelial growth factor,VEGF)和缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)的表达,表明HMGB1 可能通过促进血管生成进一步加重关节炎症[26]。滑膜细胞会通过核苷酸结合寡聚化结构域样受体蛋白家族NLRPs炎症小体介导的焦亡来释放大量的HMGB1作用于软骨[27];在OA 患者的滑膜细胞中,HMGB1表达上调,并从细胞核位移至细胞质,HMGB1 与IL-1β 协同放大炎症反应,产生大量细胞因子、趋化因子和MMP,并诱导ERK1/2、p38 和Akt 的磷酸化,激活核转录因子-κB(nuclear factor-kappa B,NF-κB)信号通路,导致OA 的滑膜炎以及关节软骨破坏[28],而抑制HMGB1可能通过抑制NF-κB 信号通路来减少滑膜炎症和软骨分解代谢,从而减轻TMJOA[29]。受损的软骨细胞会分泌HMGB1,诱导IL-6、IL-8 等细胞因子产生,减少细胞基质,诱导OA 样表型并促进炎症反应,特异性抑制HMGB1 的表达可明显降低OA 软骨细胞分泌PGE2、NO、促炎细胞因子和MMP,延缓OA 的炎性反应[30-31]。
本研究结果显示,加载同一作用时间但不同大小的FFSS,滑膜细胞及软骨细胞均失去原有的形态,逐渐肿胀破裂,这符合细胞发生焦亡时的形态变化。其次在免疫细胞化学染色中可观察到,随着FFSS 的增大,HMGB1 及IL-1β 的表达由细胞核逐渐移至胞浆中。在正常的生理状态下,滑膜细胞与软骨细胞均有着较低炎症因子的释放,但受到FFSS 干预后,滑膜细胞与软骨细胞呈现应激状态,且随着FFSS 的不断增加,滑膜细胞与软骨细胞所释放的炎性因子HMGB1、IL-1β 呈上升趋势。在滑膜细胞中,HMGB1、IL-1β 的表达均随着FFSS的增大而增加,故推测在滑膜细胞中,HMGB1 在接近于1 dy/cm2时大量释放;而在软骨细胞中,随着FFSS 的升高,软骨细胞所表达的HMGB1 蛋白水平逐渐升高,但在8 dyn/cm2时达到最低值,后又逐渐升高,而IL-1β 的表达则呈现逐渐升高的趋势,这与软骨细胞所释放至胞外的HMGB1 含量相符,故推测HMGB1 在FFSS 接近于8 dyn/cm2时,大量软骨细胞通过焦亡所导致的细胞胞膜的破裂,致胞内产生的HMGB1 被大量释放至细胞外,故表现为胞内蛋白水平的降低以及胞外HMGB1 水平的增加,后随着FFSS 的继续增加,细胞可能通过发挥某种保护机制来试图修复细胞膜的破裂,具体还需要进一步的实验探索。本研究结果提示,HMGB1 可能可以作为滑液中临床生物标志物来进行OA 的早期诊断和治疗,可能是减缓OA 进展的有效治疗靶点。
基于本实验结果可推测,当异常机械力作用于滑膜组织及软骨组织,由于二者对应力的耐受程度不同,滑膜先于软骨细胞发生损伤,释放HMGB1 于滑液中,作为一种DAMPs 作用于软骨细胞,与其表面PRRs 结合,启动焦亡,细胞肿胀,最后破裂,释放胞内所有的炎性物质,这导致滑液中以HMGB1 为代表的促炎细胞因子的浓度增加,加重OA。本研究的不足之处在于阐述了滑膜细胞与软骨细胞分别受到异常机械力刺激后产生的HMGB1 的水平,但不能完全代替关节腔内环境,且未进行滑膜细胞与软骨细胞共培养,或对其在受到异常机械力刺激后所产生的细胞因子进行相互作用,来更好模拟关节腔中的变化。本课题组将继续从临床出发,深入探讨HMGB1 在OA 发生、发展过程中的作用。
综上,本研究使用大鼠滑膜细胞和软骨细胞进行干预,滑膜细胞及软骨细胞释放HMGB1 流体力学阈值分别接近于1 dyn/cm2和8 dyn/cm2;推测在异常机械刺激下,颞下颌关节腔中,滑膜细胞先于软骨细胞释放HMGB1,即滑膜炎症先于软骨损伤。本研究结果进一步为滑膜炎症与软骨损伤之间的相互作用提供了新的参考依据,并为以HMGB1 为靶点预防和治疗TMJOA 提供新思路。
【Author contributions】Tong QY designed the study, performed the experiments, analyzed the data and wrote the article. Shao B, Xu YJ, Jia MY, Ma YY performed the experiments and analyzed the data. Gong ZC designed the study and reviewed the article. All authors read and approved the final manuscript as submitted.
