芍药苷调节RhoA/ROCK信号通路对实验性自身免疫性葡萄膜炎小鼠Th17/Treg免疫平衡的影响
2024-05-17庞彬彬陈震邢怡桥武汉大学人民医院眼科中心湖北武汉430060
庞彬彬,陈震,邢怡桥(武汉大学人民医院眼科中心,湖北 武汉 430060)
人类自身免疫性葡萄膜炎是包括慢性炎症性疾病在内的视力障碍的主要原因,被认为是威胁视力的疾病[1]。与其他自身免疫性疾病(如自身免疫性脑脊髓炎、自身免疫性心肌炎和自身免疫性神经炎)类似,实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis,EAU)是人类自身免疫性葡萄膜炎的动物模型,是一种T细胞介导的疾病。自身反应性T细胞的归巢和炎症细胞(如单核细胞)的浸润会引发EAU[2]。恢复体内辅助性T淋巴细胞17(helper T lymphocytes 17,Th17)/调节性T细胞(regulatory T cells,Treg)平衡可以对EAU小鼠起到治疗效果[3]。
芍药苷是来源于芍药科植物的活性物质,芍药苷可以抑制自身免疫性疾病动物炎症,如实验性关节炎、银屑病和实验性自身免疫性脑脊髓炎等。芍药苷可调节免疫细胞的功能和激活,减少炎症产生,并恢复异常信号通路[4]。研究[5]发现,芍药苷可以通过调节Ras同源基因家族蛋白A(Ras homolog gene family member A,RhoA)/Rho相关卷曲螺旋形成蛋白激酶(Rho-associated coiled-coil forming protein kinase,ROCK)信号传导来抑制胶质母细胞瘤细胞的迁移和侵袭以及肌动蛋白重排。有研究[6]报道称,抑制RhoA/ROCK信号通路可以抑制T滤泡辅助细胞分化,恢复Th17/Treg平衡,对类风湿性关节炎小鼠起到积极效果。但是关于RhoA/ROCK信号通路在EAU上的研究尚未见报道,本研究旨在探究芍药苷是否可以通过抑制RhoA/ROCK信号传导对EAU小鼠Th17/Treg免疫平衡产生积极影响。
1 材料与方法
1.1 动物SPF级雄性C57BL/6小鼠,6~8周龄,体质量20~30 g,购自湖北省实验动物研究中心,动物质量合格证号:11072511310924,动物生产许可证号:SCXK(鄂)2020-0018。所有动物在12 h/12 h光黑暗循环、温度(22±2)℃、湿度55%~60%的标准条件下饲养。本研究已获得武汉大学人民医院动物伦理委员会的批准,批准号:20220301。
1.2 药物及主要试剂芍药苷(分析标准品,纯度≥98%)购自上海源叶生物有限公司,批号:20210509;百日咳毒素(纯度≥99%)、光感受器间维生素A类结合蛋白1-20(IRBP1-20)多肽片段,购自上海生工生物工程股份有限公司,批号分别是:20220109、20220112;RhoA/ROCK信号通路激活剂溶血磷脂酸(lysobisphosphatidic acids,LPA),购自深圳市健竹科技有限公司,批号:20211215;结核分支杆菌H37RA,购自美国Difco公司,批号:231141;转化生长因子-β(trarsforming growth factor beta,TGF-β)、试剂盒,购自博辉生物科技(广州)有限公司,批号:20220416;白细胞介素10(interleukin 10,IL-10)试剂盒、白细胞介素17(interleukin 17,IL-17)试剂盒、白细胞介素23(interleukin 23,IL-23)试剂盒,购自武汉伊莱瑞特生物科技股份有限公司,批号分别是:20220325、20220407、20220411;维甲酸相关孤儿受体γt(retinoid-related orphan nuclear receptor γt,RORγt)、叉头状转录因子3(forkhead box P3,FoxP3)、RhoA、ROCK1抗体,购自美国Abcam公司,批号分别是:ab207082、ab215206、ab187027、ab134181。
1.3 主要仪器iMark680多功能酶标仪,美国Bio-Rad公司;BX61光学显微镜,日本Olympus公司;S4型裂隙灯显微镜,上海玉研科学仪器有限公司;FACSCalibur流式细胞仪,美国Becton-Dickinson公司。
1.4 EAU小鼠模型构建及分组随机选择10只小鼠作为正常对照组,其余小鼠参考相关文献[7]的方法,腹腔注射800 ng百日咳毒素,于小鼠单足后和脊柱两侧皮下注射含有200μg IRBP1-20、0.8 mg结核分支杆菌H37RA和不完全弗氏佐剂的乳化剂免疫,建立EAU模型。正常对照组小鼠注射相同体积的不完全弗氏佐剂的乳化剂。免疫21 d后用于后续实验。
将EAU小鼠随机均分为模型组、芍药苷组、LPA组、芍药苷+LPA组,每组10只。芍药苷组小鼠在免疫7 d后,通过腹腔注射10 mg·kg-1的芍药苷[8];LPA组在免疫7 d后,通过腹腔注射25μmol·L-1的RhoA/ROCK信号通路激活剂LPA[9];芍药苷+LPA组在免疫7 d后,开始腹腔注射10 mg·kg-1的芍药苷以及25μmol·L-1的LPA。每天给药1次,持续14 d。模型组和正常对照组给予等量生理盐水。
1.5 小鼠眼前节临床表现评分在药物治疗结束后第2天,用裂隙灯显微镜观察小鼠眼前节炎症表现,并参照Caspi评分标准进行EAU的临床评分[10]。0分:无疾病,红光反射正常;0.5分:虹膜血管轻度扩张;1分:虹膜中度扩张充血,瞳孔异常;2分:前房模糊,红光反射减弱;3分:中度不透明前房,瞳孔可见,红光反射变暗;4分:前房混浊,瞳孔模糊(膜闭),红光反射消失,眼球突出。
1.6 标本采集药物治疗结束第2天,摘除各组小鼠眼球采血1 mL,经离心机3 000 r·min-1离心10 min(离心半径8 cm)后取其上清液,置于-20℃保存以备后续ELISA检测。颈椎脱臼处死小鼠,分离出眼球组织和脾脏组织,眼球组织固定于4%多聚甲醛中用于HE染色,脾脏组织用于Western Blot和流式细胞术。
1.7 HE染色观察眼球组织形态取4%多聚甲醛溶液中固定的眼球组织,经过水洗、脱水、透明、浸蜡、包埋后切成4μm薄片。随后将切片置于烤箱1 h,脱蜡、脱水后,用苏木精和伊红染色,在光学显微镜下观察视网膜病变情况。参照Caspi组织病理分级进行评分,标准如下[10]:0分:无疾病,视网膜结构正常;0.5分:轻度炎症伴或不伴光感受器损伤;1分:轻度炎症和/或光感受器外段损伤;2分:轻度至中度炎症和/或病变延伸至外核层;3分:中度到明显炎症和或病变延伸到内核层;4分:严重的炎症和/或全层视网膜损伤。
1.8 ELISA法检测血清中炎性因子取“1.6”项中保存的血清,参照ELISA试剂盒步骤检测小鼠血清中炎症因子(IL-10、TGF-β、IL-17、IL-23)水平。
1.9 流式细胞术检测脾脏Th17/Treg细胞水平Th17细胞检测:取脾脏组织研磨后,使用淋巴细胞分离液分离淋巴细胞,调整细胞浓度到1×106个·mL-1,随后加入PMA、Ionomycin和Golgistop,室温下培养4 h,离心后弃去上清;加入PBS重悬细胞,加入FITC-CD4抗体,随后加入2 mL破膜固定液避光孵育30 min;加入2 mL破膜液离心后弃去上清,加入PE标记的IL-17抗体染色,加入2 mL细胞破膜液,上机检测Th17细胞。Treg细胞检测:T细胞中加入破膜固定液,4℃避光过夜;TruStainFcXTM PLUS封闭细胞表面Fc受体;加入FITC-CD4和PE-Foxp3抗体,4℃避光孵育30min染色,上机检测Treg细胞。
1.10 Western Blot法检测脾脏RORγt、Foxp3以及RhoA/ROCK信号通路蛋白表达取保存在-80℃冰箱的脾脏组织加入RIPA裂解缓冲液后提取总蛋白,将蛋白质进行定量、电泳、转膜,将膜室温封闭3 h后分别加入RORγt(1∶1 000)、Foxp3(1∶1 000)、RhoA(1∶1 000)、ROCK1(1∶1 000)和GAPDH抗体(1∶1 000)的一抗,4℃孵育一夜;再加入HRP标记的山羊抗兔二抗(1∶2 000),室温孵育3 h;加入ECL试剂使蛋白条带显影后,使用ImageJ软件分析蛋白的灰度值。
1.11 统计学处理方法用SPSS 25.0软件进行统计分析,计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两组间比较用SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 芍药苷对小鼠眼前节临床表现评分的影响见表1。正常对照组小鼠无葡萄膜炎症状。与正常对照组比较,模型组小鼠出现虹膜血管舒张充血,前房不透明,瞳孔模糊,无红光反射,眼前节临床表现评分明显增加(P<0.05);与模型组比较,芍药苷组小鼠虹膜血管充血症状明显缓解,前房少量渗出,瞳孔正常,眼底红光反射减弱,眼前节临床表现评分明显降低(P<0.05);与模型组比较,LPA组小鼠眼部炎症加重,包括严重虹膜扩张充血,前房大量蛋白渗出,瞳孔膜闭,眼前节临床表现评分明显增加(P<0.05);与芍药苷组比较,芍药苷+LPA组小鼠眼部炎症反应加重,虹膜充血、结膜血管舒张情况与模型组相似,瞳孔缩小,眼前节临床表现评分明显增加(P<0.05)。
表1 芍药苷对小鼠眼前节临床表现评分和组织病理评分的影响(±s,n=10)Table 1 Effects of paeoniflorin on retinal performance score and histopathological score inmice(±s,n=10)

表1 芍药苷对小鼠眼前节临床表现评分和组织病理评分的影响(±s,n=10)Table 1 Effects of paeoniflorin on retinal performance score and histopathological score inmice(±s,n=10)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与芍药苷组比较,△P<0.05
组别正常对照组模型组芍药苷组LPA组芍药苷+LPA组眼前节临床表现评分/分0.58±0.13 2.43±0.29*1.68±0.19#3.15±0.81#2.93±0.21△组织病理评分/分0.11±0.02 2.63±0.25*1.29±0.18#3.04±0.31#2.55±0.26△
2.2 芍药苷对小鼠眼球组织病理变化的影响见表1、图1。正常对照组小鼠眼部结构正常。与正常对照组比较,模型组小鼠前房、虹膜、睫状体和视网膜内均有大量炎性细胞浸润,病变累及内核层并伴有全层结构紊乱,组织病理评分明显增加(P<0.05)。与模型组比较,芍药苷组小鼠炎性细胞浸润减少,病变累及至外核层并伴有轻微渗出性视网膜脱离,组织病理评分明显降低(P<0.05);LPA组小鼠存在重度视网膜炎性细胞浸润,病变累及全视网膜并伴有全层结构损害,组织病理评分明显增加(P<0.05);芍药苷+LPA组与模型组视网膜形态相似。与芍药苷组比较,芍药苷+LPA组组织病理评分明显增加(P<0.05),LPA逆转了芍药苷对EAU小鼠的改善效果。

图1 各组小鼠眼球组织病理形态(HE染色,×200)Figure 1 Pathologicalmorphology of eyeball ofmice in each group(HE staining,×200)
2.3 芍药苷对小鼠血清炎性因子的影响见表2。与正常对照组比较,模型组小鼠IL-17和IL-23含量明显上升(P<0.05),IL-10和TGF-β含量明显下降(P<0.05)。与模型组比较,芍药苷组小鼠IL-17和IL-23水平明显降低(P<0.05),IL-10和TGF-β水平明显上升(P<0.05);LPA组IL-17和IL-23含量明显上升(P<0.05),IL-10和TGF-β含量明显下降(P<0.05)。与芍药苷组比较,芍药苷+LPA组小鼠IL-17和IL-23含量明显增加(P<0.05),IL-10和TGF-β含量明显减少(P<0.05),LPA逆转了芍药苷的改善效果。
表2 芍药苷对小鼠血清IL-10、TGF-β、IL-17及IL-23水平的影响(±s,n=10)Table 2 Effects of paeoniflorin on serum levels of IL-10,TGF-β,IL-17 and IL-23 inmice(±s,n=10)

表2 芍药苷对小鼠血清IL-10、TGF-β、IL-17及IL-23水平的影响(±s,n=10)Table 2 Effects of paeoniflorin on serum levels of IL-10,TGF-β,IL-17 and IL-23 inmice(±s,n=10)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与芍药苷组比较,△P<0.05
组别正常对照组模型组芍药苷组LPA组芍药苷+LPA组IL-10/(pg·mL-1)95.97±9.54 46.34±5.23*84.12±9.12#25.79±2.42#56.96±6.45△TGF-β/(pg·mL-1)95.43±9.89 74.86±8.43*91.57±9.67#45.57±5.47#78.14±9.34△IL-17/(pg·mL-1)15.97±2.54 77.65±9.43*22.58±2.32#115.45±13.63#63.96±6.41△IL-23/(pg·mL-1)16.38±1.39 90.23±9.79*33.12±3.56#148.12±16.56#78.86±8.43△
2.4 芍药苷对小鼠脾脏Th17/Treg细胞水平的影响见图2、表3。与正常对照组比较,模型组Th17细胞水平、Th17/Treg均明显上升(P<0.05),Treg细胞水平明显下降(P<0.05)。与模型组比较,芍药苷组Th17细胞水平、Th17/Treg均明显下降(P<0.05),Treg细胞水平明显升高(P<0.05);LPA组Th17细胞水平、Th17/Treg均明显上升(P<0.05),Treg细胞水平明显下降(P<0.05)。与芍药苷组比较,芍药苷+LPA组Th17细胞水平、Th17/Treg均明显上升(P<0.05),Treg细胞水平明显下降(P<0.05),LPA逆转了芍药苷的改善效果。
表3 芍药苷对小鼠脾脏组织Th17/Treg细胞水平的影响(±s,n=5)Table 3 Effects of paeoniflorin on Th17/Treg cell level of spleen tissues inmice(±s,n=5)

表3 芍药苷对小鼠脾脏组织Th17/Treg细胞水平的影响(±s,n=5)Table 3 Effects of paeoniflorin on Th17/Treg cell level of spleen tissues inmice(±s,n=5)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与芍药苷组比较,△P<0.05
组别正常对照组模型组芍药苷组LPA组芍药苷+LPA组Th17/%0.90±0.08 3.54±0.35*1.14±0.14#5.49±0.52#2.33±0.29△Treg/%8.43±0.89 5.78±0.61*8.11±0.83#2.89±0.23#7.54±0.84△Th17/Treg 0.10±0.01 0.61±0.09*0.14±0.02#1.89±0.24#0.31±0.03△

图2 各组小鼠脾脏组织Th17/Treg细胞比例Figure 2 Proportion of Th17/Treg cells in spleen tissue ofmice in each group
2.5 芍药苷对小鼠脾脏组织Foxp3、RORγt蛋白水平的影响见图3、表4。与正常对照组比较,模型组Foxp3蛋白水平明显降低(P<0.05),而RORγt水平明显升高(P<0.05)。与模型组比较,芍药苷组Foxp3蛋白水平明显升高(P<0.05),RORγt水平明显降低(P<0.05);LPA组Foxp3蛋白水平明显降低(P<0.05),而RORγt水平明显升高(P<0.05)。与芍药苷组比较,芍药苷+LPA组Foxp3蛋白水平明显降低(P<0.05),而RORγt水平明显升高(P<0.05),LPA逆转了芍药苷的改善效果。
表4 芍药苷对小鼠脾脏组织Foxp3、RORγt水平的影响(±s,n=5)Table 4 Effects of paeoniflorin on Foxp3 and RORγt levels in spleen tissues ofmice(±s,n=5)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与芍药苷组比较,△P<0.05
组别正常对照组模型组芍药苷组LPA组芍药苷+LPA组Foxp3/GAPDH 1.35±0.14 0.61±0.06*1.03±0.11#0.28±0.03#0.84±0.09△RORγt/GAPDH 0.72±0.19 1.53±0.16*0.93±0.20#2.31±0.24#1.06±0.13△
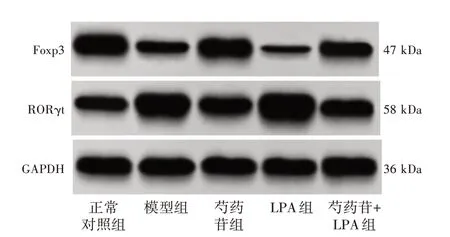
图3 Western Blot法检测各组小鼠脾脏组织Foxp3、RORγt水平Figure 3 Western Blot analysis of Foxp3 and RORγt levels in spleen tissues ofmice in each group
2.6 芍药苷对小鼠脾脏组织RhoA/ROCK信号通路蛋白水平的影响与正常对照组比较,模型组RhoA、ROCK1蛋白水平明显上调(P<0.05);与模型组比较,芍药苷组RhoA、ROCK1蛋白水平明显降低(P<0.05),而LPA组趋势相反(P<0.05);与芍药苷组比较,芍药苷+LPA组RhoA、ROCK1蛋白水平明显升高(P<0.05),见图4、表5。
表5 芍药苷对小鼠脾脏组织RhoA/ROCK信号通路蛋白水平的影响(±s,n=5)Table 5 Effects of paeoniflorin on protein levels of RhoA/ROCK signaling pathway in mouse spleen(±s,n=5)

表5 芍药苷对小鼠脾脏组织RhoA/ROCK信号通路蛋白水平的影响(±s,n=5)Table 5 Effects of paeoniflorin on protein levels of RhoA/ROCK signaling pathway in mouse spleen(±s,n=5)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05;与芍药苷组比较,△P<0.05
组别正常对照组模型组芍药苷组LPA组芍药苷+LPA组RhoA/GAPDH 0.21±0.02 0.57±0.07*0.29±0.04#0.86±0.09#0.50±0.04△ROCK1/GAPDH 0.32±0.04 0.61±0.08*0.34±0.06#0.97±0.03#0.58±0.05△

图4 Western Blot法检测各组小鼠脾脏组织RhoA/ROCK通路蛋白水平Figure 4 Western Blot analysis of RhoA/ROCK pathway protein levels in spleen tissues ofmice in each group
3 讨论
自身免疫性葡萄膜炎是一种常见的威胁视力的眼病,实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis,EAU)是一种经典的动物模型,广泛用于研究自身免疫性葡萄膜炎。用IRBP1-20免疫后,外周淋巴结或脾脏中的视网膜抗原特异性T细胞活化浸润到视网膜[11],随后非特异性T细胞、巨噬细胞和中性粒细胞与局部实质细胞浸润引起炎症级联反应,导致感光细胞和视网膜损伤[12]。Th17/Treg免疫平衡在EAU中起到重要作用,改善Th17/Treg免疫平衡可以对EAU小鼠起到治疗效果[13]。芍药是毛茛科、芍药属的多年生草本植物,分为赤芍和白芍,其中白芍可平抑肝阳、敛阴养血,赤芍有清热凉血、祛瘀止痛之效;芍药甘草汤(白芍90 g、甘草30 g)治疗葡萄膜炎疗效明显,可提高患者视力,且其作用机制与调节Th17细胞分化、调节免疫、抑制炎症反应有关[14-15]。芍药苷是芍药的有效成分,是一种炎症治疗药物,对Th17/Treg免疫平衡的恢复起到积极影响。Wang等[16]发现,芍药苷可以通过恢复Th17/Treg免疫平衡改善幼鼠自身免疫性心肌炎;Zheng等[17]也发现,芍药苷可以通过恢复Th17/Treg免疫平衡改善小鼠溃疡性结肠炎。本研究发现,模型组小鼠出现虹膜血管舒张充血,前房、虹膜、睫状体和视网膜内均有大量炎性细胞膨胀,眼前节临床表现评分明显升高,提示EAU造模成功。以芍药苷治疗后,小鼠虹膜血管充血症状明显缓解,眼前节临床表现评分明显下降,表明芍药苷可能对小鼠EAU起到治疗效果。
Th17细胞在多种免疫性疾病中发挥促炎作用,而Treg细胞是维持免疫稳态和诱导免疫耐受的关键因子,Th17/Treg失衡促进了EAU的发生[18]。Th17细胞可以通过产生IL-17、IL-22和IL-23等促炎因子,募集中性粒细胞,加重炎症反应,而Treg细胞可以通过产生抗炎因子IL-10和TGF-β,来维持免疫稳态[19]。RORγt与Foxp3是反应Th17/Treg细胞比例的标志物[20]。本研究发现,模型组小鼠IL-17、IL-23含量,Th17细胞水平,Th17/Treg、RORγt水平均明显上升,而IL-10和TGF-β含量,Treg细胞水平,Foxp3蛋白水平均明显下降,提示EAU大鼠Th17/Treg失衡,而芍药苷处理后改善了Th17/Treg失衡现象,表明芍药苷可能通过恢复Th17/Treg平衡对EAU小鼠起到治疗效果。
RhoA/ROCK通路在维持Th17/Treg平衡方面起到重要作用[21]。抑制RhoA-ROCK途径促进Treg反应,可以改善脓毒症相关的胰腺损伤[22]。抑制RhoA/ROCK通路还可以恢复Th17/Treg平衡,对类风湿性关节炎实验小鼠起到改善作用[6]。在本研究中,EAU小鼠RhoA、ROCK1蛋白高表达,与先前趋势一致,芍药苷治疗后RhoA、ROCK1蛋白水平明显降低,提示芍药苷可能通过抑制RhoA/ROCK信号通路发挥治疗效果。为了进一步验证此猜想,我们用RhoA/ROCK信号通路激活剂LPA处理EAU小鼠以及芍药苷治疗的EAU小鼠,结果发现,LPA消除了芍药苷对EAU小鼠的治疗效果。
综上所述,芍药苷可能通过抑制RhoA/ROCK信号通路,恢复Th17/Treg平衡,进而保护EAU小鼠。本研究尚缺少对芍药苷作用剂量的探究,芍药苷的最佳剂量和临床给药剂量仍需深入分析,这将是我们下一步研究的重点。
