毛蕊异黄酮对氧糖剥夺再灌注BV2小胶质细胞极化的影响
2024-05-17王圣鑫贺颖颖林依璇谢碧香谢凯王利胜南方医科大学皮肤病医院广东广州5009广州中医药大学广东广州50006广州白云山汉方现代药业有限公司广东广州5040
王圣鑫,贺颖颖,林依璇,谢碧香,谢凯,王利胜(.南方医科大学皮肤病医院,广东 广州 5009;.广州中医药大学,广东 广州 50006;3.广州白云山汉方现代药业有限公司,广东 广州 5040)
缺血性脑中风(Ischemic stroke,IS)是最常发生的脑血管疾病之一,具有高发病率、高致残率、高死亡率和高复发率,以及并发症多的特点[1]。缺血性脑中风会引发炎症反应、氧化应激、兴奋性毒性和细胞凋亡等复杂过程,从而导致神经元死亡[2]。研究[3]表明,缺血后脑组织炎症反应的主要特征是小胶质细胞的激活。小胶质细胞活化后分为M1促炎型和M2抗炎型两种表型,并可在周围环境的影响下在两种细胞类型间进行功能性转换[4]。因此,通过抑制M2型向M1型转变,诱导M1型向M2型转变,提高M2型/M1型的比例,可以减轻炎症反应以发挥脑保护作用,为缺血性脑中风的治疗提供了新的研究方向。
毛蕊异黄酮是中药黄芪的有效成分之一,具有抗炎、抗氧化、抗肿瘤的作用[5],对脑缺血损伤具有一定的脑保护作用。研究[6]发现,毛蕊异黄酮能抑制脑缺血再灌注损伤大鼠脑组织中NF-κB的表达,减轻脑组织的炎性反应,提示其抗炎作用可能是通过抑制促炎细胞因子的形成来实现的。但目前关于毛蕊异黄酮调控脑中风后小胶质细胞的作用机理研究较少。故本研究拟通过建立小胶质细胞(BV2)氧糖剥夺再灌注损伤(OGD/R)模型,探讨毛蕊异黄酮对BV2细胞分型的影响,以阐明毛蕊异黄酮治疗缺血性脑中风可能的作用机制。
1 材料与方法
1.1 细胞BV2细胞(批号:21031405),由武汉普诺赛生命科技有限公司提供。
1.2 药物及试剂毛蕊异黄酮(纯度>98%,批号:CHB181019),成都克洛玛生物科技有限公司;尼莫地平(批号:182694201),上海源叶生物科技有限公司。胰酶(批号:2152875)、DMEM高糖培养基(批号:8198451)、胎牛血清(批号:8198311)、DMEM无糖培养基(批号:8116461),美国Gibco公司;青霉素-链霉素溶液(批号:BL791A),中国兰杰柯科技有限公司;CCK-8试剂盒(批号:GB904),日本同仁化学研究所;一氧化氮(NO)一步法试剂盒(批号:20210713),南京建成生物工程研究所;白细胞介素10(IL-10)ELISA检测试剂盒(批号:202111)、白细胞介素1β(IL-1β)ELISA检测试剂盒(批号:202111)、肿瘤坏死因子α(TNF-α)ELISA检测试剂盒(批号:202111),均购自江苏酶免实业有限公司;CD68抗体(批号:2145312)、iNOS抗体(批号:2198541)、CD206抗体(批号:2115685)、FITC二抗(批号:2112395)、Fluor595二抗(批号:2115562)、山羊抗兔IgG(H+L)HRP(批号:2116615),均购自江苏亲科生物研究中心有限公司。
1.3 主要仪器CO2培养箱,德国Binder公司;SWCJ型超净台,苏州净化仪器厂;AE2000型倒置相差显微镜,中国麦克奥迪实业集团有限公司;CCL-170T-8型三气培养箱,新加坡Esco公司;GeneSpeed 416型低速离心机,美国基因公司;电泳槽、转印槽、电泳仪及凝胶成像系统,美国Bio-Rad公司;Tecan酶标仪,瑞士帝肯公司。
1.4 BV2细胞生长曲线测定将BV2细胞稳定传3代后进行实验。细胞在培养瓶中生长至80%时进行洗脱,使用完全培养基分别稀释细胞密度为2×104、4×104、8×104、1×105、2×105、4×105个·mL-1;将细胞悬液接种在96孔板中,每个密度接种7份,每份平行6孔;每孔接种100μL,使每孔中的细胞数分别为2×103、4×103、8×103、1×104、2×104、4×104个;将接种后的培养板置于37℃、5%CO2培养箱中培养;每隔24 h弃去原培养基,加入含10%CCK-8的完全培养基,孵育2 h后采用酶标仪测定450 nm处的吸光度。生长曲线测定持续7 d。
1.5 OGD/R模型复制BV2细胞生长至80%左右,吸弃细胞培养液,PBS洗涤5次后,加入DMEM无糖培养基;在培养箱中孵育10 min后,置于缺氧小室(含1%O2、5%CO2、94%N2)中进行氧糖剥夺操作,在37℃下培养3 h;吸弃DMEM无糖培养基,加入完全培养基,重新置于正常氧浓度的培养箱中复氧6 h,即为OGD/R模型。
1.6 细胞分组及给药课题组前期通过预实验考察了0.1~40μg·mL-1毛蕊异黄酮对OGD/R模型小胶质细胞活力的影响,结果发现5~20μg·mL-1毛蕊异黄酮能有效提高OGD/R模型细胞的活力(P<0.01)。因此,选择毛蕊异黄酮5、10、20μg·mL-1浓度进行后续实验。
选取对数生长期的BV2细胞,置于6孔培养板中培养,将细胞随机分为6组:正常组、模型组、尼莫地平组(5μg·mL-1)、毛蕊异黄酮高剂量组(20μg·mL-1)、毛蕊异黄酮中剂量组(10μg·mL-1)、毛蕊异黄酮低剂量组(5μg·mL-1)。正常组细胞始终在正常条件下培养;其他各组细胞按照“1.5”项下氧糖剥夺3 h后,模型组将无糖培养基换成完全培养基,各给药组换成含药的完全培养基,然后复氧6 h。
1.7 CCK-8法检测细胞活力选择对数生长期的BV2细胞,以1×104个·mL-1的密度接种于96孔板,培养24 h后,按照“1.6”项下分组及干预,每组设6个复孔。给药结束后,每孔加入10μL CCK-8溶液,37℃下孵育2 h;采用酶标仪在450 nm波长下检测各孔吸光度(A)值,计算:细胞活力(%)=(A实验组-A空白孔)/(A对照组-A空白孔)×100%。
1.8 细胞上清液中NO含量测定选择对数生长期的BV2细胞,以1×104个·mL-1的密度接种于96孔板,培养24 h后,按照“1.6”项下分组及干预,每组设6个复孔。收集处理后的细胞上清液,按照试剂盒说明书步骤操作,测定上清液中的NO含量。
1.9 ELASA法检测细胞上清液中的TNF-α、IL-1β、IL-10含量以2×105个·mL-1的密度将对数生长期的BV2细胞接种到6孔板中,培养24 h后,按照“1.6”项下分组及干预,每组设6个复孔。收集处理后的细胞上清液,按试剂盒说明书操作步骤,采用ELASA法测定TNF-α、IL-1β、IL-10含量。
1.10 免疫荧光双染法检测BV2细胞极化选择对数生长期的BV2细胞,以每孔3×105个细胞密度接种到24孔板中(含爬片),随机分为正常组、模型组及毛蕊异黄酮组(10μg·mL-1)。BV2细胞干预同“1.6”项下;复氧6 h后,弃去上清液,PBS洗涤3次;加入4%多聚甲醛溶液固定20 min,PBS洗涤3次后,用0.2%TritonX-100透化10 min;再用5%BSA封闭30 min后,加入鼠抗CD68(1∶200)和兔抗iNOS(1∶200),4℃下孵育过夜;次日,在避光条件下分别滴加荧光二抗山羊抗兔FITC(1∶250)和山羊抗鼠Fluor595(1∶250),室温下孵育1 h;PBS洗涤3次,加入Hochest染料染核10 min;最后,加入抗荧光淬灭剂,封片后在显微镜下观察并采集图像,进行荧光强度分析。
1.11 Western Blot法检测BV2细胞的iNOS、CD206蛋白表达水平选择对数生长期的BV2细胞,以每孔4×106个细胞密度接种到6孔板中,随机分为正常组、模型组及毛蕊异黄酮组(10μg·mL-1)。BV2细胞干预同“1.6”项下;复氧6 h后,收集细胞。采用RIPA裂解细胞,以BCA法进行总蛋白定量;制备蛋白样品,进行SDS-聚丙烯酰胺凝胶电泳(PAGE),将蛋白转移至PVDF膜上;用5%脱脂牛奶封闭2 h后,加入兔抗iNOS(1∶1 000)、兔抗CD206(1∶1 000)一抗,4℃下孵育过夜;TBST充分漂洗后,加入HRP标记的二抗,室温下孵育1 h;采用全自动化学发光图像分析仪显影成像,以β-actin为内参,采用ImageJ软件对目的蛋白进行半定量分析。
1.12 统计学处理方法采用SPSS 19.0统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 BV2细胞的生长曲线细胞生长曲线是判定细胞活力的重要指标,是培养细胞生物学特性的基本参数之一。由图1可见,BV2细胞在种板后密度为8×103、1×104、2×104、4×104个·mL-1的细胞生长迅速,接种后第2天处于对数生长期;密度为2×103、4×103个·mL-1的细胞在接种后始终生长缓慢。根据生长曲线,选择密度为1×104个·mL-1的对数生长期(即接种后第2天)细胞进行后续实验。
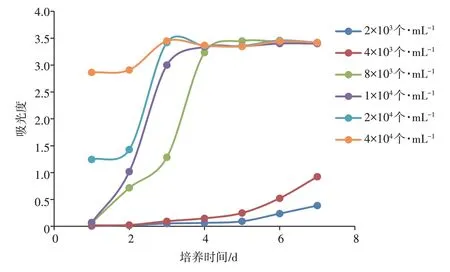
图1 BV2细胞的生长曲线Figure 1 Growth curve of BV2 cells
2.2 BV2细胞造模前后的形态变化结果见图2。BV2小胶质细胞静息状态下呈分枝状,被激活后细胞形态发生明显改变,细胞变大、边缘模糊且去分枝化,变成阿米巴样。
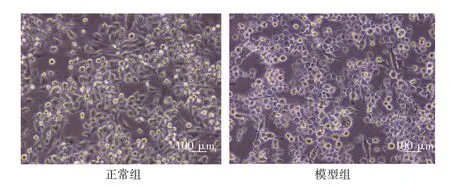
图2 BV2细胞形态Figure 2 BV2 cellsmorphology
2.3 毛蕊异黄酮对BV2细胞活力的影响结果见图3。与正常组比较,模型组的BV2细胞活力显著降低(P<0.01)。与模型组比较,毛蕊异黄酮低、中、高剂量组及尼莫地平组的BV2细胞活力显著提高(P<0.01)。结果表明,5、10、20μg·mL-1毛蕊异黄酮可以提高OGD/R模型BV2细胞的存活率。

注:与正常组比较,##P<0.01;与模型组比较,**P<0.01图3 毛蕊异黄酮对BV2细胞活性的影响(±s,n=6)Figure 3 Effect of calycosin on the activity of BV2 cells(±s,n=6)
2.4 毛蕊异黄酮对BV2细胞NO水平的影响结果见图4。与正常组比较,模型组BV2细胞的NO水平明显升高(P<0.05)。与模型组比较,毛蕊异黄酮低、中、高剂量组及尼莫地平组BV2细胞的NO水平明显降低(P<0.05)。结果表明,毛蕊异黄酮能降低OGD/R引起的BV2细胞的氧化损伤。
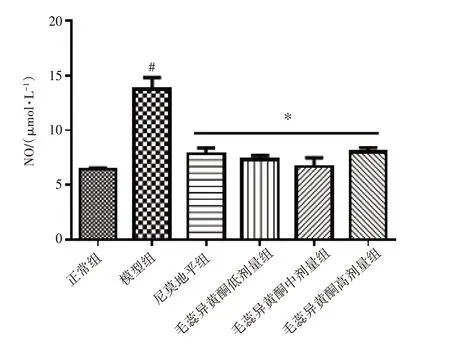
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05图4 毛蕊异黄酮对BV2细胞上清液中NO含量的影响(±s,n=6)Figure 4 Effect of calycosin on the content of NO in the supernatant of BV2 cells(±s,n=6)
2.5 毛蕊异黄酮对BV2细胞炎性因子水平的影响结果见图5。与正常组比较,模型组BV2细胞的IL-10水平明显降低(P<0.05),TNF-α、IL-1β水平明显升高(P<0.05)。与模型组比较,毛蕊异黄酮苷高、中、低剂量组及尼莫地平组BV2细胞的IL-10水平明显升高(P<0.05),TNF-α、IL-1β水平明显降低(P<0.05)。

注:与正常组比较,#P<0.05;与模型组比较,*P<0.05图5 毛蕊异黄酮对BV2细胞上清液中TNF-α、IL-1β及IL-10含量的影响(±s,n=6)Figure 5 Effects of calycosin on the contents of TNF-α,IL-1βand IL-10 in the supernatant of BV2 cells(±s,n=6)
2.6 毛蕊异黄酮对BV2细胞分型的影响结果见图6。与正常组比较,模型组BV2细胞的M1型小胶质细胞标记物iNOS表达显著增强(P<0.01)。与模型组比较,毛蕊异黄酮(10μg·mL-1)组BV2细胞的iNOS表达显著减弱(P<0.01)。结果表明,毛蕊异黄酮能够减少M1型小胶质细胞的表达。
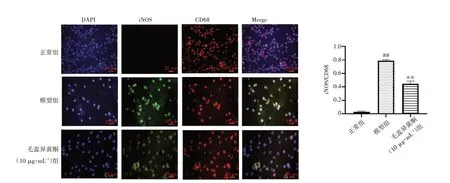
注:蓝色荧光为细胞核;红色荧光标记小胶质细胞(CD68);绿色荧光为iNOS表达;标尺=20μm。与正常组比较,##P<0.01;与模型组比较,**P<0.01图6 毛蕊异黄酮对BV2细胞中iNOS表达的影响(±s,n=3)Figure 6 Effect of calycosin on the expression of iNOS in BV2 cells(±s,n=3)
2.7 毛蕊异黄酮对BV2细胞iNOS、CD206蛋白表达的影响结果见图7。与正常组比较,模型组BV2细胞的M1型细胞标志物iNOS蛋白表达明显上调(P<0.05),M2型细胞标志物CD206蛋白表达明显下调(P<0.05)。与模型组比较,毛蕊异黄酮(10μg·m L-1)组BV2细胞的iNOS蛋白表达明显下调(P<0.05),CD206蛋白表达明显上调(P<0.05)。结果表明,毛蕊异黄酮能够减少M1型小胶质细胞的表达,而增加M2型小胶质细胞的表达。
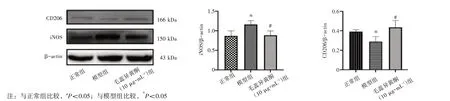
图7 毛蕊异黄酮对BV2细胞中iNOS、CD206蛋白表达的影响(±s,n=3)Figure 7 Effects of calycosin on the protein expressions of iNOS and CD206 in BV2 cells(±s,n=3)
3 讨论
小胶质细胞作为中枢神经系统(CNS)中的免疫细胞,存在于脊椎动物的大脑中[7],约占所有神经胶质细胞的5%~12%[8]。小胶质细胞很活跃,通过与神经元突触的特异性相互作用调节神经回路[9-10],参与整理和清除凋亡细胞,以保证中枢系统的稳定[11-12]。
研究[13]表明,脑缺血1 h再灌注24 h后,缺血核心中小胶质细胞标记物CD11b表达增加,表明该区域的小胶质细胞被激活。脑缺血炎症过程的特征在于脑内小胶质细胞及其他免疫细胞快速被激活,引起强烈的炎性反应,释放炎性因子,从而加重脑缺血损伤[14]。活化的小胶质细胞存在M1、M2两种不同表型,可能具有有害或有益双重作用[15]。从形态上来看,静息状态下小胶质细胞呈现分枝状,可以起到修复神经元的作用,而活化的小胶质细胞呈肥大状[16-17]。从释放因子来看,M1型小胶质细胞处于激活状态,会产生炎症因子如白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)等,并产生炎性反应;而M2型小胶质细胞处于激活状态,可产生抗炎因子如转化生长因子β(TGF-β)、脑源性神经营养因子(BDNF)等,对大脑具有保护作用[18-19]。因此,在缺血性脑中风发展的关键时刻抑制小胶质细胞M1表型或刺激M2表型可能是治疗脑缺血性损伤的重要策略。
毛蕊异黄酮是黄芪重要的活性成分之一,其分子量小,易于透过血脑屏障,对脑卒中、脑缺血、脑出血、大脑退行性疾病、糖尿病性脑病和阿尔兹海默症等疾病导致的脑损伤具有保护作用[20]。ERK1/2和NF-κB磷酸化是糖基化终产物诱导炎症的关键下游信号,毛蕊异黄酮能通过抑制ERK1/2和NF-κB磷酸化参与抗炎相关机制[21]。研究[22]发现,毛蕊异黄酮能减轻脑缺血损伤大鼠的脑水肿及梗塞面积,上调P62、NBR1及Bcl-2表达,下调TNF-α表达。毛蕊异黄酮还能抑制NF-κB和MAPK信号通路相关蛋白表达,减少促炎因子NO、PGE-2、TNF-α、IL-1β和IL-6产生,抑制脂多糖诱导的巨噬细胞中炎性介质iNOS、COX-2 mRNA表达[23]。鉴于毛蕊异黄酮的抗炎活性,有研究[24]认为毛蕊异黄酮对促炎因子TNF-α等的抑制作用可能是其抗脑缺血损伤的重要机制之一,降低相关炎性介质水平可能是其改善脑损伤的作用基础。但目前关于毛蕊异黄酮脑保护作用的更深层次研究较少,具体的作用机制及准确靶点还有待深入探讨。
尼莫地平为1,4-二氢吡啶类钙离子拮抗剂,易透过血脑屏障,能有效阻止钙离子进入细胞内部,抑制平滑肌收缩,解除血管痉挛,从而保护脑神经元,增进脑血灌流,改善脑供血,提高对缺氧的耐受力。本研究采用BV2细胞复制氧糖剥夺再灌注(OGD/R)体外模型,机制与尼莫地平治疗作用一致,故参考相关研究[25-26]选择其为阳性对照药。
本研究结果显示,毛蕊异黄酮能够提高OGD/R模型BV2细胞的存活率,降低NO、TNF-α、IL-1β水平,提高IL-10水平,下调M1型细胞标志物iNOS蛋白表达,上调M2型细胞标志物CD206蛋白表达。结果表明,毛蕊异黄酮能促进小胶质细胞转化为抗炎的M2型,并抑制促炎的M1型表达,减少炎性介质的产生,降低氧化损伤,对缺血后脑组织损伤具有保护作用。
