一种新型氧合器的设计、数值仿真与实验研究
2024-05-16岳明昊张世耀李纪念刘会超苏子华王亚伟陈增胜林世航李晋渝成雅科胡永飞贾存鼎徐明洲
岳明昊,张世耀,李纪念,刘会超,苏子华,王亚伟,陈增胜,林世航,李晋渝,成雅科,胡永飞,贾存鼎,徐明洲*
(1.北京航天长峰股份有限公司,北京 100039;2.北京航空航天大学,北京 100191)
0 引言
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是体外循环领域最先进的技术之一,ECMO 设备属于重症救治领域的高端医疗器械。ECMO 设备的研制、生产能力在一定程度上代表了一个国家的高端医疗器械科技水平[1-4]。氧合器是ECMO 设备的核心部件,主要功能是进行血氧交换和二氧化碳清除。
在氧合器设计中,血流通路的设计十分重要,会直接影响氧合器跨膜压差、传热性能和血氧交换性能。目前临床应用中ECMO 设备存在长时间运行的情况,因此血栓发生率高、血氧交换效率降低的问题较常见。这与氧合器整体血流流路设计不好,存在大量流动死区,导致血液流通扩散效率不佳,使一部分红细胞无法及时进行血氧交换等原因有关[5-6]。
基于ANSYS FLUENT(下文简称“ FLUENT”)软件的流场仿真技术[7-8],长期以来一直应用于氧合器血液流场设计中,该仿真技术在分析氧合器内部流场(如压力、速度、血液损伤、血氧交换等)参数方面具有一定优势,该技术的应用能够节约研发成本,缩短研发周期,对后续工程化具有指导意义。
本研究在现有氧合器的基础上设计一款新型氧合器,其综合性能明显提高。本文利用FLUENT 软件对其进行数值仿真,并对氧合器样机进行性能实测,通过与Quadrox 氧合器进行对比,验证本文设计氧合器的优越性和创新性。
1 氧合器血液通路设计
氧合器共包括血液通路、气体通路和水通路,其设计重点在于血液通路的拓扑结构,因为血液通路在整个氧合器内部占据了80%左右的空间,其优劣直接决定了热交换和血氧交换效率,同时影响血栓的形成。本文重点研究血液通路的设计,对热水流动和血氧交换进行等效仿真。
以市场占有率第一的迈柯唯Quadrox PLS-i 氧合器(下文简称“ Quadrox 氧合器”)为例,该氧合器内部血液过流断面的分布为方形,工作时静脉血液从方形腔室底部流入,经过热交换和血氧交换之后从对侧方形腔室底部流出,这种进出方式的不足之处是大部分血液都从氧合器中下部流动至出口,氧合器中上部膜丝利用率不高,更重要的是经临床证实[9-10]在方形氧合器血液流动方向发生明显转折的顶角位置处存在较大的流动死区(流动长期滞留区),因此容易引发血栓。本文设计氧合器血液通过位于入口面几何中心的入口流入,并均匀分布到缓冲区域四周,每个方向血液到达氧合器边缘所经过的路程基本一致,流场和压力场分布均匀,此后血液在重力作用下从上往下依次通过热交换水丝(下文简称“水丝”)和中空纤维膜丝(下文简称“膜丝”),最后汇集到氧合器底部出口流出。该设计的优点包括:(1)增加水丝、膜丝和血液接触面积,可提高水丝和膜丝利用率,提升热交换和血氧交换效率;(2)全面改善氧合器内部血流动力学性能,使血液均匀通过所有水丝、膜丝,流场和压力场,消除流动死区,减小氧合器跨膜压差,降低红细胞损伤及血栓发生概率。
本文设计氧合器的血液通路及各功能区示意图如图1 所示。其血液流场基本外形为扁平圆柱体,血液从位于入口面几何中心的入口流入氧合器,随即向四周扩散,充满整个入口缓冲区,依次经过热交换区、血氧交换区和出口缓冲区,最终到达位于出口面底部的血液出口,从而流出氧合器进入人体。
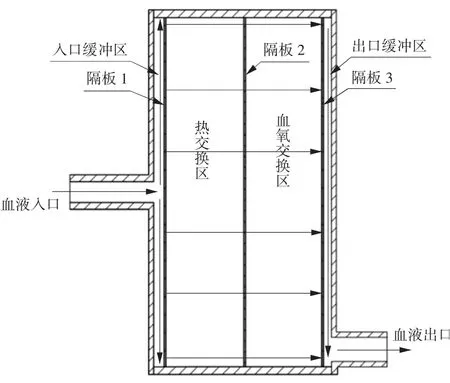
图1 本文设计氧合器的血液通路及各功能区示意图
2 氧合器血液通路数值仿真
2.1 三维建模
基于图1 的设计,对本文设计氧合器的血液通路拓扑结构进行了三维建模,模型示意图如图2所示。血液通路的主体部分为一个扁平圆柱体,其内部被3 个隔板分成4 个区域,隔板起到固定膜丝的作用,其上开有小孔,能够保证血液的顺利通过及均匀分布。
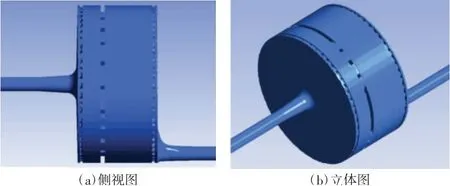
图2 本文设计氧合器的血液通路三维模型示意图
2.2 网格划分
本文采用ANSYS ICEM CFD 软件对氧合器三维模型进行非结构网格划分,划分网格前将整个流场切分成多个区域,包括血液入口段及入口缓冲区(紫色区域)、热交换区(绿色区域)、血氧交换区(红色区域)、出口缓冲区及血液出口段(蓝色区域),每个区域为一个单独的流动区域。对流场区域进行非结构网格划分,其示意图如图3 所示,该图体现了网格局部尺寸与整体尺寸的比例关系、不同功能分区的相对位置及隔板上小孔的布置情况。整个模型的网格总数约900 万,经过前期验证,已达到网格无关解的要求。
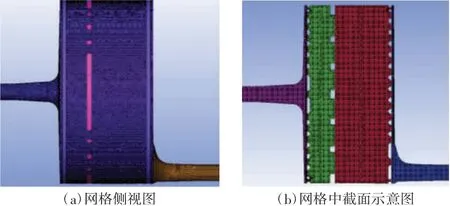
图3 本文设计氧合器的网格示意图
2.3 压力及速度仿真
氧合器内部包含4 000 多根水丝和10 000 多根膜丝,如果按照真实尺寸对所有水丝(外径600 μm)和膜丝(外径380 μm)进行建模、网格划分和流场仿真,所需时间及计算资源将远远超出普通工作站的承受能力。为解决该问题,使用ANSYS FLUENT 软件以多孔介质模型等效替代水丝和膜丝区域[11-12]。使用该模型的最大优势在于省去了膜丝和水丝的三维建模过程,缩短了网格划分的时间,从而节约了计算资源,同时能够较为准确地反映真实膜丝和水丝存在时对流场压力、速度等方面的影响。该模型定义了一个具有多孔介质特征的流体区域,流体经过该区域产生的压力损失由输入多孔介质动量方程中的内容来决定,具体可设置方向、黏性阻力系数、惯性阻力系数以及孔隙率等参数。除了定义多孔介质相关参数外,还需要对湍流模型(默认选择SST K-omega)、血液参数(主要涉及密度、黏性)、入口边界条件及相关选项(如流速、压力、水力直径等)、出口边界条件及相关选项进行设置,对氧合器流场进行稳态仿真,再对血液流量为1、3、5、7 L/min 的具体情况进行仿真。取中截面作为云图显示位置,以临床应用最多的血液流量5 L/min 为例,提取该截面上的压力云图和速度云图,如图4 所示。
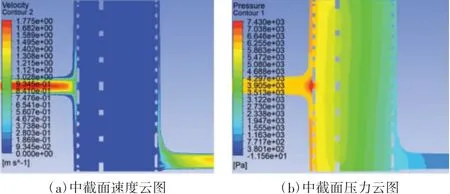
图4 本文设计氧合器的中截面流场云图
氧合器入口与出口的压力差称为跨膜压差,跨膜压差的增加通常表明氧合器中有堵塞,通常是由血栓形成所导致[13],因此,跨膜压差成为氧合器设计中非常重要的指标。在相同血液流量情况下,如果该值较低,则表示氧合器性能较好。在中截面压力云图的血液入口段和血液出口段,分别选取适当位置获得2 段各自平均压力,二者相减即得到跨膜压差。通过仿真计算,得出的跨膜压差值为34.8 mmHg(1 mmHg=133.32 Pa)。目前临床应用较多的几款氧合器[14-15]在血液流量为5 L/min 时,其跨膜压差为40~50 mmHg。本文设计氧合器由于对流场进行了创新性设计,其跨膜压差低于40 mmHg,性能更加优越。
2.4 热交换仿真
将本文设计氧合器的第1 部分多孔介质区域作为热交换区,该区域内有交替叠放的水丝,水丝内部有流动的恒温热水,其温度高于血液温度,从而能对流经水丝外表面的血液起到加热作用。该部分采用多孔介质模型的非平衡热模型进行仿真,重点设置了交界面密度和热导率。之后,FLUENT 软件会自动生成1 个与多孔介质区域重合的固体区域,该区域需要设置内部发热率等参数。仿真设定热水温度为313 K(40 ℃),入口血液温度为303 K(30 ℃),热交换区保持恒温的重点在于血氧交换区的温度升高。本文仿真设计氧合器在水流量为10 L/min,血液流量为1、3、5、7 L/min 时的温度升高情况,以血液流量3、5 L/min 为例提取中截面温度场,如图5 所示。
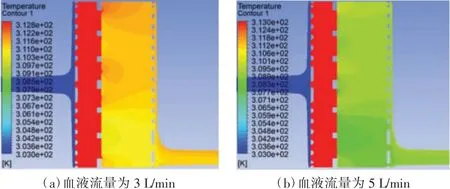
图5 本文设计氧合器的中截面温度场云图
由图5 可知,由于热交换区有恒温热水,所以该区域的温度始终保持在313 K(40 ℃)左右。当血液流量分别为3、5 L/min 时,血液在血氧交换区的温度有所下降,流至出口时其温度分别为310 K(37 ℃)和309 K(36.5 ℃),均与人体温度较为接近,对入口血液的加热效果较为明显。另外,随着血液流量增多与血液流速加快,相同时间内被加热的血液量增多,相同量的血液在流经热交换区的时间缩短,因此加热效果有所减弱,符合客观事实。
2.5 血氧交换仿真
氧合器工作时,膜丝内部空腔通有高体积分数氧气,膜丝外部有静脉血液流过。膜丝内部氧气体积分数高于膜丝外部静脉血液氧气体积分数,氧气由高体积分数区向低体积分数区扩散,氧气从膜丝内部传输到静脉血液进行血氧交换。根据相关理论[16],氧分压及血氧交换相关计算方法如下:
氧气在血液中的有效扩散系数Deff计算公式为
式中,DO2为氧气扩散系数;λO2为与血红蛋白摄取氧气有关的氧分压PO2的函数,并且与血红蛋白解离曲线斜率成比例,通过希尔方程描述为
式中,SO2为氧饱和度;P50为血氧饱和度50%所对应的氧分压;n为希尔常数。
λO2计算公式为
式中,Ch为血红蛋白浓度;KO2为氧气的质量传输系数(实验值)。
氧分压计算公式为
式中,dx为x方向上的偏导数;α 为氧气在血液中的溶解度;ε 为膜丝或水丝的孔隙率;β 为由实验拟合的经验系数;d为膜丝的直径;A为单位体积膜丝或水丝表面积;μ 为动力粘度;Q为血液体积流量;ρ 为血液密度;P'O2为膜丝内部的氧分压。通过氧分压可以估算出血氧交换率计算公式为
式中,mO2为血氧交换率;ΔPO2和ΔSO2为氧合器出入口处的氧分压和氧饱和度的差值。
根据以上内容,使用自定义标量了本文设计氧合器内部血氧交换过程,其中氧合器入口处的氧饱和度设置为60%。以血液流量5 L/min 为例,提取了该截面上的氧分压云图和氧饱和度云图(如图6 所示),并计算得到本文设计氧合器血氧交换率为357mL/min。
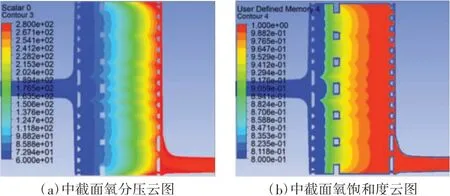
图6 本文设计氧合器的中截面血氧交换云图
血氧交换率是氧合器最重要的指标,该指标直接决定了氧合器的性能,因此,须将其控制在合理范围内。目前临床应用较多的几款氧合器在血液流量为5 L/min 时,其血氧交换率在350~400 mL/min[12-13],本文设计氧合器的血氧交换率为357 L/min,因此本文设计氧合器的血氧交换率与临床应用氧合器水平一致。
2.6 Quadrox 氧合器性能仿真
Quadrox 氧合器为正方体,其横截面为菱形,同样分为2 个多孔介质区域,第1 区域为热交换与血氧交换混合区,第2 区域为血氧交换区,其三维几何模型如图7 所示。

图7 Quadrox 氧合器的血液通路三维模型示意图
通过仿真Quadrox 氧合器在血液流量5 L/min时的压力场、速度场、温度场及血氧交换情况(如图8 所示),所得跨膜压差为39.5 mmHg,血液出口温度为309.3 K(36.8 ℃),血氧交换率为325 mL/min。对比图6 与图8 的云图发现,在相同的最大值、最小值限定下,本文设计氧合器出口处的氧分压数值明显高于Quadrox 氧合器,氧饱和度云图中显示本文设计氧合器的氧饱和度明显优于Quadrox 氧合器,充分体现了本文设计氧合器在血氧交换方面的优越性能。
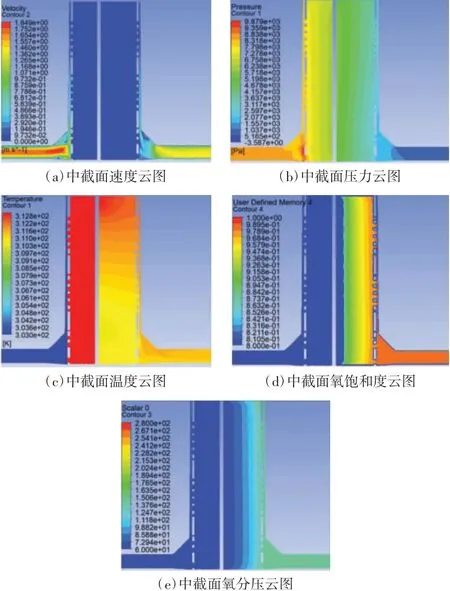
图8 Quadrox 氧合器仿真结果的中截面云图
将本文设计氧合器与Quadrox 氧合器在血液流量5 L/min 情况下的仿真值进行对比,详见表1。
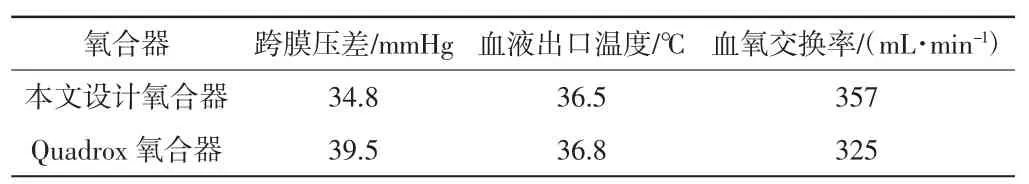
表1 2 种氧合器仿真值
2.7 流量均匀性对比
流量分布是否均匀是衡量流场优劣的重要指标,流量分布越均匀,流场各部分压力梯度、速度梯度越小,血液流动受到的阻力越小,红细胞损伤越小,同时膜丝、水丝的利用率也越高。
以血液流量5 L/min 为例仿真计算了流场流量。在氧合器的2 个多孔介质区垂直流动方向上截取中截面,在每个中截面上选取一系列取样平面(如图9所示),通过计算每个平面的质量流量,进而得到流量标准差(详见表2)。本文设计氧合器在热交换区以及血氧交换区的流量均匀性标准差均小于Quadrox氧合器,因此其流量均匀性优于Quadrox 氧合器。
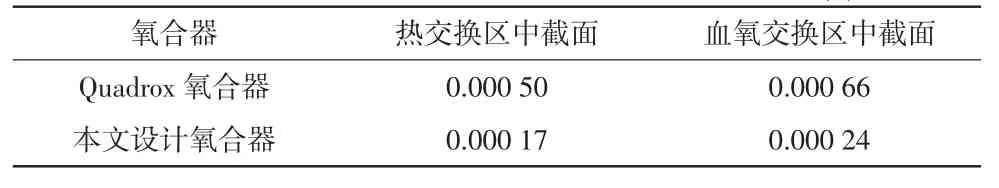
表2 2 种氧合器流场流量标准差单位:L/min
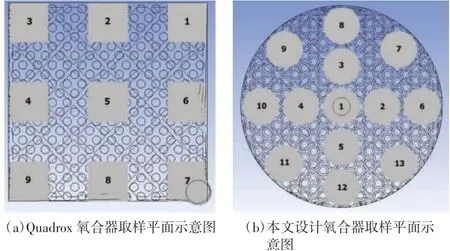
图9 2 种氧合器取样平面示意图
2.8 结论
通过仿真本文设计氧合器的压力场、速度场、温度场、血氧交换、流量均匀性,并以血液流量5 L/min为例,提取了中截面相关云图,计算了跨膜压差与血氧交换率。对比Quadrox 氧合器,本文设计氧合器整体性能与其处于同等水平,并在跨膜压差、血氧交换和流量均匀性方面优于Quadrox 氧合器,具有一定的优越性。
3 氧合器性能实验研究
3.1 循环回路搭建
根据设计和仿真制作了氧合器样机,将其用于循环回路的搭建,实验回路原理图如图10 所示。实验设备主要包括氧合器、血泵、储血罐、传感器及测试装置,主要对本文设计氧合器及Quadrox 氧合器的跨膜压差及血氧交换率进行测试。
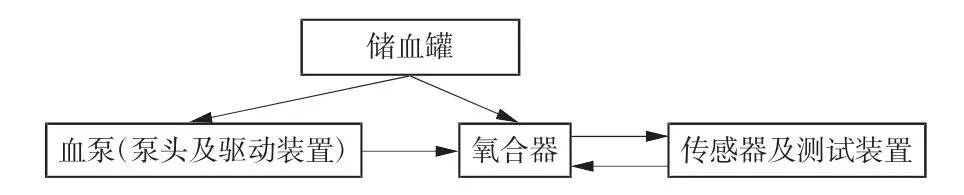
图10 实验回路原理图
3.2 实验结果与仿真结果对比
将实验得到的数据与本文设计氧合器和Quadrox氧合器相关仿真数据绘制成折线图,如图11、12 所示,可知本文设计氧合器仿真值与实验值吻合度较高,其误差在合理范围(15%以内)。分析造成误差的主要原因有:(1)仿真使用了多孔介质模型,未体现真实的膜丝、水丝;(2)仿真模型中所有结构的壁面均为光滑壁面,实际氧合器壳体具有一定粗糙度;(3)仅对血液通路进行了仿真,实际氧合器包括气路、水路和血液通路,其结构比仿真所用几何模型复杂;(4)血氧交换模型与实际复杂的血氧交换过程相比存在一定程度的简化,以上因素导致跨膜压差的仿真值小于实验值,血氧交换率的仿真值大于实验值。同时,本文设计氧合器跨膜压差实验值低于Quadrox 氧合器实验值,证明本文设计氧合器在跨膜压差上优于Quadrox 氧合器;另外,本文设计氧合器血氧交换率实验值高于Quadrox 氧合器实验值,证明本文设计氧合器在血氧交换率上优于Quadrox 氧合器。

图11 跨膜压差折线图
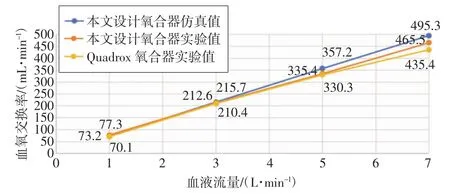
图12 血氧交换率折线图
4 结语
本文提出了一种新型氧合器的设计方案,并通过数值仿真和实验测试2 种方式对其进行了研究,结果表明,在跨膜压差、血氧交换效率方面,本文设计氧合器均优于Quadrox 氧合器,在一定程度上解决了氧合器存在的跨膜压差大、血氧交换效率低、易发血栓等问题。但本研究使用多孔介质模型替代真实的膜丝和水丝,未能将氧合器气路和水路的三维结构考虑进仿真模型中,因此存在一定误差。未来研究将致力于使用膜丝、水丝的三维模型代替多孔介质模型,同时全面考虑氧合器气路和水路的三维结构,并构建更加精确的血氧交换模型,以进一步提升仿真的准确性。
