去甲槟榔碱对慢性不可预知应激所致焦虑小鼠改善作用及机制研究
2024-05-14王丹阳孙源范蓓孙晶刘新民王凤忠卢聪
王丹阳 ,孙源,范蓓,孙晶,刘新民,王凤忠*,卢聪*
1.山西农业大学 食品科学与工程学院,山西 晋中 030801
2.中国农业科学院 农产品加工研究所,北京 100193
3.宁波大学 新药技术研究院,浙江 宁波 315211
槟榔Areca catechuL.为棕榈科槟榔属常绿乔木,是我国南部热带亚热带地区的经济作物之一,位列我国“四大南药”之首,具有较大的药食两用价值。槟榔在《中国药典》1953 年版中就有收载记录,且在《中国药典》2015 年版一部收载的槟榔相关饮片及成方制剂多达60 余种[1]。药用槟榔具有驱虫[2]、消肿镇痛[3]、消食化积[4]、抗炎[5]、抗病毒[6]、抗氧化[7-8]、抗疲劳[9-10]、抗衰老[4]、抗抑郁[11]、抗缺氧[12]、抗血栓[13]、抗肿瘤[14]、降血糖[15-16]、保护血管[17]、改善肠胃功能[18-19]等多种功效。
焦虑症表现为持续性的紧张、不安、惊恐,并伴有自主神经功能紊乱及运动性不安等症状[20-21]。焦虑症的终身患病率最高,影响全球近30%人群的寿命,随着生活节奏的加快,学习工作压力的增大,焦虑症已成为当今社会危害人类身体健康的主要疾病,对焦虑症的治疗成为国际研究的热点[22]。目前,市售主要化学药物包括苯二氮䓬类药物和5-羟色胺(5-HT)再摄取抑制剂,为临床常用治疗药物,其疗效显著,但也存在诸多不良反应[23-25]。
在人们对健康的认知水平提高、对健康的追求也日渐增加的背景下,药食同源食品契合了当代人们的需求,同时药食同源产业是国家发展“健康中国”战略中至关重要的一环,展示出了巨大的市场前景和发展潜力。然而目前槟榔产业应用不足,国家市场监管总局2020 年最新修订的《食品生产许可分类目录》里未将“食用槟榔”收录在内,意味着槟榔不再作为食品来管理,也不能颁发食品生产许可[26-27],槟榔国家食品安全标准尚无,相关的《食用槟榔》(DB46/T75-2007)等食品质量海南地方标准无法修订和升级,且槟榔仍未列入国家药食同源目录,导致其作为食品的生产许可和监管已缺乏依据。尤其2021 年国家广播电视总局办公厅发出明确指出停止利用任何媒体宣传推销槟榔及其制品的通知[28-29],使我国槟榔产业发展遭遇“滑铁卢”,面临生存危机。因此,面对当前形势,深入挖掘槟榔功能因子,解析其健康效应的作用机制,夯实槟榔基础理论,使其回归药用,引导槟榔行业转换思路谋求再发展,对提升槟榔产业具备现实意义。
生物碱被认为是槟榔中最主要的活性物质,对神经系统和消化系统具有较强的药理作用[30-32]。槟榔中主要生物碱包括槟榔碱、槟榔次碱、去甲基槟榔碱、去甲基槟榔次碱等[33],其总生物碱质量分数为0.3%~0.7%[34]。Jain 等[35]建立一种液相色谱-质谱联用(LC-MS)方法同时定量4 种生物碱。张莹等[36]采用高效液相色谱法测定达原饮中槟榔生物碱的含量,结果发现,达原饮药液中去甲槟榔碱的质量分数为0.014 mg/mL。刘月丽等[28]研究发现,槟榔提取物能改善衰老小鼠的学习记忆能力、脑组织抗氧化能力和组织学改变,有抗衰老作用。Siregar等[37]通过成年斑马鱼行为测试,发现暴露于去甲槟榔碱的斑马鱼的攻击性减少,表现出异常的探索行为。作为槟榔中一种生物碱有效成分,去甲槟榔碱的活性尤其抗焦虑功能尚未见报道,其具体作用机制不明。因此本研究首次以去甲槟榔碱为研究对象,采用经典的慢性不可预知温和应激所致小鼠焦虑模型在动物行为学水平筛选评价去甲槟榔碱在体内的神经活性,并采用分子生物学手段探索其发挥抗焦虑活性的作用机制,旨在探究去甲槟榔碱的体内抗焦虑活性及可能的作用机制,为全面揭示槟榔健康功效提供数据支持并为槟榔资源的开发利用奠定理论基础。
1 材料与方法
1.1 实验材料
1.1.1 试剂 去甲槟榔碱(货号N23911,质量分数≥98%,上海吉至生化科技有限公司)。地西泮片(山东信宜制药有限公司,批号220802)。
1.1.2 实验动物 SPF 级C57/BL6 小鼠72 只,雄性,体质量18.0~22.0 g,购于北京维通利华实验动物技术有限公司,实验动物生产许可证号SCXK(粤)2019-0063,实验动物合格证号44829700011576,在湖南普瑞玛药物研究中心有限公司屏蔽环境D 区饲养,实验动物使用许可证号SYXK(湘)2020-0015。小鼠自由饮用食水,实验期间室内温度保持在22~24 ℃,相对湿度保持在(55±10)%,保持12 h 黑暗/12 h 照明的昼夜规律(8∶00~20∶00 亮灯)。本实验已通过中国农业科学院农产品加工研究所动物实验伦理委员会审核并获得批准(审批号SYXK-2023042384)。
1.1.3 试剂及仪器 超氧化物歧化酶(SOD)试剂盒(货号A001-3-2)、丙二醛(MDA)试剂盒(货号A003-1-2)、过氧化氢酶(CAT)试剂盒(货号A007-1-1)、皮质酮(Cort)试剂盒(货号H205)、白细胞介素(IL)-1β(IL-1β)试剂盒(货号H002-48)、IL-6 试剂盒(货号H007-1-1)、肿瘤坏死因子-α(TNF-α)试剂盒(货号H052)、多巴胺(DA)试剂盒(货号H170)、血清素/5-羟色胺(5-HT)试剂盒(货号H104)、小鼠去甲肾上腺素(NE)试剂盒(货号H096)、γ-氨基丁酸(GABA)试剂盒(货号H168),购自南京建成生物有限公司;Behav 动物行为分析系统(上海吉量科技有限公司);ME2002E 型电子天平(梅特勒公司)。
1.2 方法
1.2.1 分组与给药 根据C57/BL6小鼠体质量随机分为对照组、模型组、地西泮片2.5 mg/kg 组、去甲槟榔碱(10、20、40 mg/kg)组,每组12 只。依据文献报道[38-39]折算结合实验室前期预实验筛选确定药物剂量。除对照组外,其余小鼠每日随机接受各种不同应激源刺激,包括束缚12 h、45°倾笼12 h、禁食12 h、湿笼12 h、4 ℃冰水游泳10 min,频闪12 h、噪音30 min、禁水12 h、昼夜颠倒等刺激,每天随机安排,同一种刺激不能连续出现,使动物不能预见给予的刺激,每日2~3 种,造模时间持续14 d,造模同时各组小鼠ig 给药,对照组和模型组ig 给予纯水,其余各组小鼠分别ig 给予相应药液,给药体积为20 mL/kg,每天给药1 次,连续给药14 d后进行旷场、明暗箱、高架十字迷宫行为学实验。
1.2.2 检测指标 旷场检测:给药14 d 后末次给药后30 min,采用动物行为分析系统检测10 min 内小鼠旷场自主活动。明暗箱检测:小鼠旷场实验次日,进行明暗箱测试实验,记录小鼠10 min 内穿箱次数。采用动物行为分析系统检测小鼠在明暗箱内活动。高架十字迷宫:明暗箱实验次日,进行高架十字迷宫测试实验。采用动物行为分析系统检测小鼠闭臂进入次数、闭臂内活动路程。
1.2.3 生化指标测定 高架十字迷宫实验结束后进行取材。小鼠眼球提取血液样本,于4 ℃离心(3 500 r/min,10 min),吸取血清,于-80℃冰箱贮藏。采血后,将小鼠处死,在冰上迅速剥离出全脑组织,按序分装于0.5 mL 离心管中并放入液氮中暂存,取材结束统一贮藏于-80 ℃冰箱。血清生物标志物包括Cort、MDA、SOD、CAT,脑组织指标包括氧化因子MDA、SOD、CAT,神经递质NE、DA、5-HT、GABA,炎症因子TNF-α、IL-6、IL-1β,均严格按照各自试剂盒操作。
1.2.4 蛋白免疫印迹测定 取小鼠脑组织加入裂解缓冲液和磷酸酶抑制剂,匀浆后冰上裂解30 min,将混合物在4 ℃下13 000 r/min 离心4 min,取上清液,用BCA 检测试剂盒测定总蛋白浓度,加热使蛋白变性。配制8%分离胶,浓缩胶浓度为5%,等量蛋白质样品(30 μg)进行电泳(浓缩胶恒压90 V,约20 min;分离胶恒压120 V),根据相对分子质量进行分离。随后将分离的蛋白质转移到PVDF 膜上(300 mA 恒流,0.45 μm 孔径,60 min)。之后在4 ℃下一抗孵育过夜:NMDAR(1∶1 000)、CamkII(1∶1 000)、Kalirin(1∶1 000)、Rac(1∶1 000)、β-actin(1∶1 000)。孵育次日,用T-TBS 清洗膜3 次,每次10 min 以去除未结合的抗体。二抗孵育:5% BSATBST 稀释二抗,山羊抗兔IgG(H+L)HRP 1∶10 000,室温孵育1 h。ECL 滴加到膜的蛋白面,反应3~5 min;胶片曝光显影2 min,定影。使用凝胶图像分析系统进行蛋白质条带的可视化分析,使用Image J 软件将相对蛋白表达水平归一化为β-actin。
1.3 数据处理与统计分析
实验数据均采用SPSS 23.0 软件进行统计分析,数值以表示。使用GraphPad Prism 8.0.2 软件作图。
2 结果与分析
2.1 去甲槟榔碱对小鼠旷场活动的影响
如表1 所示,与对照组比较,模型组小鼠总路程、平均速度显著增加(P<0.01),活动次数、休息时间显著减少(P<0.05),表现出焦虑行为,说明造模成功。与模型组比较,去甲槟榔碱10、20 mg/kg 组小鼠总路程、平均速度显著降低(P<0.05、0.01)。去甲槟榔碱各剂量组小鼠活动次数显著增加(P<0.05、0.01);去甲槟榔碱20 mg/kg 组小鼠休息时间显著增加(P<0.05)。
表1 去甲槟榔碱对小鼠旷场活动的影响(,n =12)Table 1 Effects of guvacoline on open field test of mice (,n =12)

表1 去甲槟榔碱对小鼠旷场活动的影响(,n =12)Table 1 Effects of guvacoline on open field test of mice (,n =12)
与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01。*P < 0.05 **P < 0.01 vs control group;#P < 0.05 ##P < 0.01 vs model group.
2.2 去甲槟榔碱对小鼠在明暗箱实验中的影响
如表2 所示,与对照组比较,模型组小鼠穿箱次数、明室时间显著降低(P<0.05、0.01),表现出焦虑行为,说明造模成功。与模型组比较,去甲槟榔碱20 mg/kg 组小鼠穿箱次数显著增加(P<0.01)。
表2 去甲槟榔碱对小鼠明暗箱的影响(,n =12)Table 2 Effects of guvacoline on light-dark box test in mice(,n =12)

表2 去甲槟榔碱对小鼠明暗箱的影响(,n =12)Table 2 Effects of guvacoline on light-dark box test in mice(,n =12)
与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05##P<0.01。*P < 0.05 **P < 0.01 vs control group;#P < 0.05 ##P < 0.01 vs model group.
2.3 去甲槟榔碱对小鼠在高架十字迷宫实验中的影响
如表3 所示,与对照组比较,模型组小鼠闭臂总路程、闭臂进入次数显著升高(P<0.01)。表现出焦虑样行为,表明造模成功。与模型组比较,去甲槟榔碱各剂量组小鼠闭臂总路程、闭臂进入次数显著降低(P<0.01)。
表3 去甲槟榔碱对小鼠高架十字迷宫的影响(,n =12)Table 3 Effects of guvacoline on elevated plus maze test in mice (,n =12)
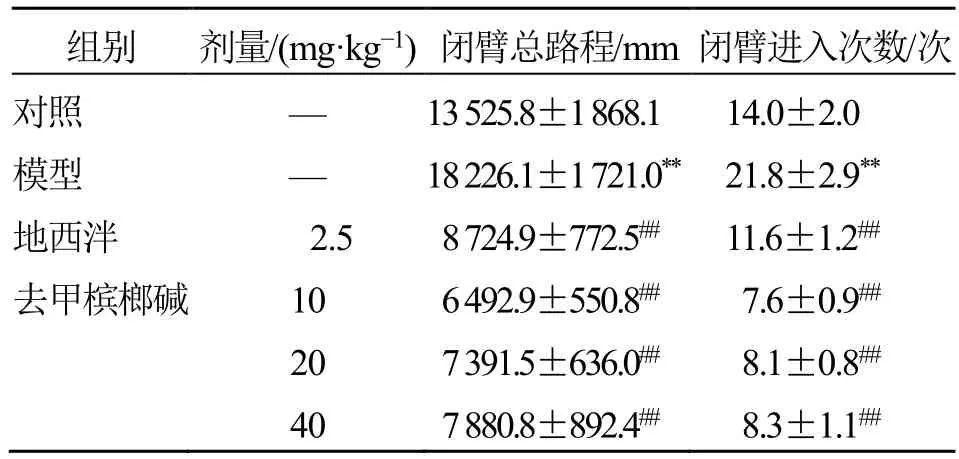
表3 去甲槟榔碱对小鼠高架十字迷宫的影响(,n =12)Table 3 Effects of guvacoline on elevated plus maze test in mice (,n =12)
与对照组比较:**P<0.01;与模型组比较:##P<0.01。**P < 0.01 vs control group;##P < 0.01 vs model group.
2.4 去甲槟榔碱对小鼠血清氧化应激指标的影响
如图1 所示,与模型组比较,去甲槟榔碱20、40 mg/kg 组小鼠Cort、MDA 显著降低(P<0.01、0.001),去甲槟榔碱各剂量组小鼠SOD、CAT 显著增加(P<0.05、0.001)。

图1 去甲槟榔碱对小鼠血清氧化应激指标的影响(,n =12)Fig.1 Effect of guvacoline on serum oxidative stress indexes in mice (,n =12)
2.5 去甲槟榔碱对小鼠脑组织中氧化应激指标的影响
如图2 所示,与模型组比较,去甲槟榔碱各剂量组小鼠MDA 含量显著降低(P<0.01、0.001),SOD、CAT 含量显著增加(P<0.001)。

图2 去甲槟榔碱对小鼠脑组织氧化应激指标的影响(,n =12)Fig.2 Effects of guvacoline on oxidative stress indexes in brain tissue of mice (,n =12)
2.6 去甲槟榔碱对小鼠脑组织中神经递质5-HT、DA、NE、GABA 释放的影响
如图3 所示,与模型组比较,去甲槟榔碱各剂量组小鼠的5-HT、DA、NE、GABA 含量显著增加(P<0.05、0.01、0.001)。

图3 去甲槟榔碱对脑组织中5-HT、DA、NE、GABA 的影响(,n =12)Fig.3 Effects of guvacolineon 5-HT,DA,NE and GABA in brain tissue (,n =12)
2.7 去甲槟榔碱对小鼠脑组织中细胞因子TNF-α、IL-6、IL-1β 的影响
如图4 所示,与模型组比较,去甲槟榔碱40 mg/kg 组小鼠TNF-α 含量显著降低(P<0.05),去甲槟榔碱各剂量组小鼠IL-6、IL-1β 含量显著降低(P<0.05、0.001)。

图4 去甲槟榔碱对脑组织中TNF-α、IL-6、IL-1β 的影响(,n =12)Fig.4 Effects of guvacoline on TNF-α,IL-6 and IL-1β in brain tissue (,n =12)
2.8 去甲槟榔碱对小鼠脑组织NMDAR/CamkⅡ/Rac 通路的影响
如图5 结果所示,与模型组相比,去甲槟榔碱40 mg/kg 组可显著上调 NMDARa、p-CamkII/CamkII、Kalirin/β-actin、Rac/β-Actin 蛋白表达(P<0.001)。
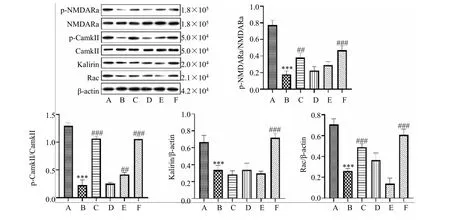
图5 去甲槟榔碱对慢性不可预知温和应激小鼠NMDAR/CamkⅡ/Rac 通路的影响(,n =3)Fig.5 Effect of guvacoline on NMDAR/CamkⅡ/Rac pathway in chronic unpredictable mild stress mice (,n =3)
3 讨论
焦虑症是一种以焦虑情绪为主要表现的神经症,是以广泛和持续发作性焦虑或反复发作性惊恐不安为主要特征的神经性障碍,常伴有躯体、认知和行为障碍,是一种常见的危害人类身心健康的精神疾病[40]。慢性不可预知温和应激已经成为一种广泛使用的啮齿类动物焦虑症模型[41],其是让大鼠或小鼠在持续2 周重复暴露于各种不可预测的轻度压力下,而形成与焦虑症患者相似的行为学改变,是国内外比较认可的焦虑模型,也是抗焦虑评价的主要动物模型。因此,本研究采用慢性不可预知性应激制备焦虑小鼠模型,通过旷场、明暗箱、高架十字迷宫等行为学评价小鼠焦虑样行为。本研究结果发现,在旷场中模型小鼠总路程、平均速度显著增加,活动次数、休息时间显著减少;在明暗箱实验中模型小鼠穿箱次数、明室时间显著降低;在高架十字迷宫实验中模型小鼠闭臂总路程、闭臂进入次数显著升高。结果表明本研究造模成功。
慢性应激导致下丘脑-垂体-肾上腺轴(HPA轴)的过度激活,这在焦虑的发展中起着关键作用。血清Cort 是啮齿动物中HPA 轴活性的生物标志物[42]。本研究通过测定血清Cort 水平来评估去甲槟榔碱对HPA 轴的影响。MDA 为脂质过氧化物,一定程度上反映细胞内的氧化程度[43],而抗氧化酶SOD、CAT 亦是抗氧化的重要影响因素[44-45],通过制约氧化损伤来维持细胞内氧化-抗氧化平衡。裴海月[39]研究发现,在连续给予槟榔14 d 后,小鼠体内SOD、CAT 活性明显升高且MDA 表达量显著下降,表明槟榔具有较好的抗氧化活性。本研究结果表明,去甲槟榔碱20、40 mg/kg 组可明显降低小鼠MDA 含量,且去甲槟榔碱各剂量组均能显著提高小鼠SOD 和CAT 表达水平,结果与之相一致。目前,抗焦虑药物的研究主要针对特定的神经递质系统,在单胺类神经递质假说中,神经细胞突触间隙的单胺类神经递质,如5-HT、DA 和NE 水平的降低是诱导神经性疾病,如焦虑、抑郁发生的主要原因之一[46]。据报道,肠道微生物群通过多种途径影响大脑,包括GABA 系统的变化,并导致多种精神障碍[47]。Johnston 等[48]研究发现,槟榔成分是大鼠脑切片中中枢抑制递质GABA 摄取的有效抑制剂。Chu[49]研究发现,槟榔中的生物碱是GABA 摄取的强抑制剂,咀嚼槟榔可能会影响交感神经功能,增加去甲肾上腺素的血浆浓度。本研究结果发现,去甲槟榔碱各剂量组显著增加小鼠5-HT、DA、NE 和GABA 含量,即去甲槟榔碱干预逆转了慢性不可预知温和应激诱导的5-HT、DA、NE 和GABA 水平下降,结果提示胆碱能系统功能改善是去甲槟榔碱发挥抗焦虑活性的潜在作用机制之一。IL-6、IL-1β具有较强的促炎活性[50],可诱导多种促炎介质,如细胞因子和趋化因子。IL-1β 对各种细胞有多种作用,并最终导致广泛的炎症事件[51]。与IL-1β 相似,TNF-α 是一种多效性促炎细胞因子,在调节多种发育和免疫过程中发挥着不同的作用,包括炎症、分化、脂质代谢和凋亡[52]。TNF-α 的调节失调与多种病理状况有关,如感染、自身免疫性疾病、癌症、动脉粥样硬化、阿尔茨海默病、炎症性肠病和椎间盘退变等[53-55]。Ma 等[56]根据来自动物和临床研究的数据,发现重度抑郁障碍患者的亚群具有增强的血浆TNF-α 水平的作用,阻断TNF-α 可以改善动物模型和临床试验中的抑郁症状。本研究中,去甲槟榔碱40 mg/kg 组干预使小鼠TNF-α 含量显著降低。结果与之相一致。NMDAR、CamkII、Kalirin、Rac 等蛋白或神经受体都与神经突触可塑性的改变密切相关。N-甲基-D-天冬氨酸受体(NMDAR)信号转导与啮齿动物的焦虑样行为有关。Jiang 等[57]研究表明,樱桃叶煎剂改善慢性不可预知温和应激引起的抑郁样行为与调节NMDAR 表达有关。结果发现,去甲槟榔碱40 mg/kg 组可显著上调NMDAR 蛋白表达、p-CamkII/CamkII、Kalirin/β-actin 及Rac/βactin。结果表明去甲槟榔碱可通过调控NMDAR/CamkⅡ/Rac 通路对焦虑小鼠起到改善作用。
综上,本研究首次发现了去甲槟榔碱具备显著抗焦虑活性,其作用机制与对抗氧化应激损伤、抑制神经炎性反应、调节神经递质水平以及NMDAR/CamkⅡ/Rac 信号通路有关,相关结果可为去甲槟榔碱神经功效挖掘提供新方向,并为槟榔功效成分研究利用提供理论依据。
利益冲突所有作者均声明不存在利益冲突
