1例头孢他啶阿维巴坦致四肢阵发性痉挛的药学监护Δ
2024-05-14周佳谭湘萍李洁娜邓燕红深圳市人民医院暨南大学第二临床医学院南方科技大学第一附属医院药学部广东深圳51800广州医科大学附属第三医院药学部广东省产科重大疾病重点实验室广州510150
周佳 ,谭湘萍 ,李洁娜 ,邓燕红 #(1.深圳市人民医院/暨南大学第二临床医学院/南方科技大学第一附属医院药学部,广东 深圳 51800;.广州医科大学附属第三医院药学部/广东省产科重大疾病重点实验室,广州 510150)
头孢他啶阿维巴坦钠(ceftazidime and avibactam sodium,CZA-AVI)是一种新型β-内酰胺酶抑制剂复方制剂,分别于2015年2月与2019年5月获美国FDA和我国国家药品监督管理局批准上市,用于治疗由多重耐药或泛耐药革兰氏阴性菌引起的复杂性腹腔内感染、医院获得性肺炎和呼吸机相关肺炎、复杂性尿路感染[1]。CZAAVI的临床安全性良好,常见的不良反应包括胃肠道反应、头痛头晕和转氨酶升高等,严重不良反应发生率低[2],药品说明书中注意事项提到接受头孢他啶治疗的患者有癫痫发作、脑病、昏迷和肌阵挛的报道[1]。CZAAVI作为一种新型酶抑制剂复方制剂,上市时间短,目前关于其神经系统毒性的报道不多。本文报道了临床药师参与1例重症肺炎患者使用CZA-AVI期间出现四肢阵发性痉挛的药学监护全过程,鉴别、分析并总结了抗菌药物导致神经系统毒性的临床表现、危险因素及处理方法等,为临床合理安全用药提供参考。
1 病例资料
患者,男性,83岁,身高176 cm,体重70 kg,因“反复咳嗽、气促20余年,再发1个月,加重3 d”于2022年4月30日就诊于广州医科大学附属第三医院(以下简称“我院”)呼吸与危重症医学科。患者有既往高血压史10余年,规律服用降压药,控制尚可;冠心病史40余年,用药情况不详;慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)史20余年,长期规律用药,控制尚可;否认糖尿病等其他慢病史。患者1个月余前因“咳嗽、气促加重伴嗜睡”于外院治疗,予无创呼吸机辅助通气、抗感染、化痰解痉等对症治疗后症状较前好转;近3 d病情出现恶化,为求进一步治疗转入我院。入院时,患者呈昏迷状态,口唇紫绀,呼吸急促,双肺闻及大量湿啰音,体温38.3 ℃,医师予小剂量多巴胺维持血压至102/60 mmHg(1 mmHg=0.133 kPa),脉搏110次/min,呼吸24次/min,外周血氧饱和度52%(10 L/min鼻导管吸氧)。
入院后辅助检查:血常规示白细胞(white blood cell,WBC)12.15×109L-1,中性粒细胞10.34×109L-1,中性粒细胞百分数(neutrophil ratio,N%)85.00%,红细胞3.48×1012L-1,血红蛋白107.00 g/L,血小板155.00×109L-1;感染指标示降钙素原(procalcitonin,PCT)2.04 ng/mL,C反应蛋白(C-reactive protein,CRP)137.35 mg/L;生化指标示尿素(blood urea nitrogen,BUN)11.34 mmol/L,血肌酐(serum creatinine,SCr)170 μmol/L;肝功能、凝血功能尚可。肺部胸片示双肺水肿合并炎症可能,双肺肺气肿,多发肺大泡,双侧少量胸腔积液。
入院初步诊断:(1)重症肺炎;(2)Ⅱ型呼吸衰竭;(3)感染性休克;(4)肺性脑病;(5)COPD。
2 主要治疗经过
入院后,医师立即予经鼻气管插管改善通气及氧合,行纤支镜检查+吸痰术,行右颈内静脉穿刺开放静脉通道。入院前,外院痰培养及药敏结果示耐碳青霉烯的铜绿假单胞菌(carbapenem-resistantPseudomonasaeruginosa,CRPA),对哌拉西林他唑巴坦和阿米卡星敏感,医师予注射用哌拉西林钠他唑巴坦钠4.5 g,q8 h+硫酸阿米卡星注射液0.4 g,qd,静脉滴注抗感染治疗,同时予盐酸氨溴索口服溶液和孟鲁司特钠片化痰平喘等对症支持治疗。
2022年5月3日患者体温热峰38.4 ℃,尿量2 000 mL。5月4日(入院第5天),患者呈嗜睡状态,格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分9T分(因插管无法测试言语的患者在评分后加“T”作为标记)(E3VTM6:E为睁眼反应,V为语言反应,M为肢体运动,数字代表每一项测试的评分),经鼻气管插管接呼吸机辅助通气,双肺呼吸音粗,可闻及湿啰音。血常规检查示WBC 8.89×109L-1,N% 82.10%;感染指标检查示PCT 2.61 ng/mL;生化指标检查示BUN 24.65 mmol/L,SCr 483 μmol/L(较前日明显升高)。患者呼吸、氧合及循环较前好转,但仍有反复低热。临床药师考虑SCr升高可能与使用阿米卡星有关,建议停用阿米卡星,待痰培养结果检出后再调整抗感染方案,医师予以采纳。
2022年5月6日(入院第7天),患者呈嗜睡状态,GCS评分8T分(E3VTM5),经鼻气管插管接呼吸机辅助通气。入院时患者的肺泡灌洗液培养为耐碳青霉烯的大肠埃希菌(carbapenem-resistantEscherichiacoli,CRECO),其只对替加环素、黏菌素敏感;而CRPA只对阿米卡星、黏菌素、CZA-AVI敏感。咽拭子筛查示耐碳青霉烯的肺炎克雷伯菌(carbapenem-resistantKlebsiella pneumoniae,CRKP)。医师考虑该患者为老年男性,病程急,且有COPD病史,可能的致病菌为CRPA、CRECO、CRKP。经哌拉西林他唑巴坦+阿米卡星抗感染治疗6 d,但PCT略有上升,近日仍反复低热,抗感染效果欠佳,结合肺泡灌洗液培养的药敏结果,医师停用哌拉西林他唑巴坦,改予注射用CZA-AVI 2.5 g,qd,静脉滴注+注射用多黏菌素B 50万单位,q12 h(首剂100万单位),静脉滴注+注射用多黏菌素B 25万单位,q12 h,雾化吸入抗感染治疗。
2022年5月11日(入院第12天),患者呈昏睡状态,GCS评分6T分(E2VTM4),经鼻气管插管接呼吸机辅助通气。血常规检查示WBC 12.19×109L-1,N% 73.80%;感染指标检查示PCT 0.86 ng/mL;生化检查示BUN 22.22 mmol/L,SCr 422 μmol/L。2日前的肺泡灌洗液培养为CRECO,其对替加环素、CZA-AVI、黏菌素敏感;CRPA对阿米卡星、CZA-AVI、黏菌素敏感。1日前的痰液培养为CRKP,其对替加环素、CZA-AVI、黏菌素敏感;CRPA对阿米卡星、CZA-AVI、黏菌素敏感。患者近日热峰降至38 ℃以下;双肺可闻及湿啰音,右侧有所减少。但前一日起患者神志较前变差,呈谵妄状态,四肢反复出现不自主痉挛,因患者短时间无脱离呼吸机的指征,医师行气管切开术。临床医师请临床药师会诊判断患者四肢痉挛是否与药物有关。临床药师查阅患者近期使用的所有药物、询问病史、综合分析患者病情及细菌培养结果,发现可疑药物较多,其中多黏菌素B、CZAAVI可疑性最大。因患者出现的四肢痉挛在使用多黏菌素B之后发生,故临床药师建议先停用多黏菌素B,暂继续使用CZA-AVI抗感染治疗,并建议CZA-AVI剂量减至1.25 g,qd和停用非必需的孟鲁司特钠,此外需排除患者缺血缺氧性脑病引起的癫痫发作。医师接受停用多黏菌素B和孟鲁司特钠的意见,但考虑患者目前感染严重,未采纳CZA-AVI减量的建议。
2022年5月15日(入院第16天),患者仍呈昏睡状态,GCS评分6T分(E2VTM4),气管切开接呼吸机辅助通气。血常规检查示WBC 9.27×109L-1,N% 77.10%;感染指标检查示PCT 0.63 ng/mL;生化指标检查示BUN 28.44 mmol/L,SCr 407 μmol/L。停用多黏菌素B后2 d,患者四肢痉挛发作频率和持续时间略有减少,但近2 d患者四肢痉挛发作又进行性加重,医师再次请临床药师会诊。临床药师考虑多黏菌素B的半衰期为9~11.5 h(肾功能不全者可能会延长),孟鲁司特钠的半衰期为2.5~5 h,多黏菌素B和孟鲁司特钠已停用4 d,理论上两药在患者体内已基本清除,但患者四肢痉挛仍未缓解,神志较前变差,头颅CT未见异常,不排除为CZA-AVI导致的神经毒性,遂建议停用CZA-AVI,医师予以采纳。
2022年5月17日(入院第18天,停用CZA-AVI第2天),患者神志较前好转,能唤醒,GCS评分为8T分(E3VTM5),四肢痉挛发作频率和持续时间较前明显减少;5月18日动态脑电图检查示未见癫痫样异常放电,医师考虑为药物作用脑电波,现已停用可疑药物,待进一步观察。血常规检查示WBC 10.94×109L-1,N%79.50%;感染指标检查示PCT 0.65 ng/mL;生化指标检查示BUN 23.59 mmol/L,SCr 273 μmol/L。
2022年5月22日(入院第23天,停用CZA-AVI第7天),患者偶有四肢不自主运动,GCS评分为10T分(E4VTM6)。血常规检查示WBC 10.14×109L-1,N%77.30%;感染指标检查示CRP 47.94 mg/L,PCT 0.38 ng/mL;生化指标检查示BUN 15.63 mmol/L,SCr 234 μmol/L;肝功能、凝血功能正常。停用CZA-AVI后,患者神志逐渐好转,感染指标逐渐下降,病情好转。家属于当日要求转社区医院继续治疗,医师予以办理转院。患者住院期间使用的主要药物与不良反应发生的时间关系如图1所示。

图1 患者住院期间用药与不良反应发生的时间关系
3 分析与讨论
3.1 患者四肢阵发性痉挛与CZA-AVI的相关性分析
本研究中,该患者从入院第10天起出现四肢阵发性痉挛,与该不良反应的发生有时间相关性的药物有异丙托溴铵、左沙丁胺醇、呋塞米、重组人脑利钠肽、孟鲁司特钠、多烯磷脂酰胆碱、CZA-AVI、多黏菌素B。药品说明书记载或文献报道可引发肌肉痉挛或强直不良反应的药物有异丙托溴铵、左沙丁胺醇、孟鲁司特、呋塞米、CZA-AVI、多黏菌素B[3―6]。因患者既往使用过异丙托溴铵、左沙丁胺醇、孟鲁司特钠、呋塞米,均未发生痉挛相关不良反应,故临床药师认为上述药物与四肢阵发性痉挛的相关性较小。该患者四肢阵发性痉挛发生在输注多黏菌素B后,不排除与多黏菌素B相关,故临床药师建议暂先停用多黏菌素B,CZA-AVI剂量减半。但由于该患者合用了多种可导致肌肉痉挛的药物,不良反应的发生风险增加,故临床药师建议尽可能停用目前非必需的孟鲁司特钠。医师综合分析患者病情和治疗需要,同意停用多黏菌素B和孟鲁司特钠,但未采纳CZA-AVI减量的建议,同时予丙戊酸钠和地西泮控制痉挛。
在停用多黏菌素B和孟鲁司特钠后第4天,患者四肢阵发性痉挛仍未好转,鉴于该患者既往无癫痫病史,无神经系统疾病史,头颅CT检查未见异常,无肝性脑病,且自身免疫性脑炎检查为阴性,电解质紊乱已纠正,故临床药师认为需进一步排查药物相关不良反应。由于CZA-AVI的药品说明书和相关文献均指出其可导致神经系统毒性,且该药主要通过肾脏清除,需根据肌酐清除率调整用量[6]。临床药师根据患者最近一次(5月11日)SCr(422 μmol/L)估算得肌酐清除率为10~15 mL/min,参考药品说明书推荐剂量应为0.94 g,qd,静脉滴注。但有文献指出,当患者肌酐清除率为10~30 mL/min时,CZA-AVI剂量降为0.94 g,q12 h,静脉滴注[6]。医师考虑患者感染程度较重,继续予CZA-AVI 2.5 g,qd,静脉滴注抗感染治疗。在使用CZA-AVI期间,患者SCr(正常值:44~111 μmol/L)一直较高,停用后2 d(入院第18天)SCr降至273 μmol/L,四肢阵发性痉挛的发作频率和持续时间较前明显减少,神志较前好转;停用第5天,患者偶见四肢轻微收缩运动。由此,临床药师推测患者在使用CZA-AVI期间的SCr较高,药物代谢减慢,血药浓度升高,进而导致CZA-AVI进入脑脊液的药物浓度增加,最终引发了四肢阵发性痉挛发作和神志变差。根据Naranjo’s不良反应评估量表[7],该患者的四肢阵发性痉挛与多黏菌素B、孟鲁司特钠的相关性评分均为2分,与CZA-AVI的相关性评分为5分,因此患者四肢阵发性痉挛与多黏菌素B、孟鲁司特钠的相关性为“可能”,与CZA-AVI的相关性为“很可能”。
3.2 CZA-AVI致神经系统毒性的文献回顾分析
目前,关于头孢他啶导致神经系统毒性的国内外报道较多[8―11],CZA-AVI药品说明书中神经系统常见的不良反应为头痛、头晕,注意事项中提到接受头孢他啶治疗的患者有癫痫发作、脑病、昏迷的报道[1],但关于CZAAVI复方制剂导致的神经系统毒性报道不多。基于美国不良反应报告系统(FDA adverse event reporting system,FDA-FEARS)的数据挖掘,提示CZA-AVI与神经系统毒性存在很强的相关性[12―14]。2021年Gatti等[12]研究发现,使用标准或较高剂量的CZA-AVI均可引起严重的中枢神经系统毒性,主要表现为头孢类抗生素脑病和精神状态改变。2022年一项关于CZA-AVI的不良反应监测数据显示,CZA-AVI致神经系统不良事件比例高达15.62%,且与美罗培南、头孢他啶、头孢曲松相比,具有更强的神经系统不良事件信号[13]。另有一项研究也表明,与头孢他啶相比,CAZ-AVI致神经系统毒性的发生风险更高,主要风险信号为脑病和癫痫[14],提示阿维巴坦可能增加头孢他啶的神经系统毒性的发生风险。此外,2021年Pingue等[15]报道了1例肾功能正常患者在使用推荐剂量的CZA-AVI后,出现了局灶性癫痫发作和进行性意识障碍,脑磁共振成像示脑膜炎病变;停用CZAAVI 2 d后,患者意识和身体反应性大大改善;停用2周后,脑CT示脑膜受累消退。由上可知,使用标准或较高剂量的CAZ-AVI均可能会增加神经系统毒性发生的风险,故临床在使用CAZ-AVI时需谨慎。
3.3 CZA-AVI致神经系统毒性的机制、危险因素及其处理
CZA-AVI致神经系统毒性可能与头孢他啶相关,头孢菌素诱导神经系统毒性的机制可能与脑脊液中高浓度的头孢菌素抑制γ-氨基丁酸(γ-aminobutyric acid,GABA)与其受体结合,抑制中枢递质氨基酸的合成和运输,同时抑制中枢神经细胞钠-钾泵,使静息膜电位降低,导致中枢毒性反应,常见症状为异常运动,如肌阵挛、震颤和脑炎等[10]。
现有研究指出,头孢菌素诱导的神经系统毒性的主要危险因素有给药剂量过大、肾功能不全、神经系统疾病、高龄,其他潜在因素包括蛋白结合率低、肝功能不全、合并使用肾毒性或促惊厥药物、经中枢神经系统给药等[10,13,16];主要机制是通过影响抗菌药物的药代动力学参数变化,如肾功能不全患者,由于积累的有毒有机酸竞争性抑制头孢菌素从脑脊液到血液的主动转运,使脑脊液中头孢菌素血药浓度过高,从而导致神经毒性的发生[17]。高龄是肾功能下降的危险因素[18],当CAZ-AVI用于肾功能减退的老年人(尤其是用药疗程较长的老年患者)时,引发神经系统毒性的风险增加。因此,若患者合并有上述危险因素时,需警惕CZA-AVI致神经系统毒性的发生,同时密切监测患者的肌酐清除率并及时调整用药剂量。
目前研究发现,CAZ-AVI导致神经系统毒性的中位发病时间为6~7 d[15,19]。常规处理方法为:首先停用致病药物,症状通常在停用后可消退,其消退的中位时间约为4 d[9,20];同时可使用GABA激动剂(如苯巴比妥类、巴比妥类药物)对症治疗,若出现难治性症状时,则可使用肾脏替代治疗以加快药物清除[10]。
3.4 药物致神经系统毒性的药学监护
在临床工作中,临床药师不仅要熟悉药物的用法用量、常见的不良反应、药物间的相互作用,还需要识别各类不良反应发生的高危因素、具体表现及其处理方式等。本研究中,临床药师查阅大量资料,汇总了常见的具有神经系统毒性的抗菌药物,如青霉素类、头孢菌素类、碳青霉烯类、喹诺酮类、大环内酯类、磺胺类、四环素类等[21―23],详见表1。熟悉每类抗菌药物致神经系统毒性的表现、症状出现时间、危险因素及处理方式等,对于临床药师快速识别和纠正药物导致的神经系统毒性非常重要,可为临床治疗提供合理建议。
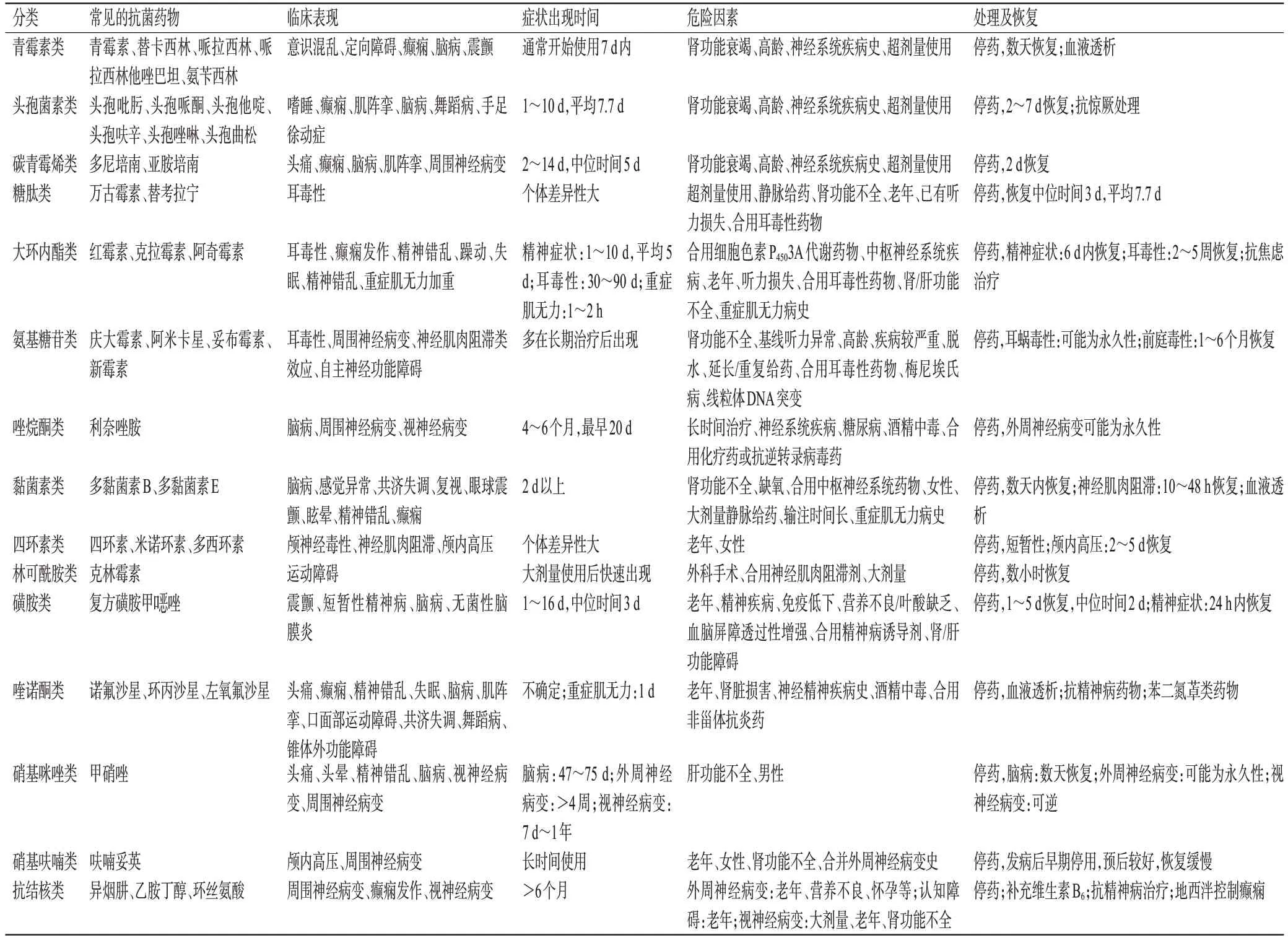
表1 具有神经系统毒性的常见抗菌药物的药学监护
在药物相互作用方面,本研究中该患者同时使用了多种具有神经系统毒性的药物,增加了不良反应发生的风险。此外,呋塞米还可增加头孢他啶等抗菌药物的药-时曲线下面积,虽没有足够的证据支持抗菌药物在与袢利尿剂合用时需改变标准剂量[24],但临床需密切监测患者的肾功能及其可能发生的不良反应。
血药浓度监测对于评估疗效和预防不良反应具有重要的作用。2020年欧洲重症医学会等建议对接受β-内酰胺类抗菌药物治疗的危重患者进行常规药物浓度监测,对于严重感染者建议将血药浓度增加至2~5倍最小抑菌浓度(minimal inhibitory concentration,MIC)(即游离血药浓度高于2~5倍MIC的时间占给药间隔时间的40%~100%)[25]。同时也有研究数据表明,β-内酰胺类药物血药浓度的增加与其神经毒性相关,当头孢他啶谷浓度/MIC>8(或血药浓度>64 mg/L)时可增加其神经毒性的暴露风险[26]。因此,在医疗条件允许的情况下,建议临床监测CAZ-AVI的血药浓度。
4 结语
本研究中,该患者为高龄男性,且具有急性肾功能不全、未完全根据肌酐清除率调整给药剂量、合并使用多种具有神经系统毒性或肾毒性药物的特点,在使用CZA-AVI第6天后出现四肢阵发性痉挛和神志转差,停用CZA-AVI第2天,四肢阵发性痉挛发生的持续时间和频率较前减少、神志较前好转,停用第5天后症状几乎消失。建议在临床使用CZA-AVI时,需警惕该药所致的神经系统毒性,尤其是对于高龄、肾功能不全、合并使用具有神经毒性或肾毒性的药物、具有神经精神病史等高危因素的患者。同时需提醒医师尽量避免联合使用多种具有神经毒性、肾毒性的抗菌药物,若确需使用,需根据患者的肾功能制定个体化用药方案,并密切监测药物的血药浓度及可能出现的不良反应。
