葫芦素B预防小鼠脓毒症急性肺损伤的作用及机制Δ
2024-05-14陈寿珊李方芳刘福艳付超汤正珍遵义市第一人民医院儿童重症医学科贵州遵义563000
陈寿珊,李方芳,刘福艳,付超,汤正珍 (遵义市第一人民医院儿童重症医学科,贵州 遵义 563000)
脓毒症是一种由感染引起的全身炎症反应综合征,因炎症细胞过度分泌炎症介质和细胞因子,导致免疫功能障碍和组织器官功能受损[1]。肺组织是脓毒症患者最先损伤的靶器官之一,因此脓毒症通常会导致急性肺损伤(acute lung injury,ALI),以下简称为脓毒症ALI[2―3]。脓毒症ALI是一种失控的炎症反应,可导致大量炎症细胞浸润肺组织;一方面,其可启动肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)级联反应,在肺部聚集大量中性粒细胞,促进其他炎症因子释放,引起肺损伤;另一方面,中性粒细胞释放弹性蛋白酶,促使大量中性粒细胞进入肺组织,引起肺水肿、蛋白质渗漏,加重肺损伤[4]。目前治疗脓毒症ALI的关键是快速有效地控制或减少肺的过度炎症反应[5]。糖皮质激素是治疗脓毒症ALI的常用药物,虽然治疗效果明显,但也具有严重副作用。
葫芦素B(cucurbitacin B,CB)是从葫芦科等植物中分离得到的一种四环三萜类化合物,具有改善中枢神经系统疾病、抗肿瘤、预防糖尿病、抗炎、抗氧化等药理作用[6]。相关研究报道,CB对脂多糖诱导的巨噬细胞炎症反应具有明显的抑制作用[7]。因此,笔者推测CB对脓毒症ALI可能也具有抑制作用。基于此,本研究建立脓毒症ALI动物模型,探讨CB对脓毒症ALI的预防作用及机制,以期为脓毒症ALI的治疗提供参考。
1 材料
1.1 主要药品与试剂
CB对照品(批号2022-0442,纯度>98%)购自维琪生物科技(上海)有限公司;苏木精-伊红(HE)染色液(批号G1120)购自北京索莱宝科技有限公司;BCA蛋白定量试剂盒购自北京普利莱基因技术有限公司;脂多糖(批号#202307)购自美国Sigma公司;鼠源白细胞介素6(interleukin-6,IL-6)、IL-6受体(interleukin-6 receptor,IL-6R)、Janus激酶2(Janus kinase 2,JAK2)、磷酸化JAK2(p-JAK2)、信号转导及转录活化因子3(signal transducer and activator of transcription 3,STAT3)、磷酸化STAT3(p-STAT3)、GAPDH一抗和辣根过氧化物酶标记的兔抗鼠免疫球蛋白G二抗(批号分别为#3771、#3230、#9145、#9133、#3629、#3917、#5174、#58802)均购自美国CST公司;地塞米松对照品(批号D829854,纯度99%)购自上海麦克林生化科技有限公司;IL-6、IL-1β、TNF-α的酶联免疫吸附测定(ELISA)试剂盒(批号分别为E-ELN-M0044c、E-ELN-M0037c、E-ELN-M0049c)均购自武汉伊莱瑞特生物科技股份有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、髓过氧化物酶(myeloperoxidase,MPO)的检测试剂盒(批号分别为A001-1、A003-1、A044-1-1)均购自南京建成生物工程研究所有限公司。
1.2 主要仪器
本研究所用主要仪器有BS124S型电子天平(北京赛多利斯仪器系统有限公司)、D3024型台式高速微量离心机(美国Scilogex公司)、RT-6000型酶标分析仪(深圳雷杜生命科学股份有限公司)、GZX-9070 MBE型数显鼓风干燥箱(上海博迅医疗生物仪器股份有限公司)、Tanon 5200型曝光仪(上海天能科技有限公司)、DYC型系列电泳仪(北京六一生物科技有限公司)、RES3050型动物呼吸机(河北赛维医疗科技有限公司)。
1.3 实验动物
本研究所用动物为C57BL6小鼠,雄性(排除雌性小鼠的雌激素抗炎作用),6周龄,体重16~18 g,购自上海斯莱克实验动物有限责任公司,动物生产许可证号为SCXK(沪)2022-009。所有动物实验均按照遵义医科大学动物中心研究委员会指南操作,伦理批号为(2021)-2-24。
2 方法
2.1 分组、造模与给药
将小鼠分为对照组、模型组、地塞米松组(阳性对照,2 mg/kg,剂量参考文献[8]设置)和CB低、高剂量组(25、50 mg/kg,剂量参考文献[9]设置),每组20只。各药物组小鼠腹腔注射相应药物,对照组与模型组小鼠腹腔注射等体积生理盐水,每天1次,连续3 d。末次给药24 h后,除对照组小鼠外,其余各组小鼠参照文献[10]方法,采用腹腔注射脂多糖(10 mg/kg)的方法构建脓毒症ALI模型,当造模小鼠相比对照组小鼠中性粒细胞数显著升高同时肺功能显著降低时,表明造模成功。造模结束后,对照组小鼠无死亡,地塞米松组死亡6只,模型组和CB低剂量组均死亡12只,CB高剂量组死亡9只,最终每组选取8只小鼠进行后续实验。
2.2 小鼠肺功能检测
腹腔注射脂多糖24 h后,采用RES3050型动物呼吸机及AniKes2005软件共同测量小鼠肺总阻力、肺出气阻力、肺动态顺应性、呼吸峰值流速和最大通气量。
2.3 小鼠血常规指标检测
肺功能检测后,以戊巴比妥钠(50 mg/kg)麻醉小鼠,摘除眼球采血,迅速吸取45 μL全血,与5 μL抗凝剂充分混匀(剩余全血静置离心后取上层血清备用),采用血常规检测仪检测小鼠全血中白细胞总数、中性粒细胞数、淋巴细胞数。
2.4 小鼠肺组织干湿比测定
采血结束后,在冰上摘除小鼠右肺(左肺同时取出备用),分离气管和食管,获取右肺叶,并立即测定小鼠肺组织湿重(记为d)。随后,将肺组织在60 ℃下干燥72 h以去除所有水分,测定肺组织干重(记为w),并计算肺组织干湿比(w/d×100%)。
2.5 小鼠肺组织病理学形态观察
取“2.4”项下小鼠左肺部分组织固定于4%甲醛溶液中72 h,经乙醇梯度脱水、二甲苯透明、石蜡包埋后,切成4 μm厚的组织切片,取部分切片(剩余部分用于免疫组化实验)进行HE染色。采用显微镜观察小鼠肺组织病理变化,并拍照。
2.6 小鼠血清中炎症因子、氧化应激指标水平以及肺组织中MPO水平检测
采用ELISA法检测。取“2.3”“2.4”项下小鼠适量血清样品或左肺组织,根据试剂盒说明书方法,检测小鼠血清中炎症因子(IL-6、IL-1β、TNF-α)、氧化应激指标(SOD和MDA)水平以及肺组织中MPO水平。
2.7 小鼠肺组织中p-STAT3阳性表达检测
采用免疫组化法检测。取“2.5”项下小鼠肺组织切片在60 ℃下烘烤1 h,以二甲苯去除石蜡,经梯度乙醇脱水、抗原修复后,以3%牛血清白蛋白封闭,加入p-STAT3一抗(稀释度为1∶500)孵育过夜;加入相应二抗孵育10 min,磷酸盐缓冲液(PBS)洗涤3次,每次3 min;以苏木精染色,经梯度乙醇和二甲苯脱水后,以中性树脂密封。采用光学显微镜观察肺组织中p-STAT3蛋白表达情况,每只切片随机选取1个视野,以棕黄色为阳性染色,采用Image J软件测定每个视野中的光密度值,光密度值越大,蛋白阳性表达水平越高。
2.8 小鼠肺组织中IL-6/JAK2/STAT3信号通路相关蛋白表达水平检测
采用Western blot法检测。取各组小鼠肺组织适量,裂解后提取总蛋白,并用BCA法测定蛋白含量。将蛋白进行变性处理,然后取适量蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,并将其转移至PVDF膜上。采用5%脱脂奶粉封闭2 h,加入IL-6、IL-6R、JAK2、p-JAK2、STAT3、p-STAT3、GAPDH一抗(稀释度均为1∶1 000),孵育过夜;以TBST洗膜,然后加入相应二抗(稀释度为1∶500),孵育30 min;以TBST洗膜,采用增强化学发光试剂显影。采用凝胶成像仪分析蛋白条带灰度值,以IL-6、IL-6R与内参(GAPDH)的灰度值比值表示其表达水平,以p-JAK2与JAK2、p-STAT3与STAT3的灰度值比值表示JAK2、STAT3的磷酸化水平。
2.9 统计学方法
采用SPSS 20.0软件进行统计分析,数据表示为±s。多组间比较采用单因素方差分析,组间两两比较采用LSD-t法。检验水准α=0.05。
3 结果
3.1 CB对脓毒症ALI小鼠肺功能的影响
与对照组比较,模型组小鼠肺总阻力、肺出气阻力均显著升高(P<0.01),肺动态顺应性、呼吸峰值流速、最大通气量均显著降低(P<0.01)。与模型组比较,地塞米松组和CB各剂量组小鼠上述指标均显著逆转(P<0.01)。结果见表1。
表1 各组小鼠肺功能比较(±s,n=8)
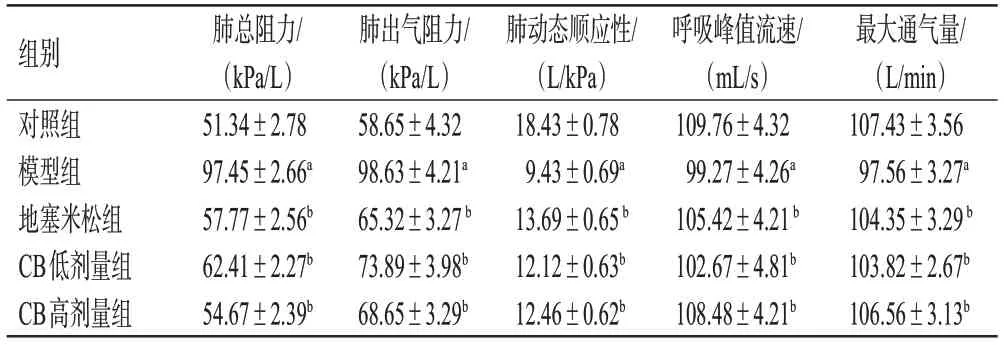
表1 各组小鼠肺功能比较(±s,n=8)
a:与对照组比较,P<0.01;b:与模型组比较,P<0.01。
组别对照组模型组地塞米松组CB低剂量组CB高剂量组最大通气量/(L/min)107.43±3.56 97.56±3.27a 104.35±3.29 b 103.82±2.67b 106.56±3.13b肺总阻力/(kPa/L)51.34±2.78 97.45±2.66a 57.77±2.56b 62.41±2.27b 54.67±2.39b肺出气阻力/(kPa/L)58.65±4.32 98.63±4.21a 65.32±3.27 b 73.89±3.98b 68.65±3.29b肺动态顺应性/(L/kPa)18.43±0.78 9.43±0.69a 13.69±0.65 b 12.12±0.63b 12.46±0.62b呼吸峰值流速/(mL/s)109.76±4.32 99.27±4.26a 105.42±4.21 b 102.67±4.81b 108.48±4.21b
3.2 CB对脓毒症ALI小鼠血常规指标和肺组织干湿比的影响
与对照组比较,模型组小鼠全血中白细胞总数、中性粒细胞数、淋巴细胞数、肺组织干湿比均显著升高(P<0.01)。与模型组比较,地塞米松组和CB各剂量组小鼠上述指标均显著逆转(P<0.01)。结果见表2。
表2 各组小鼠血常规指标和肺组织干湿比比较(±s,n=8)
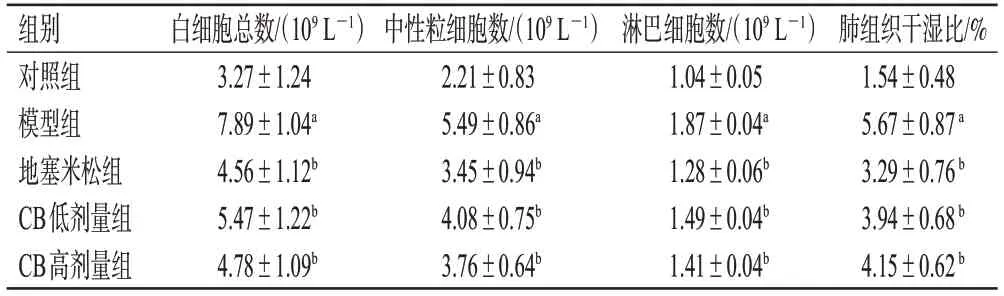
表2 各组小鼠血常规指标和肺组织干湿比比较(±s,n=8)
a:与对照组比较,P<0.01;b:与模型组比较,P<0.01。
对照组模型组地塞米松组CB低剂量组CB高剂量组3.27±1.24 7.89±1.04a 4.56±1.12b 5.47±1.22b 4.78±1.09b 2.21±0.83 5.49±0.86a 3.45±0.94b 4.08±0.75b 3.76±0.64b 1.04±0.05 1.87±0.04a 1.28±0.06b 1.49±0.04b 1.41±0.04b 1.54±0.48 5.67±0.87 a 3.29±0.76 b 3.94±0.68 b 4.15±0.62 b
3.3 CB对脓毒症ALI小鼠肺组织病理学形态的影响
对照组小鼠肺组织形态规则,肺泡结构清晰完整。模型组小鼠肺组织出现肺泡塌陷、肺泡壁和肺泡间隔增厚以及炎症细胞浸润。与模型组比较,地塞米松组和CB各剂量组小鼠肺组织病理损伤减轻。结果见图1。

图1 CB对脓毒症ALI小鼠肺组织病理学形态影响的显微图(HE染色)
3.4 CB对脓毒症ALI小鼠血清中炎症因子、氧化应激指标水平以及肺组织中MPO水平的影响
与对照组比较,模型组小鼠血清中IL-6、IL-1β、TNF-α、MDA水平和肺组织中MPO水平均显著升高(P<0.01),血清中SOD水平显著降低(P<0.05)。与模型组比较,地塞米松组和CB各剂量组小鼠上述指标水平均显著逆转(P<0.05或P<0.01)。结果见表3。
表3 各组小鼠血清中炎症因子、氧化应激指标水平以及肺组织中MPO水平的比较(±s,n=8)
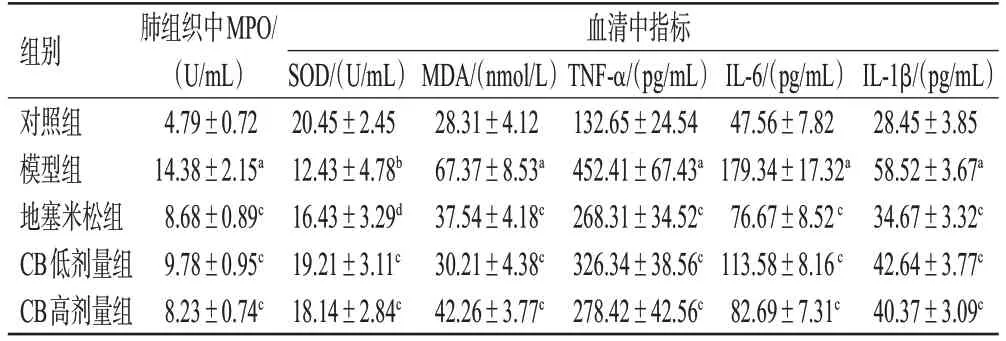
表3 各组小鼠血清中炎症因子、氧化应激指标水平以及肺组织中MPO水平的比较(±s,n=8)
a:与对照组比较,P<0.01;b:与对照组比较,P<0.05;c:与模型组比较,P<0.01;d:与模型组比较,P<0.05。
组别对照组模型组地塞米松组CB低剂量组CB高剂量组肺组织中MPO/(U/mL)4.79±0.72 14.38±2.15a 8.68±0.89c 9.78±0.95c 8.23±0.74c血清中指标IL-1β/(pg/mL)28.45±3.85 58.52±3.67a 34.67±3.32c 42.64±3.77c 40.37±3.09c SOD/(U/mL)20.45±2.45 12.43±4.78b 16.43±3.29d 19.21±3.11c 18.14±2.84c MDA/(nmol/L)28.31±4.12 67.37±8.53a 37.54±4.18c 30.21±4.38c 42.26±3.77c TNF-α/(pg/mL)132.65±24.54 452.41±67.43a 268.31±34.52c 326.34±38.56c 278.42±42.56c IL-6/(pg/mL)47.56±7.82 179.34±17.32a 76.67±8.52 c 113.58±8.16 c 82.69±7.31c
3.5 CB对脓毒症ALI小鼠肺组织中p-STAT3蛋白阳性表达的影响
与对照组(光密度值为0.368±0.032)比较,模型组小鼠肺组织中p-STAT3蛋白阳性表达水平(光密度值为0.853±0.041)显著升高(P<0.01)。与模型组比较,地塞米松组和CB低、高剂量组小鼠肺组织中p-STAT3蛋白阳性表达水平(光密度值分别为0.431±0.027、0.585±0.024、0.513±0.022)均显著降低(P<0.01)。结果见图2。
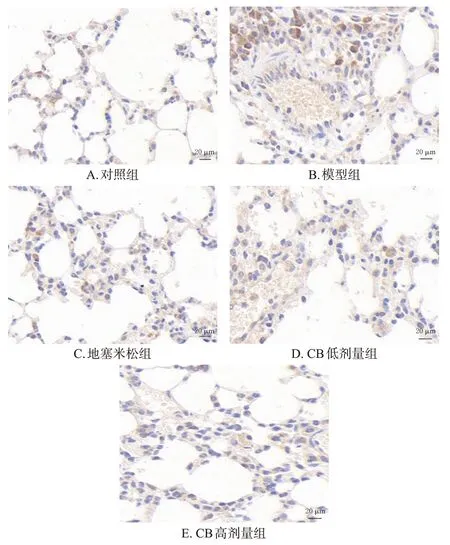
图2 各组小鼠肺组织中p-STAT3蛋白阳性表达的显微图
3.6 CB对脓毒症ALI小鼠肺组织中IL-6/JAK2/STAT3信号通路相关蛋白表达的影响
与对照组比较,模型组小鼠肺组织中IL-6和IL-6R蛋白表达水平和JAK2、STAT3蛋白磷酸化水平均显著升高(P<0.01)。与模型组比较,地塞米松组和CB各剂量组小鼠肺组织中上述指标水平均显著降低(P<0.01)。结果见图3、表4。
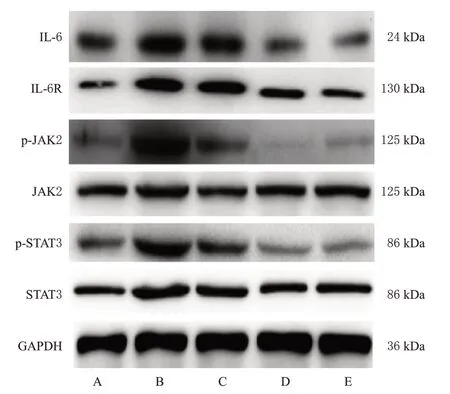
图3 各组小鼠肺组织中IL-6/JAK2/STAT3信号通路相关蛋白表达的电泳图
表4 各组小鼠肺组织中IL-6/JAK2/STAT3信号通路相关蛋白表达水平比较(±s,n=8)
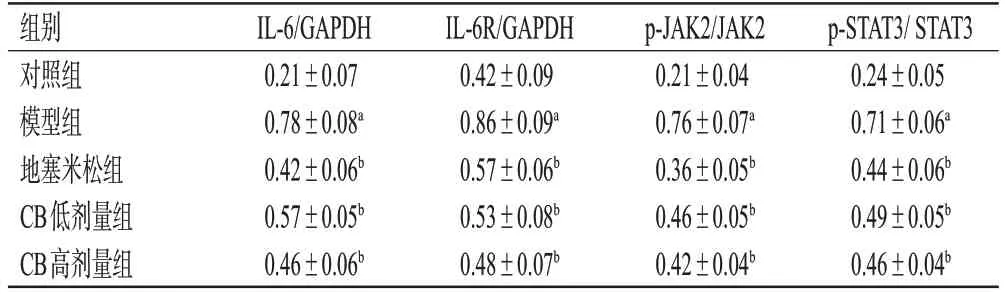
表4 各组小鼠肺组织中IL-6/JAK2/STAT3信号通路相关蛋白表达水平比较(±s,n=8)
a:与对照组比较,P<0.01;b:与模型组比较,P<0.01。
组别对照组模型组地塞米松组CB低剂量组CB高剂量组p-STAT3/ STAT3 0.24±0.05 0.71±0.06a 0.44±0.06b 0.49±0.05b 0.46±0.04b IL-6/GAPDH 0.21±0.07 0.78±0.08a 0.42±0.06b 0.57±0.05b 0.46±0.06b IL-6R/GAPDH 0.42±0.09 0.86±0.09a 0.57±0.06b 0.53±0.08b 0.48±0.07b p-JAK2/JAK2 0.21±0.04 0.76±0.07a 0.36±0.05b 0.46±0.05b 0.42±0.04b
4 讨论
相关研究发现,氧化应激失衡可引发机体炎症或细胞死亡,与脓毒症ALI的发病机制密切相关[11]。MPO是骨髓细胞的特异性标志物,主要存在于中性粒细胞中,可催化氯离子生成次氯酸和具有氧化能力的自由基,从而启动脂质过氧化,导致机体氧化应激失衡[12]。本研究结果发现,CB可降低脓毒症ALI模型小鼠血清中MDA水平和肺组织中MPO水平,升高SOD水平,这提示CB可能通过调节氧化应激预防小鼠脓毒症ALI。
炎症细胞因子如IL-1、IL-6、IL-18和TNF-α在脓毒症的发病机制中起着关键作用[13]。IL-1β可由巨噬细胞、单核细胞和成纤维细胞分泌合成,是重要的炎症介质,有研究发现,脓毒症模型动物体内IL-1β水平显著升高[14]。IL-6是另一种重要的炎症细胞因子,且IL-6 mRNA在脓毒症患者肺组织中显著升高[15]。TNF-α是一种由单核细胞和巨噬细胞分泌的促炎细胞因子,在脂质代谢、胰岛素抵抗中具有重要作用[16]。本研究结果发现,CB可降低脓毒症ALI模型小鼠血清中IL-6、IL-1β、TNF-α水平,这表明CB可能通过抑制炎症因子水平预防小鼠脓毒症ALI。
炎症风暴是脓毒症ALI发生的主要病机之一,其中IL-6是参与炎症风暴最活跃的细胞因子。研究表明,IL-6与IL-6R结合产生的IL-6/IL-6R复合物与信号转导成分gp130结合,诱导gp130的同源二聚体激活酪氨酸激酶家族和STAT家族,从而诱导炎症反应[17]。本研究结果发现,CB可降低脓毒症ALI模型小鼠肺组织中IL-6、IL-6R蛋白表达水平以及JAK2、STAT3蛋白磷酸化水平,且免疫组化实验结果也显示,CB可降低模型小鼠肺组织中p-STAT3蛋白阳性表达,这表明CB可能通过抑制肺组织中IL-6/JAK2/STAT3信号通路相关蛋白表达,预防小鼠脓毒症ALI。
综上所述,CB可预防小鼠脓毒症ALI,其作用机制可能与抑制IL-6/JAK2/STAT3信号通路活性、减轻炎症反应有关。
