马里苷对酒精性脂肪肝的保护作用及机制Δ
2024-05-14牛广豪徐俊驰顾利青许英顾宇人宋华峰苏州市第五人民医院苏州大学附属传染病医院临床试验机构办公室江苏苏州5000苏州市第五人民医院苏州大学附属传染病医院检验中心江苏苏州5000
牛广豪 ,徐俊驰 ,顾利青 ,许英 ,顾宇人 ,宋华峰 #[.苏州市第五人民医院(苏州大学附属传染病医院)临床试验机构办公室,江苏 苏州 5000;.苏州市第五人民医院(苏州大学附属传染病医院)检验中心,江苏苏州 5000]
长期大量饮酒会引起酒精性脂肪肝(alcoholic fatty liver,AFL)[1]。AFL的发病机制非常复杂,由多种因素共同参与。其中,氧化应激和脂代谢异常在AFL的发生发展过程中具有重要作用[2]。过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)是抑制肝脏脂质生成的关键蛋白,上调PPARα表达可以改善肝脏的脂代谢异常,减轻脂肪堆积[3]。研究表明,AFL的发生可能与PPARα调控的脂代谢通路抑制密切相关[4]。
马里苷的化学名为奥卡宁-4′-O-葡萄糖苷,是一种查尔酮类化合物,在两色金鸡菊头状花序的水和乙醇提取部位中含量最高[5]。近年来国内外研究发现,马里苷具有较多有益的药理活性,如改善糖脂代谢[6]、抗炎和抗氧化应激[7]等。同时有研究表明,马里苷可减缓糖尿病所造成的肝脏损伤[8]。本课题组前期研究已经证实,在缺氧诱导的心肌肥大细胞中,马里苷可以通过上调PPARα的表达进而改善其脂代谢异常[9]。鉴于马里苷对肝损伤的减缓作用以及其抗氧化应激和改善PPARα介导的脂质代谢异常的药理活性,本研究拟通过建立体内和体外AFL模型,探讨马里苷对AFL的影响,并从氧化应激和PPARα介导的脂质代谢2个角度探究其抗AFL的可能作用机制,为进一步研究马里苷的药理作用提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器有:Infinite M1000 Pro型全波长多功能酶标仪(瑞士Tecan公司),FJ-200型高速分散均质机(美国LI-COR公司),Power PAC 2000型电泳仪、ChemiDoc XRS 型自动凝胶成像系统、电泳槽(美国Bio-Rad公司),Fresco 21型高速微量台式冷冻离心机(美国Thermo Fisher Scientific公司),CX31型倒置显微镜(日本Olympus公司)。
1.2 主要药品与试剂
本研究所用的主要药品与试剂有:马里苷标准品(上海源叶生物科技有限公司,批号B29210,纯度≥98%),MK886(PPARα抑制剂)标准品(上海Med Chem Express公司,批号HY-14166,纯度≥99.7%),高度白酒(北京红星股份有限公司,酒精度:52%vol),油红O染色试剂盒(德国Sigma公司,批号MAK194),考马斯亮蓝蛋白、甘油三酯(triglyceride,TG)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(南京建成生物工程研究所,批号分别为20230403、20230412、20230415、20230514),兔源PPARα抗体、兔源肉碱棕榈酰转移酶1(carnitine palmitoyltransferase-1,CPT-1)抗体、兔源二脂酰甘油酰基转移酶(diacylgly- cerol acyltransferase,DGAT)抗体和兔源β-肌动蛋白(β-actin)抗体(英国Abcam公司,批号分别为ab314112、ab220789、ab100982、ab8226),辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(武汉Proteintech公司,批号SA02502),ECL化学发光液(上海天能生命科学有限公司,批号180-5001)。
1.3 动物
实验动物为SPF级健康雄性昆明小鼠,共37只,体重20~22 g,购自上海斯莱克实验动物有限责任公司,实验动物生产许可证号为SCXK(沪)2022-0004。小鼠购入后,饲养于苏州大学SPF级动物房内,饲养环境温度为(22±2) ℃、相对湿度为 55%、12 h 光照/12 h 黑暗循环。实验动物所有操作均严格按照苏州大学动物伦理委员会标准执行(伦理批件号:SUDA20230622A01)。
1.4 细胞
大鼠BRL肝细胞购自中国科学院细胞库。将细胞接种于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养基中,并在饱和湿度、5%CO2、37 ℃培养箱中培养。
2 方法
2.1 动物实验
2.1.1 小鼠AFL模型建立及分组、给药
在进行正式实验前,小鼠进行环境适应性饲养2 d。然后按体重将小鼠随机分为正常对照组(n=9)、模型组(n=10)和马里苷75、150 mg/kg组(n=9,给药剂量根据相关文献报道[10―11]及本课题组前期预实验结果确定;以0.5%羧甲基纤维素钠溶液为溶剂进行药液配制,马里苷母液质量浓度分别为3.75、7.5 mg/mL)。马里苷75、150 mg/kg组小鼠灌胃相应剂量的马里苷药液(0.02 mL/g),正常对照组和模型组小鼠灌胃等体积0.5%羧甲基纤维素钠溶液,每天1次,持续30 d。每天完成给药30 min后,模型组和各给药组小鼠均采用高度白酒灌胃30 d的方法建立AFL小鼠模型[12]:初始灌胃剂量为0.01 mL/g,并在7 d内将剂量逐渐加大到0.015 mL/g;正常对照组小鼠灌胃相应剂量双蒸水。实验第30天取1只模型组小鼠,采用苏木素-伊红(HE)染色后观察其肝组织病理改变,以肝细胞出现脂滴沉积、脂肪空泡变性为造模成功判定标准。
2.1.2 取材及肝组织中TG、MDA和SOD水平测定
末次给药后,小鼠禁食不禁水12 h,称重。经眼球取血后,脱颈处死小鼠。取出小鼠肝脏,用冷生理盐水冲洗,滤纸吸干后,取大约0.3 g肝组织,加2.7 mL生理盐水制成10%肝组织匀浆,以4 000 r/min离心10 min;取上清,按照试剂盒说明书操作,测定肝组织中TG、MDA和SOD水平。另取部分肝组织置于10%甲醛溶液中固定,剩余肝组织置于-80 ℃冰箱中保存备用。
2.1.3 肝组织病理形态学观察
采用HE染色法进行观察。取“2.1.2”项下经10%甲醛溶液固定的肝组织(每只小鼠取的部位相同),常规操作制备石蜡切片(厚度4 μm)后行HE染色,在显微镜下观察肝组织脂肪浸润情况。
2.1.4 肝组织中PPARα、CPT-1和DGAT蛋白表达检测
采用Western blot法进行检测。取“2.1.2”项下冻存的肝组织(每组取3只小鼠样本),采用RIPA裂解液超声提取组织中总蛋白,测定总蛋白浓度后,调整样品体积,使各组上样量保持一致。将蛋白高温变性后,配制10%分离胶,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(电压80 V、电泳时间 20 min,电压 120 V、电泳时间 40 min),之后按90 V、90 min的转膜条件转移至NC膜,用5%脱脂奶粉封闭90 min;加入PPARα、CPT-1、DGAT和β-actin一抗(PPARα的稀释度为1∶500,CPT-1的稀释度为1∶300,DGAT和β-actin的稀释度为1∶1 000),4 ℃孵育过夜。洗膜后,加入对应二抗,室温孵育1 h。ECL 化学发光显影,采用 ChemiDoc XRS 凝胶成像系统进行信号扫描,利用Image J软件进行图像分析获取蛋白条带灰度值,以目的蛋白与内参蛋白(β-actin)条带灰度值的比值表示目的蛋白的表达水平。
2.2 细胞实验
2.2.1 马里苷对大鼠BRL肝细胞活力的影响
为筛选马里苷后续实验干预的浓度和时间,采用MTT法测定马里苷对正常BRL肝细胞活力的影响。取对数生长期的细胞,接种于96孔板中(铺板密度为1×105个/mL),置于CO2培养箱内培养 24 h 后,将细胞分为正常对照组、1‰二甲基亚砜(DMSO)组和马里苷3、6、12 μmol/L组(浓度参考文献[9]设置,以1‰DMSO为溶剂进行药液配制),每组设置3个复孔。各组细胞分别经空白培养基、含1‰DMSO的培养基、含药培养基处理24 h后,每个细胞培养孔加入20 μL MTT溶液作用4 h,吸取上清液,加入100 μL DMSO作用15 min后,利用全波长酶标仪测定490 nm波长下吸光度值,计算细胞相对活力:细胞相对活力=(实验孔吸光度值-空白孔吸光度值)/(对照孔吸光度值-空白孔吸光度值)×100%。实验重复3次。
2.2.2 马里苷对乙醇诱导的肝细胞损伤的影响
取对数生长期的细胞,接种于6孔板中(铺板密度为1×104个/mL)。实验分为正常对照组、模型组、模型+1‰DMSO组和马里苷3、6、12 μmol/L组,每组设3个复孔。参考文献[13]方法并进行改良后建立酒精性肝细胞损伤模型:用0.5%乙醇、0.01%硫酸亚铁和0.1 μmol/L油酸刺激大鼠BRL肝细胞24 h致脂质堆积(采用油红O染色法观察肝细胞内脂滴的分布,观察到脂滴提示造模成功)。马里苷各浓度组在造模同时给予不同浓度的马里苷作用24 h。收集细胞,按照试剂盒说明书操作,测定肝细胞中TG、MDA和SOD水平,并参照“2.1.4”项下方法测定细胞中PPARα、CPT-1和DGAT的蛋白表达。实验重复3次。
2.2.3 MK886干预后马里苷对乙醇损伤肝细胞中PPARα、CPT-1和DGAT蛋白表达的影响
为进一步验证马里苷是否通过调控PPARα发挥作用,采用MK886处理细胞。取对数生长期的细胞,接种于6孔板中(铺板密度为1×104个/mL)。实验分为正常对照组、模型组、模型+MK886组、模型+MK886+马里苷12 μmol/L组,每组设3个复孔。MK886的给药浓度参考文献[14]设定为10 μmol/L,马里苷给药浓度根据“2.2.2”项下结果设定。正常对照组不处理,模型组按“2.2.2”项下方法建立酒精性肝细胞损伤模型,模型+MK886组造模的同时加入MK886,模型+MK886+马里苷12 μmol/L组造模的同时加入MK886和马里苷。培养24 h后收集各组细胞,按照“2.1.4”项下方法测定细胞中PPARα、CPT-1和DGAT的蛋白表达。实验重复3次。
2.3 统计学方法
采用GraphPad Prism软件作图和进行数据统计分析。符合正态分布的计量资料以±s表示,采用单因素方差分析和LSD-t法进行组间比较。检验水准α=0.05。
3 结果
3.1 动物实验结果
3.1.1 马里苷对小鼠肝组织中TG、MDA和SOD水平的影响
与正常对照组比较,模型组小鼠肝组织中TG、MDA水平显著升高(P<0.01),SOD水平显著降低(P<0.01)。与模型组比较,马里苷75、150 mg/kg组小鼠肝组织中TG、MDA水平显著降低(P<0.05或P<0.01),SOD水平显著升高(P<0.05或P<0.01)。结果见表1。
表1 各组小鼠肝组织中TG、MDA和SOD水平测定结果(±s,n=9)
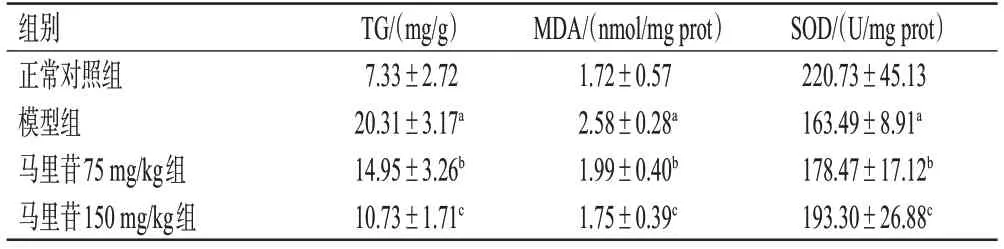
表1 各组小鼠肝组织中TG、MDA和SOD水平测定结果(±s,n=9)
a:与正常对照组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
SOD/(U/mg prot)220.73±45.13 163.49±8.91a 178.47±17.12b 193.30±26.88c组别正常对照组模型组马里苷75 mg/kg组马里苷150 mg/kg组TG/(mg/g)7.33±2.72 20.31±3.17a 14.95±3.26b 10.73±1.71c MDA/(nmol/mg prot)1.72±0.57 2.58±0.28a 1.99±0.40b 1.75±0.39c
3.1.2 马里苷对小鼠肝组织病理形态学的影响
正常对照组小鼠肝组织中肝细胞排列有序、整齐,肝小叶结构正常,肝细胞未见脂肪变性、炎症细胞浸润现象。模型组小鼠肝组织中肝细胞排列紊乱,肝小叶结构被破坏,分布有弥散性的脂质空泡。马里苷不同剂量组小鼠肝组织中脂肪变性的程度较模型组明显减轻,肝细胞的排列渐趋正常,肝小叶的结构有所恢复,尤以马里苷150 mg/kg组的改善更为明显。结果见图1。

图1 各组小鼠肝组织HE染色病理形态学观察图
3.1.3 马里苷对小鼠肝组织中PPARα、CPT-1和DGAT蛋白表达的影响
与正常对照组比较,模型组小鼠肝组织中PPARα、CPT-1的蛋白表达水平显著降低(P<0.01),DGAT蛋白表达水平显著升高(P<0.01)。与模型组比较,马里苷75、150 mg/kg组小鼠肝组织中PPARα、CPT-1蛋白表达水平显著升高(P<0.05或P<0.01),DGAT蛋白表达水平显著降低(P<0.05或P<0.01)。结果见图2和表2。

图2 各组小鼠肝组织中PPARα、CPT-1、DGAT蛋白表达的电泳图
表2 各组小鼠肝组织中PPARα、CPT-1、DGAT蛋白表达水平测定结果(±s,n=3)
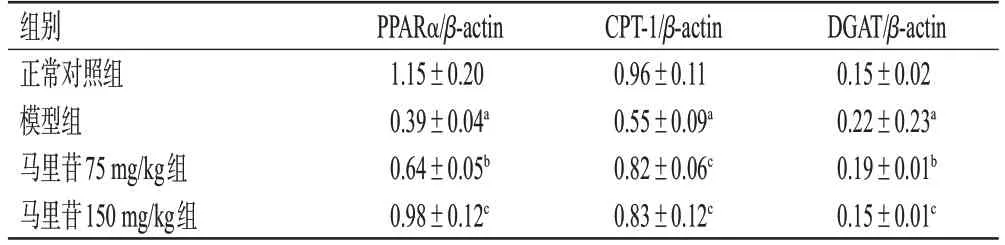
表2 各组小鼠肝组织中PPARα、CPT-1、DGAT蛋白表达水平测定结果(±s,n=3)
a:与正常对照组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
DGAT/β-actin 0.15±0.02 0.22±0.23a 0.19±0.01b 0.15±0.01c组别正常对照组模型组马里苷75 mg/kg组马里苷150 mg/kg组PPARα/β-actin 1.15±0.20 0.39±0.04a 0.64±0.05b 0.98±0.12c CPT-1/β-actin 0.96±0.11 0.55±0.09a 0.82±0.06c 0.83±0.12c
3.2 细胞实验结果
3.2.1 马里苷对正常大鼠BRL肝细胞活力的影响
与正常对照组[相对细胞活力为(100.00±0.00)%,n=3]比较,1‰DMSO组和马里苷3、6、12 μmol/L组作用24 h后,细胞活力[分别为(99.21±6.42)%、(99.02±5.39)%、(96.24±5.98)%、(96.83±9.43)%,n=3]均无显著变化(P>0.05),因此该浓度可以用于后续实验。
3.2.2 马里苷对肝细胞脂质生成的影响
与正常对照组比较,模型组细胞中有较多被染成红色的脂滴,其分布在靠近细胞膜的区域,使整个细胞呈现出“印戒”状;与模型组比较,3、6、12 μmol/L马里苷作用后可显著减少细胞中红色脂滴分布,细胞轮廓变得清晰,且以马里苷12 μmol/L组细胞红色脂滴减少最明显。结果见图3。

图3 各组细胞的油红O染色观察结果
3.2.3 马里苷对肝细胞中TG、MDA和SOD水平的影响
与正常对照组比较,模型组细胞中TG、MDA水平显著升高(P<0.01),SOD水平显著降低(P<0.01)。与模型组比较,模型+1‰DMSO组细胞中上述指标差异均无统计学意义(P>0.05);马里苷3、6、12 μmol/L组细胞中TG、MDA水平均显著降低(P<0.05或P<0.01),SOD水平均显著升高(P<0.05或P<0.01)。结果见表3。
表3 各组细胞中TG、MDA和SOD水平测定结果(±s,n=3)

表3 各组细胞中TG、MDA和SOD水平测定结果(±s,n=3)
a:与正常对照组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
SOD/(U/mg prot)56.98±6.89 23.37±6.41a 29.20±2.05 37.43±6.57b 43.30±6.55c 47.01±4.01c组别正常对照组模型组模型+1‰DMSO组马里苷3 μmol/L组马里苷6 μmol/L组马里苷12 μmol/L组TG/(mg/g prot)1.23±0.12 2.86±0.40a 2.34±0.52 1.74±0.22b 1.58±0.17c 1.55±0.15c MDA/(nmol/mg prot)1.34±0.13 3.50±0.62a 3.32±0.65 2.24±0.38b 1.82±0.21c 1.52±0.11c
3.2.4 马里苷对肝细胞PPARα、CPT-1和DGAT蛋白表达的影响
与正常对照组比较,模型组细胞中PPARα、CPT-1蛋白表达水平显著降低(P<0.01),DGAT蛋白表达水平显著升高(P<0.01)。与模型组比较,模型+1‰DMSO组细胞中上述指标水平差异均无统计学意义(P>0.05);马里苷3、6、12 μmol/L组细胞中PPARα、CPT-1蛋白表达水平显著升高(P<0.05或P<0.01),DGAT蛋白表达水平显著降低(P<0.05或P<0.01)。结果见图4和表4。
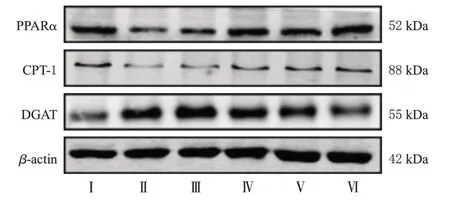
图4 各组细胞中PPARα、CPT-1、DGAT蛋白表达的电泳图
表4 各组细胞中PPARα、CPT-1、DGAT蛋白表达水平测定结果(±s,n=3)

表4 各组细胞中PPARα、CPT-1、DGAT蛋白表达水平测定结果(±s,n=3)
a:与正常对照组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
DGAT/β-actin 0.20±0.02 1.02±0.09a 1.13±0.10 0.78±0.09b 0.64±0.08c 0.27±0.05c组别正常对照组模型组模型+1‰DMSO组马里苷3 μmol/L组马里苷6 μmol/L组马里苷12 μmol/L组PPARα/β-actin 0.78±0.05 0.25±0.05a 0.33±0.06 0.59±0.04b 0.60±0.09b 0.75±0.04c CPT-1/β-actin 0.23±0.05 0.12±0.02a 0.11±0.02 0.16±0.01b 0.18±0.02c 0.20±0.01c
3.2.5 MK886干预后马里苷对乙醇损伤肝细胞中PPARα、CPT-1和DGAT蛋白表达的影响
与正常对照组比较,模型组和模型+MK886组细胞中PPARα、CPT-1蛋白表达水平显著降低(P<0.01),DGAT蛋白表达水平显著升高(P<0.01)。与模型组比较,模型+MK886+马里苷12 μmol/L组细胞中上述指标水平差异均无统计学意义(P>0.05),表明在用MK886预处理后,马里苷对乙醇诱导肝细胞中PPARα、CPT-1和DGAT蛋白表达的影响消失。结果见图5、表5。

图5 MK886干预后肝细胞中PPARα、CPT-1和DGAT蛋白表达的电泳图
表5 MK886干预后肝细胞中PPARα、CPT-1和DGAT蛋白表达水平测定结果(±s,n=3)
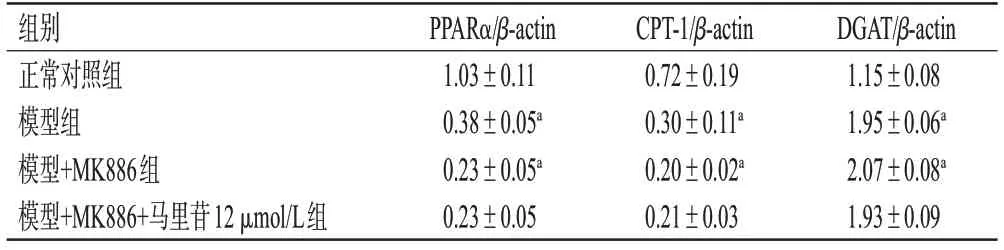
表5 MK886干预后肝细胞中PPARα、CPT-1和DGAT蛋白表达水平测定结果(±s,n=3)
a:与正常对照组比较,P<0.01。
组别正常对照组模型组模型+MK886组模型+MK886+马里苷12 μmol/L组DGAT/β-actin 1.15±0.08 1.95±0.06a 2.07±0.08a 1.93±0.09 PPARα/β-actin 1.03±0.11 0.38±0.05a 0.23±0.05a 0.23±0.05 CPT-1/β-actin 0.72±0.19 0.30±0.11a 0.20±0.02a 0.21±0.03
4 讨论
乙醇可能会影响肝脏脂质代谢,并导致肝脏脂质蓄积和脂肪变性[15―16]。在本研究中,动物实验采取小鼠连续灌胃高度白酒30 d,细胞实验采取0.5%乙醇、0.01%硫酸亚铁和0.1 μmol/L油酸诱导大鼠BRL肝细胞损伤来进行药效研究。结果显示,在动物和细胞模型中均检测到肝细胞中TG水平显著增加,而在给予马里苷后,细胞中TG水平均显著下降,表明马里苷可拮抗乙醇引起的肝脏脂肪堆积。
研究表明,乙醇蓄积可导致活性氧自由基的大量产生,进而诱发机体的氧化应激和脂质过氧化反应,最终导致肝细胞损伤。而乙醇蓄积不但会引起活性氧自由基的大量产生,还会降低机体的抗氧化能力[17]。在本研究中,笔者检测了小鼠肝组织中MDA、SOD水平。结果发现,在马里苷作用后,小鼠肝组织中MDA水平显著降低,SOD水平显著升高;同时,在乙醇诱导的肝细胞中也检测到马里苷的上述作用。由此可知,马里苷可通过提高机体的抗氧化酶水平,增加对活性氧自由基的清除能力,从而减轻氧化应激引起的肝损伤。
PPARα是调节脂质代谢的一种重要的转录因子,主要在肝脏表达[18]。在乙醇蓄积的情况下,肝组织中PPARα表达被抑制,从而导致脂质代谢异常,使肝脏受损[3]。PPARα可通过调控其靶基因CPT-1和DGAT表达,在肝脏脂质代谢中发挥重要作用[19―20]。CPT-1是调控脂肪酸β氧化的关键酶,DGAT则是调控TG合成的关键酶,这2种酶的异常表达会导致脂质合成增加。在本研究中,动物实验和细胞实验结果均表明,乙醇诱导肝细胞损伤后会抑制PPARα蛋白表达,且CPT-1蛋白表达也随之下调,但DGAT蛋白表达却上调,这表明PPARα参与了乙醇引起的肝脂质代谢紊乱;而马里苷可上调乙醇诱导肝细胞中PPARα、CPT-1蛋白的表达,下调DGAT蛋白的表达。为了进一步验证马里苷对PPARα的靶向调控作用,本研究在采用MK886对肝细胞进行预处理后,观察到马里苷对细胞中PPARα、CPT-1和DGAT的调控作用被阻断,证实了马里苷改善乙醇诱导肝脏脂肪变性的作用可能是通过调控PPARα信号通路实现的。
综上所述,马里苷对AFL具有保护作用,其作用机制可能为增加肝脏的SOD水平以抑制乙醇引起的氧化应激,也可能是通过增强PPARα的表达进而调控其介导的脂质代谢相关靶蛋白CPT-1和DGAT的表达,但其更多的作用机制仍待进一步研究。
