血根碱对腰椎间盘突出症大鼠炎性疼痛的改善作用及机制Δ
2024-05-14阮祯何生华龚雪花乔松王超武汉市中医医院推拿科武汉40000武汉市第七医院中南路街第一社区卫生服务中心武汉40060湖北省中西医结合医院康复医学中心推拿科武汉4000
阮祯 ,何生华 ,龚雪花 ,乔松 ,王超 (.武汉市中医医院推拿科,武汉 40000;.武汉市第七医院中南路街第一社区卫生服务中心,武汉 40060;.湖北省中西医结合医院康复医学中心推拿科,武汉 4000)
腰椎间盘突出症(lumbar disc herniation,LDH)是一种常见的临床脊柱疾病,是由于各种原因导致腰椎间盘纤维环部分或完全破裂,髓核组织从破裂口向后突出,刺激或压迫神经根和马尾神经的临床综合征[1]。LDH具有腰痛、麻木、下肢疲劳等多种临床表现,严重影响患者的生活质量和工作能力。研究表明,LDH的发病机制与机械性神经根压迫和炎症有关,LDH髓核病变导致背根神经节(dorsal root ganglia,DRG)炎症反应增强,会引起持续性疼痛反应[2]。目前,LDH的治疗方案主要是保守治疗和手术治疗,但是大多数保守治疗可能出现症状无改善的情况,而手术治疗存在一定副作用。因此,迫切需要治疗效果更好的新药来治疗LDH引起的神经性疼痛。
血根碱(sanguinarine,SG)是从血根草和其他罂粟蓝堇属植物的根中提取的生物碱,具有抗菌、抗病毒、抗炎、抗氧化和抗肿瘤作用[3]。已有研究表明,SG可通过抑制小胶质细胞和丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)信号通路的激活来减轻神经性疼痛[4]。因此,本课题组推测SG对LDH大鼠炎性疼痛有改善作用。研究表明,各种炎症刺激会导致免疫细胞中MAPK、胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和c-Jun氨基端激酶(c-Jun N-terminal kinases,JNK)的磷酸化激活,激活的MAPK可促进核因子κB(nuclear factor-κB,NF-κB)的激活,进而促进肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素1β(interleukin-1β,IL-1β)的产生。有报道指出,激活LDH大鼠脊髓组织中MAPK/ERK/NF-κB信号通路可促进炎症反应,进而导致神经性疼痛[5]。此外,有研究表明,SG可通过抑制慢性缩窄损伤大鼠脊髓组织中p38 MAPK激活的神经炎症来减轻神经性疼痛[6]。但SG是否可通过抑制MAPK/ERK/NF-κB信号通路激活,减轻LDH大鼠炎性疼痛尚不明确。基于此,本研究基于MAPK/ERK/NF-κB信号通路,探讨SG对LDH大鼠炎性疼痛的改善作用及机制,旨在为SG应用于LDH的治疗提供理论依据。
1 材料
1.1 动物
1.2 主要试剂与仪器
SG标准品(批号230604,纯度≥98%)购自武汉艾美捷科技有限公司;Anisomycin(MAPK激活剂,批号221115,纯度≥99%)购自美国MCE公司;苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(批号221209)购自上海一研生物科技有限公司;TNF-α、神经肽Y(neuropeptide Y,NPY)的酶联免疫吸附测定(ELISA)试剂盒(批号分别为230204、230412)均购自上海信裕生物科技有限公司;5羟色胺(5-hydroxytryptamine,5-HT)、IL-1β的ELISA试剂盒(批号分别为220908、220814)均购自武汉菲恩生物科技有限公司;兔源离子钙接头蛋白1(ionized-calcium binding adaptor molecule-1,Iba-1)、胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、磷酸化p38 MAPK(p-p38 MAPK)、p38 MAPK、磷酸化ERK1/2(p-ERK1/2)、ERK1/2、磷酸化NF-κB p65(p-NFκB p65)、NF-κB p65、TNF-α、IL-1β和GAPDH抗体(批号分别为221103、221216、230105、230403、230212、230310、230306、221109、221004、230304、230211)均购自英国Abcam公司;辣根过氧化物酶标记的羊抗兔IgG二抗(批号230106)购自美国Thermo Fisher Scientific公司。
1.3 主要仪器
本研究所用主要仪器有Multiskan GO型全自动酶标仪(美国Thermo Fisher Scientific公司)、CX23型光学显微镜(日本Olympus公司)、DM IL LED型荧光显微镜(德国Leica公司)、Ugo Basile型足底热痛仪(上海玉研科学仪器有限公司)。
2 方法
2.1 动物分组、造模与给药
随机选取10只大鼠作为对照组,剩余大鼠参照文献[7]构建LDH模型,具体操作如下:麻醉大鼠,将背部和腹部脱毛,在距肛门约1 cm的尾根处切一个3~3.5 cm长的切口,从第二和第三椎骨之间的尾椎间盘中取出髓核。在背侧切开内侧纵切口,依次剥离皮肤、皮下组织和腰背筋膜,沿旋突左侧将骶棘肌剥离并分离,切断左侧L4至L5椎板、关节突和部分椎弓根,暴露左侧神经根以及L4、L5相应的DRG,将自体髓核放入硬膜外腔,缝合伤口。对照组大鼠暴露神经根,切除尾椎髓核,不进行移植。术后3 d静脉注射青霉素防止感染。当造模大鼠出现精神萎靡、行走缓慢、后肢跛行等行为时表明造模成功[8]。将造模成功的大鼠分为模型组和SG低、中、高剂量组以及SG高剂量+Anisomycin组,每组10只。SG低、中、高剂量组大鼠分别于腹腔注射1.00、2.50、6.25 mg/kg SG[3],SG高剂量+Anisomycin组大鼠在腹腔注射6.25 mg/kg SG的同时腹腔注射Anisomycin 5 mg/kg[9],对照组和模型组大鼠腹腔注射等体积生理盐水,每天1次,连续7 d。
2.2 大鼠一般情况及神经功能变化观察
末次给药结束后,观察各组大鼠一般情况,包括毛发、饮食、体重、运动情况等,并参考文献[10]对其神经功能进行评分:0级(2分),正常;1级(4分),步态基本正常,足趾异常;2级(6分),左后肢无力,轻度跛行;3级(8分),左后肢无力,跛行明显;4级(10分),站立不稳,左后肢活动;5级(12分),左后肢瘫痪,不能自主活动。
2.3 大鼠疼痛阈值检测
机械性痛觉过敏测定:“2.2”项下实验结束后通过Von Frey纤维丝测试大鼠右足机械痛阈。将大鼠固定于安静环境,施加足够的力将Von Frey纤维丝垂直刺激大鼠后爪表面6~8 s,若出现爪子迅速缩回、舔爪子或嚎叫即为阳性反应,将该力记为机械刺激缩足反射阈值(paw withdrawal mechanical threshold,PWMT)。每次测试间隔时间大约2 min,重复3次,取平均值。
热痛觉过敏测定:上述实验结束后采用热痛仪测试大鼠后爪足底的热敏感性,若大鼠出现缩足情况即为阳性反应,将开始刺激到出现阳性反应的时间记为热刺激缩足反射潜伏期(paw withdrawal thermal latency,PWTL)。热刺激时间为10~15 s,上限为20 s,以防止组织损伤。每次测试间隔5 min,重复3次,取平均值。
2.4 样本取材
痛觉实验结束后,麻醉处死大鼠,心脏取血,离心取上清,保存于-20 ℃用于TNF-α、IL-1β、5-HT、NPY检测。取血完成后,解剖大鼠,将椎旁肌与腰椎节段分离,切除椎间盘纤维环,暴露L4~L6节段髓核组织;收集DRG组织,一部分固定于4%多聚甲醛中,其余部分冷冻并保存在-80 °C。
2.5 大鼠DRG组织的病理学形态观察
将DRG组织于4 °C条件下固定于4%多聚甲醛中48 h,磷酸盐缓冲液(PBS)清洗后经乙醇梯度脱水、二甲苯透明、石蜡包埋后,切成4 μm薄片;取部分切片(剩余部分用于免疫荧光实验)进行HE染色后,置于显微镜下观察DRG组织的病理变化。
“等等,把逃兵送师部,我到想听听他为什么要当逃兵,也想听听他是怎么躲过鬼子毒气弹的。”赵锡田做了个停止的动作。
2.6 大鼠血清中炎症因子和疼痛因子水平的检测
采用ELISA法进行检测。取-20 ℃保存的大鼠血清,按照ELISA试剂盒说明书,检测炎症因子TNF-α、IL-1β和疼痛因子5-HT、NPY的水平。
2.7 大鼠脊髓小胶质细胞和星形胶质细胞活化情况的观察
采用免疫荧光法进行观察。取“2.5”项下剩余切片,以PBS洗涤后,透化30 min;以7%驴血清封闭1 h后,与一抗Iba-1(稀释度为1∶500)、GFAP(稀释度为1∶500)在4 °C孵育过夜;洗涤后与二抗(稀释度为1∶400)在室温下孵育45 min,以DAPI处理切片后,在荧光显微镜下观察切片并采集图像,采用Image Pro Plus软件分析Iba-1、GFAP蛋白(镜下均呈绿色荧光)的荧光强度。Iba-1蛋白荧光强度越高,表明脊髓小胶质细胞活化程度越高;GFAP蛋白荧光强度越高,表明星形胶质细胞活化程度越高。
2.8 大鼠DRG组织中MAPK/ERK/NF-κB信号通路相关蛋白和炎症相关蛋白表达检测
采用Western blot法进行检测。取各组大鼠DRG组织适量,经裂解液裂解后,取30 μg蛋白样品进行变性处理,然后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、转膜;以5%脱脂牛奶封闭,在4 °C条件下加入p-p38 MAPK、p38 MAPK、p-ERK1/2、ERK1/2、p-NF-κB p65、NF-κB p65、TNF-α、IL-1β、GAPDH(稀释度均为1∶1 000)一抗孵育过夜;洗膜后,在室温下加入二抗(稀释度为1∶2 000)孵育60 min。采用凝胶成像仪显影,并使用ImagePro Plus软件分析蛋白条带灰度值,以p-p38 MAPK与p38 MAPK、p-ERK1/2与ERK1/2、p-NF-κB p65与NF-κB p65的灰度值比值表示p38 MAPK、ERK1/2、NF-κB p65蛋白的磷酸化水平,以TNF-α、IL-1β与内参蛋白(GAPDH)的灰度值比值表示两者的表达水平。
2.9 统计学方法
采用SPSS 22.0和GraphPad Prism 8.0软件进行统计分析,数据采用±s表示。多组间比较用单因素方差分析,两两比较采用SNK-q检验,检验水准α=0.05。
3 结果
3.1 SG对大鼠一般情况及神经功能的影响
对照组大鼠行为正常,毛发光滑,饮食与行为状态良好;模型组大鼠精神萎靡,毛发杂乱,食欲不振,体重下降,后肢运动障碍;SG各剂量组大鼠精神、食欲好转以及后肢运动障碍缓解,体重升高;SG高剂量+Anisomycin组大鼠的精神、运动状况较SG高剂量组下降。对照组、模型组、SG低剂量组、SG中剂量组、SG高剂量组、SG高剂量+Anisomycin组大鼠神经功能评分分别为(2.01±0.24)、(9.03±1.08)、(5.93±0.62)、(4.75±0.49)、(2.84±0.31)、(6.55±0.68)分。与对照组相比,模型组大鼠神经功能评分显著升高(P<0.05);与模型组相比,SG各剂量组大鼠神经功能评分均显著降低(P<0.05);与SG高剂量组相比,SG高剂量+Anisomycin组大鼠神经功能评分显著升高(P<0.05)。
3.2 SG对大鼠疼痛阈值的影响
与对照组相比,模型组大鼠PWMT、PWTL均显著降低(P<0.05);与模型组相比,SG低、中、高剂量组PWMT、PWTL均显著升高(P<0.05);与SG高剂量组相比,SG高剂量+Anisomycin组PWMT、PWTL均显著降低(P<0.05)。结果见表1。
表1 各组大鼠疼痛阈值比较(±s,n=10)

表1 各组大鼠疼痛阈值比较(±s,n=10)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与SG高剂量组比较,P<0.05。
PWTL/s 14.83±1.52 6.94±0.72a 8.25±0.88b 10.43±1.52b 12.47±1.35b 7.29±0.83c组别对照组模型组SG低剂量组SG中剂量组SG高剂量组SG高剂量+Anisomycin组PWMT/g 32.65±3.48 10.86±1.27a 18.04±2.15b 24.28±2.63b 29.07±3.15b 15.74±1.61c
3.3 SG对大鼠DRG组织病理变化的影响
对照组大鼠DRG椎间盘神经元细胞结构正常,细胞核完整。模型组大鼠DRG椎间盘神经元细胞排列紊乱,细胞肿胀,界限模糊,核仁染色不均。与模型组比较,SG各剂量组大鼠DRG椎间盘神经元细胞结构改善,细胞肿胀减轻,界限清晰,核仁染色均匀。与SG高剂量组比较,SG高剂量+Anisomycin组大鼠DRG椎间盘神经元细胞结构紊乱。结果见图1。
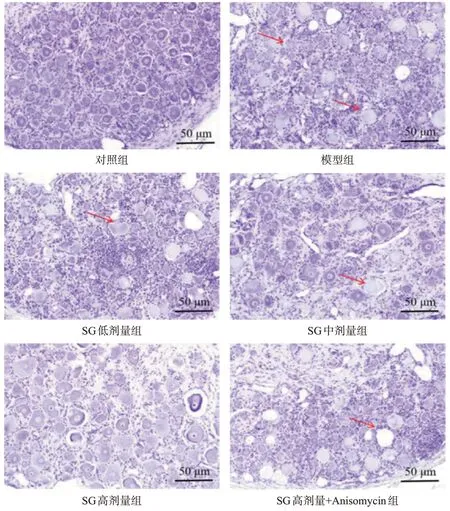
图1 各组大鼠DRG组织病理变化情况(HE染色)
3.4 SG对大鼠血清中炎症因子和疼痛因子水平的影响
与对照组相比,模型组大鼠血清中TNF-α、IL-1β、NPY水平均显著升高,5-HT水平显著降低(P<0.05);与模型组相比,SG各剂量组大鼠血清中TNF-α、IL-1β、NPY水平均显著降低,5-HT水平均显著升高(P<0.05);与SG高剂量组相比,SG高剂量+Anisomycin组大鼠血清中TNF-α、IL-1β、NPY水平均显著升高,5-HT水平显著降低(P<0.05)。结果见表2。
表2 各组大鼠炎性因子和疼痛因子水平比较(±s,n=10)
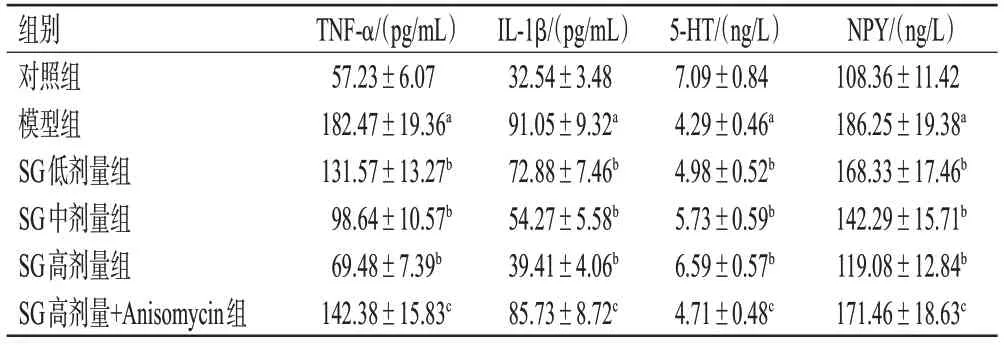
表2 各组大鼠炎性因子和疼痛因子水平比较(±s,n=10)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与SG高剂量组比较,P<0.05。
NPY/(ng/L)108.36±11.42 186.25±19.38a 168.33±17.46b 142.29±15.71b 119.08±12.84b 171.46±18.63c组别对照组模型组SG低剂量组SG中剂量组SG高剂量组SG高剂量+Anisomycin组TNF-α/(pg/mL)57.23±6.07 182.47±19.36a 131.57±13.27b 98.64±10.57b 69.48±7.39b 142.38±15.83c IL-1β/(pg/mL)32.54±3.48 91.05±9.32a 72.88±7.46b 54.27±5.58b 39.41±4.06b 85.73±8.72c 5-HT/(ng/L)7.09±0.84 4.29±0.46a 4.98±0.52b 5.73±0.59b 6.59±0.57b 4.71±0.48c
3.5 SG对大鼠脊髓小胶质细胞和星形胶质细胞活化的影响
与对照组相比,模型组大鼠脊髓小胶质细胞中Iba-1、星形胶质细胞中GFAP的阳性表达均显著升高(P<0.05);与模型组相比,SG各剂量组大鼠Iba-1、GFAP的阳性表达均显著降低(P<0.05);与SG高剂量组相比,SG高剂量+Anisomycin组大鼠Iba-1、GFAP的阳性表达均显著升高(P<0.05)。结果见图2(SG低剂量组图略)、表3。
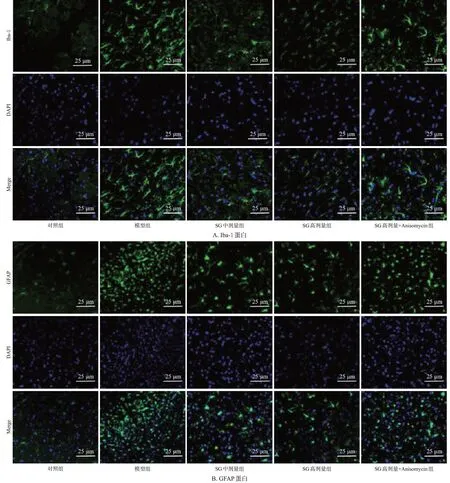
图2 各组大鼠Iba-1、GFAP蛋白荧光染色结果
表3 各组大鼠DRG组织中Iba-1、GFAP蛋白荧光强度比较(±s,n=10)
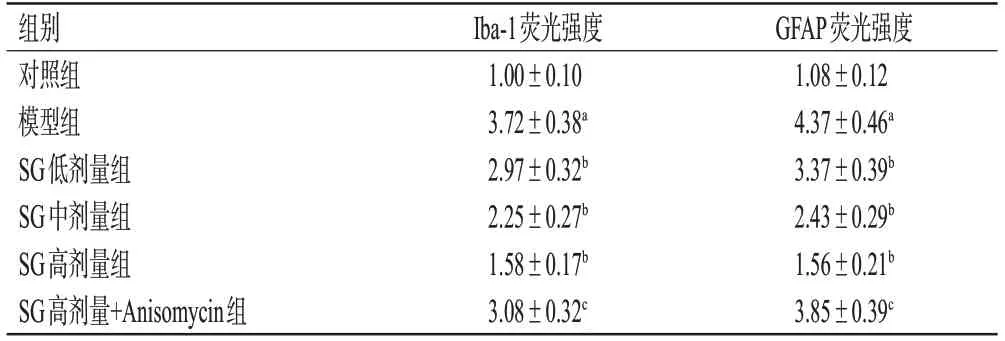
表3 各组大鼠DRG组织中Iba-1、GFAP蛋白荧光强度比较(±s,n=10)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与SG高剂量组比较,P<0.05。
GFAP荧光强度1.08±0.12 4.37±0.46a 3.37±0.39b 2.43±0.29b 1.56±0.21b 3.85±0.39c组别对照组模型组SG低剂量组SG中剂量组SG高剂量组SG高剂量+Anisomycin组Iba-1荧光强度1.00±0.10 3.72±0.38a 2.97±0.32b 2.25±0.27b 1.58±0.17b 3.08±0.32c
3.6 SG对大鼠DRG组织中MAPK/ERK/NF-κB信号通路相关蛋白及炎症相关蛋白表达的影响
与对照组相比,模型组大鼠DRG组织中p38 MAPK、ERK1/2、NF-κB p65蛋白磷酸化水平和TNF-α、IL-1β蛋白表达水平均显著升高(P<0.05);与模型组相比,SG各剂量组大鼠DRG组织中上述指标水平均显著降低(P<0.05);与SG高剂量组相比,SG高剂量+Anisomycin组大鼠DRG组织中上述指标水平均显著升高(P<0.05)。结果见图3、表4。

图3 各组大鼠DRG组织中相关蛋白表达的电泳图
表4 各组大鼠DRG组织中相关蛋白表达比较(±s,n=10)
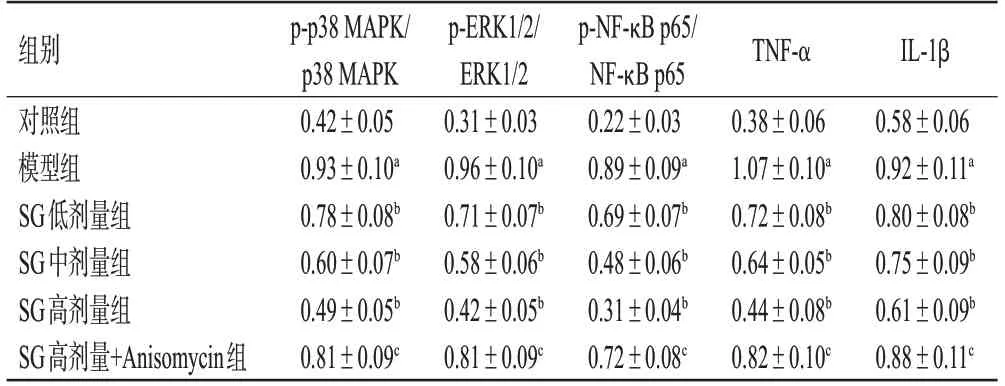
表4 各组大鼠DRG组织中相关蛋白表达比较(±s,n=10)
a:与对照组比较,P<0.05;b:与模型组比较,P<0.05;c:与SG高剂量组比较,P<0.05。
p-p38 MAPK/p38 MAPK 0.42±0.05 0.93±0.10a 0.78±0.08b 0.60±0.07b 0.49±0.05b 0.81±0.09c p-ERK1/2/ERK1/2 0.31±0.03 0.96±0.10a 0.71±0.07b 0.58±0.06b 0.42±0.05b 0.81±0.09c p-NF-κB p65/NF-κB p65 0.22±0.03 0.89±0.09a 0.69±0.07b 0.48±0.06b 0.31±0.04b 0.72±0.08c IL-1β 0.58±0.06 0.92±0.11a 0.80±0.08b 0.75±0.09b 0.61±0.09b 0.88±0.11c组别对照组模型组SG低剂量组SG中剂量组SG高剂量组SG高剂量+Anisomycin组TNF-α 0.38±0.06 1.07±0.10a 0.72±0.08b 0.64±0.05b 0.44±0.08b 0.82±0.10c
4 讨论
LDH是一种常见的慢性疾病,是引起下腰痛和神经痛的主要原因。学者普遍认为机械压迫神经根是慢性疼痛的主要原因,但近期有研究表明,髓核引起的促炎因子释放是引起神经疼痛的重要病理机制[11]。LDH的治疗选择包括保守治疗和手术,但仅有10%~20%的患者适合手术治疗,因此,非手术治疗仍是大多数LDH患者的最佳选择[12]。目前,临床治疗LDH的药物易引起不良反应,且效果不佳,因此寻找新的治疗方法对改善LDH的炎性疼痛至关重要。
DRG作为感觉传入的初级神经元,在疼痛的产生和传递中起重要作用。本研究通过自体髓核抑制构建LDH大鼠模型,发现模型大鼠出现后肢运动障碍、椎间盘变性以及DRG组织中神经元细胞损伤,PWMT、PWTL显著降低,表明LDH模型构建成功,大鼠疼痛阈值降低,出现痛觉反应。小胶质细胞作为中枢神经系统的常驻巨噬细胞,在免疫反应中起着重要作用,活化的小胶质细胞可释放TNF-α、IL-1β,从而加重疼痛[13]。小胶质细胞和星形胶质细胞分别在疼痛发展的早期和中期被激活,Iba-1、GFAP分别为小胶质细胞和星形胶质细胞的特异性细胞标志物[14]。5-HT、NPY为疼痛因子,其中5-HT存在于神经系统,具有镇痛作用;抑制血清中NPY的表达,可减轻LDH患者的疼痛反应[15]。本研究发现,模型大鼠血清中TNF-α、IL-1β、NPY水平和Iba-1、GFAP阳性表达均升高,5-HT水平降低,表明模型大鼠出现炎性疼痛反应。经SG干预后,大鼠一般情况及神经功能改善,血清中TNF-α、IL-1β、NPY水平和Iba-1、GFAP阳性表达均降低,PWMT、PWTL、5-HT水平均升高,表明SG可能通过抑制DRG组织中小胶质细胞活化,减少炎症因子释放,提高大鼠疼痛阈值,进而减轻LDH大鼠炎性疼痛。
神经损伤引起的异常疼痛取决于MAPK信号通路的激活,在小胶质细胞活化的早期阶段,MAPK在促炎因子下启动,激活其信号分子p38 MAPK、ERK等,其中ERK主要分布在星形胶质细胞和神经元中,p38 MAPK主要分布在小胶质细胞中[16]。NF-κB是MAPK的另一个下游转录因子,其发生磷酸化后,导致核转位增加,进一步促进TNF-α、IL-1β等炎症因子的释放[17]。因此,抑制小胶质细胞的活化和MAPK/ERK/NF-κB信号通路的激活可以缓解周围神经损伤引起的痛觉过敏。本研究结果显示,经SG干预后,大鼠DRG组织中p38 MAPK、ERK1/2、NF-κB p65蛋白磷酸化水平和TNF-α、IL-1β蛋白表达水平均降低,表明SG可能具有抑制MAPK/ERK/NF-κB信号通路的作用。为了进一步验证SG是否通过抑制MAPK/ERK/NF-κB信号通路发挥作用,本研究在SG干预的基础上同时加入MAPK激活剂Anisomycin,结果发现,SG对模型大鼠的改善作用受到抑制,提示SG可能通过抑制MAPK/ERK/NF-κB信号通路,改善模型大鼠炎性疼痛。
综上所述,SG可通过抑制LDH大鼠DRG组织中小胶质细胞活化,减少炎症因子释放,提高疼痛阈值,从而改善炎性疼痛,其作用机制可能与抑制MAPK/ERK/NFκB信号通路有关。
