新型生物反应器对浓香型酒醅微生物群落及理化指标的影响
2024-05-14莫玉婷袁思棋税梁杨杨明永杨周林范宏筠
莫玉婷,袁思棋,周 帅,税梁杨,杨明永,刘 君,杨周林,范宏筠*
(1.四川轻化工大学 生物工程学院,四川 宜宾 644000;2.泸州国之荣耀酒业有限公司,四川 泸州 646000;3.泸州老窖集团有限责任公司,四川 泸州 646000;4.酿酒生物技术及应用四川省重点实验室,四川 宜宾 644000)
据国家统计局和中国酒业协会的相关数据显示:2022年全国白酒产量为671.2万kL,其中上半年浓香型白酒产量375.1万kL,占白酒总产量55.88%。浓香型白酒酿造原料为单粮或多粮,以泥窖作为发酵容器,在微氧或无氧的条件下厌氧菌或兼性厌氧菌将可发酵性糖转化成乙醇和风味物质,形成具有独特风味的白酒[1-2]。浓香型白酒窖池发酵过程中绝对厌氧或微氧状态促进乙醇和风味物质的生成和转化,从而要求窖池具有良好的密封性,即浓香型白酒窖池的封窖泥质量和生产过程中窖泥维护等对窖池发酵有至关重要的作用。为提升浓香型白酒固态发酵窖池酿造密闭性,相继对浓香型白酒的封窖方式进行探索和实验。刘念等[3-4]对浓香型白酒的密封方式进行了初步研究,相继发明了浓香型固态发酵容器;苏占元等[5-6]探究了生物反应器和发酵窖池中酒醅理化变化和白酒产量和品质,表明生物反应器在白酒酿造生产实践是可行的。罗杰等[7]运用生物反应器进行浓香型白酒发酵生产并采取不同控温措施对比发酵工艺白酒品质,结果显示相较于对照组而言,控温窖池的窖泥和酒醅经过发酵后出酒率和酒质最优。相较于传统窖皮泥和塑料薄膜封窖方式而言,白酒酿造生物反应器不仅密闭性好、卫生、提高了白酒产量,而且能够有效利用土地资源,节约后续护养资金和人工成本,进一步推动了生产机械化[8]。
酒醅是白酒酿造的物质载体,是白酒酿造过程生化反应、物质循环、能量转换、代谢产酒产香等转化介质,即酒醅质量与白酒品质密切相关[9-10]。黄水是酒醅发酵的副产物,其不仅富含醇、酸、醛、酯等呈香呈味物质,还含有大量有益微生物、糖类物质、含氮化合物以及少量的单宁、色素等有机物[11]。随着对黄水的不断研究,黄水在白酒酿造中具有不可替代的价值,将其逐渐运用于白酒酿造和窖池养护过程,促使黄水重复应用。
高通量测序技术已经被广泛运用到白酒酿造的微生物群落结构分析[12-13],有利于对白酒酒醅在发酵过程中微生物群落组成及群落演替研究。本研究以新型生物反应容器和传统窖池为研究对象,探索传统窖池生产工艺(对照组)、新型生物反应器生产工艺(实验组I),以及在此基础上优化后的白酒新型生物反应器生产工艺(实验组II)对发酵酒醅中微生物的影响,联合酒醅理化指标和微生物指标,运用高通量测序技术分析酒醅发酵过程中微生物群落结构和群落动态变化规律,探讨新型生物反应器优化工艺的生产实践可行性;同时,利用冗余分析(redundancy analysis,RDA)技术综合分析理化因子与微生物生长演替的相关性,以期在生物反应器基础优化生产工艺而提升酒醅发酵状态,进而为新型生物反应器在白酒酿造生产过程中应用提供理论指导,进一步推动白酒企业机械化、自动化生产,提高白酒产量和品质。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醅:四川省泸州市某酒厂。选用9口窖龄和出酒率基本一致的窖池用于3组研究实验中,每组工艺设置3口平行组且做3次重复试验,共取54个样品用于理化与微生物检测。
1.1.2 试剂
E.Z.N.A.RSoil DNA Kit 脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:美国Omega Bio-Tek公司;氢氧化钠(分析纯):国药集团化学试剂有限公司;次甲基兰、酚酞、盐酸、硫酸铜、酒石酸钾钠(均为分析纯):成都科龙化工试剂厂;葡萄糖(分析纯):天津市致远化学试剂有限公司。
1.2 仪器与设备
FA2004B 电子天平:上海市安亭电子仪器厂;101-E 电热鼓风干燥箱:北京市永光医疗仪器有限公司;WST-411数显温度计:上海博取仪器有限公司;GeneAmp9700R型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI 有限公司;Illumina MiSeq PE300高通量测序仪:美国Illumina公司;NanoDrop2000 DNA浓度测定仪:美国Thermo Scientific公司。
1.3 方法
1.3.1 样品采集与保存
取样方法参照五点取样法分别对出、入窖酒醅面、上、下3层分别取样并置于无菌取样袋中立即密封混合均匀。将混匀后酒醅样品平均分成2 份装入无菌袋并冷藏,一份用于理化实验分析(4 ℃保存),一份用于高通量测序(-20 ℃保存)。样品根据分组和层面进行编号,样品Ⅰ(入窖:C1、C2、C3;出窖:C_1、C_2、C_3),样品Ⅱ(入窖:N1、N2、N3;出窖:N_1、N_2、N_3),样品Ⅲ(入窖:S1、S2、S3;出窖:S_1、S_2、S_3)。罗马数字I、II、III分别代表传统窖池生产工艺、新型生物反应器生产工艺、优化白酒新型生物反应器生产工艺。新型生物反应器示意图见图1[4]。
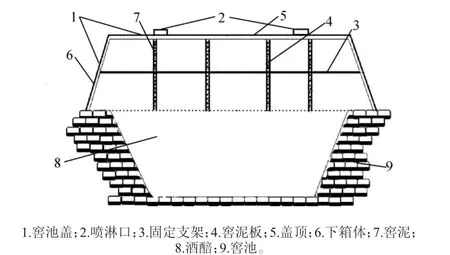
图1 新型生物反应器装置示意图Fig. 1 Diagram of new bioreactor device
对照组窖池为传统黄泥+窖皮封窖工艺;实验组I为新型生物反器封窖工艺;实验组II根据实验I装置经过改造优化后形成具有黄水处理和控温、保温设施的新型生物反应器。3组工艺的发酵时间均为60 d,冬季顶温为32~35 ℃。
1.3.2 酒醅理化指标测定
酒醅温度测定:使用数显温度计对窖池和容器内发酵酒醅实时测温;水分含量:参照国标GB 5009.3—2016《食品中水分含量的测定》中的第一法直接干燥法进行测定;酸度、淀粉含量、还原糖含量的测定:参照《白酒生产技术全书》[1]。酸度测定:采用氢氧化钠滴定法;淀粉含量测定:采用酸水解法;还原糖含量的测定:采用斐林试剂滴定法。
1.3.3 样品总DNA提取
本实验采用E.Z.N.A.RSoil DNA Kit DNA 抽提试剂盒提取样品中的总DNA,提取步骤参考试剂盒说明方法,使用1%琼脂糖凝胶电泳检测DNA 提取质量,并用NanoDrop 2000检测DNA 浓度和纯度。
1.3.4 PCR扩增
细菌采用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和引物806R(5'-GGACTACHVGGGTWTCTAAT-3')对V3-V4可变区进行PCR 扩增,真菌采用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')扩增ITS1区。
细菌PCR扩增条件:95 ℃预变性3 min,35 个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),再72 ℃稳定延伸10 min,10 ℃保存直至反应结束;真菌PCR扩增条件参照卫春会等[14]实验方法。
PCR扩增体系:上、下游引物(5 μmol/L)各0.8 μL,5×FastPfu缓冲液吸取4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)取2 μL,Fast Pfu DNA聚合酶0.4 μL,模版DNA 10 ng,添加双蒸水(ddH2O)至20 μL。
1.3.5 高通量测序
质检合格的PCR扩增样品送至上海美吉生物技术有限公司进行高通量测序和生物信息学分析。生物公司返回测序数据后,使用Fastp(version 0.19.6)软件对双端原始测序序列进行质控,FLASH(version 1.2.11)软件进行拼接,过滤reads尾部质量值20以下的碱基,去除含N碱基的reads,根据PE reads之间的overlap关系,将成对reads拼接(merge)成一条序列。然后,使用Qiime2流程中的Deblur插件对质控拼接之后的优化序列进行降噪处理后得到扩增子序列变体(amplicon sequence variants,ASVs)。物种分类学分析基于Sliva 16S rRNA基因数据库(v138),通过Qiime2中的Naivebayes分类器,置信度阈值为0.7,对ASVs进行数据分析。
1.3.6 数据处理
含高通量测序数据于上海美吉生物医药科技有限公司的多样性云分析平台进行统计分析及数据可视化。Alpha多样性分析Chao1、香农(Shannon)等指数运用Mothur软件计算,Wilxocon秩和检验进行α-多样性的组间差异分析。使用RDA技术来反映酒醅理化指标与微生物群落结构的关系。酒醅理化指标则是运用IBM SPSS Statistics 27.0和Origin 2021进行数据分析。
2 结果与分析
2.1 酒醅理化指标分析
2.1.1 不同生产工艺条件下酒醅温度的变化
3种不同生产工艺条件下,酒醅温度的变化见图2。由图2可知,发酵温度整体呈现先上升后降低的趋势,符合白酒酿造生产温度变化趋势。3种生产工艺入窖酒醅温度范围在20.0~23.9 ℃,实验II入窖温度较高(23.9 ℃)。在0~30 d发酵过程中,窖池内发酵温度均呈现上升趋势,其中实验组II温度上升幅度大。发酵时间达到15 d时,实验组I窖池和对照组窖池温度上升幅度放缓,直到27~28 d,酒醅温度上升到最高,分别为33.0 ℃和33.2 ℃,后缓慢降温。但是,实验组II酒醅温度15 d后继续上升,到第30天达到顶温35.5 ℃,后缓慢回落,直至第60天温度回落至30.8 ℃。实验组II在第35天经过生物反应器中控温装置调控处理后,温度呈现小幅度上升趋势,且该工艺封窖下保持适宜温度时间更长。结果表明,对照组和实验组在发酵周期内,温度变化趋势基本一致,但是优化新型生物反应器生产工艺的保温效果更好。

图2 酒醅温度在三种不同生产工艺条件下的变化Fig. 2 Changes of temperature of fermented grains under 3 different production process conditions
2.1.2 不同生产工艺条件下酒醅理化指标的变化
将出、入窖酒醅样品进行理化指标分析,结果见图3。水分含量是酿酒生产活动的必须条件之一,且浓香型入窖酒醅水分含量合适范围为52%~56%[1]。由图3a可知,3组入窖酒醅水分含量为53.2%~55.8%,出窖酒醅水分含量为58.5%~62.3%。从整体上看,出窖酒醅水分含量均高于入窖酒醅,且增长了约5.3%~6.5%。3种不同生产工艺中,实验组II出窖酒醅下层水分含量(62.3%)比对照组(60.0%)、实验组I(60.9%)稍高,其中,水分含量下层(62.3%)>上层(60.1%)>面层(59.6%),实验组II下层出窖水分含量最高,达到62.3%,说明实验组II封窖模式下,密封性效果最好。

图3 酒醅水分(a)、酸度(b)、淀粉(c)、还原糖(d)含量在三种不同生产工艺条件下的变化Fig. 3 Changes of moisture (a), acidity (b), starch (c) and reducing sugar (d) contents of fermented grains under 3 different production process conditions
在适当的酸度范围内,酸度增长对抑制杂菌生长和糊化作用起着积极影响。由图3b可知,酒醅酸度随发酵时间延长而显著增大,且出窖酒醅下层样品酸度值比面层、上层更大,这可能是下层醅长期与黄水浸泡的因素引起酸度较高。出窖酒醅酸度为2.28~4.24 mmol/10 g,对照组与实验组II面层、下层酸度分别为2.28 mmol/10 g、3.39 mmol/10 g和3.81 mmol/10 g、4.24 mmol/10 g,两组酿造工艺存在显著差异(P<0.05),然而,实验组II中下层出窖醅S_3的酸度高达4.24 mmol/10 g,可能是采用黄水控温和保温装置后,持续稳定的温度和丰富的营养成分利于微生物生长和代谢,促进浓香型白酒风味物质生成。
淀粉与还原糖在白酒酿造中为微生物提供营养成分和发酵能量,入窖淀粉含量应在16%~22%[1]。由图3c和图3d可知,酒醅淀粉与还原糖含量随发酵而呈现下降趋势,且各层酒醅淀粉含量均大幅度降低且下层消耗量最多,对照组与实验组II下层酒醅淀粉含量由18.76%和20.65%分别下降至10.72%、9.36%,两者差异显著(P<0.05)。由图3d可知,还原糖含量由1.76%~2.06%降至0.09%~0.27%,其中,实验组II各层淀粉消耗量均比其余两组消耗多,对照组、实验组I上层出窖醅还原糖分别为0.23%、0.31%,而实验组II还原糖由1.93%降至0.09%,三组生产工艺还原糖含量差异显著(P<0.05)。结果表明,实验组II生产工艺在保温装置的作用下,微生物代谢旺盛,持续利用淀粉类物质和可发酵性糖,从而一定程度上降低了残余糖类,对浓香型白酒酒醅作用效果最佳。
2.2 酒醅微生物α-多样性指数分析
采用降噪后的样本扩增子序列变体(ASV)序列进行酒醅微生物α-多样性分析,酒醅样品中细菌和真菌微生物的α-多样性分析结果分别见表1和表2。细菌测序共得到有效序列790 608条;真菌测序共得到有效序列1 234 842条。ASV数是样本扩增子序列数;Sob指数和Chao1指数均反映群落丰富度;香农(Shannon)指数和辛普森(Simpson)指数表示群落多样性反映谱系多样性[15],且Simpson指数与Shannon指数含义相反,Simpson指数越大,说明群落多样性越低。

表1 酒醅细菌Alpha多样性指数Table 1 Alpha diversity indexes of bacteria of fermented grains
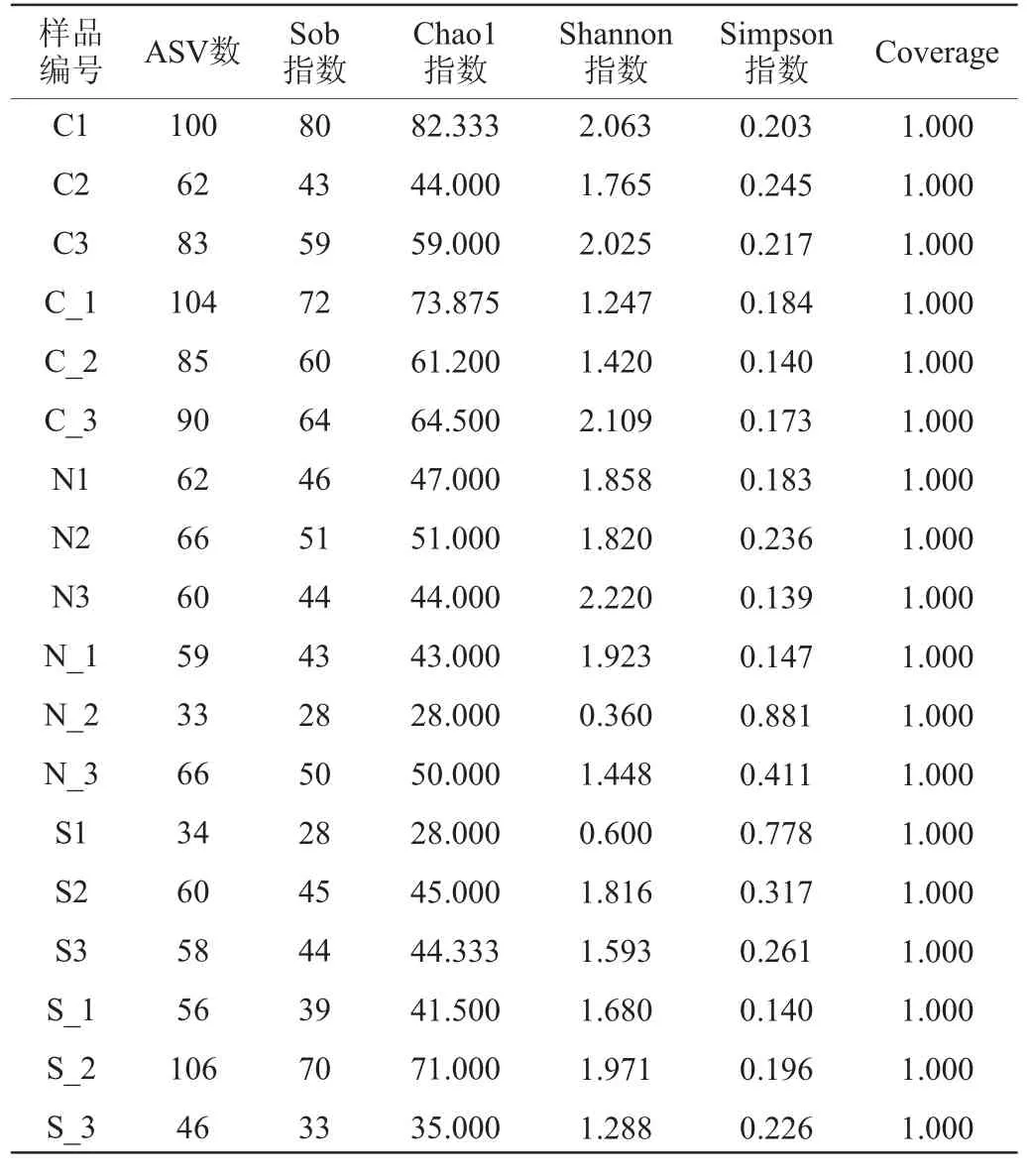
表2 酒醅真菌Alpha多样性指数Table 2 Alpha diversity indexes of fungi of fermented grains
由表1可知,所有样本覆盖率均达到99.9%以上,说明测序结果可以全面准确地反映物种信息。整体来看,酒醅发酵过程中细菌菌群入窖样品的丰富度和多样性均高于出窖样品;对照组、实验组II的出窖酒醅真菌群落数略高于入窖酒醅,实验组I出窖酒醅相较入窖酒醅菌落数呈下降趋势。结果表明,随着酒醅发酵的进行,微生物生长和代谢,以及温度、酸度等理化指标的变化而影响酒醅中微生物群落多样性,从而利于酿酒的微生物生长。
由表1可知,物种丰富度和多样性随发酵进行呈下降趋势,3组入窖酒醅的细菌群落丰富度(Sob指数、Chao1指数)和细菌群落多样性(Shannon指数)整体上均高于出窖酒醅样品,说明入窖酒醅微生物丰度和多样性高于出窖酒醅,推测可能是由于发酵前期营养物质充分且入窖微生物主要来源于大曲和窖池,随着发酵后期氧气和底物的减少以及环境变化,不适应发酵环境微生物被淘汰,出窖酒醅多样性及丰度随之降低。其中对照组入窖酒醅的上、下层微生物物种丰富度最大,发酵结束后出窖醅最大丰富度为面层,可能是随着发酵时间的延长,实验组面层酒醅原料大量被利用,形成风味化学物质,部分微生物生长受到抑制;实验组Ⅰ和实验组Ⅱ入窖酒醅面、上两层物种丰富度和多样性最高,出窖醅则存在差异,其中,实验组Ⅰ物种丰度以面层和下层较高,实验组Ⅱ物种丰度则以上、下层较为突出,说明优化后的白酒新型生物反应器可使上、下层的温度更有利于微生物生存。各层不适应发酵环境的细菌群落不断减少,3组样品出窖酒醅微生物丰富度和多样性则是实验组Ⅱ>对照组>实验组Ⅰ。
由表2可知,对照组出窖酒醅的ASV数增加,面层出窖酒醅多样性指数降低,上、下层出窖酒醅多样性则是升高;实验组Ⅰ上、下层入窖酒醅多样性高于出窖酒醅,而面层物种多样性发酵后增加;实验组Ⅱ各层出窖酒醅多样性均高于入窖酒醅。Simpson 指数越小,多样性越大,对照组、实验组Ⅱ总体上显示出窖各层酒醅样品真菌群落多样性大于入窖,说明发酵后期微生物群落分布更均匀;实验Ⅱ组则是随发酵时间推移真菌群落数逐渐减少。
2.3 稀释曲线
稀释曲线主要利用各样本在不同测序深度时的微生物Alpha多样性指数构建曲线,以此反映各样本在不同测序数量时的微生物多样性,可以用来比较测序数据量不同的样本中物种的丰富度和多样性,亦可证明样本的测序数量是否合理。多样性指数Sob反映实际观测到的物种数,以此构建稀释曲线见图4。
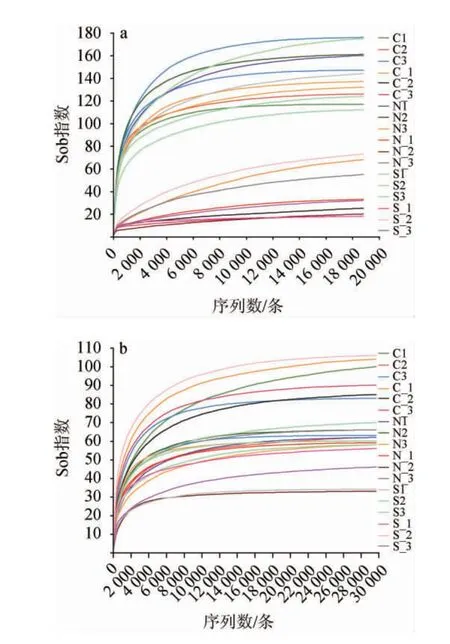
图4 基于Sob多样性指数构建细菌(a)和真菌(b)的稀释曲线Fig. 4 Dilution curves of bacteria (a) and fungi (b) based on Sob diversity index
由图4可知,对照组和实验组的稀释曲线随着序列数的增加趋于平坦,说明测序数据量合理。
2.4 酒醅微生物群落结构分析
2.4.1 酒醅发酵过程中细菌群落组成分析
根据降噪得到的ASV在门分类水平的物种分类信息检出酒醅细菌构成有33门、93纲、227目、374科、717属。不同酿造工艺中发酵前后对照组和实验组酒醅样品细菌的相对丰度,选取样品在门、属水平上相对丰度≥1%(相对丰度<1%为others)ASV生成相对丰度堆积柱状图分别见图5和图6。
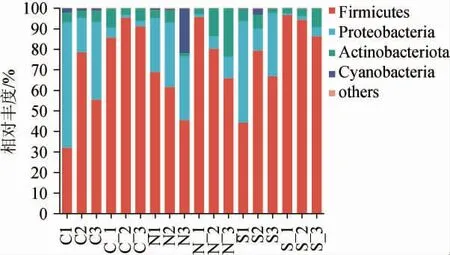
图5 基于门水平酒醅发酵过程中细菌群落结构Fig. 5 Bacterial community structure of fermented grains during fermentation process based on phylum level
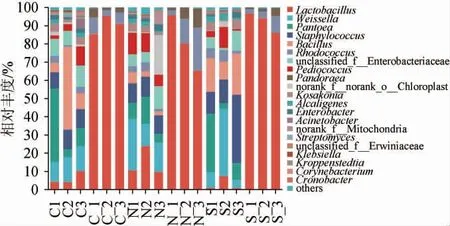
图6 基于属水平酒醅发酵过程中细菌群落结构Fig. 6 Bacterial community structure of fermented grains during fermentation process based on genus level
由图5可知,酒醅在发酵过程中主要的细菌有厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota),整个发酵过程中厚壁菌门(Firmicutes)是丰度最高的优势门,并且在酒醅样品对照组、实验组Ⅰ、实验组Ⅱ平均相对丰度分别为73.02%、69.65%、77.95%;变形菌门(Proteobacteria)在酒醅样品对照组、实验组Ⅰ、实验组Ⅱ平均相对丰度分别为20.84%、17.83%、16.42%,放线菌门(Actinobacteriota)在酒醅样品对照组、实验组Ⅰ、实验组Ⅱ组平均相对丰度分别为5.41%、8.58%、4.97%。经过对比发现,厚壁菌门(Firmicutes)在对照组、实验组Ⅱ的相对丰度明显高于实验组Ⅰ,变形菌门(Proteobacteria)在对照组中略高于实验组Ⅰ、实验组Ⅱ,而放线菌门(Actinobacteriota)在实验组Ⅰ高于对照组、实验组Ⅱ。
通过对比3组生产工艺,3组的出窖酒醅中厚壁菌门(Firmicutes)相对丰度明显高于入窖酒醅,而变形菌门(Proteobacteria)则与之相反;对照组、实验组Ⅰ、实验组Ⅱ中厚壁菌门(Firmicutes)平均相对丰度分别由55.30%、58.70%、63.47%上升到90.74%、80.61%、92.44%,变形菌门(Proteobacteria)平均相对丰度分别由38.66%、29.58%、30.41%下降至6.20%、13.25%、5.07%。随着发酵时间的延长,酒醅中细菌丰度随时间而变化,厚壁菌门(Firmicutes)在发酵过程中整体呈大幅度上升趋势,变形菌门(Proteobacteria)相对丰度则显著降低,杂菌减少,与宋建阳等[16]研究结果基本一致。由此可知,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)是发酵过程中常见的细菌门,二者主要来源于大曲优势微生物,且VITAL M等[17]研究发现,厚壁菌门(Firmicutes)是主要合成丁酸的潜力细菌,同时上述两种菌富集可能是酒醅高醇、高酸的主要因素[18]。
由图6可知,酒醅发酵过程中共检出21个优势细菌属,且各样品细菌菌落组成相似,但丰富度存在差异。其中,优势细菌属主要为乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、泛菌属(Pantoea)、葡萄球菌属(Staphylococcus)和芽孢杆菌属(Bacillus),与李泽等[19]研究结果基本一致。上述5类细菌优势属在酒醅样品对照组、实验组Ⅰ、实验组Ⅱ中平均相对丰度分别达到78.80%、68.89%、82.35%;酒醅入窖发酵前后,乳杆菌属(Lactobacillus)在对照组、实验组Ⅰ、实验组Ⅱ平均相对丰度分别由6.13%上升到90.47%,14.66%上升到80.37%,3.02%剧增到92.30%,与陈进等[20]研究结论基本一致。经过对比发现,不同酒醅层的群落结构无明显差异,而不同发酵阶段酒醅的微生物菌群差异相对较大。泛菌属(Pantoea)在对照组、实验组Ⅰ、实验组Ⅱ平均相对丰度分别由18.17%、9.44%、14.82%均降至0;魏斯氏菌属(Weissella)在对照组、实验组Ⅰ、实验组Ⅱ平均相对丰度分别由12.73%、18.87%、16.71%均降至0,葡萄球菌属(Staphylococcus)在对照组、实验组Ⅰ、实验组Ⅱ平均相对丰度分别由10.08%、10.72%、20.82%降至0.01%,芽孢杆菌属(Bacillus)在3组酒醅中平均相对丰度分别由19.83%下降到0.17%,3.69%下降到0.03%,16.97%下降到0.02%。
由此可得出,当酒醅入窖发酵后,随着发酵时间推移和酒醅理化性质的变化,酒醅中优势细菌属相对丰度有显著性变化,即酒醅发酵前细菌优势菌属由泛菌属(Pantoea)、魏斯氏菌属(Weissella)、葡萄球菌属(Staphylococcus)和芽孢杆菌属(Bacillus)所构成,而酒醅发酵后则由乳杆菌属(Lactobacillus)、红球菌属(Rhodococcus)和潘多拉菌属(Pandoraea)所取代,且酒醅发酵结束后乳杆菌属(Lactobacillus)占绝对优势,也是酒醅发酵后丰度最高的优势菌属。乳杆菌属(Lactobacillus)微生物代谢产物为乳酸及乙酸等有机酸能力,代谢过程还可以这些有机酸为底物发生酯化反应生成乳酸乙酯、乙酸乙酯等酯类物质,为白酒风味的形成提供前体物质,提升相应酒体中风味成分[21-24]。与实验组Ⅰ相比,对照组、实验组Ⅱ发酵前乳杆菌属(Lactobacillus)较少;发酵后大幅度增长,对照组、实验组Ⅱ乳杆菌属(Lactobacillus)多于实验组Ⅰ,其中实验组Ⅱ乳杆菌属(Lactobacillus)增长最多。乳杆菌属(Lactobacillus)是酒醅发酵中重要呈香脂肪丁酸的合成代谢主要贡献菌[25],其在发酵中后期大量繁殖,是由于发酵过程中微生物代谢导致还原糖分解生成乙醇和乳酸等物质[26],酒醅颗粒间隙中的氧气近乎消耗殆尽,以及产物的抑制作用使得霉菌和酵母活性减弱,产酸菌开始大量生长繁殖,总酸含量快速上升。因此,乳杆菌属(Lactobacillus)的大量生长可作为酒醅在发酵后期的标志性象征,优化后的生物反应器在酒醅发酵过程中能起到较好封闭效果,加上其自带的保温、降温装置能够有效控制酒醅发酵过程,有一定促进效果;随着发酵阶段推移,3组酒醅样品中物种多样性显著下降,大量原始微生物被抑制、淘汰,适合生长的微生物富集成优势群,相对丰度得以提高[27],其中实验组Ⅱ相对丰富度最高,杂菌大量减少;实验组Ⅰ相对丰度最低。
2.4.2 酒醅发酵过程中真菌群落组成分析
真菌内源转录间隔区(internally transcribed spacer,ITS)分析共检测出6门、23纲、51目、98科、178属。物种相对丰度堆积图根据物种注释结果分别见图7和图8。选取样品在门、属水平上相对丰度≥1%的物种(相对丰度<1%合并为others)而生成的不同工艺中发酵前后酒醅真菌的相对丰度。
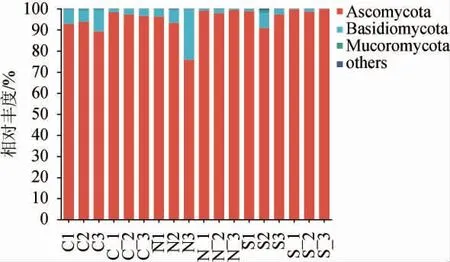
图7 基于门水平酒醅发酵过程中真菌群落结构Fig. 7 Fungal community structure of fermented grains during fermentation process based on phylum level

图8 基于属水平酒醅发酵过程中真菌群落结构Fig. 8 Fungal community structure of fermented grains during fermentation process based on genus level
由图7可知,酒醅在发酵过程中检测出优势真菌门3个,主要真菌为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),子囊菌门(Ascomycota)在对照组、实验组Ⅰ、实验组Ⅱ的平均相对丰度分别为94.75%、93.69%、97.59%,占据绝对优势;而担子菌门(Basidiomycota)在对照组、实验组Ⅰ、实验组Ⅱ的平均相对丰度分别为4.91%、6.10%、2.04%。子囊菌门(Ascomycota)和担子菌门(Basidiomycota)主要来源于大曲微生物且是大曲在酒醅发酵中的优势真菌门,与李义等[28]研究结果基本一致。
所有酒醅的微生物随着发酵时间推移,子囊菌门(Ascomycota)相对丰度增加,担子菌门(Basidiomycota)相对丰度降低。入窖酒醅开始发酵时子囊菌门(Ascomycota)比例最高,表明其能在该酿造环境条件下生长代谢,将原料中的淀粉与蛋白质分解成葡萄糖与氨基酸。子囊菌门(Ascomycota)在整个发酵过程中是丰度最高的优势门,占据了酒醅发酵前后真菌绝对优势门的地位,高含量的子囊菌门(Ascomycota)对驱动酒醅活性微生物群落变化起重要作用[25]。担子菌门(Basidiomycota)在发酵中相对丰度逐渐减低,原因可能为担子菌门(Basidiomycota)是好氧性微生物,随着发酵时间增加,氧气含量不断减少且养分不断消耗,导致真菌含量减少[29]。
由图8可知,酒醅样品检出优势真菌属17个,主要优势真菌属包括未分类的曲霉菌科(unclassified_f__Aspergillaceae)、伊萨酵母属(Issatchenkia)、哈萨克斯坦酵母属(Kazachstania)和嗜热子囊菌属(Thermoascus),这4种真菌属在酒醅样品对照组、实验组Ⅰ、实验组Ⅱ平均相对丰度分别为70.72%、63.82%、77.47%。曲霉属在酿造过程中能产生糖化酶、液化酶、蛋白酶等多种酶,降解原料,提高出酒率以及生香[30-31]。随着发酵时间的推移,unclassified_f__Aspergillaceae在发酵前期丰度较高,在酒醅样品对照组、实验组Ⅰ、实验组Ⅱ相对丰度分别达到41.75%、32.40%、60.84%,对照组、实验组Ⅰ、实验组Ⅱ随发酵后相对丰度分别降低至15.52%、13.87%、22.96%,可能是unclassified_f__Aspergillaceae菌群不适应高酸、高醇、厌氧环境而生长代谢受阻碍或死亡,该实验结果与车路萍[32]研究结果基本一致。其次,伊萨酵母属(Issatchenkia)在对照组发酵过程中呈下降趋势,下降了5.67%;其在实验组Ⅰ、实验组Ⅱ的相对丰度上升,分别由14.72%、7.59%上升至25.34%、33.97%,与以往的研究结论相同[33],其对酒醅的香气形成具有重要作用[34-36]。嗜热子囊菌属(Thermoascus)在酒醅样品对照组、实验组Ⅰ、实验组Ⅱ发酵过程中整体呈现下降趋势;哈萨克斯坦酵母属(Kazachstania)在3组样品的发酵前期未检出,但随着发酵过程的进行而不断增长,其在对照组相对丰度最高,达到51.56%,该菌主要存在于C_1和C_2酒醅样品中,可能原因是面层、上层酒醅淀粉残余量充足且氧气含量较高利于生长,实验组Ⅰ、实验组Ⅱ分别上升至16.26%、17.60%。因此,unclassified_f__Aspergillaceae和伊萨酵母属(Issatchenkia)为酒醅发酵中优势真菌,对白酒糟醅形成更多风味物质起到积极作用。
2.5 理化指标与优势微生物属相关性分析
根据获取的ASV数据集,将不同生产工艺的酒醅发酵过程中的理化指标与优势细菌属、真菌属进行RDA,结果见图9。

图9 酒醅发酵过程中基于属水平细菌与理化因子(a)、真菌与理化因子(b)冗余分析Fig. 9 Redundancy analysis of bacteria and physicochemical factors(a), fungi and physicochemical factors (b) of fermented grains during fermentation process based on genus level
由图9a可知,水分和温度与乳杆菌属(Lactobacillus)呈显著正相关(P<0.05),淀粉与乳杆菌属(Lactobacillus)、红球菌属(Rhodococcus)呈显著负相关(P<0.05),淀粉与芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)、魏斯氏菌属(Weissella)呈显著正相关(P<0.05)。由图9b可知,水分、温度和酸度与unclassified_f__Aspergillaceae、嗜热子囊菌属(Thermoascus)、复膜孢酵母属(Saccharomycopsis)、unclassified_f__Metschnikowiaceae呈显著负相关(P<0.05),与哈萨克斯坦酵母属(Kazachstania)、伊萨酵母属(Issatchenkia)呈正相关性,淀粉与unclassified_f__Aspergillaceae、嗜热子囊菌属(Thermoascus)呈正相关关系,这与汤涵岚等[37]研究结论基本一致。通过RDA,微生物对白酒发酵产酒生香中起到推动作用,白酒质量的优劣取决于发酵中微生物的群落组成,浓香型白酒发酵过程中在理化因子的作用下,与微生物之间相互影响、相互协同或拮抗,从而影响着微生物群落的演替和组成情况。
2.6 不同生产工艺条件下白酒产量分析
对照组、实验组Ⅰ、实验组Ⅱ分别投入原料为4 200 kg、6 300 kg、6 300 kg,经过发酵后对照组、实验组Ⅰ、实验组Ⅱ所产浓香型白酒产量分别为1 376 kg、1 704 kg、2 055 kg。实验组Ⅱ白酒产量和出酒率均最高,相较于对照组和实验组Ⅰ白酒产量分别多产679 kg、351 kg,说明优化后白酒生物反应器对白酒产量和出酒率均有着显著的提高。优化后白酒生物反应器采用控温和黄水结合,使得一系列产酒微生物获得舒适生境和营养底物,大量生长繁殖,从而促进白酒产量的提升。
3 结论
通过研究传统窖池、新型生物反应器,以及优化后新型生物反应器进行酿酒生产而对比分析3种不同发酵模式下,实验组和对照组的酒醅微生物群落和理化指标的影响。结果表明,与对照组相比,实验组II升温效果最优且保持适宜温度时间更长,实验组水分含量、淀粉及还原糖消耗量更高,实验组II下层酒醅酸度最高(4.24 mmol/10 g)。基于高通量测序技术分析可知,3组工艺发酵过程中酒醅样品的细菌丰富度和多样性均显著高于真菌,其中厚壁菌门和子囊菌门分别为丰度最高的优势细菌门和优势真菌门。RDA结果表明,酒醅发酵过程中微生物群落结构变化与理化因子有着显著的相关性,水分和温度与Lactobacillus呈显著正相关(P<0.05),淀粉与Bacillus、Staphylococcus、Weissella呈显著正相关(P<0.05);水分、温度和酸度与unclassified_f__Aspergillaceae、Thermoascus、Saccharomycopsis呈显著负相关(P<0.05),与Kazachstania、Issatchenkia呈正相关性。
综上所述,采用优化后的白酒生物反应器封窖能够更好的保持窖池内密封性,从而保障微生物在相对厌氧或厌氧条件下的生存,后续发酵控制更加有利于微生物长期处于适宜的生存环境,充分利用营养物质,提升粮食利用率和出酒率。优化后白酒生物反应器在浓香型白酒酿造中实践应用,为实际生产酿造浓香型白酒工艺改良以及智能化生产优质的白酒提供理论依据和实践支撑。
