酱香型白酒冬季堆积发酵过程中酒醅升温机制初探
2024-05-14张德芹胡建锋张二康李岭卓
张德芹,胡建锋,吴 成,张二康,李岭卓*
(1.贵州习酒投资控股集团有限责任公司,贵州 遵义 564600;2.贵州习酒股份有限公司,贵州 遵义 564600;3.贵州省制造业创新中心,贵州 遵义 564500;4.中国轻工业酱香型白酒智能化酿造工程技术研究中心,贵州 遵义 564600)
堆积发酵是酱香型白酒独具特色的生产工艺之一[1-2],因该过程具有网罗环境微生物的作用[3-4],也被称为“二次制曲”。研究证实,堆积发酵过程中种类、数量十分丰富的酒醅微生物生长代谢与演替变化,分解大分子物质,产生了大量的风味物质以及其前体,为酒醅进入窖池发酵产酒、产香创造必要的条件[5-6]。任婷婷等[7]对洞酿酱香酒一轮次堆积发酵过程微生物群落与理化因子关联性进行研究,结果表明酒醅中优势细菌属为乳杆菌属(Lactobacillus)、枝芽孢杆菌属(Virgibacillus)和克罗彭斯特菌属(Kroppenstedtia),优势真菌属为嗜热真菌属(Thermomyces)、曲霉属(Aspergillus)和复膜孢酵母属(Saccharomycopsis)。吴成等[8]探究了酱香酒造沙轮次堆积发酵酒醅微生物与理化指标演替规律,表明在发酵末期乳杆菌属(Lactobacillus)和毕赤酵母属(Pichia)为绝对优势菌属,且与酒醅温度呈显著正相关关系(P<0.05)。张春林等[9]研究了酱香酒二轮次堆积过程酒醅微生物与理化指标变化规律,证实酒醅温度与假丝酵母属相对丰度呈正相关,与裸胞壳属(Emericella)、毕赤酵母属呈负相关。此外,还有研究表明,酱香型白酒堆积发酵过程微生物的代谢产热作用带动酒醅温度升高,进而利于微生物生长繁殖[10]。
一般地,酱香型白酒一、二轮次发酵生产处于气温较低的冬季(1~2月份),堆积酒醅容易出现“来温慢、冷心、达不到顶温”等发酵异常现象,从而导致发酵不彻底,进而影响基酒产质量。袁再顺等[11]研究表明,破堆移位处理能使异常堆恢复正常升温、降低酒醅的总酸与水分含量,并显著增加二轮次酒醅中还原糖含量,该处理对堆积酒醅中好氧细菌芽孢杆菌的生长具显著促进作用,而乳酸杆菌大量减少。谈冲等[12]对酱香型白酒一轮次酒醅微生物的溯源分析发现,生产环境为堆积酒醅提供了大多数细菌(93.8%),乳酸菌主要来源于车间过道以及生产工具。目前,尽管已有研究者对冬季酱香型白酒堆积发酵过程酒醅中微生物来源以及堆子温度变化原因进行了分析,但对于整个堆积发酵过程酒醅升温的内在机制仍缺乏较为清晰的认知。基于此,本研究以酱香型白酒冬季一轮次堆积发酵酒醅为研究对象,采用实时温度监测仪、传统可培养方法和高通量测序技术,对堆积发酵过程中酒醅温度、微生物菌落总数、真菌群落结构的变化规律及其相关性进行了探索,以期为阐释酱香型白酒堆积发酵过程升温机制提供基础数据和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醅样品:贵州习酒股份有限公司制酒车间。
1.1.2 化学试剂
脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Omega BioTek公司;聚合酶链式反应(polymerase chain reaction,PCR)引物、2×HieffRRobust PCR Master Mix、Hieff NGSTMDNA Selection Beads:上海翌圣生物科技股份有限公司。
1.1.3 培养基
孟加拉红培养基、营养琼脂培养基:北京奥博星生物技术有限责任公司;WL培养基:上海博微生物科技有限公司。
1.2 仪器与设备
SW-CJ-2F无菌操作台:苏州净化设备有限公司;ZQPW-70全温振荡培养箱:天津市莱玻特瑞仪器设备有限公司;KG-AP32L自动蒸汽灭菌器:日本ALP公司;Pico-21台式离心机:美国Thermo Fisher公司;GL-88B漩涡混合器:海门市其林贝尔仪器制造有限公司;TND03-H-H混匀型干式恒温器:深圳托能达科技有限公司;L300T3实时温度监测杆:四川科学仪器有限责任公司。
1.3 方法
1.3.1 样品采集
酒醅经出甑、摊晾、拌曲、完全收堆后开始采集,完全收堆时记为发酵0 h,每24 h采集样品一次至入窖,如图1所示。A、B、C、D、E、F分别为糖化堆上层中心、表面;中层中心、表面;下层中心、表面,不同位置采集样品时绕堆子1周随机取3个酒醅样品混合进行检测分析。

图1 堆积发酵过程中取样示意图Fig. 1 Sampling diagram during heap fermentation process
1.3.2 发酵温度及菌落总数检测
将3支实时温度检测杆插入糖化对上、中、下不同位置,从完堆开始(0 h)至堆积发酵结束(116 h),每4 h采集一次糖化堆各取样点温度。分别使用WL培养基、孟加拉红培养基和营养琼脂分离筛选酒醅中的酵母菌、霉菌和细菌,并采用稀释平板涂布法,记录菌落总数[13]。
1.3.3 MiSeq高通量测序
采用E.Z.N.ATMMag-Bind Soil DNA试剂盒提取样本总DNA,具体操作流程见试剂盒说明书。分别选取不同堆积发酵时间和不同位置的酒醅样品,进行高通量测序检测分析,扩增区域为ITS3~ITS4区,扩增引物为ITS3(3'-GCATCGATGAAGAACGCAGC-5')和引物ITS4(3'-TCCTCCGCTTATTGATATGC-5')。PCR扩增条件为:95 ℃预变性3 min;94 ℃变性20 s;55 ℃退火20 s;72 ℃延伸30 s;25次循环;72℃终延伸5 min降至4 ℃。PCR扩增体系为:2×HieffRRobust PCR Master Mix15 μL,正向及反向引物各1 μL,DNA模板20~30 ng,使用双蒸水(ddH2O)补齐体系至30 μL。
1.3.4 数据分析
高通量测序下机序列经cutadapt去除引物接头序列后,根据PE reads间的overlap关系使用PEAR将成对的reads拼接成一条序列,再按照barcode对其进行识别和过滤等处理后得到有效序列数据。将相似度为97%下的有效系列进行可操作分类单元(operational taxonomic units,OTU)划分,采用UNITE数据库进行比对。数据的分析及计算使用Microsoft Office Excel 2016软件;微生物相对丰度热图采用TBtools软件绘制;选取相对丰度排名前10的真菌属和酒醅温度,采用SPSS 24.0软件计算Spearman相关性系数。
2 结果与分析
2.1 酒醅温度和菌落总数变化
一轮次酒醅堆积发酵过程中酒醅温度变化情况,结果见图2。由图2可知,完堆时,不同位点酒醅中心温度均高于表面,上、中、下层中心温度(18.8 ℃,24.4 ℃,25 ℃)>上、中、下层表面温度(16 ℃,15.8 ℃,15.7 ℃),而中层和下层温差较大,中心温度分别高于表面温度8.6 ℃和9.3 ℃。在堆积发酵0~64 h阶段,堆子上层中心和表面酒醅温度升高较快,温度分别由18.8 ℃和16 ℃上升至32.7 ℃和29 ℃;中层和下层中心酒醅温度变化不大,中层中心温度维持在24.4~26.6 ℃,下层中心温度维持在25 ℃左右;而中、下层表面酒醅温度呈现缓慢上升趋势,温度分别由15.8 ℃和15.7 ℃上升至27.1 ℃和19.0 ℃。当堆积发酵至67 h时进行翻堆操作,堆子上、中、下层温度均降至22.4 ℃左右,然后随着堆积发酵至96 h,上层中心和表面酒醅温度迅速上升,堆积发酵至116 h时顶温达到最高48.7 ℃;而中层表面和下层表面酒醅温度则升高缓慢,分别由23.6 ℃和24.2 ℃(67 h)上升至36.9 ℃和31 ℃(116 h),中心酒醅温度基本维持恒定,分别在24 ℃和28 ℃左右。
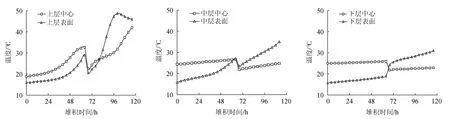
图2 堆积发酵过程中不同位置温度变化Fig. 2 Changes of temperature at different positions during heap fermentation process
一轮次酒醅堆积发酵过程中酒醅不同位置微生物菌落总数平均值的变化情况,结果见表1。由表1可知,酵母菌菌落总数在堆积过程中大幅增长,从完堆时的103数量级,到最高时(96 h)达到106数量级;细菌菌落总数在堆积过程中变化不大,从完堆到下窖,细菌数量在106~107数量级之间波动,这与张健等[14]的报道一致;霉菌菌落总数稳定在102~103数量级之间,发酵96 h后,霉菌菌落总数未检出。需要特别注意的是,在堆积发酵48~72 h阶段进行了翻堆操作,堆子上层表面酒醅的酵母菌数量急剧上升(数量级从102增加至104),翻堆操作增加了酒醅中酵母菌数量,有利于解决糖化堆升温较慢的问题。研究表明,酱香型白酒第二轮次堆积发酵过程经“FD工艺”处理后酒醅真菌群落多样性和丰富度均有明显增加,且有利于大部分真菌群落的生长,有效提高了出酒量和基酒的品质[15]。由此可见,酱香型白酒一轮次酒醅堆积发酵过程中心位置酒醅率先启动发酵,温度缓慢上升并扩散至表层;表层酒醅达到一定温度后,在较充足的溶氧条件下酵母菌快速生长,温度迅速上升,且翻堆操作可以显著增加上层表面酒醅中酵母菌数量,有利于提升糖化堆快速达到顶温。
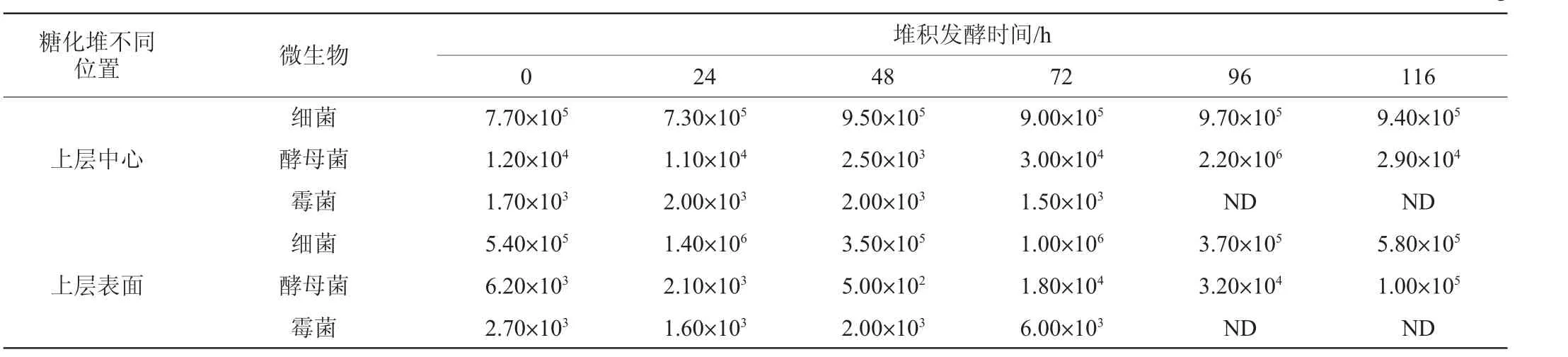
表1 堆积发酵过程中不同位置微生物菌落总数变化Table 1 Changes of number of total microbial colonies at different positions during heap fermentation process CFU/g
2.2 微生物菌落总数与酒醅温度相关性分析
温度是评价堆积发酵状态最直观的指标[15-17]。为了探究堆积发酵过程可培养微生物数量与温度之间的相互作用关系,采用SPSS 24.0软件对酒醅温度和微生物数量进行了Spearman相关性分析,结果见表2。
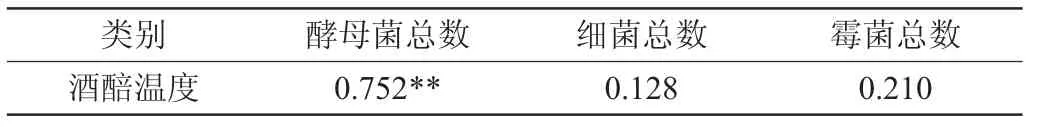
表2 酒醅温度与微生物菌落总数的相关性Table 2 Correlation between temperature of fermented grains and total number of microbial colonies
由表2可知,酒醅温度与酵母菌总数呈极显著正相关(P<0.01),这表明堆积发酵过程酒醅热量可能主要来源于酵母菌生长代谢产热。而酒醅温度与细菌总数、霉菌总数无显著相关(P>0.05),相关研究表明,温度和乙酸对酵母菌群的协同抑制可以导致酿造菌群失稳,且粟酒裂殖酵母(Schizosaccharomyces pombe)能够通过提高丙酸和丁酸代谢关键酶的表达水平从而提高相关醇酸的含量,促进群落中其他挥发性风味代谢产物的生成,进而影响酱香型白酒发酵进程[1,18]。
2.3 一轮次堆积发酵酒醅真菌群落结构组成及演替规律
基于菌落总数与温度相关性分析结果,进一步对一轮次堆积发酵酒醅真菌群落结构进行高通量测序分析,结果见图3。
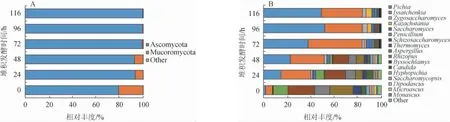
图3 基于门水平(A)和属水平(B)堆积发酵过程中酒醅样品真菌群落相对丰度变化Fig. 3 Changes of relative abundance of fungal communities of fermented grains samples during heap fermentation process at phylum level (A) and genus level (B)
由图3可知,一轮次堆积发酵过程共检测到真核微生物2个门、5个纲、5个目、13个科、17个属和19个种。门水平上,全发酵过程以子囊菌门(Ascomycota)为主导;属水平上,优势真菌属主要有毕赤酵母属(Pichia)、伊萨酵母属(Issatchenkia)、嗜热真菌属(Thermomyces)、根霉属(Rhizopus)、曲霉属(Aspergillus)、青霉属(Penicillium)等,这与GUAN T W等[19-20]的研究报道一致。堆积发酵过程中Pichia相对丰度由初期的1.82%上升至结束时的49.14%,Issatchenkia相对丰度由6.03%上升至34.67%;Rhizopus相对丰度由19.67%下降至0.24%;Penicillium相对丰度由12.45下降至1.44%;Thermomyces相对丰度由22.63%下降至0.73%。发酵中后期Pichia和Issatchenkia成为绝对优势菌属,这与吕锡斌等[21]研究报道一致。
选择相对丰度排名前10的优势真菌属(包括Pichia、Issatchenkia、接合酵母属(Zygosaccharomyces)、哈萨克斯坦酵母属(Kazachstania)、酿酒酵母属(Saccharomyces)、Penicillium、裂殖酵母属(Schizosaccharomyces)、Thermomyces、Aspergillus和Rhizopus),对堆积发酵过程中优势真菌属进行聚类分析,结果见图4。
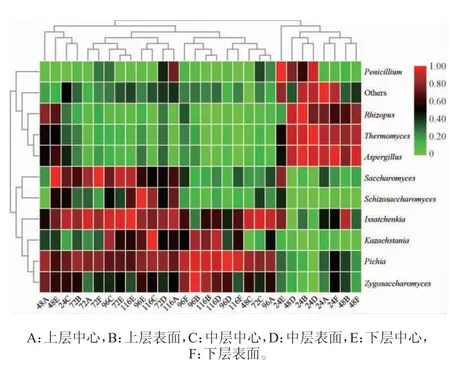
图4 堆积发酵过程中酒醅优势真菌属聚类分析Fig. 4 Cluster analysis of dominant fungi genus in fermented grains during heap fermentation process
由图4可知,在堆积发酵24~48 h阶段,以Thermomyces、Aspergillus、Rhizopus、Penicillium,以及其他小类真菌属为主。从完堆(0 h)至堆积发酵结束(116 h),由于Pichia、Issatchenkia、Zygosaccharomyces和Saccharomyces相 对 丰度发生变化,从而造成酒醅中心位置真菌群落结构组成与表面、下层存在较大差异,被聚类在两边。堆积发酵至72 h时,酒醅不同位置真菌群落结构差异较大,72A和72F、72B、72E、72D、72C样品分别被单独聚成一类,表明翻堆操作将重塑酒醅真菌微生物群落结构组成。王贵军等[22]研究表明,酱香型酒醅在堆积发酵过程,不同部位升温不同而使各层酒醅具有不同风格。此外,采用破堆移位技术,可使堆积发酵酒醅再次网罗空气中的微生物,提高酱香型白酒出酒率的同时,优质品率也得到了提升[23]。当堆积发酵96~116 h阶段时,堆子表面位置酒醅Pichia相对丰度显著高于Issatchenkia,中心位置酒醅Pichia相对丰度则略低于Issatchenkia。由于Issatchenkia具有更强的厌氧耐受能力,本阶段好氧条件下Pichia在与Issatchenkia的竞争中占据优势,而厌氧条件下Pichia在与Issatchenkia的竞争中则处于劣势。研究表明,Saccharomyces、Issatchenkia、Zygosaccharomyces、Schizosaccharomyce、Kazachstania等酵母菌对高级醇、酸、酯、醛等风味成分的贡献很大[24]。
2.4 真菌群落组成与温度相关性分析
选取温度变化较为剧烈的堆积发酵48 h和96 h的酒醅,结合酒醅温度与相对丰度排名前10的优势真菌属进行Spearman相关性分析,结果见表3。
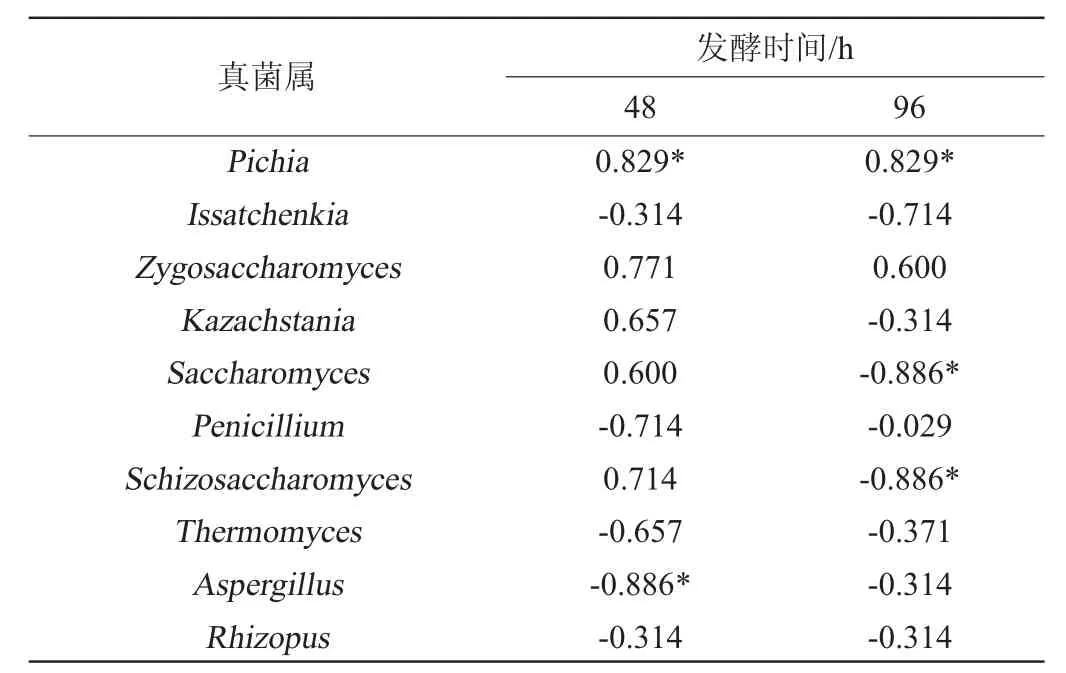
表3 酒醅温度与优势真菌属相对丰度的相关性Table 3 Correlation between the temperature and the dominant fungi genus of fermented grains
由表3可知,Pichia与酒醅温度呈显著正相关(P<0.05),说明Pichia在糖化堆升温过程中扮演了重要的角色。ZHANG H X等[25]研究发现,酿造环境是酱香型白酒堆积发酵过程中重要微生物Pichiasp.的主要来源,其具有较好的热耐受性以及较强的竞争效应,对维持酱香型白酒固态发酵稳态具有重要意义。林良才等[26]在高温、高酸双胁迫条件下从酱香型白酒酒醅中筛选获得11株具有高耐性的库德里阿兹威氏毕赤酵母(Pichia kudriavzevii),利用玉米浓醪进行模拟白酒发酵,发现菌株XDNZ_PK05除可耐受45 ℃高温、5 g/L乙酸、70 g/L乳酸和体积分数14%乙醇之外,还具有高产酯低产高级醇的代谢特性。将该株菌应用于酱香型白酒的生物强化实际生产中,可提高原料利用率20%,提升乙醇产量13%,同时降低正丙醇含量53%,同时其他风味物质无显著差异。堆积发酵48 h时,Aspergillus与酒醅温度呈显著负相关(P<0.05);堆积发酵96 h时,Saccharomyces、Schizosaccharomyces与酒醅温度呈显著负相关(P<0.05)。酱香型白酒堆积发酵过程中霉菌和酵母是最重要的微生物,霉菌可以分泌水解酶类降解大分子物质为酵母菌的生长和发酵提供底物,而酵母菌将底物转化为乙醇和风味物质。陈笔[27]研究表明,米曲霉(A.oryzae)与酿酒酵母(S.cerevisiae)混合发酵,能够提高酯类、酸类、醇类、醛酮类等风味物质的浓度,表明Aspergillus与Saccharomyces在酱香型白酒一轮次堆积发酵可能存在协同作用。袁再顺[28]对“破堆移位”影响酱香型白酒冬季堆积发酵因素进行了探究,结果表明发酵酒醅曲霉与温度呈显著负相关,与本研究结果一致,课题组拟在后续研究中进一步探究温度对Aspergillus、Saccharomyces和Schizosaccharomyces的作用机理。
3 结论
本研究以酱香型白酒一轮次堆积发酵为研究对象,采用实时温度监测仪、传统可培养方法和高通量测序技术,并结合多元统计学方法,初步探究了酱香型白酒冬季堆积发酵酒醅升温机制。结果表明,堆积发酵不同部位温度变化存在差异,中心位置酒醅率先启动发酵,温度缓慢上升并扩散至表层,且温度与酵母菌菌落总数呈极显著正相关关系(P<0.01)。进一步结合高通量测序和相关性分析结果表明,温度是酱香型白酒冬季堆积发酵菌群演替的重要驱动因素,酒醅中心位置真菌群落结构组成与表面、下层存在较大差异,Pichia与酒醅温度呈显著正相关(P<0.05),表明酵母菌以Pichia为主的生长代谢产热为糖化堆升温提供了主要动力,本研究为进一步解析酱香型白酒冬季堆积发酵升温机制提供了理论参考。
