中药调控氧化应激防治急性肺损伤的研究进展
2024-05-14张茂福张志明宋忠阳张昺磊沈雁云刘叶元李欣钰
张茂福,张志明,宋忠阳,张昺磊,沈雁云,刘叶元,李欣钰
中药调控氧化应激防治急性肺损伤的研究进展
张茂福1,张志明2*,宋忠阳3,张昺磊2,沈雁云1,刘叶元1,李欣钰1
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃省中医院,甘肃 兰州 730050 3. 甘肃中医药大学附属医院,甘肃 兰州 730020
急性肺损伤(acute lung injury,ALI)是临床常见的极危重症之一,其死亡率与发病率居高不下,早期以低氧血症、肺间质水肿及肺部炎症为主,后进一步发展成为急性呼吸窘迫综合症,表现为严重的缺氧性呼吸衰竭。氧化应激作为诱发ALI的作用机制之一,在其发生发展中扮演重要作用。中药可通过抑制炎症及氧化应激反应,减轻肺间质水肿,改善肺通气,恢复肺组织损伤等起到治疗ALI的作用。基于此,从氧化应激作用功能、调控ALI机制及中药干预机制等方面进行归纳总结,为ALI的临床研究及新药创新探索提供理论指导。
氧化应激;急性肺损伤;黄芩苷;表儿茶素;罗汉果皂苷V
急性肺损伤(acute lung injury,ALI)是各种体内外损伤因素引起的急性缺氧性呼吸功能不全,导致毛细血管内皮细胞和肺泡上皮细胞屏障破坏,病理学特征为肺泡水肿、炎性细胞过度浸润及肺泡通透性增加[1-3]。近年来,随着新型冠状病毒肺炎疫情的爆发,全球已有5亿多例临床确诊病例,其中600多万例死亡,其导致的ALI患者人数显著增加,给人类健康带来严重危害[4-6]。目前,ALI的治疗以机械通气和氧气治疗为主,尽管呼吸支持和危重症患者诊疗技术的发展取得了进步,但ALI的死亡率仍然很高,且缺乏有效的治疗手段[7]。因此,迫切需要寻求有效的疗法和安全的药物,而中医药作为祖国传统医学,具有“整体观念”与“辨证论治”的独特优势,在ALI的治疗中发挥重要作用,能够抑制氧化应激反应,减轻炎症反应,改善肺组织损伤,从而起到治疗ALI的作用[8-9]。研究表明,中药单体及中药复方可以通过调控氧化应激信号通路及相关蛋白、基因的表达而阻止氧化应激进程,恢复机体内源性氧化与抗氧化的平衡[10-11]。因此,本文总结梳理氧化应激与急性肺损伤的内在调控机制,探讨中药单体及其活性成分、中药提取物、中药复方干预氧化应激的作用机制,以期为中医药防治ALI提供新方法、新理论。
1 氧化应激概述
氧化应激是机体内氧化与抗氧化防御失衡的结果,与生理衰老以及多种疾病的发病机制密切相关[12-13],该过程中产生了大量的活性氧(reactive oxygen species,ROS),造成气道和血管的重塑,侵袭肺间质造成肺水肿,并且ROS还能对肺实质细胞直接造成氧化损伤[14]。在生理条件下,适量的ROS参与细胞的信号传导、免疫反应、宿主防御及蛋白质翻译后处理等生物学过程,并在基因表达的调节和细胞分化等生理功能中起着重要作用。在病理条件下,大量ROS的产生会导致机体抗氧化系统谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(recombinant glutathione peroxidase,GPX)、过氧化氢酶(catalase,CAT)及核因子红系衍生2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf-2)、血红素加氧酶-1(heme oxygenase-1,HO-1)等的表达异常,引起氧化还原反应平衡的失调,最终导致脂质、蛋白质和DNA的损伤,并进一步促进炎症反应,对机体细胞造成持续性的伤害[15-16],机制图见图1。
2 氧化应激调控ALI的机制
氧化应激作为引发ALI的重要机制之一,在诱发脂质过氧化(lipid hydroperoxide,LPO)、损伤DNA、诱发肺水肿等方面发挥关键作用[17-18]。研究表明,氧化应激诱导巨噬细胞活化和LPO,引起促炎细胞因子表达,进而导致ALI的发生[19]。ROS的释放以及随后的氧化应激诱导在ALI的病程中起着重要作用,LPO作为肺损伤后氧化应激的可靠指标,可以反映ROS代谢产物对组织损伤的程度[4],丙二醛(malonaldehyde,MDA)是细胞膜中多不饱和脂肪酸过氧化的主要终产物,其水平高低反映了细胞是否受到氧自由基的攻击[21]。髓过氧化物酶(myeloperoxidase,MPO)属于血红素过氧化物酶家族,是一种具有强效氧化还原酶活性的酶,同样可以作为LPO的生物学标志物[22]。研究显示,在发生LPO过程中,II型肺泡上皮细胞及血管内皮细胞易受到攻击,进一步加重肺部的损伤。此外,LPO代谢产物可以与蛋白质、核酸等生物大分子相结合而导致其活性的丧失,进而引起细胞死亡。氧化应激产生的ROS刺激肺组织,血液中诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的活性显著升高,产生过量的一氧化氮(nitric oxide,NO)。当肺部组织产生大量NO时,引起肺部血管舒张,血供增加,支气管动脉扩张,血液直接经支气管-肺血管吻合支流入肺,最终形成肺水肿[23]。另外,NO与过氧化物相结合生成氧化性极强的过氧亚硝基阴离子(peroxynitrite,ONOO−),损伤肺血管内皮细胞膜,增加通透性,进一步加重肺水肿[24]。在氧化应激反应中,Nrf-2/HO-1信号途径及SOD、CAT、GPX等抗氧化酶的活性也被激活,以对抗ROS诱导的氧化损伤[25-27]。Nrf2是一种重要的转录因子,也是抗氧化防御系统的主要调节因子,具有细胞保护和维持内氧化-抗氧化平衡的作用,当细胞中存在氧化失衡时,游离Nrf2与细胞核中的抗氧化反应元件结合,从而激活下游靶基因的表达,发挥抗氧化作用[28]。HO-1作为一种细胞保护蛋白,在抗氧化系统中扮演关键角色,活化的Nrf2诱导HO-1蛋白的表达,从而减轻活性氧诱导的氧化损伤[29]。SOD是生物体内存在的一种抗氧化金属酶,能加速清除超氧阴离子自由基转化生成的细胞毒性物质H2O2,并且H2O2可以通过CAT分解成H2O和O2,以保护肺细胞免受其的损害[30]。GSH是细胞内的重要还原剂,在过氧化诱导的ALI中发挥重要防御作用,可使得过氧化物快速从体内清除,以达到氧化与抗氧化新平衡状态[31]。SOD和GSH可提供细胞保护作用,以防止来自氧的自由基的破坏。GPX是一个需要还原GSH作为底物的酶家族,在氧化还原反应中,GPX可以将有毒的过氧化物还原成无毒的羟基化合物,同时使过氧化氢快速分解,以便保护细胞黏膜组织免受过氧化物的破坏[32]。另外,核因子κB(nuclear factor kappa-B,NF-κB)作为转录调节因子,参与调节机体炎症反应、细胞凋亡、氧化应激等过程,在ROS和促炎因子等的刺激下可以被激活[33]。
综上所述,氧化应激在ALI的进程中发挥重要作用,通过调控相关蛋白与基因的表达而诱导LPO与肺水肿的发生,损伤DNA、肺部组织与细胞。中医药通过干预氧化应激途径及调控相关蛋白与基因的表达而抑制氧化应激反应,减轻炎症反应,从而起到治疗ALI的作用。
3 中药调控氧化应激治疗ALI
ALI属于中医学“喘证”“暴喘”“喘脱”等范畴[34],其病因多为正气亏损,邪毒蕴肺,肺气宣降失司,产生痰、热、瘀、闭等病理变化,久之脏腑功能紊乱,气机升降失调,痰湿、瘀血等病理产物累积,出现阴阳两虚,内闭外脱之喘脱症状,而临床治疗以益气养阴、补益气血固其本,清热解毒、化痰祛瘀、通腑泄热治其标[35]。中医药在防治ALI中发挥巨大潜力,可以有效的减轻肺组织损伤,改善生活质量,降低死亡率。
3.1 中药单体及活性成分
3.1.1 黄酮类化合物 黄芩苷镁盐是中药黄芩有效成分与镁盐相结合而制备的单体化合物,具有抗炎、抗氧化的作用[36]。研究表明,黄芩苷镁盐能减少炎性细胞激活与聚集,明显改善肺水肿,并能下调MDA、MPO的表达,上调SOD的活性,从而减轻肺部炎症反应,降低氧化应激程度[37]。魏莹莹等[38]研究显示,狼毒双高色原酮能降低MPO、MDA的表达,提高Nrf2、HO-1、SOD等的表达,改善肺水肿与肺通透性,抑制LPS诱导的ALI炎症与氧化应激反应。张钦钦等[39]研究发现,猫眼草酚D能下调MDA、ROS的表达,上调SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等的含量,并且通过减轻炎症反应,提高机体抗氧化能力而发挥抗ALI作用。崔卫正等[40]研究显示,芹菜素能抑制炎症及氧化应激反应,抑制NF-κB信号通路活化,并通过下调MDA的含量,上调SOD、CAT等的表达而保护肺功能,抑制ALI进程。于婧等[41]实验研究表明,桑黄素通过激活Nrf2/HO-1信号通路,下调NADPH氧化酶1(reduced nicotinamide adenine dinucleotide phosphate oxidase 1,NOX1)、NOX4的表达,上调Nrf2、HO-1的表达,从而抑制氧化应激,减轻LPS引起的肺损伤。另外,杨莉等[42]研究显示,桑黄素能抑制磷脂酰肌醇3-激酶/蛋白激酶B/NF-κB(phosphatidylinositol 3 kinase/protein kinases/ nuclear factor kappa-B,PI3K/Akt/NF-κB)信号通路,降低MDA的表达,升高SOD的含量,从而发挥ALI的保护作用。任辉邦等[43]研究表明,山姜素通过激活PI3K/Nrf2/HO-1信号通路,下调MPO、MDA的表达,上调Nrf2、HO-1、SOD、GSH的表达,减少炎症和氧化应激反应,改善盲肠结扎和穿刺(cecal ligation and puncture,CLP)诱导的ALI。王贵佐等[44]实验表明,异甘草素通过激活Nrf2信号通路,降低MPO、MDA的含量,提高Nrf2、SOD的表达,从而对LPS诱导的ALI发挥保护作用。蔡雨春等[45]研究显示,淫羊藿苷通过激活Nrf2通路、抑制NF-κB信号通路,下调MPO、MDA的表达,进而抑制炎症和氧化应激反应,发挥对LPS诱导的ALI保护作用。徐玲文等[46]研究表明,黄芩苷能下调MDA的含量,上调SOD的表达,抑制TLR4/NF-κB信号通路激活,阻止炎症与氧化应激反应,进而减轻脓毒症诱导的肺组织急性损伤。刘晟文等[47]研究显示,槲皮素通过调控Nrf2/ARE信号通路相关蛋白的表达水平,降低MPO、MDA、NF-κB的含量,升高SOD的水平,减少促炎性因子的释放,保护LPS诱导的ALI。阮丹等[48]实验研究显示,柚皮素可以下调MDA的表达,上调GSH-Px、SOD的表达,并激活Nrf2/HO-1信号通路,改善百草枯中毒大鼠引起的ALI。钟海等[49]研究显示,三叶苷通过激活AMPK/GSK-3β/Nrf2通路,抑制NF-κB通路,降低MDA、NF-κB的表达,上调GSH、CAT、SOD的含量,有效预防ALI的炎症及氧化应激反应。唐敏强等[50]研究表明,鹰嘴豆芽素A能下调MDA、ROS的表达,上调Nrf2、HO-1、SOD的表达,并激活Nrf2 /HO-1信号通路,抑制LPS诱导的肺泡上皮细胞氧化应激损伤。
3.1.2 多酚类化合物 表儿茶素具有抗氧化、抗炎以及免疫调节等作用,李泽林等[51]研究显示,表儿茶素能抑制MAPK信号通路,并降低MDA、NO的水平,升高GSH-Px、SOD、CAT的含量,进而调节氧化应激和炎症反应来改善ALI。范风颖等[52]研究表明,龙眼核多酚通过下调MDA、NF-κB的表达,激活TLR4/NLRP3信号通路,减轻LPS诱导ALI的炎症及氧化应激反应,并缓解肺组织损伤。樊黎丽实验研究显示[53],姜黄素可以通过抑制HMGB1/NF-κB信号通路活化,并下调MDA、MPO的水平,上调GSH、SOD的含量来减轻LPS诱导的ALI损伤。黄晓军等[54]通过研究发现,白藜芦醇能下调MPO的水平,上调SOD的表达,并激活Nrf2信号通路来减轻ALI的严重程度。何诗灵等[55]研究表明,丹酚酸A通过激活SIRT3/FOXO3信号通路,下调MDA、ROS的含量,上调SOD的水平,抑制炎症及氧化应激反应,减轻LPS诱导的肺组织病理损伤。李玉婷等[56]通过实验发现,丹酚酸B通过抑制NF-κB的表达与磷酸化,降低MDA、MPO的水平,上调SOD、HO-1、Nrf2等的含量来减轻LPS诱导的小鼠ALI。金焕治等[57]发现,芍药醇能下调MDA的水平,上调SOD、CAT、Nrf2的表达,并激活Nrf2信号通路来抑制脓毒症大鼠的炎症及氧化应激,对ALI具有保护作用。Liu等[58]研究显示,厚朴酚可以激活Nrf2信号通路,下调MDA、MPO的表达,上调SOD、HO-1、Nrf2的表达,减少氧化应激反应,并抑制NLRP3炎症小体来减轻LPS诱导的ALI损伤。
3.1.3 萜类化合物 曹银利等[59]研究显示,罗汉果皂苷V通过下调MDA、MPO、磷酸化c-Jun氨基末端激酶(phosphorylated c-Jun-terminal kinase,p-JNK)的水平,上调SOD的表达,并抑制JNK磷酸化激活来减轻胎粪吸入综合征病程中炎性和氧化应激损伤而发挥ALI的保护作用。黄小强等[60]通过实验研究发现,泽泻三萜通过激活Nrf2/HO-1信号通路,降低MDA、MPO的水平,上调SOD、HO-1、Nrf2、GSH等的表达减轻肺组织氧化损伤,并调控炎症因子的产生而抑制炎症反应,进而发挥保护ALI的作用。裴彩霞等[61]研究表明,桔梗皂苷D可显著减轻脂多糖诱导的ALI大鼠肺组织的病理损害,其作用机制可能是通过调控NF-κB信号通路,抑制细胞因子IL-1β、TNF-α、IL-6的分泌,并下调MDA、MPO、NF-κB的表达,上调SOD、CAT、GSH等的表达抑制氧化应激反应,保护肺组织,减轻肺水肿。柯维强等[62]研究显示,积雪草酸可通过调控TLR4 /MyD88/NF-κB信号通路,下调MDA的表达,上调SOD、GSH-Px等的表达来抑制氧化应激,并抑制NLRP3炎症小体激活,减轻LPS诱导的ALI。凌林等[63]研究发现,芍药苷可以通过降低Kelch样环氧氯丙烷相关蛋白-1(kelch-like ECH-associated protein 1,Keap1)的水平,升高SOD、HO-1、Nrf2等的表达,并激活Nrf2/Keap1信号通路来降低肺组织氧化应激与炎症水平,进而改善脓毒症诱导的ALI。Yang等[64]研究表明,冬凌草甲素通过Nrf2非依赖性炎症和Nrf2依赖性抗氧化活性对LPS诱导的ALI发挥保护作用。任丽等[65]研究显示,虾青素通过下调MDA的含量,上调SOD、HO-1、Nrf2等的水平,进而减轻X射线全身照射小鼠肺部的氧化应激水平,发挥急性放射性肺损伤的保护作用。
3.1.4 其他化合物 刘锐等[66]研究发现,牛磺酸能保护脓毒症大鼠诱导的肺损伤,其作用机制可能与抑制NF-κB信号通路的激活,下调MDA、MPO的水平,上调SOD的表达来发挥抗氧化、抗炎作用有关。杨敏华等[67]研究显示,姜油酮能促进Nrf2通路的激活,抑制肺组织炎症反应及氧化应激,从而减轻ALI模型小鼠肺损伤。钟春蕾等[68]研究发现,五味子乙素通过抑制NF-κB信号通路,降低MDA、NF-κB的水平,升高SOD的含量来抑制炎症及氧化应激反应,减轻LPS诱导的脓毒症ALI大鼠肺组织的病理损伤。张强泽等[69]研究表明,水飞蓟素可能通过下调MPO的表达,上调SOD的表达,并调控TLR4/NF-κB通路来抑制炎症及氧化应激反应,保护ALI大鼠肺功能。王蓉等[70]研究表明,连翘酯苷A可通过激活Nrf2信号通路,提高MPO、SOD的水平激活抗氧化机制,进一步减轻脂多糖诱导的小鼠ALI。曹银利等[71]研究发现,重楼皂苷Ⅰ通过抑制p38-NLRP3/caspase-1信号通路,激活AMPK/ Nrf2/KEAP1信号途径,降低MDA、MPO的含量,升高SOD、Nrf2、NO的水平来减轻LPS诱导的小鼠ALI。姚培宇等[72]实验研究发现,异丹叶大黄素能抑制NF-κB信号通路,下调ROS的表达来激活巨噬细胞自噬,抑制炎症及氧化应激反应,进而对LPS诱导的ALI小鼠起保护作用。杨锴等[73]研究显示,鱼腥草素钠能下调MDA、MPO的含量,上调SOD的表达,并抑制NF-κB信号通路与MAPK信号通路来抑制肺部炎症反应、减少氧化应激,从而减轻肺部损伤。张海云等[74]研究显示,丹参酮ⅡA通过抑制NF-κB信号通路,调控氧化应激相关蛋白的表达,显著降低脂多糖诱导的ALI小鼠肺组织中的炎症及氧化应激反应水平。王慧等[75]研究表明,青藤碱可以调控 Nrf2/Keap1信号通路,降低MDA的含量,提高SOD、HO-1、Nrf2的表达缓解肺组织损伤程度,保护肺组织,改善脓毒症引起的ALI。李雯等[76]研究发现,枸杞多糖通过下调MDA的含量,上调SOD的表达,并激活Akt/ eNOS信号通路来抑制肺部炎症反应、减轻氧化应激及减少细胞凋亡,从而缓解ALI肺微血管内皮屏障损伤。刘振峰等[77]研究显示,萝卜硫素通过能激活Nrf2/ARE信号通路,降低MPO的水平,上调SOD、iNOS、Nrf2的表达来减轻LPS诱导的ALI。
3.2 中药提取物
研究表明,松科松属植物云南松的球果松塔乙醇提取物具有抗肿瘤、抗氧化等多种药理活性。邓多等[78]发现,云南松松塔提取物可以通过抑制TLR4/NF-κB信号通路,降低MDA、NO的含量,升高SOD的表达来减轻LPS诱导的大鼠ALI。宋肖等[79]研究表明,山麦冬水提物可能激活NF-κB信号通路,下调LDH、NO、MPO的水平来减轻炎症及氧化应激反应,进而发挥良好的防治ALI的作用。张钦钦等[80]研究显示,月见草提取物通过下调MDA的表达,上调SOD、GSH-Px、Nrf2等的水平,并调控Nrf2/NLRP3信号通路来降低炎症、氧化应激与细胞凋亡水平,从而改善LPS诱导的ALI。陈宝磊等[81]研究发现,枇杷叶提取物通过激活PI3K/Akt信号通路抑制A549细胞增殖、凋亡和氧化应激反应,减轻脂多糖诱导的肺细胞损伤。陈永生等[82]研究表明,金荞麦提取物抑制AMPK/NF-κB信号通路的激活,降低MDA的表达,上调SOD的水平来减轻氧化应激及炎症反应,改善肺纤维化,保护百草枯肺损伤。具体中药及调控机制见表1。
3.3 中药复方
越来越多研究证实,中药复方可以通过干预氧化应激信号通路,调控相关蛋白与基因的表达,能有效改善氧化应激引发的ALI。大多数医家对其的辨证多从热毒、痰热、血瘀、正虚等角度出发,治疗以清热解毒、通腑泻热、化痰祛瘀为主。现将近年来关于该领域的研究成果进行总结分析,以期为临床实践提供理论依据。
尚罗锐等[83]研究发现,大承气汤(大黄、枳实、厚朴、芒硝)通过激活Nrf2/TGF-1/ERK信号通路,降低MDA、MPO的表达,提高Nrf2、HO-1、GSH-Px、SOD的含量来抑制炎症及氧化应激反应,并抑制上皮间质转化,减轻脂多糖引起的ALI。扶正解毒方是张忠德教授临床治疗COVID -19患者ALI的经验方,陈剑坤等[84]研究显示,扶正解毒方(熟附子、干姜、炙甘草、金银花、皂角刺、五爪龙、广藿香、陈皮)可通过抑制PI3K/Akt信号通路活化,下调氧化应激分子ROS、NO和炎症介质的表达,抑制M1型巨噬细胞增殖,改善II型肺泡上皮细胞屏障功能,发挥防治ALI的作用。刘淑玲等[85]研究表明,黄连解毒汤(黄连、黄芩、黄柏、栀子)通过下调MDA、NF-κB的水平,上调SOD、GSH-Px的表达来减轻肺水肿、改善肺通气、抑制炎症及氧化应激反应,从而保护肺组织。张敏等[86]研究发现,百合固金汤(熟地黄、生地黄、当归、白芍、生甘草、桔梗、玄参、浙贝母、麦冬、百合)通过调控Nrf2/Keap1/p62信号通路,下调MDA的表达,上调SOD、Nrf2、Keap1的表达抑制氧化应激反应,发挥对ALI的治疗作用。刘默等[87]通过实验研究证实,桑白皮汤(桑白皮、半夏、苏子、杏仁、贝母、山栀、黄芩、黄连)通过调控Keap1/Nrf2/HO-1信号通路,降低ROS、Keap1的含量,升高Nrf2、HO-1的水平来改善LPS诱导的ALI小鼠肺部炎症,并能减轻肺水肿程度,缓解肺组织病理损伤。杨丽梦等[88]研究显示,通腑平喘方(大黄、芒硝、桃仁、葶苈子、桑白皮等)可以通过调控Keap1/Nrf2/ARE信号通路,下调MDA的水平,上调SOD、Nrf2、GSH的表达,抑制氧化应激反应,减轻肺组织的损伤。杨荃怀等[89]研究证实,透邪解毒汤(槟榔、厚朴、草果仁、知母、芍药、黄芩等)能抑制炎症及氧化应激反应,并减轻LPS诱导的ALI,其作用机制可能与抑制JAK2/STAT3信号通路及上调Nrf2表达有关。石亚莉等[90]研究发现,宣肺活血汤(麻黄、桂枝、羌活、杏仁、蝉蜕、地龙、白茅根、益母草等)通过抑制AMPK/NF-κB信号通路,降低MDA、NF-κB的含量,提高SOD的水平来减轻炎症及氧化应激反应,抑制肺血管内皮CLIC1的表达,并减轻肺组织损伤。黄婷等[91]研究表明,平肺口服液(麦冬、瓜萎、五味子、百合、桑白皮、白花蛇舌草等)可以调控p38MAPK/Nrf2/HO-1信号途径,上调Nrf2、HO-1的表达来抑制氧化应激反应,改善ALI病程。

表1 中药单体及提取物干预氧化应激防治ALI作用机制

表1(续)
“↑”指促进,“↓”指抑制。
“↑”digital accelerator, “↓”digital inhibition.
通过以上研究发现,中药复方对于ALI的治疗以解毒、泄热、化痰、活血治其标,以益气、养阴、润肺、补肾治其本。中药复方通过调控氧化应激信号通路及相关蛋白,抑制炎症及氧化应激反应,改善肺组织损伤,从而防治ALI,具体中药复方及调控机制见表2。中医药调控氧化应激主要信号防治ALI的机制如图1所示。
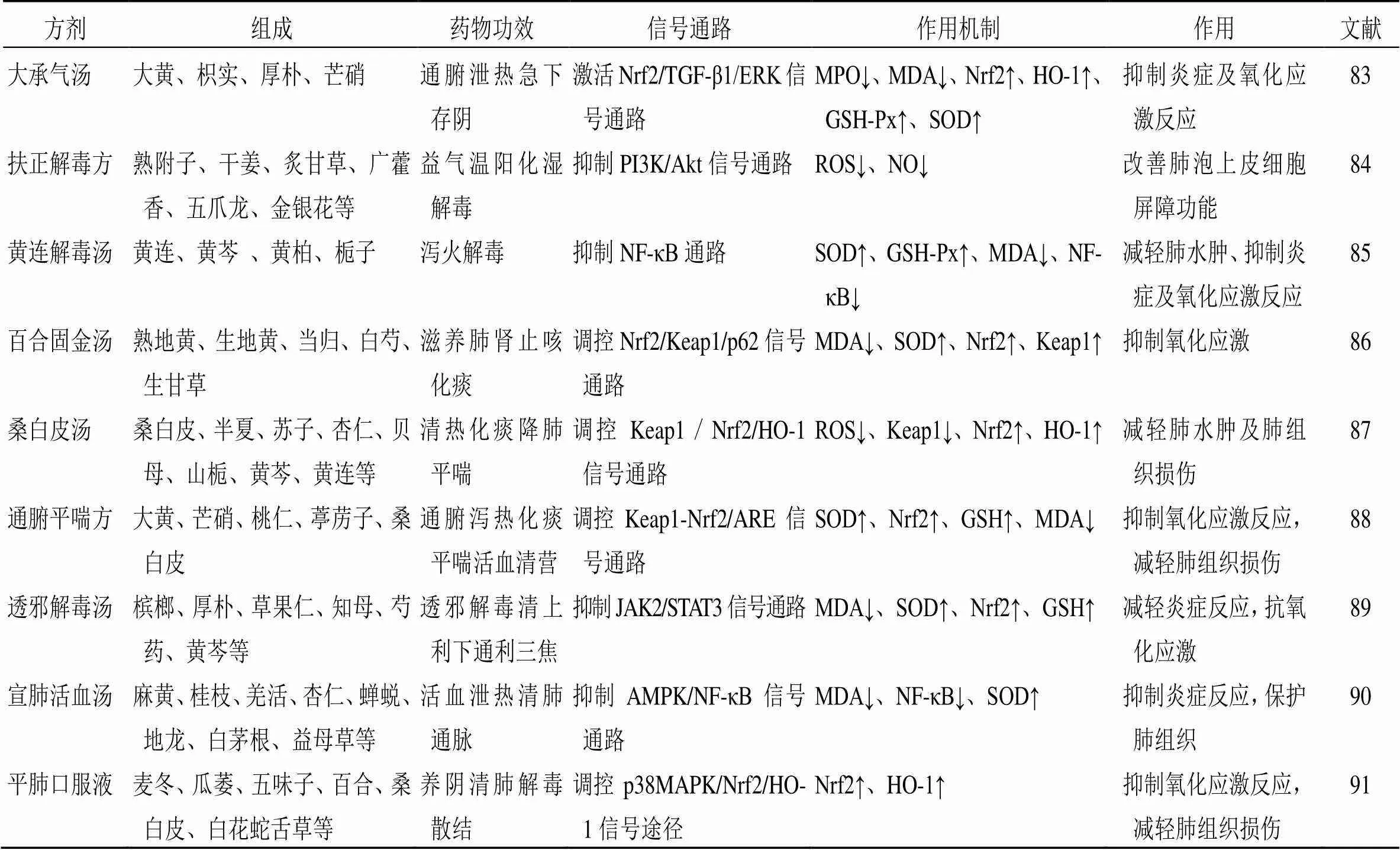
表2 中药复方干预氧化应激防治ALI作用机制
“↑”指促进,“↓”指抑制。
“↑”digital accelerator, “↓”digital inhibition.
4 结语与展望
氧化应激反应与多种肺部疾病的发病机制密切相关,近年来研究显示,氧化应激在ALI的病程中扮有重要作用,其作用机制与诱发LPO、损伤DNA、引发肺水肿等有关。氧化应激过程释放大量ROS的产生,致使体内氧化与抗氧化平衡失调,进而损伤肺血管内皮细胞及肺泡上皮细胞,最终导致ALI的发生。目前,ALI的治疗以肺保护性通气支持对症处理为主,缺乏特效的药物及治疗方法,而中医药具有多层次、多靶点、多途径的作用,在治疗ALI中具有独特优势。经归纳总结发现,中药单体及有效成分、中药提取物、中药复方可通过干预氧化应激信号通路及调控相关蛋白与基因的表达,减少氧化产物的量,增加抗氧化酶的活性来抑制炎症及氧化应激反应,促使机体氧化还原系统的平衡,减轻肺组织损伤,从而发挥治疗ALI的作用。其中中药单体及有效成分集中在黄酮类、多酚类、萜类等化合物,中药提取物有云南松松塔、山麦冬水等,中药复方以清热解毒、通腑泻热、化痰祛瘀、扶正补虚类为主。此外,ALI的发生机制还与IL-1β、TNF-α、IL-6等炎症因子相关,与Nrf2 /HO-1、NF-κB信号通路密切相关。
目前,中医药治疗ALI尽管取得巨大突破,但仍存在一定的局限性:中药单体及有效成分、中药提取物、中药复方干预氧化应激相关信号通路过于单一,主要集中在Nrf2 /HO-1、PI3K/Akt、MAPK及NF-κB等信号通路,缺乏多系统、多层面的交叉研究。中医药调控氧化应激防治ALI的研究以动物实验为主,尚未形成系统的临床数据研究,并且其在体内的确切疗效有待临床考证。缺乏高质量临床循证试验的证据支持,并且不同中药及有效成分调控氧化应激之间是否具有联系有待进一步研究。ALI发病机制复杂,与氧化应激、细胞焦亡、自噬、铁死亡等机制密切相关,缺乏多种机制之间的一体化研究。中药复方干预氧化应激途径治疗ALI的研究相对较少,未能充分体现中药配伍的重要性。
在目前研究基础上,未来须进一步开展基于多通路、多层面交叉串扰的中药及成分抗ALI机制研究,逐步进行体内安全、有效的临床研究,深入挖掘多药物、多组分之间复杂作用机制,为中医药防治ALI提供新理论、新方案、新进展。
利益冲突 所有作者均声明不存在利益冲突
[1] Li N, Zou S S, Wang B,. Targeting immunometabolism against acute lung injury [J]., 2023, 249: 109289.
[2] Zhu Y H, Han Q Q, Wang L,. Jinhua Qinggan Granules attenuates acute lung injury by promotion of neutrophil apoptosis and inhibition of TLR4/MyD88/NF-κB pathway [J]., 2023, 301: 115763.
[3] Dutta S, Zhu Y, Han Y,. Long noncoding RNA: A novel insight into the pathogenesis of acute lung injury [J]., 2023, 12(2): 604.
[4] Zhang Y W, Cui Y F, Feng Y B,.polysaccharides alleviate acute lung injury by inhibiting oxidative stress and inflammation [J]., 2022, 27(21): 7328.
[5] Li Z H, Pan H T, Yang J H,. Xuanfei Baidu formula alleviates impaired mitochondrial dynamics and activated NLRP3 inflammasome by repressing NF-κB and MAPK pathways in LPS-induced ALI and inflammation models [J]., 2023, 108: 154545.
[6] Xia J Y, Li J H, Deng M S,. Diosmetin alleviates acute lung injury caused by lipopolysaccharide by targeting barrier function [J]., 2023, 31(4): 2037-2047.
[7] Long M E, Mallampalli R K, Horowitz J C. Pathogenesis of pneumonia and acute lung injury [J]., 2022, 136(10): 747-769.
[8] Zhu W W, Luo W, Han J B,. Schisandrin B protects against LPS-induced inflammatory lung injury by targeting MyD88 [J]., 2023, 108: 154489.
[9] Zhang R, Zhao C R, Gong X W,. Ginkgolide C alleviates acute lung injury caused by paraquat poisoning via regulating the Nrf2 and NF-κB signaling pathways [J]., 2022, 2022: 7832983.
[10] Li B, Nasser MI, Masood M,. Efficiency of traditional Chinese medicine targeting the Nrf2/HO-1 signaling pathway [J]., 2020 , 126:110074.
[11] Shi K, Xiao Y X, Dong Y,. Protective effects ofrhizoma on lipopolysaccharide-induced acute lung injury via TLR4/NF-κB and Keap1/Nrf2 signaling pathwaysand[J]., 2022, 23(24): 16134.
[12] Trigo D, Nadais A, Carvalho A,. Mitochondria dysfunction and impaired response to oxidative stress promotes proteostasis disruption in aged human cells [J]., 2023, 69: 1-9.
[13] Zhang B Y, Pan C Y, Feng C,. Role of mitochondrial reactive oxygen species in homeostasis regulation [J]., 2022, 27(1): 45-52.
[14] Yuan R, Li Y Q, Han S,. Fe-curcumin nanozyme-mediated reactive oxygen species scavenging and anti-inflammation for acute lung injury [J]., 2022, 8(1): 10-21.
[15] Ali S S, Ahsan H, Zia M K,. Understanding oxidants and antioxidants: Classical team with new players [J]., 2020, 44(3): e13145.
[16] Sharifi-Rad M, Anil Kumar N V, Zucca P,. Lifestyle, oxidative stress, and antioxidants: Back and forth in the pathophysiology of chronic diseases [J]., 2020, 11: 694.
[17] Ni Y L, Shen H T, Su C H,. Nerolidol suppresses the inflammatory response during lipopolysaccharide-induced acute lung injury via the modulation of antioxidant enzymes and the AMPK/nrf-2/HO-1 pathway [J]., 2019, 2019: 9605980.
[18] Zhang Y, Yu W, Han D,.-lysine ameliorates sepsis-induced acute lung injury in a lipopolysaccharide-induced mouse model [J]., 2019, 118: 109307.
[19] Li W W, Wang T Y, Cao B,. Synergistic protection of matrine and lycopene against lipopolysaccharide‑induced acute lung injury in mice [J]., 2019, 20(1): 455-462.
[20] Bezerra FS, Lanzetti M, Nesi RT,. Oxidative stress and inflammation in acute and chronic lung injuries [J].(), 2023, 12(3):548.
[21] Zhang J, Zhang M, Zhang W H,. Total flavonoids ofalleviated the inflammatory response and oxidative stress in LPS-induced acute lung injury via inhibiting the sEH activity: Insights from lipid metabolomics [J]., 2022, 107: 154380.
[22] Shen B Y, Zhang H Q, Zhu Z J,. Baicalin relieves LPS-induced lung inflammation via the NF-κB and MAPK pathways [J]., 2023, 28(4): 1873.
[23] Golden T N, Venosa A, Gow A J. Cell origin and iNOS function are critical to macrophage activation following acute lung injury [J]., 2022, 12: 761496.
[24] Zhang H X, Liu S J, Tang X L,. H2S attenuates LPS-induced acute lung injury by reducing oxidative/nitrative stress and inflammation [J]., 2016, 40(6): 1603-1612.
[25] Liu H Y, Hao J D, Wu C Y,. Eupatilin alleviates lipopolysaccharide-induced acute lung injury by inhibiting inflammation and oxidative stress [J]., 2019, 25: 8289-8296.
[26] Dhlamini Q, Wang W, Feng G F,. FGF1alleviates LPS-induced acute lung injury via suppression of inflammation and oxidative stress [J]., 2022, 28(1): 73.
[27] Jomova K, Raptova R, Alomar S Y,. Reactive oxygen species, toxicity, oxidative stress, and antioxidants: Chronic diseases and aging [J]., 2023, 97(10):2499-2574.
[28] Luan R M, Ding D Y, Yang J L. The protective effect of natural medicines against excessive inflammation and oxidative stress in acute lung injury by regulating the Nrf2 signaling pathway [J]., 2022, 13: 1039022.
[29] Huang C Y, Deng J S, Huang W C,. Attenuation of lipopolysaccharide-induced acute lung injury by hispolon in mice, through regulating the TLR4/PI3K/akt/mTOR and Keap1/Nrf2/HO-1 pathways, and suppressing oxidative stress-mediated ER stress-induced apoptosis and autophagy [J]., 2020, 12(6): 1742.
[30] Borgstahl G E O, Oberley-Deegan R E. Superoxide dismutases (SODs) and SOD mimetics [J]., 2018, 7(11): 156.
[31] Abdallah H M, El-Agamy D S, Ibrahim S R M,.represses LPS-induced acute lung injury in mice via its antioxidative and anti-inflammatory activities [J]., 2020, 9(11): 1620.
[32] Tang X H, Tang H M.iridoid glycoside alleviates sepsis-induced acute lung injury by regulating NF-κB and Nrf2/HO-1 pathways [J]., 2022, 50(5): 121-128.
[33] Millar M W, Fazal F, Rahman A. Therapeutic targeting of NF-κB in acute lung injury: A double-edged sword [J]., 2022, 11(20): 3317.
[34] 李赋, 张志明, 宋忠阳, 等. 中医药防治急性肺损伤作用机制研究进展 [J]. 中医药信息, 2022, 39(10): 80-84.
[35] 卢悦, 张平平, 王东强, 等. 急性肺损伤中医病因病机的探讨 [J]. 中国中医急症, 2020, 29(2): 280-282.
[36] 王朔, 李卫, 白冰, 等. 黄芩苷镁盐对CCl4诱导SD大鼠急性肝损伤保护机制 [J]. 中国老年学杂志, 2022, 42(9): 2253-2256.
[37] 杨禄坤. 黄芩苷镁盐对LPS诱导急性肺损伤小鼠的保护作用 [D]. 承德: 承德医学院, 2021.
[38] 魏莹莹. 狼毒双高色原酮减轻急性肺损伤的作用及机制研究 [D]. 杭州: 浙江中医药大学, 2022.
[39] 张钦钦, 曾梦楠, 张贝贝, 等. 猫眼草酚D抑制小鼠急性肺损伤的作用及其机制研究 [J]. 中国新药杂志, 2022, 31(4): 362-368.
[40] 崔卫正, 刘爽. 芹菜素预处理对脓毒症大鼠急性肺损伤的保护作用及机制研究 [J]. 现代中西医结合杂志, 2021, 30(9): 913-918.
[41] 于婧, 冯丹丹, 潘文森. 桑黄素在脂多糖诱导的急性肺损伤中的相关机制 [J]. 癌变·畸变·突变, 2022, 34(3): 213-218.
[42] 杨莉, 郏建臣, 王玉华, 等. 桑黄素对脂多糖诱导的急性肺损伤大鼠的保护作用研究 [J]. 中国免疫学杂志, 2019, 35(20): 2438-2445.
[43] 任辉邦, 张斌, 尹启超, 等. 山姜素通过PI3K/Nrf2/ HO-1通路减少炎症和氧化应激反应改善盲肠结扎和穿刺诱导的脓毒症大鼠的急性肺损伤 [J]. 免疫学杂志, 2021, 37(7): 575-583.
[44] 王贵佐, 王霜, 陈芬芬, 等. 异甘草素对小鼠急性肺损伤的保护作用及其机制 [J]. 山西医科大学学报, 2021, 52(3): 283-288.
[45] 蔡雨春. 淫羊藿素对脂多糖诱导小鼠急性肺损伤的保护作用研究 [D]. 桂林: 桂林医学院, 2021.
[46] 徐玲文, 王华兵, 王倩, 等. 黄芩苷对脓毒症急性肺损伤小鼠TLR4/NF-κB通路及Treg/Th17平衡的影响 [J]. 中国免疫学杂志, 2022, 38(15): 1813-1818.
[47] 刘晟文. 槲皮素对脂多糖诱导大鼠急性肺损伤的保护效应及Nrf-2/ARE信号通路的影响 [D]. 遵义: 遵义医科大学, 2019.
[48] 阮丹, 朱金月, 罗波, 等. 柚皮素通过调控Nrf2/HO-1信号通路对百草枯中毒大鼠急性肺损伤保护的作用 [J]. 中国急救医学, 2021, 41(6): 524-528.
[49] 钟海. 三叶苷对LPS诱导急性肺损伤小鼠的保护作用及机理研究 [D]. 广州: 南方医科大学, 2021.
[50] 唐敏强, 黄婕, 陈佳娣. 鹰嘴豆芽素A对LPS诱导的肺泡上皮细胞氧化应激损伤的影响 [J]. 国际检验医学杂志, 2023, 44(10): 1195-1199.
[51] 李泽林, 代红丽, 沈晓静, 等. 表儿茶素对急性肺损伤小鼠抗氧化应激和抗炎作用研究 [J]. 云南农业大学学报: 自然科学, 2021, 36(5): 848-854.
[52] 范风颖, 骆姗, 赵莉. 龙眼核多酚对LPS诱导的ALI小鼠肺组织的保护作用及机制 [J]. 西南国防医药, 2021, 31(6): 497-500.
[53] 樊黎丽, 孟泳, 赵润杨, 等. 姜黄素抑制HMGB1-NF-κB信号通路减轻脂多糖诱导新生大鼠急性肺损伤实验研究 [J]. 药物评价研究, 2022, 45(11): 2224-2230.
[54] 黄晓军, 陈茜圆, 任卓超, 等. 白藜芦醇对急性肺损伤小鼠的保护作用研究 [J]. 浙江医学, 2020, 42(5): 422-425.
[55] 何诗灵. 丹酚酸A通过激活SIRT3/FOXO3a信号通路减轻内毒素诱导的大鼠急性肺损伤 [D]. 福州: 福建医科大学, 2020.
[56] 李玉婷, 罗乐, 尹素娟, 等. 丹酚酸B减轻LPS诱导的小鼠急性肺损伤 [J]. 基础医学与临床, 2021, 41(3): 376-381.
[57] 金焕治, 林岳, 陈大庆. 芍药醇对脓毒症模型大鼠急性肺损伤保护作用及其机制研究 [J]. 浙江中西医结合杂志, 2019, 29(12): 974-978.
[58] Liu Y H, Zhou J B, Luo Y Y,. Honokiol alleviates LPS-induced acute lung injury by inhibiting NLRP3 inflammasome-mediated pyroptosis via Nrf2 activationand[J]., 2021, 16(1): 127.
[59] 曹银利, 孙亚洲, 崔清洋, 等. 罗汉果皂苷V对胎粪吸入综合征大鼠的保护作用及其初步机制研究 [J]. 中国比较医学杂志, 2022, 32(9): 62-68.
[60] 黄小强, 李宣宣, 吴水生, 等. 泽泻三萜对小鼠急性肺损伤的保护作用 [J]. 中成药, 2022, 44(9): 2979-2984.
[61] 裴彩霞, 王振兴, 汪晓敏, 等. 桔梗皂苷D经NF-κB通路抑制炎症及氧化应激反应减轻脂多糖诱导的大鼠急性肺损伤 [J]. 中国病理生理杂志, 2022, 38(4): 672-679.
[62] 柯维强, 陈小玲, 蔡杨靖. 基于TLR4/MyD88/NF-κB信号通路探讨积雪草酸对急性肺损伤大鼠氧化应激和NLRP3炎症小体的影响 [J]. 现代中西医结合杂志, 2023, 32(4): 483-489.
[63] 凌林, 佟晶, 曾良. 芍药苷通过激活Nrf2/Keap1信号通路改善脓毒症急性肺损伤的研究 [J]. 四川大学学报: 医学版, 2020, 51(5): 664-669.
[64] Yang H H, Lv H M, Li H J,. Oridonin protects LPS-induced acute lung injury by modulating Nrf2-mediated oxidative stress and Nrf2-independent NLRP3 and NF-κB pathways [J]., 2019, 17(1): 62.
[65] 任丽, 张婉怡, 黄凯, 等. 虾青素通过调节Nrf2蛋白减轻小鼠急性放射性肺损伤 [J]. 齐齐哈尔医学院学报, 2022, 43(12): 1105-1108.
[66] 刘锐, 林秀玉, 孙兆瑞, 等. 牛磺酸对脓毒症大鼠急性肺损伤的保护作用机制 [J]. 医学研究生学报, 2021, 34(12): 1238-1243.
[67] 杨敏华, 姚友杰, 王娟. 姜油酮通过激活Nrf2通路减轻LPS诱导的小鼠急性肺损伤 [J]. 西安交通大学学报: 医学版, 2020, 41(1): 150-156.
[68] 钟春蕾, 黄国涛, 张志强. 五味子乙素对脂多糖诱导的脓毒症急性肺损伤大鼠肺组织病理损伤、炎症反应和核因子-κB表达的影响 [J]. 安徽中医药大学学报, 2020, 39(6): 57-62.
[69] 张强泽, 曹斌, 梁志勇. 水飞蓟素通过调控TLR/NF-κB信号通路改善急性肺损伤大鼠肺功能作用研究 [J]. 中国中医急症, 2019, 28(5): 809-813.
[70] 王蓉, 赵戈蕾, 韩亮. 连翘酯苷A对脂多糖介导的急性肺损伤小鼠肺组织的保护作用研究 [J]. 中医药导报, 2020, 26(16): 10-13.
[71] 曹银利, 孙亚洲, 崔清洋, 等. 重楼皂苷I对脂多糖诱导的小鼠急性肺损伤的保护作用研究 [J]. 中国免疫学杂志, 2022, 38(21): 2583-2587.
[72] 姚培宇, 邓瑞冰, 李珍珠, 等. 异丹叶大黄素对脂多糖诱导的小鼠急性肺损伤的影响 [J]. 中国医学科学院学报, 2022, 44(5): 794-801.
[73] 杨锴. 鱼腥草素钠缓解LPS致小鼠急性肺损伤及其可能机制研究 [D]. 上海: 中国人民解放军海军军医大学, 2021.
[74] 张海云, 韩伟东, 刘海梅, 等. 丹参酮ⅡA对急性肺损伤小鼠炎症因子和氧化应激水平的影响 [J]. 解剖学研究, 2020, 42(6): 491-495.
[75] 王慧, 龚园其, 周仪华, 等. 青藤碱调控Nrf2/Keap1信号通路对脓毒症急性肺损伤的改善作用 [J]. 实用医学杂志, 2022, 38(15): 1896-1900.
[76] 李雯, 陈兰, 戚迪, 等. 枸杞多糖通过Akt/eNOS通路减轻LPS致ARDS小鼠肺损伤 [J]. 中国药理学通报, 2018, 34(9): 1258-1263.
[77] 刘振峰, 刘代顺, 刘建英, 等. 萝卜硫素通过Nrf2/ARE信号通路对脂多糖性急性肺损伤机制的保护作用 [J]. 河北医学, 2020, 26(12): 1961-1965.
[78] 邓多, 谭会玲, 上官云兰, 等. 云南松松塔对LPS诱导急性肺损伤大鼠炎症和氧化应激的影响 [J]. 中成药, 2021, 43(7): 1721-1726.
[79] 宋肖, 李微, 周茜, 等. 山麦冬水提物对脂多糖诱导小鼠急性肺损伤的缓解作用及机制 [J]. 中国兽医杂志, 2023, 59(5): 133-140.
[80] 张钦钦, 刘娟娟, 吕雅鑫, 等. 月见草提取物对脂多糖所致大鼠急性肺损伤的作用及其机制研究 [J]. 中国药学杂志, 2023, 58(1): 41-47.
[81] 陈宝磊, 高映春, 吴磊. 枇杷叶提取物通过激活磷脂酰肌醇3激酶/蛋白激酶B信号通路减轻脂多糖诱导的肺细胞损伤 [J]. 安徽医药, 2022, 26(3): 453-457.
[82] 陈永生, 付斌, 郑永先. 金荞麦提取物对百草枯中毒大鼠急性肺损伤和MAPK/NF-κB信号通路的影响 [J]. 遵义医科大学学报, 2022, 45(6): 736-742.
[83] 尚罗锐, 刘宇寒, 李金骁, 等. 大承气汤调控Nrf2/TGF-β1/ERK通路来减轻脂多糖诱导的急性肺损伤 [J]. 中国医院药学杂志, 2021, 41(19): 1935-1939.
[84] 陈剑坤, 卢月, 李际强, 等. 扶正解毒方含药血清对小鼠肺泡巨噬细胞和II型肺泡上皮细胞共培养的炎症调控作用研究 [J]. 时珍国医国药, 2023, 34(3): 554-558.
[85] 刘淑玲, 蔡海荣, 陈燕虹, 等. 黄连解毒汤对脓毒症急性肺损伤大鼠炎症因子和氧化应激的影响 [J]. 中国兽医杂志, 2020, 56(5): 58-61.
[86] 张敏, 许成辰, 徐婷贞, 等. 基于Nrf2/Keap1/p62信号通路探讨百合固金汤对LPS诱导的小鼠急性肺损伤的保护作用 [J]. 中国实验方剂学杂志, 2019, 25(15): 77-82.
[87] 刘默. 桑白皮汤文献研究与干预LPS诱导小鼠ALI模型和斑马鱼氧化应激模型的效应及机制研究 [D]. 南京: 南京中医药大学, 2021.
[88] 杨丽梦, 熊旭东. 通腑平喘方对脓毒症急性肺损伤大鼠Keap1-Nrf2/ARE信号通路的影响 [J]. 中国中医急症, 2019, 28(2): 209-212.
[89] 杨荃怀, 陈洪, 黄桂琼, 等. 透邪解毒汤通过抑制炎症反应及氧化应激减轻脂多糖诱导的小鼠急性肺损伤 [J]. 四川中医, 2022, 40(7): 66-71.
[90] 石亚莉. 宣肺活血汤对脓毒症肺损伤大鼠肺血管内皮氧化损伤及CLIC1的影响研究 [D]. 杭州: 浙江中医药大学, 2018.
[91] 黄婷. 平肺口服液治疗急性放射性肺损伤的实验研究[D]. 北京: 北京中医药大学, 2021.
Research progress on the regulation of oxidative stress by traditional Chinese medicine in the prevention and treatment of acute lung injury
ZHANG Maofu1, ZHANG Zhiming2, SONG Zhongyang3, ZHANG Binglei2, SHEN Yanyun1, LIU Yeyuan1, LI Xinyu1
1. Gansu University of Chinese Medicine, Lanzhou 730000, China 2. Gansu Provincial Hospital of Chinese Medicine, Lanzhou 730050, China 3. Affiliated Hospital of Gansu University of Chinese Medicine, Lanzhou 730020, China
Acute lung injury (ALI) is one of the most common and critically ill diseases in clinical practice, with high mortality and morbidity. It is mainly characterized by hypoxemia, pulmonary interstitial edema and pulmonary inflammation in the early stage, and further develops into acute respiratory distress syndrome in the later stage, which is manifested as severe hypoxic respiratory failure. As one of the mechanisms inducing ALI, oxidative stress plays an important role in its occurrence and development. Traditional Chinese medicine can play a role in treating ALI by inhibiting inflammation and oxidative stress, alleviating pulmonary interstitial edema, improving lung ventilation, and restoring lung tissue damage. Based on this, this paper summarized the function of oxidative stress, the mechanism of regulating ALI and the intervention mechanism of traditional Chinese medicine, in order to provide theoretical guidance for clinical research and new drug innovation exploration of ALI.
oxidative stress; acute lung injury; baicalin; epicatechin; mogroside V
R285
A
0253 - 2670(2024)09 - 3190 - 12
10.7501/j.issn.0253-2670.2024.09.032
2023-09-13
甘肃省科技重大专项-科技领军人才(21ZDKA0014);高端人才承担省级科技计划项目(“长江学者奖励计划”)(甘科计 [2021] 20号-9);甘肃省科技重大专项(甘科计[2022]1号-25);甘肃省教育科技创新项目(2022B-108);兰州市人才创新创业基金资助项目(2021-RC-80)
张茂福,硕士研究生,研究方向为急危重症的中医药防治。E-mail: 1742547952@qq.com
通信作者:张志明,教授,主任医师、博士生导师,从事急危重症的中医药防治研究。E-mail: zhangzhiming@163.com
[责任编辑 王文倩]
